БИОХИМИЯ - Л. Страйер - 1984
ТОМ 3
ЧАСТЬ V. МОЛЕКУЛЯРНАЯ ФИЗИОЛОГИЯ
ГЛАВА 34. МЫШЕЧНОЕ СОКРАЩЕНИЕ И ПОДВИЖНОСТЬ КЛЕТОК
34.13. Актин и миозин служат сократительными элементами почти во всех эукариотических клетках
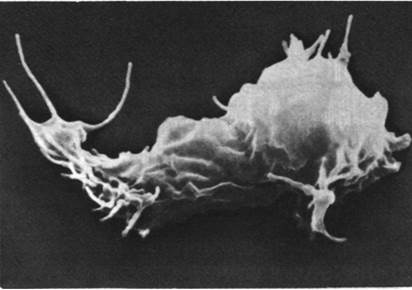
Давно уже установлено, что многие немышечные клетки способны передвигаться и менять свою форму. Миграция клеток в процессе развития эмбриона, передвижение макрофагов к поврежденным тканям, ретракция сгустка тромбоцитами, биение микроворсинок кишечного эпителия - все это примеры, иллюстрирующие универсальность клеточной подвижности. Некоторые аспекты подвижности клеток можно исследовать на культурах ткани. Так, культивируемые клетки различных типов имеют плоские складчатые выросты, так называемые ламеллиподии, форма которых медленно меняется. Они напоминают легкие складки платья на ветерке, и потому их называют также складчатыми краями или активными краями (рис. 34.21). Складчатые края выступают наружу на несколько микрометров, и с их помощью клетка может прикрепляться к поверхности. Если прикрепившаяся клетка втягивает складки на одном конце и вытягивает на другом, то при этом она постепенно перемещается.
Рис. 34.21. Слизистый плесневой гриб Dictyostelшm discoideum в сканирующем электронном микроскопе. Этот организм может существовать либо в виде свободных клеток, либо как часть организованной колонии. На поверхности Dictyostelшm хорошо видны активные края и филоподии, богатые актином
Каковы молекулярные основы движения клеток? Первые сведения по этому вопросу были получены Ариелем Лёви (Ariel Loewy) при изучении слизистого плесневого гриба Physarumpolycephalum. Этот слизевик образует плазмодий и содержит перетекающие массы цитоплазмы. Полученные при высокой ионной силе экстракты гриба были сходны по свойствам с актомиозином поперечнополосатых мышц. Так, добавление АТР вызывало быстрое падение вязкости, которая затем вновь медленно возрастала по мере гидролиза АТР. Спустя несколько лет Садаси Гатано и Фумио Осава (Sadashi Hatano, Fumio Osawa) обнаружили в грибе высокое содержание актина, очень сходного с мышечным. Он образовывал тонкие нити и взаимодействовал с миозином. Самое интересное, что актин плесневого гриба взаимодействовал с S1-головками миозина скелетных мышц позвоночных, причем возникали декорированные нити, подобные тем, которые образуются из актина и миозина позвоночных. Оказалось, что плесневой актин отличается от актина мышц кролика только по 17 из 375 аминокислотных остатков. Следовательно, актин - это высококонсервативный, древний белок эукариот. Аналогично актину из рассматриваемого плесневого гриба, а также из многих других эукариотических клеток был выделен и миозин. Однако свойства миозинов из разных источников варьировали в большей степени, чем свойства актинов, выделенных из тех же источников. Например, миозины из многих немышечных клеток не способны к быстрому формированию таких толстых нитей, какие образуются из миозина скелетных мышц. Немышечные миозины образуют короткие биполярные нити.
34.14. Распределение микрофиламентов в клетке выявляется методом иммунофлуоресцентной микроскопии
Как правило, клетки эукариот богаты актином, содержание которого составляет обычно 10% общего количества белка. По существу, актин - количественно превалирующий белок во многих типах клеток. Содержание миозина в немышечных клетках обычно в 10 раз ниже, чем актина. Следовательно, количественное отношение актина к миозину в немышечных клетках выше, чем в мышцах.
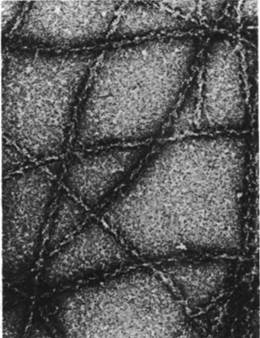
Часть актина в немышечных клетках полимеризуется с образованием микрофиламентов (рис. 34.22), напоминающих тонкие нити мышечного волокна. Микрофиламенты диаметром 70А выявляются на электронных микрофотографиях почти всех клеток эукариот. Декорирование микрофиламентов головками S1 приводит к возникновению характерной структуры регулярно расположенных стрелок; из этого следует, что микрофиламенты состоят из актина и могут взаимодействовать с миозином (рис. 34.23).
Рис. 34.22. Электронная микрофотография, демонстрирующая большое количество микрофиламентов в цитоскелете фибробластов эмбриона цыпленка
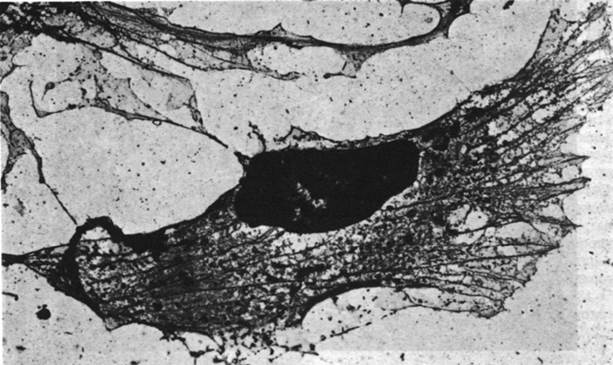
Рис. 34.23. Электронная микрофотография F-актина из Dictyostelшm, декорированного S1 -головками миозина также из Dictyostelium. Видно, что образуются такие же «наконечники стрел», как и в случае декорирования F-актина скелетных мышц S1-головками мышечного миозина
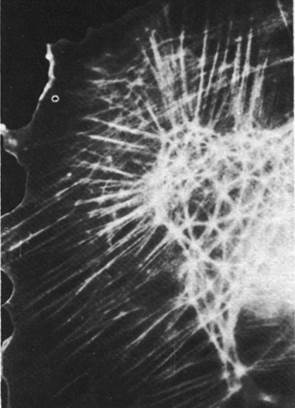
Распределение микрофиламентов в клетке выявляется с помощью иммунофлуоресцентной микроскопии. Метод состоит в том, что получают специфические к актину антитела, ковалентно связывают их с флуоресцентной меткой, например, с флуоресцеином, и добавляют к культивируемым клеткам. В результате проявляется сеть микрофиламентов, видимая под флуоресцентным микроскопом (рис. 34.24). Некоторые пучки флуоресцирующих нитей тянутся через всю клетку. В покоящейся клетке, прикрепленной к твердому субстрату, многие актиновые нити идут параллельно длинной оси клетки. В складчатых краях, напротив, флуоресценция имеет диффузный характер, что связано с наличием мономеров актина или коротких нитей актина (рис. 34.25). Методом иммунофлуоресцентной микроскопии было также исследовано внутриклеточное распределение других сократительных белков. В микрофиламентах был обнаружен тропомиозин (рис. 34.26), тогда как тропонина в них, по-видимому, нет. Ионы кальция играют важную роль в регуляции не только мышечной, но и немышечной подвижности, хотя в целом эти два процесса регулируются по-разному. Относительно внутриклеточного распределения миозина известно очень мало. В немышечных клетках обнаружен также α-актинин, который в мышцах связывает актин с Z-пластинками миофибрилл. Этот белок присутствует в наибольшем количестве в складчатых краях и других участках клетки, где происходит быстрое формирование и распад нитей актина. Возможно, что α-актинин создает мостики между нитями актина в цитоскелете и другими образованиями, связанными с подвижностью.
Рис. 34.24. Иммунофлуоресцентная микрофотография прикрепленной к поверхности покоящейся культивируемой клетки. Клетка окрашена флуоресцирующими антителами против актина. Видны длинные пучки ми- крофиламентов
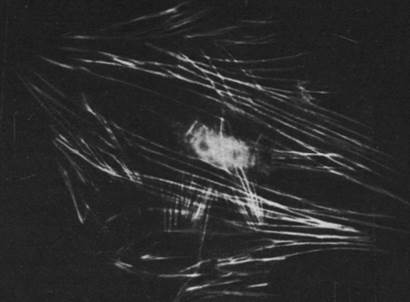
Рис. 34.25. Более диффузное распределение нитей актина в движущейся клетке, особенно в ее активных краях
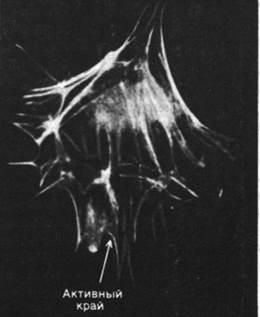
Рис. 34.26. В клетках, окрашенных флуоресцирующими антителами против актина, видны похожие на геодезические вышки куполообразные структуры
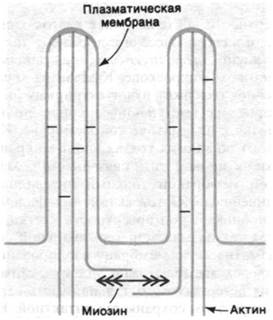
34.15. Прикрепленные к мембране нити актина опосредуют сокращение микроворсинок кишечника
Микроворсинки эпителиальных клеток кишечника (рис. 34.27) - это одна из наиболее изученных немышечных сократительных систем. Микроворсинки представляют собой выпячивания цитоплазмы на апикальной поверхности эпителиальных клеток кишечника, и в своей массе они образуют так называемую щеточную каемку, видимую в световом микроскопе. Каждая из микро - ворсинок содержит пучок актиновых нитей, которые на выступающем конце прикрепляются к плазматической мембране. Кроме того, во многих точках вдоль микроворсинки актиновые нити связаны с плазматической мембраной тонкими нитевидными соединениями. Остов актиновых филаментов проникает под поверхность клетки, достигая так называемой терминальной сети. Плазматическую мембрану изолированных щеточных каемок можно удалить, обработав их детергентом; остальная часть структуры при этом сохраняется интактной. Был обнаружен поразительный факт: лишенная мембраны щеточная каемка сокращается при добавлении АТР и Са2+ и актиновые нити быстро погружаются в терминальную сеть.
Рис. 34.27. Электронная микрофотография щеточной каемки кишечного эпителия. Микроворсинки содержат нити актина
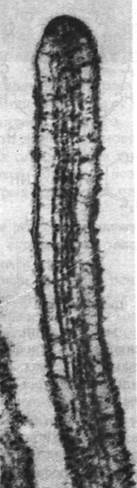
Какова структурная основа этой подвижности? Путем декорирования актиновых нитей микроворсинок S1-головками миозина было выявлено, что все нити имеют одинаковую полярность (рис. 34.28). Образовавшиеся стрелки оказались направленными к основанию микроворсинок (подобно тому как на декорированных тонких нитях мышечных волокон стрелки направлены в сторону Z-пластинок). Другими словами, полярность актиновых нитей такова, что микроворсинки при сокращении втягиваются в клетку. Было также обнаружено, что в терминальной сети имеются толстые нити, содержащие миозин. По всей вероятности, биполярные миозиновые нити терминальной сети взаимодействуют с нитями актина прилежащих ворсинок (рис. 34.28). Согласно этой гипотезе, нити актина скользят относительно нитей миозина, так что в целом движение направлено к центру клетки. В итоге микроворсинки укорачиваются, что способствует всасыванию питательных веществ клеткой.
Рис. 34.28. Предполагаемое расположение миозина и актина в микроворсинках щеточной каемки кишок