Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Предсказание функции белков на основе их теоретических моделей
Практическое применение
Моделирование структуры изоформ, полученных альтернативным сплайсингом
Многие, если не большинство, эукариотических генов допускают альтернативный сплайсинг, резко увеличивающий разнообразие зрелых молекул. Часто бывает трудно предсказать по последовательности альтернативного транскрипта, сохранится ли его функция или изменится. Моделирование структуры, где это возможно, может пролить свет на связь между структурой и функцией у альтернативных транскриптов одного гена.
В одной из первых работ в этом направлении (Fumham et al., 2004), охватившей модели 14 белков и 40 вариантов сплайсинга, было показано, что утрата экзона чаще включает потерю целиком структурных единиц, нежели более мелких фрагментов. Авторы показали, что согласно программам оценки надежности моделей, в случае моделирования делеций и вставок результаты моделирования первых более надежны. Для четырех белков с биомедицинским применением авторы смогли установить корреляцию между известными функциональными свойствами альтернативных вариантов и моделями их структур. Позднее было показано (Wang et al., 2005), что места альтерации (splicing events) обычно находятся в петлевых участках на поверхности белка, а не в элементах упорядоченной вторичной структуры. У конкретного гена в общем случае есть лишь одно-два места альтерации, охватывающие в 60% случаев не более 50 остатков. Эти результаты позволили предположить, что сплайсинг обычно происходит в тех местах и таким способом, что третичная структура белка по возможности не затрагивается. Это согласуется с тем, что большая часть альтернативных изоформ имеют близкие к оригиналу свойства укладки и, поэтому, близкую функцию. Однако позднее при анализе нескольких транскриптов со структурной точки зрения обнаружилось (Tress et al. 2007), что многие изоформы должны были бы иметь резко отличающиеся структуры по сравнению с уже известными структурами остальных изоформ. Для 49 из 85 транскриптов, сопоставленных с гомологичными им структурами, авторы пришли к выводу, что изоформы и главные транскрипты должны образовывать существенно различные структуры. Пример из работы Тресс с сотр. (Tress et al. 2007) (Рис. 12.6) иллюстрирует изоформу интерлейкина 4 без экзона 2. Структурный фрагмент, кодируемый этим экзоном, входит в ядро белка и участвует в образовании дисульфидного мостика, позволяя предположить, что пространственная структура изоформы будет существенно отличаться от известной структуры полного белка. Пока еще мы имеем далеко не полную картину влияния на функцию белка структурных изменений - больших или малых, - вызванных альтернативным сплайсингом. Так, лишь для 4 из 214 локусов оказалось возможным найти экспериментальные данные, иллюстрирующие различие в функции между альтернативными изоформами Tress et al. (2007).
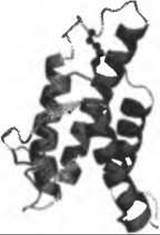
Рис. 12.6. (Цветную версию рисунка см. на вклейке.) Структура интерлейкина 4 с фрагментов, кодируемым экзоном 2. Экспериментальная структура (PDB код 1ilt) показана в ленточном представлении, фрагмент, кодируемый экзоном 2, выделен пурпурным. Дисульфидные мостики показаны в стержневом представлении; мостик во фрагменте, кодируемом экзоном 2, показан в шаростержневом представлении