Структура и функционирование белков. Применение методов биоинформатики - Джон Ригден 2014
Предсказание функции белков на основе их теоретических моделей
Практическое применение
От общей функции к молекулярным деталям
Функцию белка может рассматривать на разных уровнях сложности - от участия в клеточных процессах до понимания механизма действия на молекулярном уровне. Лизосомальная дезоксирибонуклеаза II а (ДНКаза На) стала одной из первых обнаруженных эндонуклеаз (1947) и была хорошо описана с биохимической точки зрения уже в 1960х. Этот фермент необходим для развития организма, поскольку отвечает за удаление лишней ДНК и дополнительную апоптическую фрагментацию ДНК у высших эукариот - нокаут лизосомальной ДНКазы IIа у мышей оказался летальным. Несмотря на интенсивные исследования в течение последних 50 лет и бесспорную важность ДНКазы На, не удалось выявить схожесть этого фермента с каким-либо другим семейством белков, что затрудняет исследование функции этого белка на молекулярном уровне. Ни один из методов распознавания фолда не позволил построить достоверное выравнивание мишени с шаблоном, но анализ их результатов показывает, что некоторые из этих мишеней них имеют сходство с укладкой фосфолипазы D в области активного центра, образуя так называемый мотив НхК (Cymerman et al. 2005). Известные члены надсемейства фосфолипаз D имеют двудоменную структуру с одним активным центром, состоящим из двух мотивов HxK-Xn-N-Xn-(E/Q/D), которые расположены на интерфейсе между доменами. Установить остальные остатки, образующие активный центр, основываясь на выравнивании, было невозможно. Однако анализ расположения конкретных остатков в структуре модели позволил получить эту существенную информацию и определить аминокислотные остатки, которые потенциально могут участвовать в образовании активного центра (Рис. 12.7). Обнаружение того, что ДНКаза На является отдаленным родственником фосфолипазы D позже было подтверждено экспериментальным изучением (Schafer et al. 2007) и объяснило необычные свойства этой нуклеазы, такие как устойчивость к ЭДТА. По аналогии с фосфолипазой D, чей механизм был известен, стало возможным сделать вывод, что реакция гидролиза фосфодиэфирной связи выполняется ДНКазой Нас участием ковалентно связанного промежуточного веещества реакции.
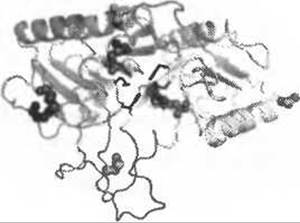
Рис. 12.7. (Цветную версию рисунка см. на вклейке.) Структурная модель ДНКазы На человека. Вычислительный анализ позволил установить принадлежность ДНКазы IIа к семейству фосфолипаз D. Фермент имеет мономерную структуру с псевдодимерной архитектурой. Два мотива НхК в N- и С-концевых доменах (показаны в ленточном представлении светлоголубым и серым соответственно) имеют каталитически важные аминокислотные остатки показаны в стержневом представлении (красным и зеленым), которые вместе образуют единый активный центр. Кроме идентификации потенциальных каталитических остатков модель объяснила близкое расположение остатков цистеина, образующих дисульфидные связи (показаны оранжевыми и темно-синими шариками), и экспонированный характер N-гликозилированных остатков (показаны зелеными шариками). Петли, потенциально связывающие ДНК, показаны лиловым. Определение функционально важных остатков в теоретической модели фермента может значительно облегчить процесс его инженерии
Случай ДНКазы Па наглядно показывает, как биоинформатика помогает обойти некоторые экспериментальные ограничения (ДНКаза IIа не поддается кристализации, поскольку гликозилируется с трудом) и, таким образом, делает возможным дальнейшее изучение свойств белка.