БІОХІМІЯ ДЛЯ ВЧИТЕЛЯ - Ф.Ф. БОЄЧКО - 1985
ЕНЕРГЕТИКА БІОЛОГІЧНИХ ПРОЦЕСІВ
ПЕРЕТВОРЕННЯ ЛІПІДІВ У КЛІТИНАХ
Найважливішою фазою перетворення ліпідів є метаболізм цих речовин у тканинах організму, який забезпечує як асиміляцію їх у вигляді пластичного матеріалу, так і розпад з вивільненням енергії. Подібно до вуглеводів ліпіди — основний енергетичний матеріал клітини. Майже 7г енергії, необхідної для забезпечення процесів життєдіяльності, організм одержує за рахунок метаболізму ліпідів. При окисленні 1 г жиру виділяється в середньому 38 кДж енергії, а при окисленні 1 г вуглеводів— 17 кДж. Домінуюча роль вуглеводів в енергозабезпеченні характерна лише для клітин головного мозку, де ліпіди не використовуються у вигляді джерела енергії.
Ліпіди організму класифікують за різними показниками. За біологічними особливостями їх поділяють на резервні і конституційні (цитоплазматичні). За фізико-хімічними особливостями — на прості (триацилгліцериди, стериди, воски), складні (фосфоліпіди, гліколіпіди, сульфоліпіди) та похідні ліпідів (каротини, жиророзчинні вітаміни).
Між різними органами і тканинами організму ліпіди розподіляються по-різному. Особливо велика кількість їх міститься в спеціалізованій сполучній і жировій тканинах, так званих жирових депо. У клітинах цих тканин більша частина цитоплазми заповнена ліпідними краплями, до складу яких ліпіди здебільшого входять у вигляді триацилгліцеридів. Вони є основною резервною формою ліпідів в організмі і становлять 99 % всіх резервних ліпідів жирової тканини.
Характерною особливістю резервних ліпідів є те, що вони містять в своєму складі значну кількість ненасичених жирних кислот, які мають високий потенціал хімічної енергії і водночас при температурі тіла забезпечують рідинний стан депонованого жиру. Загальна кількість резервних ліпідів становить в середньому 10 % усіх ліпідів організму. При ожирінні цей показник збільшується до 25—30 %. Створення резервів жиру у вигляді триацилгліцеридів є характерним не тільки для клітин хребетних тварин, а й для клітин рослин та мікроорганізмів. З жирових депо ліпіди використовуються в міру потреби, для забезпечення різноманітних метаболічних процесів. В організмі постійно відбуваються два взаємопов’язані процеси — депонування і мобілізація ліпідів з жирових депо та їх використання для потреб організму.
Складні ліпіди (фосфоліпіди, гліколіпіди) у вигляді ліпопротеїнових комплексів входять до складу різноманітних біомембран і виконують в основному структурну функцію. Це так звані конституційні, або цитоплазматичні, ліпіди. Кількість їх в організмі порівняно стала і мало змінюється навіть при тривалому голодуванні. Ці ліпіди залежно від складу поділяють на гліцерофосфоліпіди та інозитфосфоліпіди. До складу гліцерофосфоліпідів входить залишок триатомного спирту гліцерину, а до складу інозитфосфоліпідів — залишок багатоатомного спирту інозиту. Крім того, до складу перших і других входять також залишки фосфорної кислоти, азотистих сполук та жирних кислот. Залежно від азотистих сполук, що входять до їх складу, гліцерофосфоліпіди поділяють на лецитини (фосфотидилхо- ліни),кефаліни (коламінфосфоліпіди) тасеринфосфоліпіди.
Внутріклітинний обмін всіх груп простих (триацилгліцеридів, стеридів) і складних (фосфоліпідів) ліпідів має характерні особливості та певні загальні закономірності, властиві для всієї групи цих речовин.
Обмін простих ліпідів
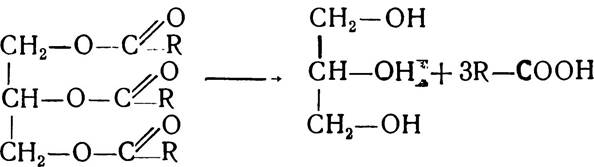
Обмін триацилгліцеридів. Початковим етапом внутрітканинного обміну триацилгліцеридів є гідролітичний розпад їх під впливом тканинних ферментів — ліпопротеїдліпаз плазми крові чи жирової тканини на складові частини — гліцерин і жирні кислоти. Кожний з цих компонентів внаслідок наступних перетворень включається в різні ланки метаболізму.
Перетворення гліцерину відбувається під впливом ферменту гліцеролкінази і АТФ, внаслідок чого утворюється гліцерофосфат, який під впливом ферменту гліцеринфос- фатдегідрогенази окислюється в діоксіацетонмонофосфат. Останній ізомеризується в фосфогліцериновий альдегід, який включається в різні ланки обмінних процесів або окислюється до кінцевих продуктів.
Проміжні продукти метаболізму гліцерину (гліцерин-фосфат, діоксіацетонмонофосфат, гліцеринальдегід-3-моно-фосфат) можуть використовуватись також для синтезу простих жирів, фосфогліцеридів, вуглеводів та інших речовин. Окислення жирних кислот, що утворилися в результаті гідролізу триацилгліцеридів, має свої специфічні особливості, які треба розглянути докладніше.
Молекулярні механізми окислення жирних кислот. Цей процес досить інтенсивно відбувається в енергетичних підстанціях клітини — мітохондріях і безпосередньо пов’язаний із процесами дисиміляції в системі перенесення електронів і циклі трикарбонових кислот, який є характерним також для окислення вуглеводів і похідних амінокислот.
Оскільки жирні кислоти містять в своєму складі більше вуглецю і водню і менше кисню, ніж вуглеводи, окислення їх супроводжується вбиранням значно більшої кількості кисню і відповідно утворенням більшої кількості АТФ в процесі окислювального фосфорилювання. При окисленні 1 моль пальмітинової кислоти утворюється 130 моль АТФ, а при окисленні 1 моль глюкози — 38 моль АТФ.
Німецький біохімік Кнооп в 1904 р. експериментально довів, що метаболізм жирних кислот в організмі відбувається за рахунок відщеплення або приєднання до їх молекул двовуглецевих фрагментів. У процесі окислення жирних кислот від їх молекул поступово відщеплюються молекули оцтової кислоти у вигляді ацетил-КоА, внаслідок чого вуглецевий ланцюг жирної кислоти вкорочується на 2 вуглецевих атоми в кожному акті окислення.
Оскільки відщеплення атомів водню з наступним утворенням ацетил-КоА відбувається переважно в р-положенні молекули вищої жирної кислоти, то весь процес називається β-окисленням.
Процес окислення складається з трьох послідовних стадій: активації жирних кислот, р-окислення та окислення в циклі трикарбонових кислот утворених молекул ацетил-КоА до СО2 і Н2О.
Перший етап — активація жирних кислот — відбувається на зовнішній мембрані мітохондрій різних органів і тканин організму (серці, нирках, слизовій оболонці тонкого кишечника, жировій тканині) і є енергозалежним. З участю АТФ жирні кислоти перетворюються в ациладенілати:
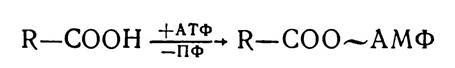
Потім ациладенілати з участю ферментів ацил-КоА-синтез приєднують молекули КоА — SH, внаслідок чого утворюються ацил-КоА.
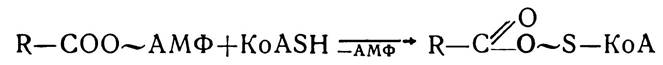
Утворені сполуки (ацилпохідні КоА) не можуть проникати через мембрани в матрикс мітохондрій, де відбувається наступне їх окислення, тому транслокація цих сполук здійснюється з участю переносників, роль яких виконує карнітин (триметилпохідне β-оксі-γ-аміномасляної кислоти). Під впливом ферменту карнітинацилтрансферази утворюється комплекс ацилкарнітин, який легко проходить через внутрішню мембрану мітохондрій у матрикс. У матриксі комплекс ацил-карнітин під впливом внутрімітохондріальної карнітинацилтрансферази розпадається. Ацильний залишок переноситься на внутрімітохондріальний КоА —SH з утворенням ацетил-КоА, а вивільнений карнітин повертається назад, у цитоплазму.
Другий етап, власне β-окислення, складається з чотирьох послідовних стадій. На першій стадії відбувається дегідрування ацил-КоА з участю флавопротеїду, внаслідок чого утворюється α, β-транс-ненасичене похідне. Електрони і протони водню з участю ФАД передаються на убіхінон (коензим Q), а потім електрони з участю системи цитохромів переносяться на кінцевий акцептор — молекулярний кисень. Внаслідок цих процесів відбувається синтез двох молекул АТФ. На наступній стадії — гідратація подвійного зв’язку з утворенням β-оксисполук. Реакцію каталізує фермент енолаза.
Третя стадія β-окислення включає дегідрування утворених β-оксисполук з участю ферментів дегідрогеназ, внаслідок чого утворюються р-кетопохідні. Роль акцептора водню виконує окислена форма НАД. При перенесенні протонів і електронів по системі дихального ланцюга відбувається синтез трьох молекул АТФ. На заключній стадії β-окислення відбувається взаємодія продукту третього етапу окислення (β-кетоацил КоА) і вільного КоА, внаслідок чого утворюється ацетил-КоА і ацил-КоА (ефір КоА і жирної кислоти), вкорочений на два вуглецевих залишки.
Утворена молекула ацил-КоА знову піддається наступному чотириетапному процесу β-окислення, при якому жирна кислота вкорочується на два вуглецевих атоми і так до кінця. При окисленні пальмітинової кислоти, що містить 16 вуглецевих атомів, утворюється вісім молекул ацетил-КоА, які вступають у цикл трикарбонових кислот.
Сумарно реакцію вкорочення ланцюга ацил-КоА на два вуглецевих атоми можна записати так:
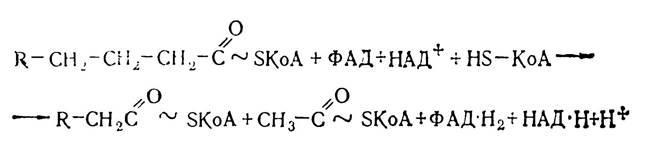
Енергія, що вивільнюється в результаті розщеплення жирних кислот, стає доступною для організму завдяки наступним перетворенням НАД·Н+Н+, ФАД·Н2 і ацетил-КоА. Наприклад, при кожному акті окислення пальмітоїл-КоА утворюються одна молекула ФАД·Н2 і одна молекула НАД·Н+Н+. При перенесенні електронів і протонів від відновленого НАД внаслідок окислювального фосфорилю- вання утворюється три молекули АТФ, а при перенесенні протонів і електронів від ФАД·Н2 — дві молекули АТФ, тобто всього утворюється п’ять молекул АТФ на 1 цикл Р-окислення. А таких актів окислення сім, враховуючи будову пальмітинової кислоти СНз—(СН2)14— СООН. Таким чином 7·5 = 35 молекул АТФ. Крім того, внаслідок кожного акту р-окислення утворюється вісім молекул ацетил-КоА, які в циклі Кребса дадуть 12·8=96 молекул АТФ. Отже, загальний енергетичний ефект β-окислення однієї молекули пальмітоїл-КоА становить 131 молекулу АТФ. З них одна молекула АТФ використовується для утворення пальмітоїл-КоА з пальмітату, тобто всього утворюється 130 молекул АТФ.
Коли врахувати, що в макроергічних зв’язках АТФ нагромаджується 46 кДж енергії, то всього утвориться 65 100 кДж енергії в формі АТФ. Такий енергетичний вихід становить 60% від 10 080 кДж, що вивільнюються при окисленні 1 моль (256 г) пальмітинової кислоти до С02 і Н2О в калориметричній бомбі. Врахувавши це, можна обчислити енергетичний баланс розпаду трипальмітину, який містить три залишки пальмітинової кислоти і молекулу гліцерину (129·3+19=406 молекул АТФ; 406·46= 18 676 кДж).
Біосинтез триацилгліцеридів. Для забезпечення цього процесу потрібні жирні кислоти та гліцерин, активні форми яких беруть участь в утворенні молекул жиру.
Гліцерин утворюється в організмі переважно з проміжного продукту окислення вуглеводів діоксіацетонмонофосфату під впливом ферменту гліцеролфосфатдегідрогенази.
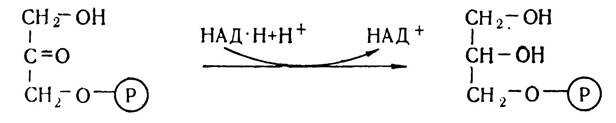
Утворений а-гліцерофосфат є активною формою гліцерину і може використовуватись для синтезу жирів. Частина гліцеринфосфату під впливом ферменту гліцерол-1-фосфатази гідролізується до гліцерину і фосфорної кислоти. Крім того, гліцерин утворюється також внаслідок розпаду тригліцеридів:
Під впливом тканинних ліполітичних ферментів у печінці гліцерин може знову перетворюватись в гліцерофосфат. Ця реакція відбувається з участю АТФ і завдяки каталітичній дії ферменту гліцеролкінази і не може відбуватись в жировій тканині та слизовій оболонці кишечника, оскільки там відсутній фермент гліцеролкіназа. Тому джерелом гліцеринфосфату в цих тканинах є діоксіацетонмонофосфат.
В організмі людини і тварин в рґзних органах і тканинах (печінці, нирках, слизовій оболонці кишечника, молочній залозі) відбувається синтез більшості жирних кислот, необхідних для росту і розвитку організму. При тривалій відсутності їх виникають різні порушення метаболічних процесів, тому ненасичені жирні кислоти відносять до групи вітамінів (вітамін F).
На відміну від β-окислення, що відбувається виключно в мітохондріях, біосинтез жирних кислот може здійснюватись на поверхні ендоплазматичного ретикулуму, у цитозолі та мітохондріях. Каталізує цей процес складний поліферментний комплекс синтетаза жирних кислот, для забезпечення функціональної активності якої необхідні відновлені форми нікотинамідних ферментів, іони Мn2+ та бікарбонат. Основний метаболічний шлях біосинтезу жирних кислот — ліпогенез відбувається в цитозолі.
У мітохондріях відбувається процес подовження жирних кислот із середньою довжиною вуглецевого ланцюга, а в мембранах ендоплазматичного ретикулуму — ферментативний процес нарощування КоА-похідних поліненасичених жирних кислот.
Насичені і мононенасичені жирні кислоти утворюються в організмі з участю ацетил-КоА. Тому будь-які речовини, при розпаді яких утворюється ця сполука, є потенціальним джерелом вуглецевих атомів в реакціях синтезу жирних кислот. Таким джерелом ацетил-КоА здебільшого є надмірні вуглеводи їжі, які не можуть використовуватись в енергетичному обміні, резервні полісахариди, деякі амінокислоти.
Оскільки можливості вищих організмів депонувати вуглеводи обмежені, надмірна кількість їх в раціоні використовується для синтезу жирних кислот. Про це свідчить той факт, що в організмі людини і тварин може досить інтенсивно нагромаджуватись жир при безжировому раціоні, який містить надмірну кількість вуглеводів. Надлишок вуглеводів в результаті окислення перетворюється в піруват, з якого після окислювального декарбоксилювання утворюється ацетил КоА — основний метаболіт р-окислення жирних кислот. Незважаючи на те, що ця сполука використовується і в процесі ліпогенезу, ці два процеси зовсім протилежні.
Біосинтез жирних кислот можна уявити у вигляді трьох послідовних етапів:
а) перенесення ацетил-КоА з мітохондрій у цитозоль, де відбувається процес біосинтезу;
б) карбоксилювання ацетил-КоА з утворенням справжнього (істинного) субстрату ліпогенезу — малоніл-КоА;
в) конденсація ацетил-КоА і малоніл-КоА та наступне відновлення їх з утворенням вищих жирних кислот.
Перший етап здійснюється внаслідок взаємодії в мітохондріальному просторі ацетил-КоА з оксалоацетатом. Утворений внаслідок цієї реакції цитрат, на відміну від ацетил-КоА, досить легко проходить через мітохондріальну мембрану, оскільки вона містить специфічну транслоказну систему для перенесення трикарбонових кислот. У цитоплазмі з участю специфічних ферментів відбувається розщеплення цитрату на ацетил-КоА і оксалоацетат, який транслокується в інтрамітохондріальний простір. На кожний цикл перенесення ацетил-КоА з інтрамітохондріального простору в цитозоль, витрачається одна молекула АТФ.
Карбоксилювання ацетил-КоА в цитозолі здійснюється з участю ферменту ацетил-КоА-карбоксилази, що містить в активному центрі біотин. В присутності АТФ молекула СO2зв’язується з простетичною групою ферменту з утворенням сполуки карбоксибіотину (С02~ біотин-фермент) — активної вугільної кислоти. З цієї сполуки карбоксильна група досить легко переноситься на ацетил-КоА з утворенням активної форми малонової кислоти — малоніл-КоА: СO2 + Біотин-фермент + АТФ → Карбоксибіотин-фермент+АДФ+ФН
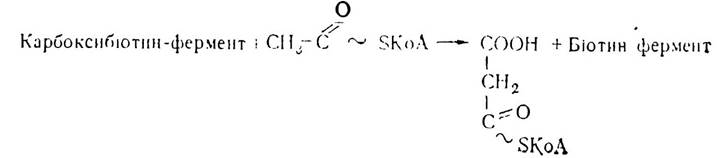
У процесі біосинтезу жирних кислот відбувається декарбоксилювання малоніл-КоА з утворенням ацетилу і СO2. Отже, до складу молекул жирних кислот малоніл-КоА не входить, а є лише проміжною сполукою, яка сприяє утворенню жирних кислот з активного ацетату. Тому процес карбоксилювання є досить важливим процесом, регулятором синтезу жирних кислот, оскільки він контролює включення в молекули вищих жирних кислот двох вуглецевих фрагментів.
На наступному етапі відбувається ферментативне перенесення ацетил-КоА і малоніл-КоА на низькомолекулярний білок, здатний до перенесення ацильних залишків (ацилпереносний білок — АПБ). Простетичною групою цього білка є похідне вітаміну Вз (пантотенової кислоти), що містить тіолову групу АПБ-SH, яка є своєрідним переносником ацильних залишків, тобто визначає каталітичну активність даного ферменту.
Ацилпереносний білок є складовою частиною шестиком- понентного ферменту синтетази жирних кислот. Кожний компонент цього поліферментного комплексу каталізує певний етап біосинтезу вищих жирних кислот. Спочатку відбувається ферментативне перенесення на тіолову групу АПБ— SH залишку ацетил-КоА. При цьому утворюється ацетил ~ S — АПБ і звільняється HS—КоА.
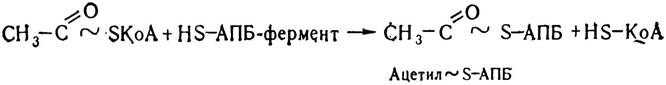
Потім відбувається перенесення на тіолову групу АПБ—SH залишку малонілу:
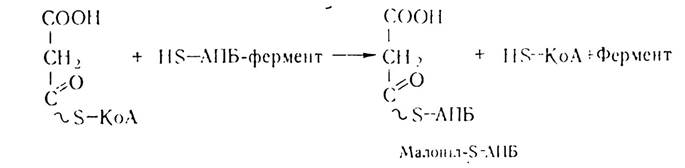
Першим етапом власне біосинтезу жирних кислот є конденсація залишків ацетил- і малоніл-КоА з участю конденсуючого ферменту — ацил-АПБ: малоніл-АПБ-лігази та декарбоксилювання малонілу з утворенням ацетоацетил-КоА.
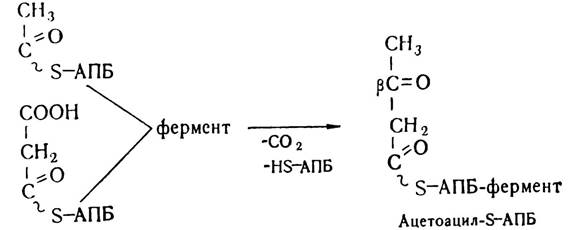
На цій стадії виділяється та сама молекула СОг, яка приєдналася з участю біотинвмісного ферменту до ацетил-КоА на стадії синтезу малоніл-КоА. Вважають, що внаслідок декар- боксилювання залишку малонілу відбувається зміщення рівноваги реакції в напрямі синтезу жирних кислот.
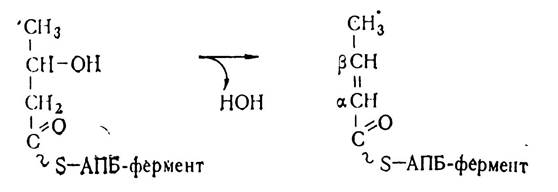
Потім ацетоацил-S—АПБ під впливом ферменту р-кето- ацил-АПБ-редуктази відновлюється з участю НАДФ-Н+Н+ до р-гідроксіацил-S—АПБ;

Гідроксибутирил-S—АПБ втрачає молекулу води під впливом ферменту еноїл-АПБ-дегідратази синтетазного комплексу і перетворюється в α, β-ненасичену форму ацильного похідного АПБ-кротоніл-S—АПБ.
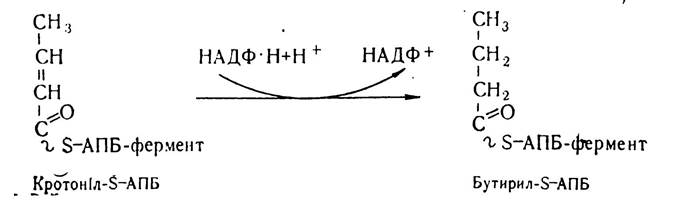
Кротоніл-S—АПБ з участю кротоніл-S—АПБ-редуктази синтетазного комплексу відновлюється до бутирил-S—АПБ.
Утворенням цієї чотиривуглецевої сполуки завершується перший цикл біосинтезу жирних кислот. Подовження ланцюга при синтезі жирних кислот відбувається внаслідок наступних реакцій, які проходять в такій самій послідовності. Знову малоніл-КоА під впливом малоніл-трансацилази переноситься на тіолову групу SH—АПБ з утворенням малоніл-S—АПБ, який під впливом конденсуючого ферменту синтетазного комплексу взаємодіє з бутирил-S—АПБ. Внаслідок цієї реакції та декарбоксилювання малонільного залишку утворюється р-кетоацил, що має на два вуглецеві залишки більше, ніж попередній ацил.
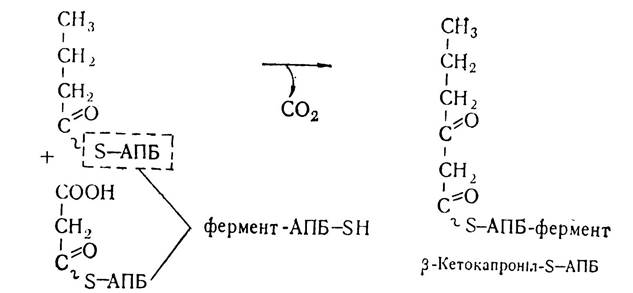
Внаслідок наступних реакцій відновлення і дегідратації ланцюг жирної кислоти подовжується ще на два вуглецевих атоми. Якщо такий цикл повториться шість разів, то утвориться молекула пальмітинової кислоти.
Отже, ріст ланцюга при синтезі жирної кислоти починається з карбоксильної групи ацетил-КоА і відбувається завдяки послідовному добавлянню ацетильних залишків до карбоксильного кінця зростаючого ланцюга. Кожний наступний ацетильний залишок є похідним малоніл-КоА і являє собою двовуглецевий фрагмент ближньої до КоА молекули малоніл-КоА, а третій найбільш віддалений від групи КоА атом вуглецю малоніл-КоА втрачається у вигляді СО2.
Сумарний процес біосинтезу жирної кислоти (пальмітинової) можна показати таким рівнянням:
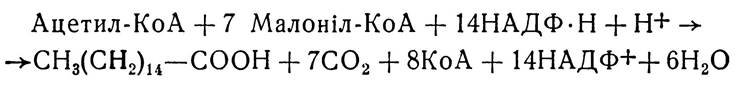
Тобто для синтезу однієї молекули пальмітинової кислоти використовується одна молекула ацетил-КоА і сім молекул малоніл-КоА. Після завершення біосинтезу утворене АПБ- похідне жирної кислоти реагує з коензимом А, внаслідок чого утворюється активна форма жирної кислоти — пальмі- тил-КоА, стеарил-КоА і т. д. При цьому відбувається регенерація АПБ—SH синтетазного поліферментного комплексу, який повторно може вступати в реакції біосинтезу жирних кислот.
Отже, можна зробити висновок, що синтез жирних кислот відрізняється від р-окислення цілим рядом особливостей. По-перше, ферментні системи, що забезпечують ці процеси, розміщені в різних місцях клітини. По-друге, (3-окислення жирних кислот відбувається з виділенням великої кількості енергії. Внаслідок процесів дисиміляції відбувається синтез АТФ і відновлених піридиннуклеотидів. При асиміляції (синтезі) жирних кислот використовується енергія АТФ та відновлених форм піридинових ферментів. По- третє, в процесах синтезу і розпаду жирних кислот беруть участь різні форми піридиннуклеотидів: при β-окисленні НАД+, а при синтезі — НАДФ+.
На першій стадії біосинтезу триацилгліцеридів гліцерофосфат взаємодіє з двома молекулами ацил-КоА, внаслідок чого утворюється фосфатидна кислота. Реакцію каталізує фермент гліцерофосфат ацилтрансфераза.
Фосфатидна кислота з участю ферменту L-a-фосфатид-фосфогідролази втрачає залишок фосфату і перетворюється в α, β-дигліцерид, який під впливом ферменту дигліцерид-трансацилази приєднує ще один залишок ацил-КоА і перетворюється в триацилгліцерид:
Фосфатидна кислота та α, β-діацилгліцерид є загальним проміжним продуктом біосинтезу триацилгліцеридів і фосфогліцеридів.
Крім наведеного фосфатидного способу біосинтезу жирних кислот, існує ще моногліцеридний біосинтез триацилгліцеридів. Цей процес відбувається переважно в слизовій оболонці тонкого кишечника під час всмоктування продуктів розщеплення жирів — моно- та дигліцеридів. Каталізують ці процеси ферменти моно- і дигліцерид-транс-ацилази.
Обмін складних ліпідів
Фосфатиди (фосфоліпіди) подібно до холестерину є важливими компонентами клітинних мембран, де вони виконують важливу структурну функцію і забезпечують протікання цілого ряду життєво важливих процесів. Крім того, ця група складних ліпідів сприяє всмоктуванню, транспорту та окисленню в тканинах простих жирів — триацилгліцеридів, тому обмін цих двох груп ліпідів в організмі досить тісно переплітається. При недостачі фосфоліпідів значно збільшується нагромадження жирів у печінці, що може призвести до її жирової інфільтрації. Враховуючи стимулюючий ефект азотовмісних компонентів фосфоліпідів, таких, як етаноламін, холін, коламін, їх називають ліпотропними факторами. Ліпотропна дія їх проявляється в тому, що вони необхідні для синтезу фосфоліпідів, які стимулюють обмін жирів.
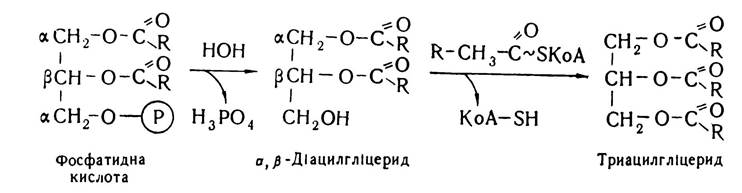
Розпад фосфоліпідів (фосфатидів). Фосфоліпіди, що потрапляють з продуктами харчування, розщеплюються в дванадцятипалій кишці під впливом гідролітичних ферментів — фосфоліпаз, які містяться в кишковому та панкреатичному соні. Розпад фосфоліпідів можна показати на прикладі лецитину (холінфосфатиду), молекула якого складається із залишку гліцерину, фосфорної кислоти, холіну та двох залишків жирних кислот.
На першій стадії від молекули лецитину під впливом фосфоліпази А відщеплюється молекула жирної кислоти в (β-положенні, внаслідок чого утворюється лізолецитин, який характеризується гемолітичною дією — зумовлює гемоліз еритроцитів. Потім від лізолецитину з участю фосфоліпази В відщеплюється друга молекула жирної кислоти, внаслідок чого утворюється а-гліцерофосфохолін:
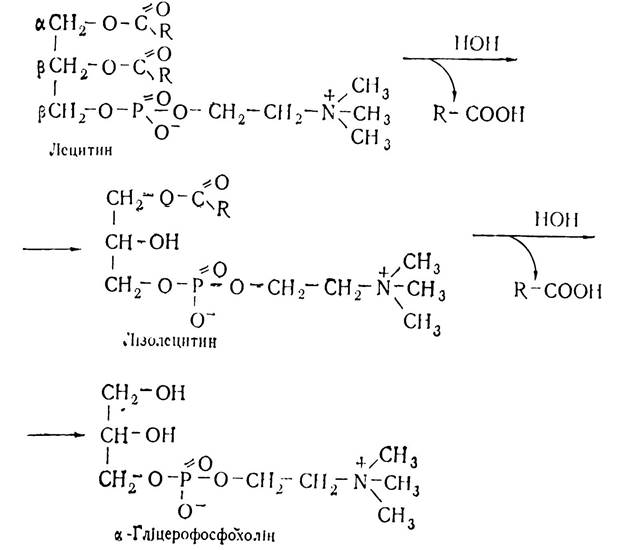
α-Гліцерофосфохолін з участю ферменту фосфоліпази D відщеплює холін і перетворюється в а-гліцерофосфат, який з участю фосфоліпази С гідролізується, утворюючи гліцерин.
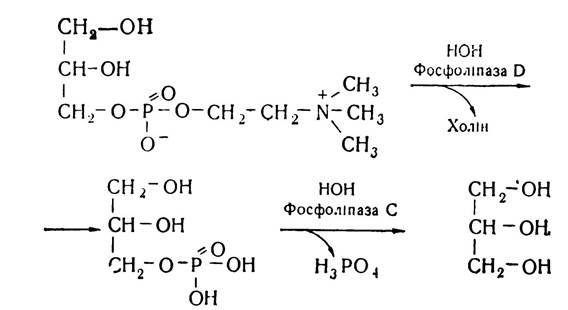
Отже, кінцевими продуктами розпаду лецитину під впливом фосфоліпаз є гліцерин, жирні кислоти, холін і фосфорна кислота. Аналогічно відбувається розпад інших груп фосфоліпідів — кефалінів, серинфосфатидів.
Продукти розщеплення фосфатидів всмоктуються епітеліальними клітинами слизової оболонки кишечника, де відбувається ресинтез їх, специфічний для певного організму. Частина фосфатидів може всмоктуватись без попереднього гідролізу у вигляді досить тонкої емульсії. Гліцерин всмоктується як у вільному стані, так і у вигляді гліцерофосфату, гліцерофосфохоліну. Основна кількість ресинтезованих фосфоліпідів, на відміну від тригліцеридів, переходить безпосередньо в капілярні судини і переноситься до різних органів — найбільше до печінки.
Частина фосфоліпідів використовується у вигляді пластичного матеріалу, а інша частина розпадається до кінцевих продуктів.
Утворений в результаті розпаду фосфоліпідів холін може піддаватись різноманітним перетворенням. У нервовій тканині під впливом ферменту холінацетилтрансферази відбувається перетворення його в ацетилхолін — важливий медіатор нервової системи. Він бере безпосередню участь у передачі нервових імпульсів у нервових центрах, а також від нервових волокон до різних органів.
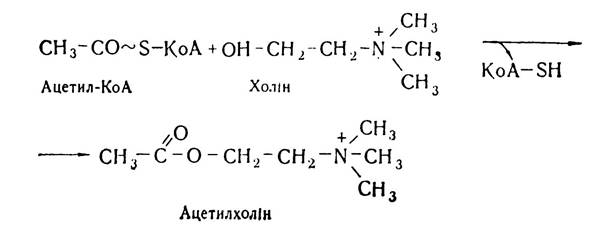
Досить важливою є роль холіну в обміні одновуглецевих залишків — метильних груп. Внаслідок окислення під впливом холіноксидази відбувається перетворення холіну до бетаїн-альдегіду і потім до бетаїну, який є безпосереднім донором метильних груп у реакціях біосинтезу метіоніну і гомоцистеїну. Таким чином, за рахунок холіну поповнюється резерв метильних груп.
Біосинтез холіну з гліцину і серину, а також участь у ньому метильних груп метіоніну, свідчать про те, що холін є однією з важливих ланок між обміном білків і ліпідів.
Біосинтез фосфатидів. Біосинтез фосфоліпідів, зокрема лецитину, досить інтенсивно відбувається в стінках тонкого кишечника, а також у печінці, де є субстрати, необхідні для цього процесу — гліцерин, жирні кислоти, фосфорна кислота та азотовмісні сполуки.
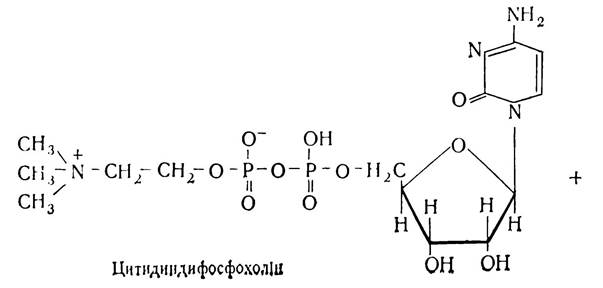
Процес біосинтезу фосфатидів (включно до утворення α, β-діацилгліцеридів) відбувається так само, як і біосинтез триацилгліцеридів, а наступні реакції пов’язані з активацією азотистих основ та взаємодією їх з α, β-діацилгліцеридами. Біосинтезу лецитину передує активування холіну. Суть активування полягає у взаємодії холіну з АТФ з участю ферменту холінкінази, внаслідок чого утворюється фосфохолін:

Потім фосфохолін з участю ферменту холінфосфатцитиди-лілтрансферази взаємодіє з цитидинтрифосфатною кислотою (ЦТФ) і перетворюється в цитидинфосфохолін. При цьому відщеплюється пірофосфат. Цитидинфосфохолін взаємодіє з дигліцеридом, внаслідок чого утворюється лецитин і цитидинмонофосфорна кислота (ЦМФ).
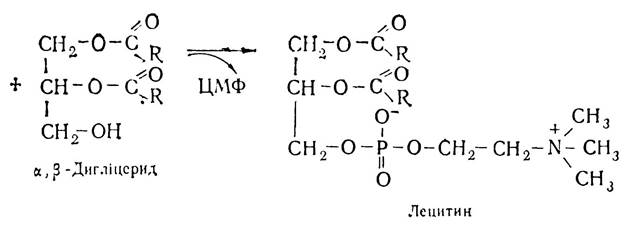
Подібно до лецитинів відбувається синтез коламінфосфатидів, серинфосфатидів та ін. Те, що в організмі утворюються триацилгліцериди і фосфатиди, свідчить, що між ними існує тісний взаємозіз’язок. Утворення спільних проміжних продуктів (фосфатидних кислот, α,β-дигліцеридів) підтверджує це.