БІОХІМІЯ - Підручник - Остапченко Л. І. - 2012
Розділ 5. БУДОВА, ВЛАСТИВОСТІ Й ФУНКЦІЇ БІЛКІВ
5.6.Різноманітність білків і їхня класифікація
5.6.3. Класифікація білків за функціями
Білки виконують у клітинах багато біологічних функцій. За ознакою схожості функцій, що виконуються білками, їх можна розділити на наступні великі групи: ферменти; регуляторні білки; рецепторні; транспортні; структурні; захисні та скоротливі білки.
Ферменти - спеціалізовані білки, які прискорюють перебіг хімічних реакцій. Завдяки ферментам у клітині швидкість хімічних реакцій збільшується в мільйони разів. Оскільки ферменти, як і будь-які білки, мають активний центр, вони специфічно зв'язують певний ліганд (або групу схожих лігандів) і каталізують певний тип хімічного перетворення даної молекули. Тепер відомо понад 2000 різних ферментів, котрі прискорюють різні ферментативні реакції. Наприклад, протеолітичний фермент трипсин руйнує в білках пептидні зв'язки, утворені карбоксильною групою основних амінокислот - аргініну або лізину, а фермент рибонуклеаза розщеплює фосфоефірний зв'язок між нуклеотидами в полінукле- отидному ланцюзі. Набір ферментів у клітинах забезпечує перетворення речовин не хаотично, а в точно визначених напрямках.
До регуляторних білків належить велика група білкових гормонів, які беруть участь у підтримці внутрішнього середовища організму і впливають на специфічні клітини-мішені. Так, гормон інсулін виділяється в кров під час підвищення концентрації глюкози у крові. Стимулюючи використання глюкози клітинами, він знижує її концентрацію до норми, тобто відновлює гомеостаз.
Крім того, до регуляторних відносять білки, приєднання яких до інших білків або деяких структур клітини регулює їхню функцію. Скажімо, білок кальмодулін у комплексі з чотирма іонами Са2+ може приєднуватися до деяких ферментів, змінюючи їхню активність.
Регуляторні ДНК-зв'язувальні білки, приєднуючись у певні моменти до специфічних ділянок ДНК, можуть регулювати швидкість зчитування генетичної інформації.
Сигнальні молекули (гормони, нейромедіатори) діють на внутрішньоклітинні процеси через взаємодію зі специфічними білками-рецепторами. Так, гормони, що циркулюють у крові, знаходять клітини-мішені й діють на них, специфічно зв'язуючись із білками-рецепторами, які вбудовані в клітинну мембрану. Для гідрофобних регуляторних молекул, що проходять через клітинну мембрану, рецептори локалізуються в цитоплазмі клітин.
Транспортні білки крові беруть участь у перенесенні специфічних лігандів з одного органу до іншого. Часто в комплексі з білками переносяться молекули, погано розчинні у воді. Так, білок плазми крові альбумін переносить жирні кислоти й білірубін (продукт розпаду гему), а гемоглобін еритроцитів бере участь у перенесенні О2 від легень до тканин. Стероїдні гормони переносяться у крові специфічними транспортними білками.
Транспортні білки беруть участь і в перенесенні гідрофільних речовин через гідрофобні мембрани. Оскільки транспортні білки мають властивість специфічно взаємодіяти з лігандами, їхній набір у клітинній мембрані визначає, які гідрофільні молекули можуть потрапити до клітини. За допомогою білків-переносників до клітини проникають глюкоза, амінокислоти, іони та інші молекули.
Структурні білки, розміщені певним чином у тканинах, надають їм форми, створюють каркас, визначають механічні властивості даної тканини. Наприклад, головним компонентом хрящів і сухожилків, як вже йшлося вище, є дуже міцний фібрилярний білок колаген. Інший структурний білок - еластин, - завдяки своїй унікальній будові, забезпечує певні тканини здатністю розтягуватися в усіх напрямках (судини, легені).
Захисні білки, зокрема імуноглобуліни, мають здатність упізнавати і зв'язувати чужорідні молекули, вірусні частинки та бактерії, у результаті чого відбувається їхня нейтралізація. Крім того, комплекс чужорідної частинки з імуноглобуліном легко впізнається і знищується клітинами імунної системи.
Захисні властивості мають білки системи згортання крові, наприклад фібриноген, тромбін. Вони беруть участь у формуванні тромбу, який закупорює пошкоджену судину й запобігає втраті крові.
Скоротливі білки під час виконання своїх функцій надають клітині здатності або скорочуватися, або рухатися. До них належать актин і міозин - фібрилярні білки, які беруть участь у скороченні скелетних м'язів. Інший приклад таких білків - тубулін, з якого побудовані клітинні органели - мікротрубочки. Останні у період поділу клітини регулюють розходження хроматид. Мікротрубочки - важливі елементи війок і джгутиків, за допомогою яких клітини рухаються.
Однак існує велика кількість білків з унікальними функціями, які не увійшли в цю досить просту класифікацію.
Родини споріднених білків. Під час еволюції в межах одного біологічного виду заміна амінокислотних залишків може зумовити виникнення різних білків, котрі виконують спорідненні функції та мають гомологічні послідовності амінокислот. Гомологічними називають послідовності, які мають багато схожих рис. Вони містять у багатьох положеннях одні й ті самі амінокислоти, які називають інваріантними, а в деяких положеннях можуть бути різні, але близькі за фізико-хімічними властивостями амінокислотні залишки.
Гомологічні білки мають схожі конформації: кількість і взаєморозміщення α-спіралі та/ або β-структур, більшість поворотів і вигинів поліпептидних ланцюгів схожі або ідентичні. Білки з гомологічними ділянками поліпептидного ланцюга, схожою конформацією та спорідненими функціями об'єднані в родину білків.
Прикладом родини споріднених білків є родина міоглобіну, куди входять, крім самого міоглобіну, також усі види гемоглобіну.
До родини споріднених білків відносять серинові протеази. Це родина ферментів, які використовують специфічно активований залишок серину, розташований у активному центрі. Мішенями для серинових протеаз є специфічні пептидні зв'язки в білках (часто в інших серинових протеазах).
Для всіх білків цієї родини характерна наявність в активному центрі залишків Сер195, Гіс57, Асп102 (цю нумерацію використовують незалежно від їхнього точного розташування в первинній структурі певних серинових протеаз). Було виявлено також високу спорідненість їхніх просторових структур, незважаючи на те, що лише в 40 % положень вони містять ідентичні амінокислоти (рис. 5.43). Каталітична ділянка серинових протеаз розташована в щілині між двома доменами.
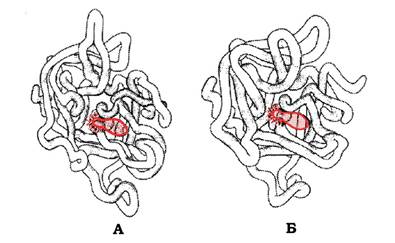
Рис. 5.43. Просторові структури еластази (А) і хімотрипсину (Б)
Деякі амінокислотні заміни привели до змін субстратної специфічності цих білків і до виникнення функціональної різноманітності всередині самої родини. Наприклад, травні серинові протеази беруть участь у травленні (гідролітичному розщепленні пеп- тидних зв'язків) денатурованих харчових білків. До них відносять трипсин, хімотрипсин, еластазу, але кожен із цих ферментів розриває пептидні зв'язки, утворені певними амінокислотами.
Субстратною специфічністю наділені також серинові протеази, які беруть участь у суворо контрольованих фізіологічних процесах, таких як активація каскаду білків згортання крові, фібринолізу, активація білків системи комплементу, утворення білків гормонів. У процесі активації нативних білків серинові протеази гідролізують один або два специфічні пептидні зв'язки із сотень зв'язків, що є в білковому субстраті. Це пов'язано з тим, що в нативному білку фермент упізнає не лише амінокислоти, які безпосередньо формують пептидні зв'язки, але й деякі амінокислотні залишки, які оточують зв'язок, котрий піддається ферментативному гідролізу.
У роботі імунної системи велику роль відіграють білки, які належать до суперродини імуноглобулінів. Ця суперродина містить три великі родини білків, котрі беруть участь в імунному захисті організму: це родина імуноглобулінів, родина Т-клітинних антигенрозпізнавальних рецепторів і білки головного комплексу гістосумістності І і ІІ класів, які в літературі позначають МНС (від англ. major histocompatibility complex). До цієї суперродини включено також родину адгезивних білків, що беруть участь в упізнаванні певних типів клітин та їхніх міжклітинних взаємодій.
Основним критерієм включення білків у суперродину імуноглобулінів є їхня доменна організація, достовірна гомологія амінокислотних послідовностей і просторове розташування структур окремих доменів. Крім того, білки цієї суперродини мають схожі функції: імуноглобуліни взаємодіють із чужорідними структурами, що містяться у крові, лімфі, міжклітинній рідині або секретах залоз, а рецептори Т-лімфоцитів і білки головного комплексу гістосумістності - з антигенами, розташованими на поверхні клітин даного організму.
Родина імуноглобулінів. Імуноглобуліни, або антитіла, - специфічні білки, які виробляються В-лімфоцитами у відповідь на надходження в організм чужорідних структур - антигенів. В організмі людини виробляється приблизно 107 клонів В-лімфоцитів, кожен з яких спеціалізований на вироблення одного з 107 видів імуноглобулінів.
Усі імуноглобуліни характеризуються загальним планом будови, який розглядатимемо на прикладі будови IgG. Молекула IgG складається із чотирьох поліпептидних ланцюгів: двох ідентичних легких (L - від англ. light), що містять близько 220 амінокислотних залишків, і двох важких (Н - від англ. heavy), які складаються із 440 амінокислот кожна. Усі чотири ланцюги сполучені один з одним багатьма нековалентними та чотирма дисульфідними зв'язками. Тому молекула IgG належить до мономерів.
Легкі ланцюги IgG складаються з двох доменів: варіабельного (Vl), що міститься в N-кінцевій ділянці поліпептидного ланцюга, і константного (СL), розташованого на С-кінці. Кожний із доменів складається з двох шарів із β-складчастою структурою, де ділянки поліпептидного ланцюга лежать антипаралельно. β-шар зв'язаний ковалентно дисульфідним зв'язком приблизно в середній частині домену (рис. 5.44).
Важкі ланцюги IgG мають чотири домени: один варіабельний (Vh), розташований на N-кінці, і три константних (СН1, СН2, СН3). Домени важких ланцюгів IgG мають гомологічну будову з доменами легких ланцюгів. Між двома константними доменами важких ланцюгів СH1 і СH2 є ділянка, в якій міститься велика кількість залишків проліну, які перешкоджають формуванню вторинної структури та взаємодії сусідніх Н-ланцюгів на даному відрізку. Цю ділянку називають шарнірною: вона надає молекулі гнучкості.
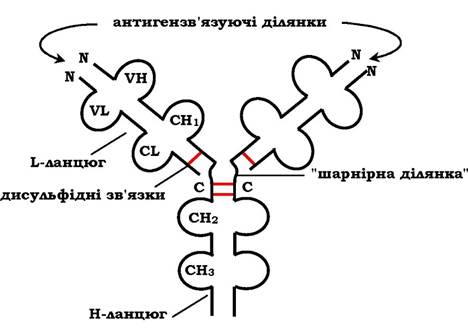
Рис. 5.44. Будова імуноглобуліну G
Між варіабельними доменами важких і легких ланцюгів є дві ідентичні ділянки, котрі зв'язують два однакові специфічні антигени; тому такі антитіла часто називають біваленти. У зв'язуванні антигену з антитілом бере участь не вся амінокислотна послідовність варіабельних доменів обох ланцюгів, а лише 20-30 амінокислот, що розташовані в гіперваріабельних ділянках кожного ланцюга. Саме ці ділянки визначають унікальну здатність кожного клону антитіл взаємодіяти з відповідним (комплементарним) антигеном.
Основні функції антитіл - виявлення та зв'язування чужорідних антигенів, що знаходяться в організмі поза його клітинами (у крові, лімфі, міжклітинній рідині, слизових секретах). Процес здійснюється за допомогою специфічних антигензв'язувальних ділянок різних клонів імуноглобулінів. Крім того, завдяки зв'язуванню антигену з антитілом полегшується процес подальшого руйнування чужорідних речовин. Специфічність шляху руйнування комплексу антиген - антитіло залежить від класу антитіл.
Існує п'ять класів важких ланцюгів імуноглобулінів, які відрізняються будовою константних доменів: α, δ, ε, γ і μ. Відповідно до них розрізняють п'ять класів імуноглобулінів: A, D, E, G і M. Особливості будови важких ланцюгів зумовлюють їхні шарнірні та С-кінцеві ділянки, які мають характерну для кожного класу конформацію. Зв'язування антигену з антитілом змінює конформацію константних доменів важких ланцюгів, що визначає шлях руйнування комплексу в організмі (зв'язування з білками системи комплементу або поглинання комплексу фагоцнтуючими клітинами).
Імуноглобуліни М - перший клас антитіл, які синтезуються в В-лімфоцитах, що розвиваються. Розрізняють дві форми імуноглобулінів М: мономерну, мембранно-зв'язану форму та пентамерну, що секретується В-лімфоцитами в крові.
В-лімфоцити, які дозрівають, синтезують мономерні бівалентні молекули IgM, за структурою подібні до розглянутих вище IgG, які вбудовуються в плазматичну мембрану клітин і грають роль перших антигенрозпізнавальних рецепторів. Прикріплення IgM до мембрани здійснюється за допомогою гідрофобної ділянки, яка міститься в С-кінцевій ("хвостовій") ділянці важких ланцюгів і має 25 гідрофобних амінокислотних залишків.
Взаємодія антигену з рецептором на поверхні В-лімфоцита викликає його розмноження й утворення цілого клону лімфоцитів, котрі походять від однієї стимульованої антигеном клітини. Цей клон В-лімфоцитів буде виробляти імуноглобуліни з однаковими антиген-зв'язувальними ділянками. Проте В-лімфоцити здатні переключатися на вироблення інших класів антитіл.
Коли В-лімфоцити вперше зустрічаються в рідинах організму з невідомим раніше антигеном, вони синтезують і секретують у кров IgM, які містять п'ять мономерних субодиниць, зв'язаних одна з одною дисульфідними зв'язками й додатковим поліпептид- ним J-ланцюгом (рис. 5.45).
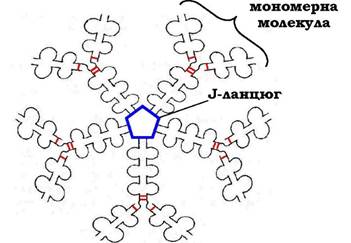
Рис. 5.45. Будова пентамерної секреторної молекули імуноглобуліну М
У важких ланцюгах їхніх мономерів відсутня гідрофобна "хвостова" частина. Пентамерна молекула містить десять ділянок зв'язування з антигеном, що збільшує вірогідність прикріплення невідомого раніше антигену до імуноглобуліну (рис. 5.46).
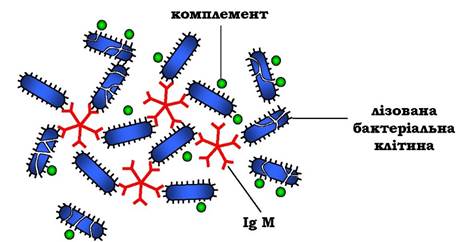
Рис. 5.46. Зв'язування IgM з антигенами бактеріальних клітин і руйнування їх активованими білками системи комплементу
Взаємодія антигену з IgM змінює його конформацію та індукує зв'язування його "хвостової" ділянки з першим компонентом системи комплементу. Якщо антиген розміщений на поверхні мікроорганізму, активування системи комплементу викликає порушення цілісності клітинної мембрани й загибель бактеріальної клітини.
У кількісному відношенні імуноглобуліни G домінують у крові та становлять близько 75 % від загальної кількості цих білків. Будову IgG докладно описано вище. У крові IgGмістяться лише в мономерній формі; вони секретуються активованими В-лімфо- цитами у великих кількостях під час вторинної імунної відповіді, коли антиген повторно потрапляє до організму.
У людини знайдено чотири підкласи IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковий номер вказує на кількісний вміст кожного підкласу в сироватці (у найбільшій кількості міститься IgGg1, у найменшій - IgGg4). Ступінь гомології між цими підкласами є дуже високою (близько 90-95 %).
IgG не тільки ефективно зв'язують та інактивують чужорідні молекули і клітини, що потрапили до організму, але й полегшують їхнє подальше знищення. Конформаційні зміни у "хвостовій" ділянці IgG після його взаємодії з антигеном приводять до зв'язування й активації білків системи комплементу. Крім того, С-кінцева ділянка IgG здатна взаємодіяти зі специфічними рецепторами макрофагів і нейтрофілів, що зумовлює фагоцитоз комплексів антиген - антитіло та руйнування їх у фагосомах (рис. 5.47).
IgG - єдиний клас антитіл, здатний проникати через плацентарний бар'єр і забезпечувати внутрішньоутробний захист плоду від інфекцій.
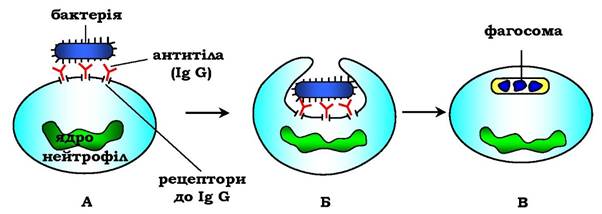
Рис. 5.47. Фагоцитоз комплексу антиген-антитіло нейтрофілом:
А - взаємодія бактерії, укритої IgG з рецепторами нейтрофілів; Б - поглинання бактерії нейтрофілом;
В - перетравлення бактерії всередині фагосоми нейтрофіла
Імуноглобуліни А - основний клас антитіл, присутній у секретах залоз організму (слина, молоко, травний сік, секрети дихальних шляхів). У сироватці крові його вміст не перевищує 10-15 % від загальної кількості імуноглобулінів. Мономерна форма за будовою нагадує IgG. Але в секретах IgA набуває в основному форму димеру, де мономери сполучені додатковим пептидним ланцюгом J (рис. 5.48).
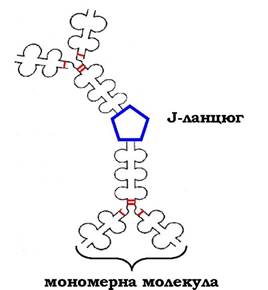
Рис. 5.48. Будова димерної молекули імуноглобуліну
На базальній поверхні епітеліальних клітин димер IgA специфічно взаємодіє з білками клітинної поверхні, які називаються секреторним компонентом. Утворений комплекс шляхом ендоцитозу транслокується всередину клітини й переміщується до її апікальної частини. Тут комплекс піддається дії протеолітичних ферментів, і вільний димер переходить в позаклітинний простір (рис. 5.49).
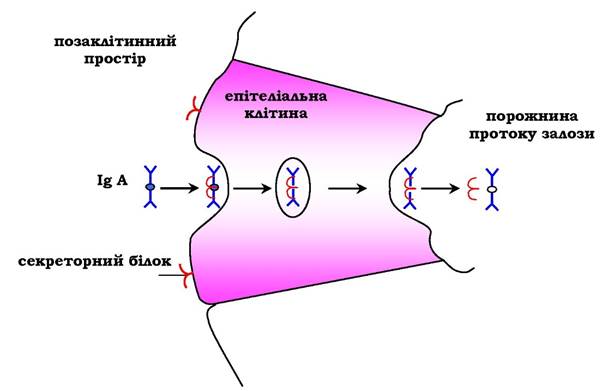
Рис. 5.49. Транспорт імуноглобулінів А через епітеліальні клітини у протоки залоз
Утворений під час взаємодії IgA з антигеном комплекс не взаємодіє з білками системи комплементу й фагоцитуючими клітинами, але запобігає прикріпленню антигенів до поверхні епітеліальних клітин і проникненню їх до організму.
Вміст імуноглобуліни Е у крові досить малий. IgE - мономери, але на відміну від IgG, їхні важкі ланцюги містять не три, а чотири константні домени. Після синтезу й секреції у кров В-лімфоцитами IgE зв'язуються своїми С-кінцевими ділянками з відповідними рецепторами на поверхні тучних клітин і базофілів (рис. 5.50).
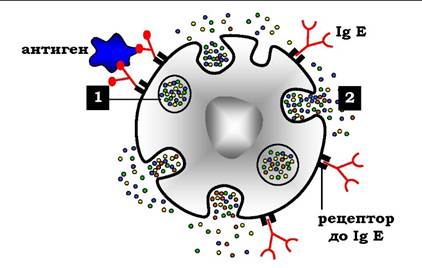
Рис. 5.50. Виділення біологічно активних речовин тучною клітиною в результаті приєднання антигену до фіксованих на його поверхні IgE: 1 - гранули заповненні гістаміном, серотоніном та іншими медіаторами; 2 - виділення гістаміну та інших медіаторів у позаклітинний матрикс
Після приєднання антигену хоча б до двох антигензв'язувальних ділянок двох сусідніх IgE клітина отримує сигнал до секреції біологічно активних речовин (серотоніну, гістаміну), що зберігаються в секреторних пухирцях. Виділення цих речовин значною мірою відповідає за розвиток запальної реакції, а також таких алергічних реакцій, як бронхіальна астма, кропивниця (кропив'янка), сінна лихоманка. Збільшення кількості IgE може передувати розвитку алергічних реакцій.
Імуноглобуліни D знайдені в крові в дуже малих кількостях. Мономерні білки відіграють роль рецепторів В-лімфоцитів; інших функцій у IgD поки що не виявлено.
Родина Т-клітинних рецепторів, що розпізнають антиген. Якщо антитіла, які виробляються В-лімфоцитами, зв'язують антигени в рідинах організму (так званий гуморальний імунітет), то Т-лімфоцити взаємодіють з антигенами на поверхні заражених вірусами та змінених у результаті пухлинної трансформації власних клітин організму (клітинний імунітет). Т-лімфоцити впізнають антигени тільки в комплексі з молекулами МНС І чи ІІ класу, що також присутні на клітинній поверхні.
Рецептори Т-лімфоцитів є гетеродимерами, тобто складаються з а- і β-ланцюгів. Кожен ланцюг має два імуноглобуліно- подібних домени: варіабельний (V) і константний (С) (рис. 5.51). С-кінцеві ділянки кожного ланцюга вбудовані в плазматичну мембрану. Єдина антигензв'язувальна ділянка розміщена між двома варіабельними доменами Vα і Vβ. Кількість рецепторів Т-лімфоцитів з різними антигензв'язувальними ділянками зіставна з різноманітністю імуноглобулінів.
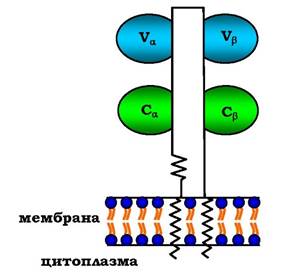
Рис. 5.51. Будова рецептора Т-лімфоцитів
Родина білків головного комплексу гістосумісності. Білки головного комплексу гістосумісності були відкриті під час вивчення питань внутрішньовидової пересадки тканин, звідки й пішла їхня назва. Їх називають також білками МНС (див. вище), або білками HLA (від англ. human lymphocyte antigen - людські лімфоцитарні антигени), оскільки вперше вони були знайдені на лімфоцитах людини.
Існує два основні класи молекул МНС: І та ІІ. Молекули МНС класу І розміщені на поверхні практично всіх клітин організму людини, а білки МНС класу ІІ - тільки на певних клітинах імунної системи, які називають антигенпрезентуючими клітинами. До них належать насамперед макрофаги й В-лімфоцити, що контактують з антигеном.
Молекули МНС класу І - гетеродимери. Вони мають один полі- пептидний α-ланцюг, зв'язаний нековалентними зв'язками з невеликим позаклітинним білком Р2-мікроглобуліном. Поліпептидний α-ланцюг має три позаклітинні глобулярні домени (α1, α2, α3), трансмембранну ділянку й карбоксильний кінець, локалізований у цитоплазмі (рис. 5.52, А). α3-Домен і β2-мікроглобулін мають конформацію, що нагадує структуру імуноглобулінів. Домени α1 та α2 містять варіабельні ділянки, здатні зв'язувати "розгорнутий" антиген (найчастіше пептидний фрагмент чужорідного білка), розміщений на поверхні клітин.
Молекули МНС класу ІІ - також гетеродимери. Вони складаються з двох поліпептидних ланцюгів - α і β, які мають по одному консервативному імуноглобуліноподібному домену та по одному варіабельному домену на N-кінцевих ділянках. Зв'язування антигенів відбувається в ділянці варіабельних доменів а- і β-ланцюгів (рис. 5.52, Б).
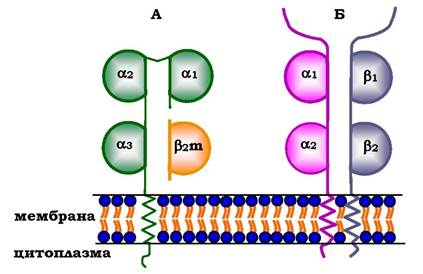
Рис. 5.52. Будова білків головного комплексу гістосумісності: МНС класу І (А) і МНС класу ІІ (Б)
Чужорідні білки у клітині людини (наприклад, білки вірусних частинок), у лізосомах піддаються обмеженому протеолізу, і невеликі фрагменти цих білків разом із білками МНС класу І або ІІ експонуються на поверхні клітинної мембрани.
Комплекси пептид - білок МНС упізнаються рецепторами Т-лімфоцитів. У результаті відбувається специфічна взаємодія (рис. 5.53), активація Т-лімфоциту та розвиток імунної реакції. Так, взаємодія цитотоксичного Т-лімфоцита з комплексом антиген - МНС І на поверхні інфікованої вірусом клітини приводить до виділення лімфоцитом спеціальних білків, які викликають пошкодження й загибель інфікованої клітини.
Ізофункціональні білки - родина білків, які виконують практично однакову або схожу функцію, але невеликі особливості будови та функціонування деяких членів цієї родини можуть мати важливе фізіологічне значення. Приклад таких білків - ізоформи гемоглобіну людини: HbA, HbA2, HbF та інші, які розглядали вище. Усі вони є тетрамерами, але складаються з різного набору протомерів а, β, γ, δ. Гемоглобіни виконують однакову функцію - приєднують О2 і переносять його до тканин. Однак кожен із них наділений функціональними особливостями. Так, гемоглобін F має більшу спорідненість до О2, ніж HbA, і завдяки цьому забезпечує дифузію О2 від HbA з крові матері до HbF у крові плоду.
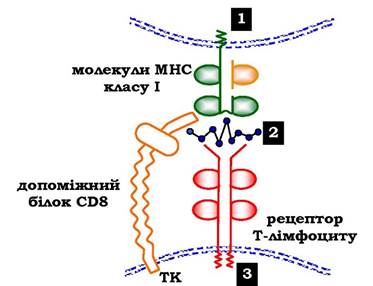
Рис. 5.53. Специфічна взаємодія рецептора цитотоксичного Т-лімфоцита з комплексом антиген - МНС І білок:
1 - клітина-мішень, уражена вірусом; 2 - пептидний антиген на поверхні клітини, з'єднаний із МНС І;
3 - цитотоксичний Т-лімфоцит; ТК — тирозинкіназа
Ізобілки - множинні форми білка, які знаходять в організмах одного виду. Білки, котрі виконують однакові функції в організмах різних біологічних видів, називаються гомологічними. Наприклад, цитохром С - мітохондріальний білок, який бере участь у біологічному окисненні, присутній у багатьох видів тварин. Цитохроми С курки та качки, що відрізняються лише двома амінокислотними залишками в первинній структурі, виконують однакову функцію, Однак через те, що вони належать до різних видів, їх відносять до гомологічних білків.
До ізобілків відносять також велику кількість ізоформ структурного білка колагену. Багато ферментів мають декілька ізо- форм і називаються ізоферментами.