БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
3. ХИМИЧЕСКИЕ КОМПОНЕНТЫ ЖИВОГО
3.1. Введение в биохимию
Изучение химии живых организмов, т. е. биохимии, тесно связано с общим бурным развитием биологии в XX в. Значение биохимии заключается в том, что она дает фундаментальное понимание физиологии, иными словами, понимание того, как работают биологические системы. Это в свою очередь находит применение в сельском хозяйстве (создание пестицидов, гербицидов и т. п.); в медицине (включая всю фармацевтическую промышленность); в различных бродильных производствах, которые поставляют нам широкий ассортимент продуктов, в том числе и хлебобулочных изделий; наконец во всем, что связано с пищей и питанием, т. е. в диететике, в технологии производства пищевых продуктов и в науке об их хранении. С биохимией связано и появление ряда новых перспективных направлений в биологии, таких как генная инженерия, биотехнология или молекулярный подход к изучению генетических болезней.
Биохимия играет также важную объединяющую роль в биологии. При рассмотрении живых организмов на биохимическом уровне чаще бросаются в глаза не столько различия между ними, сколько их сходство.
3.1.1. Элементы, содержащиеся в живых организмах
В земной коре встречается около 100 химических элементов, но только 16 из них необходимы для жизни (табл. 3.1). Наиболее распространены в живых организмах (в порядке убывающего числа атомов) четыре элемента: водород, углерод, кислород и азот. На их долю приходится более 90% как массы, так и числа атомов, входящих в состав всех живых организмов. Однако в земной коре первые четыре места по распространенности занимают кислород, кремний, алюминий и натрий. Биологическое значение водорода, кислорода, азота и углерода связано в основном с их валентностью, равной соответственно 1, 2, 3 и 4, а также с их способностью образовывать более прочные ковалентные связи, нежели у других элементов той же валентности. Приложение 1 знакомит нас с основами химии, в том числе и с таким понятием, как «ковалентная связь» (приложение I, т. 3). Полезно обратиться к нему, прежде чем продолжать читать эту главу.
Таблица 3.1. Элементы, встречающиеся в живых организмах*
Главные элементы органических молекул |
Ионы |
Микроэлементы |
|
Н (водород) |
Na+ (натрий) |
Мn (марганец) |
В (бор) |
С (углерод) |
Mg2+ (магний) |
Fe (железо) |
Аl (алюминий) |
N (азот) |
Cl- (хлор) |
Со (кобальт) |
Si (кремний) |
О (кислород) |
K+ (калий) |
Сu (медь) |
V (ванадий) |
Р (фосфор) |
Са2+ (кальций) |
Zn (цинк) |
Мо (молибден) |
S (сера) |
I (иод) |
||
* Порядок расположения атомов в каждом столбце определяется их атомными номерами, а не относительным содержанием. Элементы, перечисленные в трех первых столбцах, встречаются во всех организмах. (По A L. Lehninger, Biochemistry, Worth. N.Y. 1970.) |
|||
Значение углерода
Иногда говорят, что основу жизни на нашей планете составляет углерод. Этот элемент обнаружен во всех органических молекулах. Понятие «органический» в смысле «живой» употреблялось первоначально потому, что в то время только живым существам приписывалась способность образовывать органические соединения. Убеждение это опроверг немецкий химик Вёлер, синтезировавший в 1828 г. органическое вещество мочевину из неорганических исходных веществ. Это вынудило ученых признать, что для синтеза химических компонентов живого не требуется никакой магии, никакой особой «жизненной силы». Теоретически в наше время мы готовы к тому, чтобы синтезировать из неорганических исходных веществ даже ДНК, т. е. генетический материал, а значит, готовы уже «создать» жизнь.
Но почему столь важен именно углерод? Углерод образует с другими элементами прочные ковалентные связи, т. е. обобществляет с ними электроны. Он образует четыре ковалентные связи; его валентность, следовательно, равна 4. Простой пример такого обобществления электронов — метан, имеющий эмпирическую формулу СН4. Структурная формула метана представлена на рис. 3.1. (См. также приложение 1, т. 3.) В дополнении 3.1 приводятся правила написания структурных формул.

Рис. 3.1. Строение молекулы метана (одной из простых органических молекул). А. Структурная формула. Атомы углерода соединяются друг с другом или с атомами других элементов путем образования ковалентных связей. Каждый углеродный атом способен образовать четыре ковалентные связи. Б и В. Два способа изображения пространственных моделей молекул. Верхняя модель из стержней и шариков дает представление о тетраэдрическом расположении углеродных связей: нижняя показывает, что в действительности атомы располагаются гораздо ближе друг к другу.
Дополнение 3.1. Способы написания структурных формул
Структурные формулы часто изображают в упрощенном виде, чтобы внимание можно было сосредоточить на самых важных химических группах. В качестве простого примера на рис. 3.2 приведена формула этановой (уксусной) кислоты. В упрощенном ее изображении исключены все атомы углерода и все непосредственно связанные с ними водородные атомы. Эмпирическая формула уксусной кислоты имеет вид СН3СООН. Ее можно записать также в виде С2Н4О2, но первый вариант предпочтительнее, поскольку он дает представление об относительном расположении присутствующих в молекуле групп. А именно оно и определяет свойства молекул.
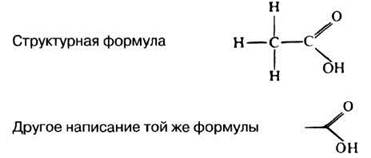
Рис. 3.2. Два способа изображения структурных формул этановой (уксусной) кислоты СН3СООН.
3.1. На основе прочитанного укажите, в чем заключается различие между эмпирической и структурной формулами.
Значение углерода определяется способностью его атомов соединяться друг с другом, образуя цепи или кольца, как показано на рис. 3.3. Эти цепи и кольца служат скелетом органических молекул, т. е. скелетом живого. Они весьма стабильны, потому что ковалентные связи, которыми соединены друг с другом углеродные атомы, отличаются высокой прочностью. Атомы или группы атомов других элементов (их называют просто группами) могут присоединяться к углеродному скелету в том или ином положении. Наиболее часто встречающиеся группы перечислены в табл. 3.2. Каждая из них характеризуется своими особыми свойствами. От карбоксильной группы, —СООН, зависит, например, кислый характер жирных кислот и аминокислот.
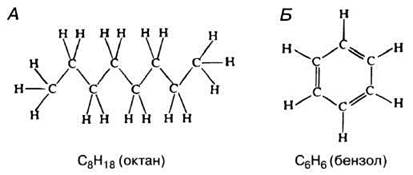
Рис. 3.3. Цепь (А) и кольцо (Б), построенные из атомов углерода путем образования С-С-связей.
Обратите внимание на упрощенное написание формул в табл. 3.2. Так, группу ![]() можно записать и в виде —СНО.
можно записать и в виде —СНО.
3.2. На рис. 3.3. представлены структурные формулы октана (А) и бензола (Б). Предложите упрощенные обозначения для этих соединений, руководствуясь правилами, изложенными в дополнении 3.1 (см. рис. 3.2).
КРАТНЫЕ СВЯЗИ. Из табл. 3.2 и рис. 3.3 видно, что углеродные атомы способны образовывать кратные связи. Такие связи они образуют между собой, а также с кислородом и азотом:
Двойные связи: ![]()
Тройные связи (редки в природе): ![]()
Таблица 3.2. Некоторые химические группы, наиболее часто встречающиеся в органических соединениях
Альдегидная группа |
|
Кетогруппа (оксогруппа) |
|
Гидроксильная группа Карбоксильная группа |
|
Карбонильная группа |
|
Аминогруппа |
|
Сульфгидрильная группа |
-S-H |
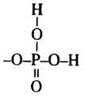
Фосфатная группа |
|
Соединения, содержащие двойные (=) или тройные (≡ углерод—углеродные связи, называются ненасыщенными. В насыщенном соединении имеются только простые (одинарные) углерод—углеродные связи.
3.3. Напишите структурную формулу ненасыщенного органического соединения этена (этилена) С2H4.
Суммируем важные химические свойства углерода.
1. Его атомы сравнительно малы и атомная масса невелика.
2. Он способен образовывать четыре прочные ковалентные связи.
3. Он образует углерод—углеродные связи, строя таким путем длинные углеродные скелеты молекул в виде цепей и(или) колец.
4. Он может образовывать кратные ковалентные связи с другими углеродными атомами, а также с кислородом и азотом.
Это уникальное сочетание свойств обеспечивает колоссальное разнообразие органических молекул. Разнообразие проявляется в 1) размерах молекул, определяемых числом углеродных атомов в скелете; 2) химических свойствах, которые зависят от присоединенных к скелету элементов и химических групп, а также от степени насыщенности скелета; и наконец, 3) различной формемолекул, определяемой геометрией, т. е. углами связей.