БИОЛОГИЯ Том 1 - руководство по общей биологии - 2004
3. ХИМИЧЕСКИЕ КОМПОНЕНТЫ ЖИВОГО
3.1. Введение в биохимию
3.1.2. Биологические молекулы
Живые организмы состоят из ограниченного числа элементов (мы перечислили их выше, в табл. 3.1); соединяясь, эти элементы образуют молекулы — строительные блоки живого. Молекулы бывают самых разных размеров — от совсем небольших, вроде диоксида углерода или воды, до таких гигантских, как молекулы белка (макромолекулы). Малые молекулы растворимы и обычно участвуют в общей химической активности клеток, в так называемом метаболизме. Более крупные молекулы служат резервом энергии или выполняют структурные функции, а некоторые из них можно назвать «информационными»: они являются носителями генетической информации (ДНК и РНК) или участвуют в ее реализации (белки).
Из малых молекул больше всего в организме содержится воды — от 60 до 95% общей сырой массы. Во всех организмах мы находим также и некоторые простые органические соединения, играющие роль «строительных блоков», из которых строятся более крупные молекулы (рис. 3.4). По мнению биологов, эти немногие виды молекул могли синтезироваться в «первичном бульоне» (т. е. концентрированном растворе химических веществ) в мировом океане на ранних этапах существования Земли, еще до появления жизни на ней (гл. 26). Простые молекулы строятся в свою очередь из еще более простых неорганических молекул, а именно из диоксида углерода, азота и воды.
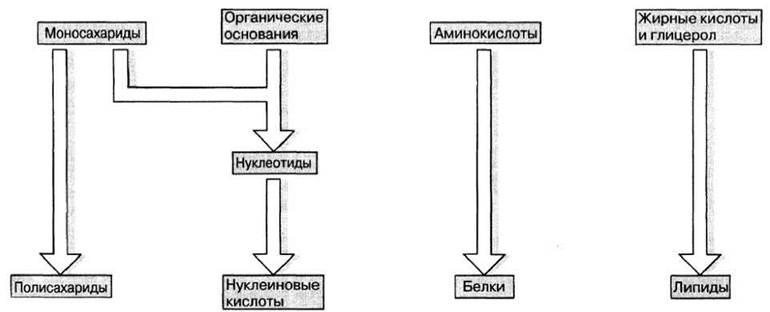
Рис. 3.4. «Строительные блоки» биомолекул.
Важная роль воды
Без воды жизнь на нашей планете не могла бы существовать. Вода важна для живых организмов по двум причинам. Во-первых, она является необходимым компонентом живых клеток, и, во-вторых, для многих организмов она служит еще и средой обитания. Именно поэтому следует сказать несколько слов о ее химических и физических свойствах.
Свойства эти довольно необычны и обусловлены главным образом малыми размерами молекул воды, их полярностью и способностью соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы («полюс») несет небольшой положительный заряд, а другой — отрицательный. Такую молекулу называют диполем. У атома кислорода способность притягивать электроны выражена сильнее, чем у водородных атомов, поэтому атом кислорода в молекуле воды стремится оттянуть к себе электроны двух водородных атомов. Электроны заряжены отрицательно, в связи с чем атом кислорода приобретает небольшой отрицательный заряд, а водородные атомы — положительный.
В результате между молекулами воды возникает слабое электростатическое взаимодействие и, поскольку противоположные заряды притягиваются, молекулы как бы «склеиваются» (рис. 3.5, А). Эти взаимодействия, более слабые, чем обычные ионные или ковалентные связи, называются водородными связями. Водородные связи постоянно образуются, распадаются и вновь возникают в толще воды (рис. 3.5, Б). И хотя это слабые связи, но их совокупный эффект обусловливает многие необычные физические свойства воды. Учитывая данную особенность воды, мы можем теперь перейти к рассмотрению тех ее свойств, которые важны с биологической точки зрения.
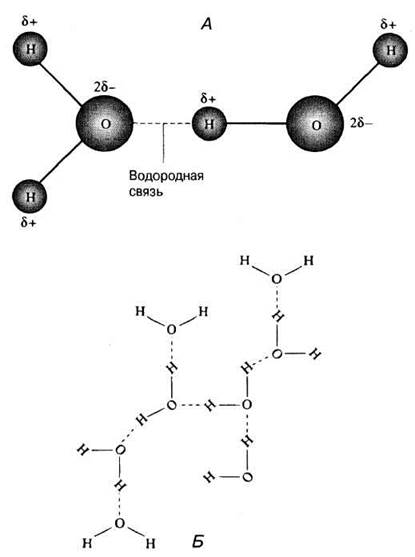
Рис. 3.5. Водородные связи между молекулами воды. А. Две молекулы воды, соединенные водородной связью. δ+ — очень маленький положительный заряд; δ- — очень маленький отрицательный заряд. Б. Сеть из молекул воды, удерживаемых вместе водородными связями. Такие структуры постоянно образуются, распадаются и вновь возникают в воде, находящейся в жидком состоянии.
Биологическое значение воды
ВОДА КАК РАСТВОРИТЕЛЬ. Вода — превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, содержащие заряженные частицы (ионы), и некоторые неионные соединения, например сахара, в молекуле которых присутствуют полярные (слабо заряженные) группы (у сахаров это несущая небольшой отрицательный заряд гидроксильная группа, —ОН). Когда вещество растворяется в воде, молекулы воды окружают ионы и полярные группы, отделяя ионы или молекулы друг от друга (рис. 3.6).
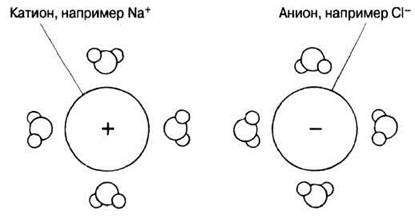
Рис. 3.6. Распределение молекул воды вокруг ионов в растворе. Обратите внимание, что более электроотрицательные атомы кислорода молекул воды обращены в сторону катиона, а вокруг аниона они направлены, наоборот, наружу. Молекулы воды разделяют ионы и удерживают их на определенном расстоянии друг от друга вследствие того, что в совокупности притяжение между ними и ионами сильнее, чем между катионами и анионами. Не будь этого, ионы образовали бы твердый кристалл, как кристалл хорошо нам знакомой поваренной соли. В воде же соль растворяется.
В растворе молекулы или ионы получают возможность двигаться более свободно, так что реакционная способность вещества возрастает. По этой причине в клетке большая часть химических реакций протекает в водных растворах. Неполярные вещества, например липиды, отталкиваются водой и в ее присутствии обычно притягиваются друг к другу, иными словами, неполярные вещества гидрофобны (гидрофобный — водоотталкивающий). Подобные гидрофобные взаимодействия играют важную роль в формировании мембран, а также в определении трехмерной структуры многих белковых молекул, нуклеиновых кислот и других клеточных компонентов.
Присущие воде свойства растворителя означают также, что вода служит средой для транспорта различных веществ. Эту роль она выполняет в крови, в лимфатической и экскреторной системах, в пищеварительном тракте и во флоэме и ксилеме растений.
БОЛЬШАЯ ТЕПЛОЕМКОСТЬ. Удельной теплоемкостью воды называют количество теплоты, которое необходимо, чтобы поднять температуру 1 кг воды на 1 °С. Вода обладает большой теплоемкостью. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Объясняется такое явление тем, что значительная часть энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды, т. е. на преодоление упомянутой выше «склеенности» ее молекул.
Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью, и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, обеспечивающей им довольно значительное постоянство условий.
БОЛЬШАЯ ТЕПЛОТА ИСПАРЕНИЯ. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для ее перехода в пар, т. е. для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии. Это объясняется существованием водородных связей между ее молекулами. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, а также при тепловой одышке у млекопитающих или у некоторых рептилий (например, у крокодилов), которые на солнцепеке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев. Большая теплота испарения означает, что отдача организмом даже больших количеств тепла сопровождается минимальными потерями воды, т. е. не обязательно ведет к его обезвоживанию.
БОЛЬШАЯ ТЕПЛОТА ПЛАВЛЕНИЯ. Скрытая теплота плавления — это мера тепловой энергии, необходимой для расплавления твердого вещества (в нашем случае — льда). Для плавления (таяния) льда необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
ПЛОТНОСТЬ И ПОВЕДЕНИЕ ВОДЫ ВБЛИЗИ ТОЧКИ ЗАМЕРЗАНИЯ. Плотность воды от +4 до 0 °С понижается, поэтому лед легче воды и в воде не тонет. Вода — единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом.
Поскольку лед плавает в воде, он образуется сначала на ее поверхности и лишь затем в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоемах вообще не могла бы существовать. Лед покрывает толщу воды, как одеялом, что повышает шансы на выживание у организмов, обитающих в воде. Это важно в условиях холодного климата и в холодное время года, но, несомненно, особенно важную роль это играло в ледниковый период. Кроме того, находясь на поверхности, лед быстрее и тает. То обстоятельство, что слои воды, температура которых упала ниже 4°С, поднимаются вверх, обусловливает перемешивание воды в больших водоемах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоемы заселяются живыми организмами на большую глубину.
БОЛЬШОЕ ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ И КОГЕЗИЯ. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях (гл. 13). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
ВОДА КАК РЕАГЕНТ. Биологическое значение воды определяется тем, что она представляет собой один из необходимых метаболитов, т. е. участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода при фотосинтезе (разд. 7.6), а также участвует в реакциях гидролиза.
Некоторые важные с биологической точки зрения функции воды перечислены в табл. 3.3.
Таблица 3.3. Некоторые важные биологические функции воды
У всех организмов Обеспечивает поддержание структуры (высокое содержание воды в клетках, 70—95%) Служит растворителем и средой для диффузии Участвует в реакциях гидролиза Служит средой обитания для водных организмов Служит средой, в которой происходит оплодотворение Обеспечивает распространение семян, гамет и личиночных стадий водных организмов, а также семян некоторых наземных растений, например кокосовой пальмы |
У растений Обусловливает осмос и тургесцентность, от которых зависит многое: рост (увеличение размеров клеток), поддержание структуры, механизм работы устьиц и т. д. Участвует в фотосинтезе Обеспечивает транспирацию, а также транспорт неорганических ионов и органических молекул Обеспечивает прорастание семян — набухание, разрыв семенной кожуры и дальнейшее развитие |
У животных Обеспечивает транспорт веществ по кровеносной, лимфатической и экскреторной системам Обусловливает осморегуляцию Способствует охлаждению тела (потоотделение, тепловая одышка) Служит одним из компонентов смазки, например в суставах Несет опорные функции (пример — гидростатический скелет аннелид) Выполняет защитную функцию, например в слезной жидкости и в слизи Способствует миграции (морские течения) |