СОВРЕМЕННАЯ БОТАНИКА - П. РЕЙВН - 1990
РАЗДЕЛ II. ЭНЕРГИЯ И ЖИВЫЕ КЛЕТКИ
ГЛАВА 5. ПОТОК ЭНЕРГИИ
Окисление-воостановление
Взаимопревращение энергии происходит в результате химических реакций, когда энергия, запасенная в одних химических связях, переходит в другие, вновь образуемые химические связи. В подобных реакциях электроны переходят с одного энергетического уровня на другой. Во многих реакциях электроны переходят от одного атома или молекулы к другим. Данные реакции называют окислительно-восстановительными; они имеют большое значение для живых систем. Потеря электрона — это процесс окисления, и атом или молекула, потерявшие электрон, окисляются. Часто в процессе окисления участвует кислород, который обладает большим сродством к электронам и нередко выступает в роли их акцептора.
Восстановление — это присоединение электрона. Окисление и восстановление происходят синхронно; электрон, потерянный окисленным атомом, присоединяется к другому атому, который восстанавливается.
В окислительно-восстановительных реакциях, как правило, могут участвовать единичные электроны: например, натрий теряет электрон и окисляется до Na+, а хлор присоединяет электрон и восстанавливается до СI-. Однако окисление органических молекул идет с потерей как электронов, так и протонов, а их восстановление — с присоединением электронов и протонов.
Например, при окислении молекулы глюкозы теряются и электроны, и ионы водорода, которые присоединяются к кислороду:
С6Н12O6 + 6O2 —> 6СO2 + 6Н2O + энергия.
Электроны переходят на более низкий энергетический уровень, и энергия выделяется.
Напротив, в процессе фотосинтеза электроны и ионы водорода переносятся от воды к двуокиси углерода, т. е. происходит восстановление углекислоты с образованием глюкозы:
6СO2 + 6Н2O + энергия —> С6Н12O6 + 6O2.
В этом случае электроны переходят на более высокий энергетический уровень, и для осуществления этой реакции необходим приток энергии.
В живых системах к окислительно-восстановительным реакциям относятся фотосинтез (энергия запасается), гликолиз и дыхание (энергия выделяется). Как уже упоминалось, полное окисление моля глюкозы дает 686 ккал свободной энергии. (Напротив, в результате восстановления двуокиси углерода с образованием одного моля глюкозы в химических связях глюкозы запасается 686 ккал свободной энергии.) Причем, если бы при окислении глюкозы шло быстрое выделение энергии, то большинство этой энергии рассеялось бы в виде тепла. Естественно, это не только бы не принесло пользу клетке, а способствовало бы гибельному для нее увеличению температуры. Однако в живых системах есть механизмы, которые регулируют многочисленные химические реакции таким путем, что энергия запасается в особых химических связях и затем может выделяться постепенно, по мере необходимости.
Ферменты и живые системы
В любой живой системе происходят тысячи различных химических реакций, многие из которых идут синхронно. Сумма всех этих реакций называется метаболизмом (от греч. metabole — «изменение»). Если просто перечислить все отдельные химические реакции, то будет трудно представить общую картину метаболических реакций в клетке. К счастью, есть целый ряд принципиальных моментов, которые помогут разобраться в лабиринте клеточного метаболизма. Во-первых, во всех химических реакциях клетки участвуют ферменты — катализаторы и регуляторы метаболических процессов живых систем. Во-вторых, биохимики группируют эти реакции по отдельным этапам, которые образуют пути. Каждый путь может состоять из дюжины и более последовательных реакций и иметь свое значение для жизнедеятельности клетки или организма. Более того, некоторые пути имеют общие «ступени» реакций, например, связанные с синтезом различных аминокислот или азотистых оснований. Некоторые пути сходны; например, гидролиз жиров и окисление глюкозы проходят с выделением энергии (рис. 5-4).
Рис. 5-4. Современное шоссе и извилистые старые дороги справа от него — это альтернативные пути через горы. Также и идентичные химические реакции могут идти альтернативными путями, что приводит к значительной разнице в скоростях реакций

Многие живые системы имеют уникальные метаболические пути. Растительные клетки тратят энергию на образование целлюлозных оболочек; подобные синтетические реакции не идут в клетках животных. Красные кровяные клетки специализируются на синтезе гемоглобина; они найдены только у животных и человека. Не удивительно, что отличительные особенности клеток и организмов связаны не только с их структурой и функциями, но и с биохимическими процессами. Однако поразительно, что метаболизм во многих своих чертах одинаков у большинства самых разнообразных организмов; различия метаболических путей, например, человека, дуба, грибов и медузы очень тонкие. Некоторые пути обнаружены практически во всех живых системах.
«Размах» химической работы, совершаемой в клетке, может проиллюстрировать тот факт, что большая часть, т. е. тысячи различных молекул, обнаруженных в клетке, в ней же и образуются. Сумма химических реакций, участвующих в их синтезе, называется анаболизмом. Анаболические реакции обычно уменьшают энтропию и почти всегда идут с затратой энергии (эндергонически).
В клетках постоянно осуществляется и распад больших молекул; совокупность процессов распада называют катаболизмом. Катаболические реакции увеличивают энтропию и, как правило, идут с выделением энергии (экзергонически). Катаболические реакции служат для двух целей: (1) высвобождают энергию для анаболизма или другой работы клетки; (2) поставляют «сырье» для анаболических реакций. Следовательно, оба аспекта метаболизма — анаболизм и катаболизм — необходимы для нормальной жизнедеятельности клетки.
Живые системы осуществляют многочисленные химические реакции в необычайно трудных условиях. Большинство из них проходит внутри клетки, где перемешиваются тысячи различных молекул. Температура не может быть высокой, иначе многие хрупкие структуры, от которых зависит жизнь, могут разрушиться. Как же осуществляется эта сложная химическая работа? Ответить на этот вопрос можно одним словом — ферменты. Биохимические реакции без ферментов проходили бы настолько медленно (если бы проходили вообще), что жизнь прекратилась бы.
Ферменты как катализаторы
Ферменты — это катализаторы биологических реакций. Они отличаются от других катализаторов тем, что чрезвычайно избирательны в своем действии. Некоторые ферменты катализируют реакцию только с одним набором реагирующих соединений. В реакциях, катализируемых ферментами, соединение, с которым взаимодействует фермент, называют субстратом. Избирательность фермента выражается в выборе субстрата и известна как специфичность. С другой стороны, ферменты аналогичны другим катализаторам, поскольку они не расходуются в ходе реакции и могут использоваться многократно.
Ферменты чрезвычайно увеличивают скорость реакций. Например, реакция двуокиси углерода с водой
СО2 + Н2О ⇄ Н2СО3
может происходить самопроизвольно, в частности в океанах. В организме человека эта реакция катализируется ферментом карбоангидразой (название фермента оканчивается обычно на суффикс «аза») Карбоангидраза —один из наиболее эффективных ферментов, каждая его молекула катализирует образование 105 молекул угольной кислоты в секунду. Катализируемая реакция происходит в 107 раз быстрее, чем самопроизвольная. У животных она важна для переноса двуокиси углерода из клеток, где она образуется, в кровеносное русло и для дальнейшего транспорта в легкие.
Активный центр
Ферменты — сложные глобулярные белки, состоящие из одной или нескольких полипептидных цепей. Цепи уложены так, что образуется «паз», или «карман», в который входят молекулы субстрата и где происходит реакция. Этот участок фермента называется активным центром.
Активный центр образуется в результате изгиба полипептидной цепи. Субстрат соответствует активному центру аналогично тому, как ключ соответствует замку (рис. 5-5). Активный центр имеет не только определенную трехмерную структуру, но подобен субстрату по распределению зарядов, расположению групп атомов, гидрофильности или гидрофобности. Если специфический участок субстрата имеет отрицательный заряд, то соответствующая зона активного центра имеет положительный заряд и т. д. Таким образом, активный центр не только удерживает молекулу субстрата, но и ориентирует ее нужным образом.
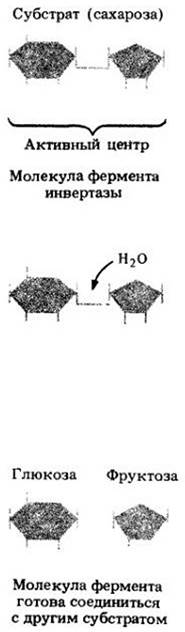
Рис. 5-5. Иллюстрация гипотезы о механизме действия фермента по принципу «ключ-замок». Молекула сахарозы гидролизуется до одной молекулы глюкозы и одной молекулы фруктозы. Фермент, осуществляющий эту реакцию, сугубо специфичен; его активный центр по конфигурации соответствует поверхности молекулы сахарозы
Аминокислоты, образующие активный центр, не обязательно находятся рядом в одной полипептидной цепи. Действительно, в ферменте, имеющем четвертичную структуру, они могут принадлежать даже разным цепям, как показано на рис. 5-6. Аминокислоты формируют активный центр в результате специфической укладки полипептидных цепей в молекуле фермента.
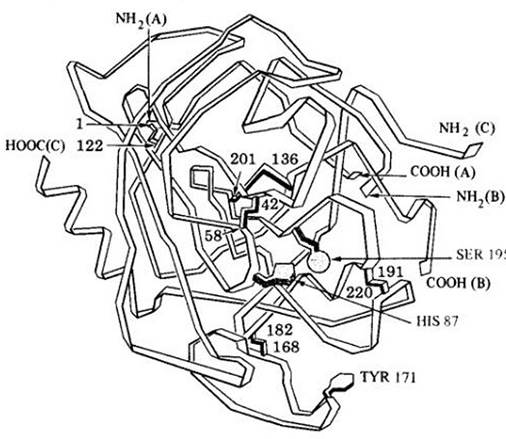
Рис. 5-6. Модель фермента. Данный фермент (пищеварительный фермент химотрипсин) состоит из трех полипептидных цепей. Отмечены амино- (-NН2) и карбоксильная (-СООН) группы. Цифрами обозначены места специфических аминокислот в цепях и дисульфидные мостики, которые связывают аминокислоты. Трехмерная структура образовалась в результате комбинации дисульфидных связей и взаимодействия между цепочками белков, а также между цепочками и окружающими молекулами
воды. Это взаимодействие обусловлено разницей в положительных и отрицательных зарядах (т. е. полярности) различных аминокислот. В результате изгибов и перекручивания полипептидных цепей специфические аминокислоты собираются вместе в виде уникальной структуры и образуют активный центр фермента. Две аминокислоты, участвующие в образовании активного центра, показаны на рисунке в коричневом цвете
Гипотеза о кратковременном изменении конформации активного центра фермента
Исследования структуры ферментов, выполненные в последние годы, дают основания предположить, что связывание субстрата ферментом вызывает изменение конформации фермента и таким образом осуществляется более точная подгонка активного центра к субстрату. Полагают, что эта индуцированная конформация может сообщать некоторое напряжение реагирующим молекулам и тем самым ускорять реакцию.