БОТАНИКА ТОМ 1 - КЛЕТОЧНАЯ БИОЛОГИЯ. АНАТОМИЯ. МОРФОЛОГИЯ - 2007
2. СТРОЕНИЕ И УЛЬТРАСТРУКТУРА КЛЕТКИ
Строение и функции клетки составляют предмет клеточной биологии. Под этим понятием объединяются изучение ультраструктуры, биохимии и молекулярной биологии, а также многие аспекты физиологии клетки. До 1950 г., еще до появления современных методов исследования на клеточном уровне, учение о клетке называли цитология (греч. куtos — пузырь, клетка). В значительной мере ее возможности были ограничены световой микроскопией.
Значение изучения клетки заключается в том, что все живые организмы состоят из клеток. Многие организмы являются одноклеточными: одна-единственная клетка представляет собой целую особь. Это мы видим у большинства прокариот и, согласно определению, у всех эукариотных протистов, в том числе, например, у жгутиковых из разных отделов водорослей, а также у диатомей. Правда, у эукариот по числу видов преобладают многоклеточные организмы. Поскольку клетки в подавляющем большинстве случаев микроскопически малы, их число у крупных многоклеточных организмов часто невообразимо большое. Одно дерево может состоять более чем из 10 000 млрд (1013) клеток. Уже один лист среднего размера покрытосеменного растения построен примерно из 20 млн (2∙107) клеток. Точки роста верхушек побегов и корней содержат от 1 0001 до 500 000 клеток, способных к делению.
1 Иногда меристемы состоят из малого числа клеток, например, у модельного растения Агabidopsis thaliana в меристеме корня клеток на порядок меньше. — Примеч. ред.
Многоклеточные организмы эволюционно моложе одноклеточных. В ходе эволюции многоклеточных организмов существенные жизненные процессы остались неизменными на уровне отдельной клетки. Это касается прежде всего запасания питательных веществ, размножения, реализации и рекомбинации генетической информации. Почти каждая клетка организма содержит полный, чаще всего даже двойной (диплоидный) набор генов и соответственно хромосом. Клетка может
удваивать этот набор генов путем репликации ДНК и в точно равных частях передавать дальше дочерним клеткам (митоз) (см. 2.2.3.5). Клетки многоклеточного организма имеют, как правило, один и тот же набор генов — они относятся к одному генному клону. То, что они все-таки закономерным путем дифференцируются, при индивидуальном развитии (онтогенезе), т.е. принимают различный облик и выполняют разные функции, выглядит при таких обстоятельствах, на первый взгляд, парадоксальным. Однако проблема дифференцировки и соответственно детерминации в настоящее время принципиально решена, поскольку установлено, что определенному состоянию дифференцировки каждый раз соответствует активизация определенной конкретной части генома и подавление остальных генов. Активизация и подавление генов управляются интеграционными сигналами, которые (поскольку они поступают не из окружающей среды и не осуществляют индивидуальные приспособления) в многоклеточной системе в конечном счете опять же исходят от клеток и воспринимаются другими, предназначенными для этого клетками.
Процессы, связанные с половым размножением, могут происходить не иначе, как с участием отдельных клеток. Для этого. как правило, образуются особые половые клетки — гаметы. Важные в биологическом смысле процессы, связанные с половым размножением, — это мейоз с рекомбинацией наследственной информации, а также сингамия — слияние клеток и ядер гамет одного и того же вида, но генетически не идентичных (см. 2.2.3.7 — 2.2.3.9).
Клетки могут происходить только из подобных им самим путем деления или слияния: «оmnis сеllulа ех сеllulа» (R. Wirchow, 1855)1. Характеристики живых систем, перечисленные во введении учебника, в совокупности проявляются лишь на уровне клетки, но не ниже. Клетка, таким образом, показала себя как самая малая жизнеспособная единица — элементарный организм. Это относится и к многоклеточным организмам, что подтверждают уже упомянутые явления полового процесса, например, возможность поддержания отдельных клеток в культуре (рис. 2.1).
1 «Каждая клетка [происходит] от клетки» (лат.) — это положение, сформулированное в 1855 г. Р. Вирховом, и поныне является основным положением клеточной теории. — Прим. Пер.
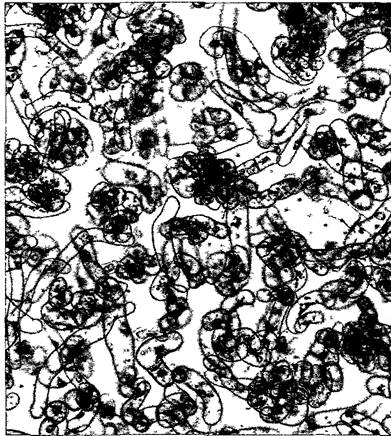
Рис. 2.1. Однонедельная суспензионная культура клеток сои (Glycine max, 90х) (клеточная культура — H. Grisebach, K.Hahlbrock, СМ-фотография — Н. Falk)
Некоторые клетки уже поделились один или несколько раз из каждой клетки может в конце концов снова вырасти целое растение, что используется для клонирования, т е для искусственного получения генетически однородного растительного материала
2.1. Изучение клетки
История развития методов изучения клетки — хороший пример зависимости прогресса естественных наук от технических возможностей Клетки в большинстве своем микроскопически малы.
Первые описания клеток появляются в XVII столетии, после создания первого микроскопа. Однако принципиальное сходство клеток растений, животных и протистов было установлено лишь после того, как к началу XIX столетия микроскоп был существенно усовершенствован. После открытия в растительных тканях клеточного ядра стало очевидным его наличие также в клетках животных и человека. Т. Шванн в 1839 г. опубликовал свое эпохальное произведение «Микроскопические исследования, касающиеся соответствия в структуре и росте животных и растений» (Т. Schwann. «Mikroskopische Untersuchungen uber die Übereinstimmung in der Struktur und dem Wachstum der Thiere und Pflanzen»). Этим были заложены основы общей биологии. Постепенно, по мере постоянного расширения возможностей наблюдения с помощью микроскопа и в результате первых исследований в области клеточной физиологии (например, осмоса), следовали дальнейшие открытия.
Во второй половине XIX столетия все четче вырисовывались три основных положения цитологии.
✵ Все живые организмы построены из клеток
✵ Многие организмы одноклеточные.
✵ Индивидуальное развитие многоклеточных организмов начинается — по крайней мере при половом размножении — с одноклеточной стадии.
Примерно в 1880-е гг. в результате нового значительного усовершенствования микроскопической оптики, осуществленного Э.Аббе, впервые было достигнуто максимальное теоретически возможное разрешение 0,2 мкм. Одновременно был достигнут заметный прогресс в технике изготовления препаратов для микроскопии.
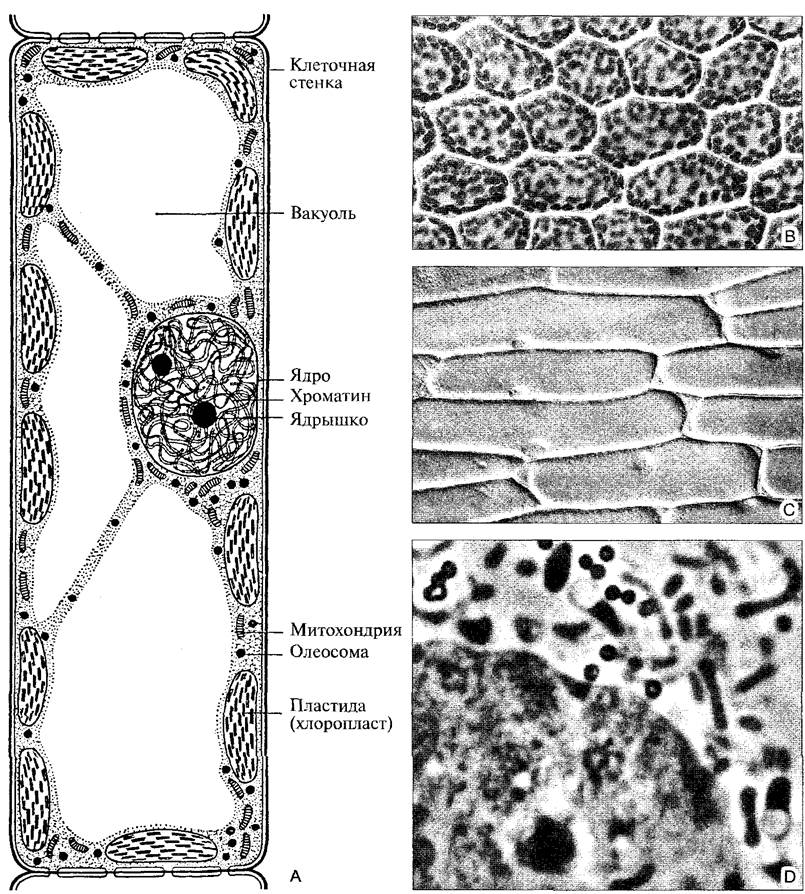
К 1900 г. были описаны вообще все органеллы клетки, видимые при световой микроскопии (рис 2.2).
Рис. 2.2. Растительная клетка в поле светового микроскопа (А—по D. von Denffer; В, С—интерференционный; D—фазовый контраст): А—схема клетки из паренхимы мезофилла листа высшего растения; В—хлоропласты в клетках листочка листостебельного мха (Mnium undulatum, 300х); С—клетки эпидермиса лука репчатого (Allium сера) в интерференционном контрасте (130х): крупные клетки почти целиком заполнены центральной вакуолью; в пристеночном слое цитоплазмы, который утолщен по углам, находится ядро с ядрышком; D—область ядра клетки Allium, как на С, фазовый контраст (3100х); в ядре хроматин и ядрышко, в цитоплазме лейкопласты (два из них со светлыми включениями крахмала), вытянутые митохондрии и округлые олеосомы
После повторного открытия законов наследования Г. Менделя к началу XX столетия в течение последующих 40 лет основное внимание стали уделять ядру и хромосомам (кариология, цитогенетика).
Взрывообразное развитие исследований клетки после 1945 г. — в области ультраструктуры, биохимии и молекулярной биологии — опять же было связано с техническим прогрессом: появился электронный микроскоп и были разработаны фракционирование клетки с помощью ультрацентрифуги (бокс 2.1) и рентгеноструктурный анализ биологических макромолекул. В последнее время принципиально отличные методики наблюдения и препарирования сильно расширили возможности исследования живых клеток. Это имеет особое значение при переходе от эры геномики к эре протеомики.
2.1.1. Световая микроскопия
Объектив светового микроскопа (СМ) (рис 2.3) дает (аналогично объективу диапроектора) увеличенное изображение объекта (препарата), которое можно сфотографировать Это промежуточное изображение рассматривают через окуляр, как через лупу Самые мелкие, еще различимые детали объекта должны быть на расстоянии не менее 0,2 мкм (200 нм) друг от друга Макромолекулярные структуры клетки остаются неразличимыми Тем не менее СМ сохранил свое значение и после появления электронного микроскопа, имеющего значительно большее разрешение. Он позволяет наблюдать объекты в живом состоянии и требует значительно меньших затрат на подготовку препаратов.
Поскольку клеточные структуры в большинстве своем бесцветны и даже по преломлению света лишь немного отличаются друг от друга, они часто остаются невидимыми даже тогда, когда их размеры превышают границу разрешения Соответственно в классической световой микроскопии исследуют преимущественно фиксированные (убитые с сохранением структуры) и искусственно окрашенные препараты Оптически анизотропные клеточные структуры, как, например, клеточные стенки, зерна крахмала и веретена ядерного деления, можно рассматривать и в живых клетках с помощью поляризационного микроскопа, позволяющего также анализировать их макромолекулярное строение На сегодняшний день за счет оптических манипуляций, которые не влияют на сам объект, решена проблема контраста За счет фазового контраста или дифференциального интерференционного контраста (ДИК, DIС) фазовые различия световых волн после прохождения через препарат трансформируются в различия в контрасте или рельефную картину (см рис 2.2, С, D, 2,81, 3,9) Особенно нежные клеточные структуры можно сделать видимыми при цифровой фотосъемке и ее обработке Далее этот материал накапливают для обработки с помощью компьютер- ной техники — видеомикроскопия. Пространственное воспроизведение клеточных структур возможно за счет конфокальной лазерной сканирующей микроскопии (КЛСМ, CLSM). При этом мы имеем дело с томографией в микроскопических размерах препарат в интактном, неизмененном виде рассматривают как серию тончайших оптических «срезов», а затем с помощью компьютера из них составляется его виртуальное пространственное изображение Такую объемную реконструкцию живого объекта можно рассматривать на экране под любым углом В отдельных изображениях оптических срезов (они строятся по растровому принципу, т е строчка за строчкой укладываются, как в кино) микроскопические детали чаще всего различимы значительно лучше, чем в самом препарате, так как в результате обсчета данных удаляются мешающие наслоения.
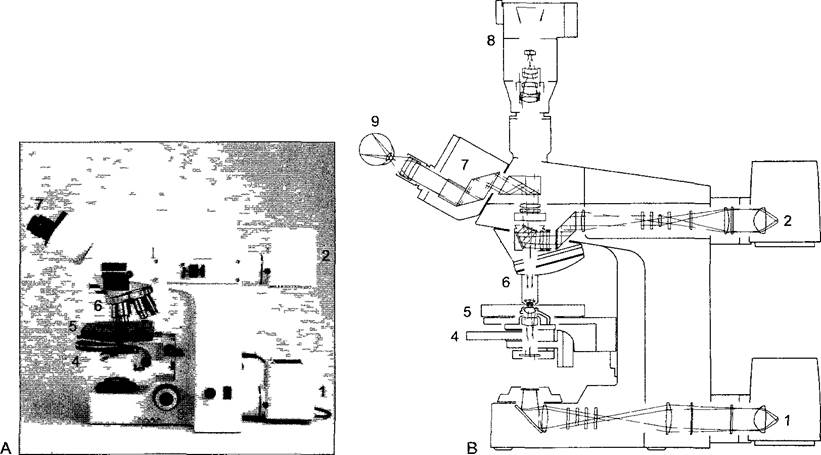
Рис. 2.3. Современный научно-исследовательский световой микроскоп (Axioplan, Carl Zeiss)
А—вид сбоку, с левой стороны, В—ход световых лучей 1,2—освещение для просмотра материала в проходящем свете и на непрозрачном фоне 3—микровинт для точной установки на резкость столика 5, 4—конденсор для освещения светового поля фазового контраста и дифференцирующего интерференционного контраста DIC, 6— турель с объективами, над ней гнездо для световых и поляризационных фильтров и др. оптических приставок, 7—бинокулярный тубус, 8—автоматическая камера для микросъемки, 9—глаз
Выявлению и локализации определенных молекул в клетке служат цитохимические методы. Среди них важную роль играют особо чувствительные флуоресцентные методы. Во флуоресцентном микроскопе препарат освещают коротковолновым светом, а соответствующие вещества в препарате возбуждаются и испускают более длинноволновые кванты (флуоресценция) Для получения изображения препарат рассматривают через светофильтр, не пропускающий возбуждающее излучение, так что освещенными остаются только флуоресцирующие части объекта Поскольку лишь немногие компоненты клетки хорошо флуоресцируют сами по себе, был разработан целый ряд методик для специфического флуоресцентного окрашивания определенных молекул. Особое значение при этом имеет иммунная флуоресценция. Она основана на крайней специфичности белков-антител иммунной системы млекопитающих, что позволяет точно локализовать в клетке различные белки, полисахариды или нуклеиновые кислоты, действующие как антигены (например, рис 2.10)1. В последнее десятилетие быстро расширяется использование зеленого флуоресцентного белка (green fluorescent protein, GFP) в качестве флуоресцентного маркера Он выявляет генную активность в живых клетках, а для определенных белков позволяет также исследовать их появление, локализацию и поведение (ср рис 2 83, С)
1 Методика окрашивания состоит из нескольких этапов: 1. Нанесение антител к определенному антигену на препарат, при котором происходит специфическое связывание 2. Отмывка от антител, которые не связались с препаратом 3. Нанесение вторичных антител с ковалентно связанным с ними флуоресцирующими молекулами Вторичные антитела реагируют с иммобилизованными на клеточных структурах первичными антителами 4. Отмывка от несвязавшихся вторичных антител Только после всех этих процедур препарат рассматривают в микроскоп Столь сложная методика требует постановки многочисленных контролей, без которых нельзя достоверно судить о распределении изучаемых антигенов в клетке — Примеч. ред.
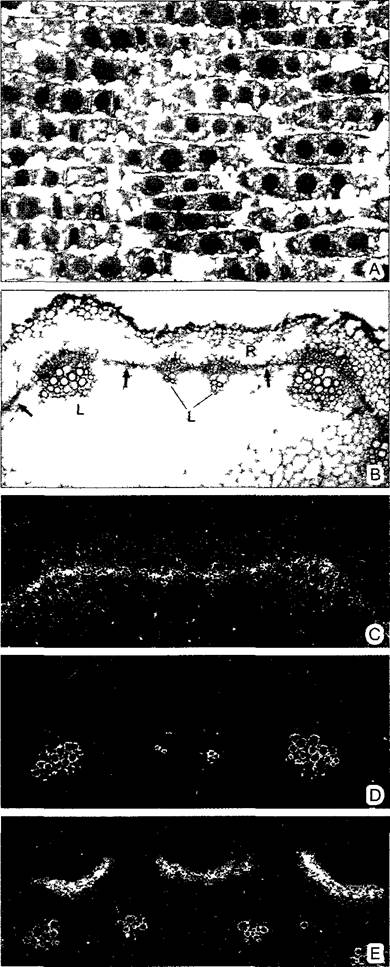
Рис. 2.4. Микрорадиоавтограмма (В—Е — препараты и съемки в темном поле D. Staiger и С. Hemtzen)
А—ткань кончика корня лука репчатого после пульс-метки 3Н-тимидином Ядра, ДНК которых реплицировалась во время пульса (S-фаза) после проявления фотоэмульсии, проведенной над срезом, заполнены многочисленными черными гранулами серебра Немеченые ядра находились во время обработки радиоактивным изотопом не в S-фазе Свободные от ДНК клеточные структуры не были мечены 3Н- тимидином (380х), В—Е — выявление транс- криптов (мРНК) путем гибридизации in situ синтетическими радиоактивными РНК-зондами на поперечных срезах побега горчицы (Smapis alba) В—с проводящими пучками L, коровой тканью R и камбием, стрелка, С, D—различная транскрипционная активность гена одного из РНК-связывающих белков в зависимости от времени суток (С—максимальная в конце светового дня, камбий особенно интенсивно связывается с меченым РНК-зондом, D—минимальная, метка не выявляется, одревесневшие части проводящих пучков светятся в темном поле и не будучи мечеными) Е—мРНК для белка клеточной стенки образуется только во внешних клетках коры (60х)
Многообразные флуоресцентные методы дополняют уже часто применявшуюся раньше микрорадиоавтографию. Этот чрезвычайно чувствительный метод основан на специфическом встраивании радиоактивных изотопов в определенные вещества/структуры живых клеток (например, меченного тритием тимидина в ДНК, соответственно 3Н-уридина в РНК или 30S-метионина в белки). На фотографической эмульсии, которой покрывают тонкие срезы меченых клеток/тканей, после соответствующей длительной экспозиции в темноте и проявления над структурами препарата, содержащими радионуклиды, образуются зерна серебра (рис 2.4)
При многих исследованиях важно целенаправленно манипулировать отдельными клетками. Для этого имеются дорогостоящие микроманипуляторы, причем в последнее время все чаще вместо механических устройств используют лазерные («оптические пинцеты»)
Наряду с новыми методами наблюдения с помощью светового микроскопа важную роль играет ряд других современных методов исследования клетки Часто основой их служит выращивание генетически однородных клеточных клонов в культуре клеток (см рис 2 1) Протопласты, путем ферментативного воздействия лишенные стенки, позволяют применить целый ряд методов, которые сначала были разработаны для клеток животных и человека К ним относятся искусственное слияние клеток (см рис 2 49) и методы patch-clamp для исследования ионных каналов и рецепторов Чтобы иметь возможность направленно манипулировать отдельными клетками, клеточная мембрана должна хотя бы временно и/или локально становиться проницаемой, что позволяло бы экспериментально влиять на те или иные параметры клеточного обмена веществ (ионная среда, значение pH, энергетический уровень и др ) Таким целям служат специально подготовленные пермеализированные клетки1 (их клеточная мембрана становится проницаемой под влиянием детергентов) или так называемые клеточные модели (отчасти активные остатки клетки после удаления клеточной мембраны, долго не сохраняющиеся) Альтернативу представляют собой методы микроинъекции. Вводить макромолекулы в живые клетки можно также путем электропорации (созданием проницаемых участков на клеточной мембране путем кратковременных электрических импульсов) и баллистическими методами или биолистикой (на частицы золота или вольфрама диаметром примерно 1 мкм наносят препарат ДНК или РНК и с помощью ударной волны включаются, например, в ткань листа)2. Такие методы позволяют, на пример, специфически блокировать определенные ферменты в живых клетках вводимыми антителами, а также искусственно изменять генетическую активность путем направленного введения чужеродной ДНК (трансфекция) факторов транскрипции или антисмысловой мРНК .
1 От англ permeable — проницаемый. Термин практически не испопьзуется в отечественной литературе — Примеч. ред.
2 Исходно в биолистике использовали патроны, заряженные порохом, и производиливыстрел из ружья (так называемой «пушки»). На сегодня разработаны щадящие методы создания ударной волны за счет сжатых газов или в соленоиде, позволяющем придать ускорение частицам металла за счет сил магнитного поля —
Примеч. ред.
2.1.2. Электронная микроскопия
В электронном микроскопе (ЭМ, рис. 2.5) освещение и отображение объектов осуществляются быстрыми электронными потоками, которые преломляются в полях электромагнитных линз. Увеличенная картина подается на флуоресцирующий световой экран и может сохраняться в виде фотографий или в электронном виде. Длина волны электронных лучей составляет после ускорения в 100 000 В (= 100 кВ) всего лишь 1/100 000 длины световой волны. За счет этого достигается гораздо лучшее разрешение, чем при световой микроскопии. В случае биологических препаратов разрешение повышается на два порядка, что очень важно.
Для исследования с помощью обычного просвечивающего (трансмиссионного) ЭМ (ТЭМ) препараты должны быть не толще 80 нм, т.е. менее чем 1/ 1000 толщины листа бумаги. Имеется несколько методов приготовления препаратов для ТЭМ. Просвечиваемые частицы (макромолекулы, мультиферментные комплексы, нити ДНК, рибосомы, вирусы, фибриллы целлюлозы, мембранные фракции) высушивают на тончайших пластиковых или угольных пленках и наблюдают непосредствен- но для повышения контрастности изображения часто используют тяжелые металлы, их вносят (позитивный контраст), наносят (негативный контраст, ср , например, рис 1 16 А, 1 17. 2 44, 2 66, 2 80) или косо напыляют (оттенение посредством рельефного эффекта, рис 2 72) Клетки и ткани после химической фиксации глутаральдегидом и оксидом осмия пропитывают (заключают) в твердую полимеризующую смолу, и из них на ультрамикротомах особым образом заточенными алмазными лезвиями приготовляют срезы (ср , например, рис 2 7, 2 93) Как альтернативный вариант можно также применять криофиксацию путем очень быстрого замораживания живой ткани до <-150°С, при которой вода в клетках затвердевает не кристаллизуясь Затем промороженный препарат раскалывают и с поверхности излома готовят тонкий отпечаток (реплику), который затем наблюдают в ТЭМ (замораживание-скалывание, ср , например, рис 21 8, 2 26, А, 2 85, 2 94, А, С) В последнее время просвечивают и относительно толстые срезы при напряжении ускорения между 300 и 700 кВ и получают изображения соответствующих мест препарата в цифровой форме С помощью компьютера по этим данным реконструируют виртуальное трехмерное изображение объекта, которое (как и в случае конфокального лазерного сканирующего микроскопа) передает его пространственную структуру.
Рис. 2.5. Современный электронный микроскоп.
Электронные лучи проходят от источника 1 сверху вниз через систему конденсорных линз в тубусе (вертикальная трубка 5), помещенный в глубокий вакуум тубуса объект (препаратный шлюз 2 с боковым сосудом Дьюара 4 для жидкого азота, охлаждающего пространство с объектом; 3—опрокидывающее устройство для препарата), далее через поля изображенных электромагнитных объективной и проективной линз (на 5) и, наконец, достигают флуоресцирующего светового экрана. Появляющееся здесь конечное изображение можно наблюдать через смотровое окно (6) или на мониторах (8) и фотографировать или сохранять в цифровой форме (цифровая камера 7). Значение остаточного давления газа в тубусе поддерживается с помощью вакуумных насосов на уровне одной миллионной атмосферного давления 9 — компьютерный блок для получения и обработки изображения

Поверхностную структуру непрозрачных объектов можно сделать видимой с помощью сканирующей электронной микроскопии (СЭМ). Этот метод работает по принципу телевизора. Препарат на ограниченной области поверхности облучают очень узко направленным пучком электронов. От соответствующих мест препарата, которые непосредственно сталкиваются с этим первичным лучом, обратно отражаются вторичные электроны1. Они синхронно управляют переводом отображения поверхности в цифровую форму на экране монитора. Отображающих линз нет Изображения с помощью СЭМ отличаются высокой глубиной изображаемого пространства и особенно пластичной передачей скульптуры объекта (ср., например, рис. 3.3, С, D; ЗЛО, 3.11; 3.14).
1 Перед просмотром на препарат напыляют тонкую пленку из металла (например, палладия), поскольку сами живые объекты хорошо пропускают и слабо отражают пучки электронов — Примеч. ред.