БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
7. ФИЗИОЛОГИЯ РАЗВИТИЯ
7.7. Контроль развития внешними факторами
Рост и дифференцировка, т. е. морфогенез, управляются не только эндогенными процессами. Напротив, развитие испытывает куда большее влияние со стороны внешних факторов в рамках генетически определенной нормы реакции. Именно растения, прикрепленные к субстрату, в отличие от свободно передвигающихся организмов часто подвергаются на месте произрастания значительным колебаниям внешних факторов и должны соответствующим образом на это реагировать.
Эндогенно регулируется реализация видоспецифичного облика растения, т. е. проявление типичных для вида признаков организации и адаптации. Однако под действием окружающих условий, влияющих на индивидуум, эти признаки модифицируются. Например, высота и возраст, в котором цветковое растение необратимо перейдет от вегетативного развития к репродуктивному, а также количество цветков, пыльцы и семян, которое оно произведет, в значительной степени зависят от обеспечения водой и питательными веществами, а также от температурных и световых условий. Появляющиеся физиологические эффекты в зависимости от влияющего фактора делятся на гигроморфозы (фактор влажность), трофоморфозы (питательные вещества), термоморфозы (температура), фотоморфозы (свет) и фотопериодически обусловленные морфозы, которые мы рассмотрим подробнее в следующих разделах.
Здесь описание ограничено только теми процессами, для которых внешние факторы являются не только источниками вещества и/или энергии, но и причинными сигналами, т. е. вносят энергию только для инициации, но не для проведения индуцированной физиологической реакции (о сигналах как возбудителях механизмов движения, см. 8.1).
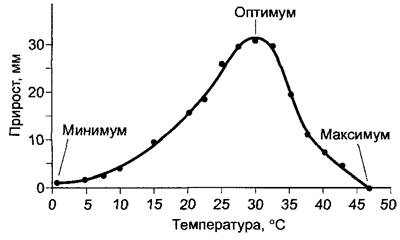
Процессы обмена веществ клеток, как и все химические реакции, зависят от температуры (см. 6.1.6.4), и диапазон температур, в котором происходит рост организма, определяется биохимическими, физиологическими и морфологическими факторами (см. 13.3). Зависимость скорости роста от температуры графически выражается в виде характерной кривой, имеющей оптимум (рис. 7.67).
Рис. 7.67. Рост в длину корней Lupinus luteus за 24 ч при различных температурах
7.7.1.1. Термопериодизм и термоморфозы
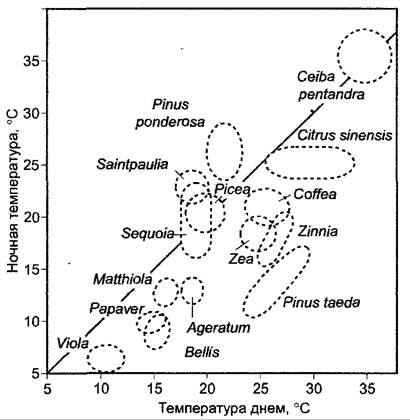
Для оптимального роста побега многим растениям требуется меняющийся с суточной периодичностью режим температур, т.е. эти растения приспособлены к смене температур между днем и ночью и развиваются оптимально только при такой регулярной смене температур (рис. 7.68; 7.69). Такое явление обозначают термином термопериодизм.1
1 Если изменение фактора происходит с периодичностью 24 ч, говорят о циркадных ритмах (лат. circum — вокруг, dies — день). Термопериодизм может быть связан с годовым интервалом и обусловлен климатом. — Примеч. ред.
Рис. 7.68. Ежедневный прирост в длину побегов томата при различных, но постоянных в течение суток температурах (нижняя кривая) или соответственно при температуре 26,5 °С в течение дня и варьирующих температурах ночью, как дано на оси абсцисс (верхняя кривая)
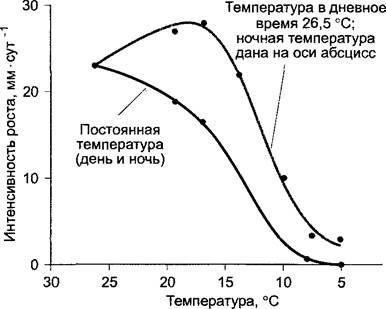
Рис. 7.69. Оптимальные области температур для роста побега различных растений
Процессы развития, видоизменяющиеся под влиянием определенных температур, называются термоморфозами. Примером этого является гетерофиллия у лютика водного (Ranunculus aquatilis, см. 11.2). Перистораздельные подводные листья развиваются при температурах воды около 8 — 18 °С. При экспериментальном повышении температуры воды до 23 — 28°С (т.е. примерно до обычной температуры воздуха летом) морфология подводных листьев соответствует листьям, образующимся в воздушном пространстве (лопастные листовые пластинки). Этот процесс можно вызвать также добавлением в воду абсцизовой кислоты. Поэтому образование «воздушных листьев» могут индуцировать два взаимосвязанных фактора: температура воздуха по сравнению с температурой воды, а также потеря тургора, которая возникает в результате транспирации «воздушных листьев» и ведет к выделению в них абсцизовой кислоты (см. 7.6.4.2).
В процессе развития растений часто имеются чувствительные к температуре фазы. Так, например, у петунии набор окрасок образовавшихся цветков определяется той температурой, которая господствует во время определенной короткой фазы развития почек. В тропиках нередко наблюдается одновременное массовое цветение
некоторых видов орхидей и других растений (например, кофе, виды бамбука). По- видимому, оно является результатом действия кратковременного охлаждения, вызванного сильными ливнями после сухого периода, которое синхронизирует дальнейшее развитие генеративных почек. Из всех проявлений воздействия температуры на развитие растения особенное значение имеют нарушение покоя семян и почек, а также индукция цветения.
7.7.1.2. Прерывание состояния покоя действием определенной температуры
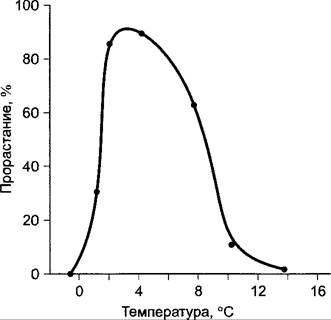
Прерывание периода покоя семян и почек воздействием определенных (как правило, низких) температур называется стратификацией. Потребность в стратификации имеют семена многих трав идревесных растений, при этом у большинства из них действенными являются низкие положительные температуры, близкие к точке замерзания (0 — 5 °С), и только немногочисленные виды (например, некоторые высокогорные растения) нуждаются в отрицательных температурах1 (рис. 7.70). Семена некоторых растений (например, хлопчатника, сои, проса) нуждаются для прорастания в высоких температурах, у других прорастание стимулируется сменой температуры в течение дня (например, у Роа pratensis).
1 Здесь в тексте использован термин Frostкеimer, не имеющий эквивалента в русском языке. Пояснить его можно как «семена, всходящие только после обработки морозом». Аналогично используется термин Lichkemer — «семена, всходящие только после предварительного освещения». — Примеч. ред.
Однако сухие семена стратификации не подвержены; действие холода воспринимают только набухшие семена, в которых идут биохимические процессы.
Некоторые семена прорастают лишь после действия низких температур (например, Fraxinus excelsior), у других видов прорастание ускоряется холодом (например, у видов Pimis).2
2 Речь идет о двух типах реакций: качественной и количественной. Качественная реакция идет по принципу «все или ничего» (нет холода — нет прорастания). Количественная реакция в принципе идет без холода, но при понижении температуры ускоряется. — Примеч. ред.
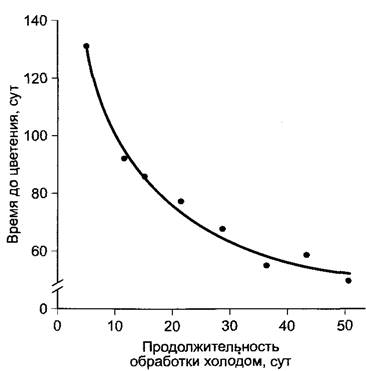
Рис. 7.70. Влияние на прорастание семян яблони 85-дневной обработки холодом при заданных температурах
Необходимая продолжительность действия холода также видоспецифична (чаще несколько недель). У некоторых видов только интактное семя нуждается в холоде, в то время как изолированный зародыш прорастает и без этого (например, у Acer pseudoplatanus). У других видов выделенный из семени зародыш сам нуждается в стратификации (например, у Sorbus aucuparia). Некоторые семена или плоды прорастают только во вторую весну после посева (например, Crategus или Cotoneaster); из-за их твердых непроницаемых покровов зародыш в первый холодный период не набухает и поэтому стратифицируется только во вторую зиму, после разрушения покровов микроорганизмами в течение лета. У некоторых Convallariaceae (например, Convallaria, Polygonatum) и у Trillium два холодных периода нужны по другим причинам: первый нарушает покой только зародышевого корня, но не других частей зародыша, и лишь второй стимулирует рост эпикотиля. У других растений (например, у абрикоса или Paeonia suffructicosa) корень может прорастать без действия холода, но рост эпикотиля начинается только после стратификации.
Низкие температуры прерывают покой семян различным, часто комплексным способом. Под действием холода покровы семени становятся более проницаемыми, ускоряется дозревание семян, усиливается действие гормонов или ферментов либо снижается содержание ингибиторов (например, абсцизовой кислоты). Часто действие холода может заменить добавление гиббереллина (см. 7.6.3.3); однако еще не выяснено, что именно стимулируют низкие температуры: повышение эндогенного уровня гиббереллина или сокращение концентрации его антагонистов (например, абсцизовой кислоты). Начинающееся после стратификации развитие семян (прорастание и развитие сеянца) имеет температурный оптимум в диапазоне, который нужен для вегетативного роста видов или экотипов (см. 13.3).
Низкие температуры оказывают влияние не только на прорастание семян, но и на почки многих растений, являясь для них сигналом окончания физиологического покоя, обусловленного внутренними факторами. Здесь также необходимы температуры около 0 — 5°С в течение нескольких недель, причем цветочные почки для прерывания покоя (не путать с индукцией их закладки, см. ниже) нуждаются часто в несколько более длительном действии холода по сравнению с семенами. В местностях с теплыми зимами, как в Калифорнии или Южной Африке, из-за недостаточного действия холода на почки могут возникнуть сложности при возделывании определенных плодовых культур (например, персиков).
Восприимчивы к действию холода сами почки. Процесс, вероятно, обусловлен дифференциальной регуляцией генов. Следствием становится снижение содержания ингибиторов (например, абсцизовой кислоты) и повышение концентрации других гормонов. Однако если, например, гибберелловой кислотой можно заставить почки прорастать, воздействуя на них до и после покоя (но не во время глубокого покоя), прерывание глубокого покоя холодом нельзя сводить к усиленному накоплению этого гормона.
Эндоспоры бактерий родов Bacillus и Clostridium и споры копрофильных грибов для прерывания покоя нуждаются во многих случаях в тепловом шоке. Споры копрофильных грибов нагреваются при прохождении по пищеварительному тракту теплокровных и, будучи активированными, могут тотчас прорастать на экскрементах, т.е. в своем естественном субстрате. Механизм активации прорастания теплом еще малопонятен. У многих грибов, прежде всего тех, чей жизненный цикл связан с жизненным циклом высших растений (это, например, микоризные грибы и фитопатогенные грибы, см. 9.2.3, 9.3.2), покой спор прерывается холодом, что позволяет им прорастать не осенью, а только весной.
7.7.1.3. Индукция цветения действием определенной температуры
Индукция образования цветка действием определенных температур называется вернализацией.1 В противоположность стратификации, при которой температура действует всегда локально, т. е. реагируют только обработанные определенной температурой части растения (например, холодом), при вернализации образуется еще неизвестный фактор или смесь факторов («верналин»), которая системно распространяется в побеге. Достаточно подвергнуть вернализации отдельные листья, чтобы добиться индукции цветения всего растения.
1 В публикациях на русском языке чаще пользуются синонимичным термином «яровизация». — Примеч. ред.
По-видимому, все виды, которые для индукции цветения нуждаются в холоде, можно вернализировать в развитом, облиственном, состоянии, а некоторые — даже уже в виде зародышей в семени. К последним, у которых, как правило, образование цветка лишь ускоряется действием холода, а закладка цветов возможна и без него (факультативно нуждающиеся в холоде), относятся белая горчица (Sinapis alba) и свекла (Beta vulgaris), а также озимые зерновые (озимая рожь, озимая пшеница и озимый ячмень), у которых процессы вернализации были исследованы особенно подробно (рис. 7.71).
Рис. 7.71. Зависимость скорости зацветания у озимой ржи (рожь сорта Petkuser) от продолжительности обработки холодом зерновок при 1 — 2 °С. Время до цветения после вернализации дано на оси ординат
У зерновых различают яровые формы, которые высевают весной, а созревают они в то же лето, и озимые сорта, которые для образования цветков и плодов сначала нуждаются в холодном периоде, а затем в длинном дне. Поэтому озимые зерновые высевают осенью, а убирают урожай следующим летом. Озимые зерновые, как правило, более урожайны. Различия между яровыми и озимыми зерновыми закреплены генетически. Действенные для озимой ржи низкие температуры находятся в диапазоне от +1 до +9 °С. Поскольку эффект проявляется только в присутствии кислорода и возрастает у культивируемых зародышей благодаря добавлению сахара, можно утверждать, что вернализация — биохимический процесс, нуждающийся в энергии. У озимой ржи пониженная температура должна воздействовать на зародыш, причем он реагирует уже через 5 дней после оплодотворения яйцеклетки. Апикальная меристема уже проросших растений ржи особенно чувствительна к раздражению холодом. Увеличение продолжительности воздействия холодом вплоть до 20 дней ведет к сокращению времени между высевом и цветением. Следовательно, вернализация у этого факультативно нуждающегося в холоде растения, по-видимому, постепенно достигает максимального эффекта. Об этом свидетельствует и то, что путем обработки высокими температурами (у ржи, например, два дня при 40 °С) эффект вернализации можно ликвидировать (девернализация) тем легче, чем короче была предшествующая продолжительность вернализации; у полностью вернализированных растений девернализация уже невозможна. Если растение ржи однажды было полностью вернализировано, оно передает это состояние без ослабления всем вновь образованным тканям, включая точки роста.
Виды, которые нуждаются в воздействии холодом, чтобы дойти до цветения, встречаются среди озимых однолетников, двулетников и многолетников. К соответствующим озимым однолетникам наряду с озимыми зерновыми относятся также Erophila vema, Veronica agrestis и Myosotis discolor. Двулетние растения часто образуют в первый год прикорневую розетку и развивают соцветие только на второй год, после действия холода и часто именно тогда, когда наступают условия длинного дня (см. 1.12.2). Сюда относятся, среди прочего, свекла (Beta vulgaris), сельдерей настоящий (Apium graveolens), кочанная капуста и другие виды Brassica, двулетние расы белены черной (Hyoscyamus niger) и наперстянка (Digitalispurpurea). В теплицах или в соответствующих климатических зонах эти виды вегетируют в течение всего года. Подробнее других исследована двулетняя раса Hyoscyamus niger. Чтобы дойти до цветения, она нуждается сначала в периоде холода и затем в длинном дне (в этой последовательности!). Индуцированный вернализацией флоральный стимул может перейти от вернализированного привоя двулетней расы белены на неиндуцированный подвой той же расы и довести его до цветения. Передача флорального стимула в прививках может происходить от привоев однолетней расы Hyoscyamus niger с цветением, индуцированным длинным днем, а также от привоев других видов пасленовых, вернализированных или индуцированных к цветению фотопериодом. Возникающее при вернализации вещество обозначается верналип. Спорно (и скорее невероятно), что верналин идентичен постулированному гормону цветения (флориген, см. 1.1.22). Возможно, верналин составляют гиббереллины; в любом случае у видов, нуждающихся в холоде, гиббереллин часто может заменить действие холода1 (см. 7.6.3.3). Напротив, несомненно, что гиббереллины не могут представлять собой флориген (см. 7.7.2.2)2.
1 Но у злаков гиббереллин не вызывает вернализации, так что представленная точка зрения дискуссионна. — Примеч. ред.
2 Понятие «флориген» введено М.Х.Чайлахяном (Россия), который исходно считал флориген, как и верналин, как минимум двухкомпонентными факторами. Он доказал, что кроме гиббереллина на растение должен действовать гипотетический антезин, поиски которого продолжаются. Немецкие авторы слабо знакомы с теорией Чайлахяна. — Примеч. ред.
Многолетними видами, которые цветут только после холодных периодов, являются, например, определенные примулы, фиалки, виды желтофиоли и разновидности хризантем, астр, гвоздик, а также Lolium perenne (английский райграсе); они должны каждую зиму заново вернализироваться. У Lolium perenne цветки закладываются зимой вследствие вернализации, но несущие цветки побеги удлиняются только при длинном дне (>12 ч в марте; см. 7.7.2.2)1. Новые образованные летом боковые побеги сначала не способны к цветению и только следующей зимой вернализируются. Чтобы определенные многолетние садовые хризантемы начали цвести после холодного периода2, должен следовать короткий день, поэтому они цветут соответственно осенью. У этих хризантем индуцированное холодом побуждение к цветению не может быть перенесено от вернализированного привоя на неиндуцированный подвой, даже от локально вернализированной вегетативной меристемы на другую невернализированную меристему того же растения.
1 Данные для климата Англии и Западной Европы. — Примеч. ред.
2 Большинство хризантем не нуждается в холоде для цветения. — Примеч. ред.
О биохимических процессах при вернализации еще мало известно. Можно ожидать, что изучение генетического контроля образования цветка (см. 7.4.3), т. е. процесса переключения развития от вегетативной меристемы к меристеме цветка, приблизит ответ на важные вопросы.
Свет вызывает разнообразные эффекты у всех низших и высших растений, независимо от их способности к фотосинтезу. Так, ориентация в пространстве как свободно передвигающихся растений (таких, как одноклеточные водоросли), так и органов неподвижных растений (см. 8.3.1.1) и даже органелл внутри клеток (перемещение хлоропластов, см. 8.2.2) часто в большой мере регулируется светом. Однако в этом разделе свет интересен как индуктор процессов развития.
7.7.2.1. Фотоморфогенез и скотоморфогенез
Индуцированные светом процессы развития называются фотоморфозами, а процесс управляемого светом развития организма в целом — фотоморфогенезом (греч. phos — свет). В то время как у низших растений. папоротников и многих голосеменных развитие в темноте протекает так же, как на свету (например, биосинтез хлорофилла в темноте), у покрытосеменных развитие на свету и в темноте сильно различается. Если растущие на свету покрытосеменные растения перенести в темноту, они теряют зеленую окраску. Этот процесс называется этиолированием (также этиоляцией), поэтому проростки покрытосеменных, выросшие в темноте, также называют этиолированными. Уже при кратковременном освещении этиолированных растений начинается фотоморфогенез (деэтиоляция).
Развитие покрытосеменных в темноте называется скотоморфогенезом (греч. skotos — темнота). Как показали опыты на мутантах, при этом происходит активное подавление фотоморфогенеза в темноте1. Если в результате мутации повреждаются гены СОР или соответственно DET у Arabidopsis thaliana, мутантные растения и в темноте развиваются так же, как на свету: они растут деэтиолированными, другими словами, они демонстрируют конститутивный фотоморфогенез (сор — англ, constitutive photomorphogenesis\ det — англ, deetiolated).
1 На практике трудно отличить скотомор- фогенез и этиоляцию. Говорить, что происходит активное подавление фотоморфогенеза в темноте, не совсем корректно: правильнее считать, что идет конкуренция между фотоморфогенезом и скотоморфогенезом (двух альтернативных программ развития). — Примеч. ред.
Фотоморфогенез существует у большинства растений. У жгутиковой водоросли Chlamydomonas, например, образование половых клеток управляется светом. Споры папоротника при прорастании в темноте или красном свете образуют нитчатый клеточный тяж (протоиема, как у мхов) и только на белом или синем свете — заросток. Грибы для нормального морфогенеза нуждаются в синем свете (или частично УФ-свете). Так, если прекратить освещение, у некоторых базидиомицетов удлиняются ножки плодовых тел и уменьшаются «шляпки». Разнообразные ското- или соответственно фотоморфогенезы высших растений рассмотрим, сравнивая этиолированные проростки с проростками того же возраста, росшими на свету (рис. 7.72, табл. 7.5).
Рис. 7.72. Проростки Vicia faba в возрасте 5 дней, выросшие в темноте (А), в возрасте 3 недель, выросшие в темноте (В) и на свету (С). Цифрами обозначены соответствующие друг другу узлы. Апикальную петельку можно наблюдать только на совсем молодых этиолированных проростках; в показанной здесь стадии В она уже исчезла (ок. 1/Зх)
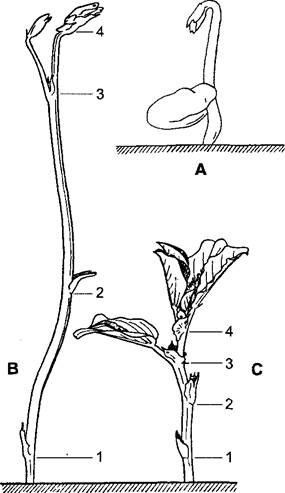
Таблица 7.5. Некоторые фотоморфозы проростков белой горчицы, Sinapis alba
Фотоморфозы
Ингибирование роста гипокотиля в длину
Ингибирование транспорта веществ из семядолей
Рост площади семядолей
Развертывание пластинки семядолей
Образование волосков на гипокотиле
Разгибание апикальной петельки
Развитие первичных семядольных листьев
Образование примордиев первого настоящего листа
Повышение отрицательного гравитропизма гипокотиля
Образование элементов ксилемы
Дифференцировка устьиц в эпидермисе семядолей
Дифференцировка пластид в мезофилле семядолей
Изменение интенсивности клеточного дыхания
Синтез антоциана
Повышение синтеза аскорбиновой кислоты
Повышение накопления хлорофилла
Повышение синтеза РНК в семядолях
Повышение синтеза белков в семядолях
Интенсификация распада запасных жиров
Интенсификация распада запасных белков
Побеги этиолированных проростков двудольных образуют сильно удлиненные междоузлия и часто также удлиненные листовые черешки, рудиментарную листовую пластинку и загнутую петельку (на гипокотиле или эпикотиле). Изгибание в районе апекса побега проявляется особенно заметно у молодых проростков, оно защищает апикальную меристему во время роста в почве. К тому же почти не образуются механические ткани и проводящие пучки, подавлен также синтез пигментов (хлорофиллов, каротиноидов, антоцианов). Хрупкость этиолированных побегов или листьев известна, например, у спаржи (Asparagus), кочанного салата (Lactucа), цикорного салата (Cichorium). У некоторых однодольных при этиоляции ось побега удлиняется намного меньше, чем листья. Из физиологических симптомов этиоляции у побегов и проростков можно назвать слабо выраженный отрицательный гравитропизм и усиленный положительный фототропизм (см. 8.3.1.1).
Экологическая польза скотоморфогенеза или соответственно этиоляции состоит в том, что в темноте (например, в почве или в щелях скал) все имеющиеся в распоряжении строительные элементы растение использует для того, чтобы вынести ассимиляционные органы на свет. Фотоморфозы (см. табл. 7.5) служат в первую очередь для того, чтобы обеспечить прочность побега в воздушном пространстве, сделать возможным фотосинтез и защитить побег от влияния коротковолнового излучения (образование УФ-защитных пигментов, например, антоцианов).
Особый случай фотоморфозов — влияние света на полярность клеток или дор- сивентральность тканей и органов. Здесь важны различия в интенсивности освещения, а не угол падения лучей света. Клеточную полярность мы уже рассматривали (см. 7.3.3).
При развитии выводковых почек печеночного мха Marchantía (ем. 11.2) свет определяет в первую очередь, какая сторона таллома будет верхней и какая — нижней. У многих заростков папоротников на противоположной от света стороне образуются только генеративные органы и ризоиды (см. 11.2). У многочисленных деревьев общий характер ветвления определяется тем, что прорастают только почки на световой стороне. Дорсивентральность боковых ветвей некоторых хвойных (например, Thuja, Thujopsis) также индуцируется односторонне падающим светом, в то время как в других случаях (Taxus, Picea) действует сила тяжести (см. 7.7.3).
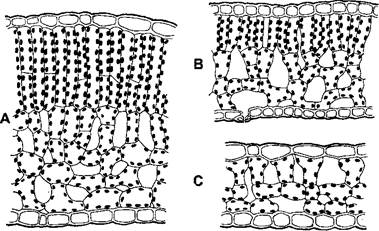
Многие растения, приспособленные к высокой интенсивности света (светолюбивые растения), но не теневыносливые растения, реагируют на затенение со стороны других растений морфологическими адаптациями, которые можно считать частичной этиоляцией. В первую очередь усиливается рост растяжением. Ростовой эффект часто начинается при увеличении густоты травостоя, прежде чем наступает прямое затенение, и вызывается светом, отражаемым соседними растениями. Эта реакция избегания тени, как и этиоляция, служит для наиболее эффективного освещения ассимиляционных органов. У многих лиственных деревьев анатомия листьев сильно зависит от освещения. Световые листья на периферии кроны, особенно на более освещенной южной стороне, обычно имеют палисадные клетки (иногда даже несколько слоев друг над другом) и значительно толще, чем теневые листья внутри кроны или на северной стороне (рис. 7.73). У теневых листьев по сравнению со световыми снижено не только содержание растворимого белка на единицу площади листа или количества хлорофилла, что прежде всего объясняется более низким количеством RubisCO, но и многие другие характеристики фотосинтетического аппарата (см. 6.5.11.1). Форма листьев и побегов также может зависеть от освещенности. Campanula rotundifolia, например, только при слабом освещении образует круглые листья, а при сильном освещении, напротив, развиваются узкие листья, в то время как Opuntia и Nopalxochia при сильном освещении образуют плоские побеги вместо радиальных (см. рис. 4.34).
Рис. 7.73. Поперечный срез через лист Fagus sylvatica: А — лист, выросший на прямом солнечном освещении; В — лист при среднем освещении; С — лист из тени (ок. 340х)
7.7.2.2. Фотопериодически индуцируемые морфозы
Фотопериодом обозначается продолжительность фазы освещения в течение 24- часового дня в естественном месте произрастания, т.е. «длина дня». Она может значительно варьировать в зависимости от географической широты и времени года и только на экваторе одинакова в течение всего года. Однако при растущей географической широте фаза освещения колеблется в течение года все сильнее: на 30° с. ш. (Каир, Дели) — между 14 и 10 ч, на 45° с.ш. (Бордо, Миннеаполис) —- между 15,5 и 9 ч, на 60° с.ш. (Стокгольм, Санкт-Петербург) — между 19 и 6 ч. Таким образом, колебания длины дня коррелируют с выраженными временами года и климатическими особенностями местности.
Фотопериодизмом называют совокупность морфозов, которые индуцируются при изменении фотопериода. При этом дополнительная световая энергия, превышающая пороговую интенсивность излучения от 10-3 до 10-2 В • м 2, практически не играет роли, так что при определенных обстоятельствах свет полной луны (сила освещения 5 • 10-3 В • м-2) может вызывать фотопериодическую реакцию.
Относительная длина дня или ночи может влиять на:
✵ индукцию цветения;
✵ начало и конец периодов покоя;
✵ активность камбия;
✵ скорость роста;
✵ образование запасающих органов (например, клубней картофеля);
✵ формирование устойчивости к морозу;
✵ опадение листьев,
а также, при необходимости, на ветвление, образование адвентивных корней, особенности строения и суккулентность листа и образование пигментов.
Различают длиннодневные растения (ДДР), у которых фотопериодически управляемый морфоз происходит только тогда, когда фотопериод превышает видоспецифичную минимальную продолжительность, так называемую критическую длину дня, и короткодневные растения (КДР), у которых для начала фотопериодически индуцированного морфоза длина дня должна быть меньше критической. Растения, у которых нет такой зависимости от фотопериода, называют нейтральными (нечувствительными к фотопериоду). Лучше всего исследован фотопериодический контроль индукции цветения, описанием которого мы и ограничимся.
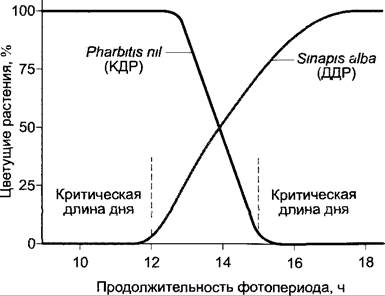
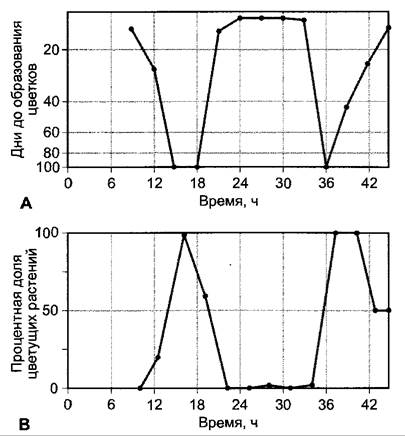
Критическая длина дня для короткодневной реакции может быть намного длиннее, чем для длиннодневной реакции (рис. 7.74). Она составляет для индукции цветения у КДР Хаnthium pensilvanicum, например, 15,5 ч (день должен быть короче, чтобы индуцировать образование цветка), у ДДР Hyoscyamus niger критическая длина дня составляет около 11 ч (она должна быть повышена, чтобы вызвать образование цветка). Следовательно, при длине дня 13 ч оба вида цветут.
Рис. 7.74. Зависимость образования цветков короткодневного (ипомея, Pharbitis nil) и длиннодневного (белая горчица, Sinapis alba) растений от продолжительности ежедневного освещения
Как показывает табл 7 6, сильно упрощенная схема деления на КДР, ДДР и нейтральные виды нуждаются в уточнении. Так, различают качественные, или абсолютные, КДР и соответственно ДДР, реагирующие по принципу «все или ничего», и количественные КДР или соответственно ДДР, так как они только ускоряют цветение под действием фотопериода. Даже разные сорта одного вида при индукции цветения могут по-разному реагировать на фотопериод. Так, многие виды или сорта, которые исходно рассматривались как «нейтральные к фотопериоду», действительно цветут при всех имеющихся фотопериодах (в эксперименте часто также при постоянном свете и в некоторых случаях — при соответствующем питании даже при постоянной темноте, как Hordeum, Raphanus, Cuscuta). Однако в дальнейшем оказалось, что изменение дневной продолжительности освещения сильно стимулирует переход к цветению (количественные ДДР удлинение фотопериода, количественные КДР укорочение фотопериода).
Наряду с КДР и ДДР существуют также длиннокороткодневные растения (например, Kalanchoe daigremontianum или пасленовое Cestrum noctumum) и короткодлиннодневные растения (например. Campanula medium, Tnfohum repens) Для начала цветения они нуждаются в двух следующих друг за другом различных фотопериодах Длиннокороткодневное растение будет цвести у нас1 в естественных условиях только при осеннем коротком дне, но не при весеннем коротком дне.
1 Имеются в виду условия умеренных широт Северного полушария — Примеч. ред.
Понятно, что между ареалом распространения растения и его фотопериодической реакцией должна существовать связь Тропические растения должны быть КДР, или нечувствительными к фотопериоду (нейтральны), потому что в тропиках нет длинного дня (в любом случае длина дня не должна превышать 12 — 14 ч)2. Растения высоких широт, напротив, часто являются ДЦР они должны цвести в такое время (летом), чтобы плоды и семена успели развиться до наступления зимы В средних широтах (примерно 35 — 40°), из которых происходят многочисленные культурные растения, есть как ДДР, так и КДР. Часто здесь можно установить связи со временем засушливого периода в течение года* растения из областей с зимней засухой (определенные районы Индии, Китая и Центральной Америки) чаще являются КДР, из областей с летней засухой (определенные части Средиземноморья, Передней Азии, Средней Азии) — напротив, ДДР. На их родине КДР должны перейти к цветению и плодоношению до зимы, а ДДР — до лета, чтобы пережить засушливое время в виде семян.3
2 Авторы противоречат себе см определение и пример с Нуoscyamus niger. Тропические длиннодневные растения можно найти в климатах с «зимней» (короткодневной) засухой — Примеч. ред.
3 Здесь реальная картина сильно огрубляется. Сравните с логикой для умеренных широт зима (короткий день) неблагоприятна -э цветение теплым летом —> ДДР (нужен длинный день). Логика для Индии зима (короткий день) неблагоприятна —> цветение до зимы (летом9) —> КДР (нужен короткий день). В действительности в Индии засуха приходится номинально на зиму, но не на самые короткие дни. Аналогично, для Средиземноморья зимних запасов влаги хватает вплоть до начала лета (июнь), а сама засуха не совпадает с самыми длинными днями (июль — октябрь) — Примеч. ред.
Таблица 7.6. Зависимость индукции цветения от фотопериода у различных растений
Длиннодневные растения (ДДР) |
Нейтральные к фотопериоду растения |
Короткодневные растения (КДР) |
* Avena sativa |
Agrimonia eupatorio |
Cannabis sativa |
* Triticum aestivum |
Cardamine amara |
* Chrysanthemum indicum |
* Secóle cereale |
Cucumis sativas |
* Chrysanthemum hort. |
*Anthoxanthum odoratum |
Euphorbia lathyrus |
* Coffea arabica |
* Festuca pratensis |
Fagopyrum esculentum |
Dahlia variabilis |
*Lemna gibba |
Helianthus tuberosas |
* Glycine max |
*Lolium temulentum |
Pastinaca sativa |
* Kalanchoe blossfeldiana |
*Phleum pratense |
Poa annua |
*Lemna perpusilla |
*Poa pratensis |
Senecio vulgaris |
*Perilla ocymoides |
*Anagallis arvensis |
Stellaria media |
*Xanthium pensyfvanicum |
Arabidopsis thaliana |
Taraxacum officinale |
Saccharum officinarum |
* Begonia semperflorens |
Thlaspi arvense |
* Setaria virdis |
*Beta vulgaris |
* Euphorbia pulcherrima |
|
* Vicia sativa |
*Amaranthus caudatus |
|
* Trifolium pratense |
*Pharbiiis nil |
|
* Sinapis alba |
||
*Hyoscyamus niger |
||
*Nicotiana tabacums |
Nicotiana tabacums |
*Nicotiana tabacums |
* Digitalis purpurea:s |
Digitalis purpureas |
|
*Hordeum vulgarés |
Hordeum vulgares |
|
* Lactuca sativas |
Lactuca sativas |
|
Oryza sativas |
* Oryza sativas |
|
Phaseolus vulgariss |
* Phaseolus vulgariss |
|
Soja hispidas |
Soja hispidas |
|
Solanum tuberosum |
Solanum tuberosums |
Solanum tuberosums |
Zea mayss |
*Zea mayss |
s — отдельные сорта.
* — качественные (абсолютные) ДДР или соответственно КДР; все остальные реагируют количественно.
Число требующихся для перехода к цветению индукционных циклов у отдельных видов очень различно. Так, КДР Xanthium pensylvanicwn и Pharbitis nil достаточно одного-единственного короткого дня, а ДДР Lolium temulentum — одного-единственно- го длинного дня, в то время как Salvia occidentalis нуждается в 17 коротких днях, а Рlantago lanceolata— 25 длинных днях. В то время как ДДР могут быть индуцированы естественным и постоянным светом, КДР в постоянной темноте голодали бы: для них фотосинтез должен идти в течение по крайней мере 1 — 5 ч ежедневно. Фотопериодичность воспринимается, как правило, листьями. Часто уже достаточно пребывания листа (или частей листа) в индуцирующих условиях, чтобы вызвать цветение. Так, индукцию цветения можно вызвать затемнением листа КДР, содержащегося при длинном дне1. Так как индукция цветения происходит в меристеме побега (о молекулярном контроле образования цветка см. 7.4.3), фактор, вызывающий цветение, должен транспортироваться от воспринимающего листа к меристеме. Очень низкая скорость транспорта (2 — 4 мм • ч-1) позволяет сделать вывод о передающемся от клетки к клетке факторе или комплексе факторов (флориген), который до сих пор, однако, не удалось выделить в чистом виде.2 Эксперименты по прививке показали, что этот фактор, вызывающий цветение, должен быть похож на тот, что имеется у КДР, ДДР и нейтральных растений, или идентичен ему. Так, индуцированный подвой КДР может индуцировать цветение у привитого ДДР-компонента. Если ДДР или КДР прививаются на нейтральные растения, то привои цветут с подвоем в неиндуцирующих для них условиях, а нечувствительный к фотопериоду паразит Cuscuta цветет вместе с растением-хозяином: с ДДР Calendula — на длинном дне, с КДР Cosmos — на коротком дне.
1 Эти опыты впервые поставил М.Х.Чайлахян (Россия). — Примеч. ред.
2 Совсем недавно этот фактор удалось идентифицировать у Arabidopsis как продукт гена FLOWERING LOCUS Т(FT), который передвигается от листьев к меристеме побега. — Примеч. ред.
Гиббереллины могут заменять у некоторых ДДР индуцирующий цветение длинный день, а именно у тех, которые образуют розетки в неиндуктивных условиях (короткий день). Однако образованные на длинном дне (или добавленные извне) гиббереллины стимулируют только ветвление, которое у этих растений является предпосылкой для образования цветка. У КДР, по-видимому, содержание гиббереллина не является ограничивающим фактором для образования цветка. Они ветвятся уже в неиндуктивных условиях, добавленные экзогенно гиббереллины не могут стимулировать цветение в неиндуктивных условиях. Следовательно, в случае гиббереллинов речь не может идти, как предполагалось изначально, о флоригене1. Скорее, в случае фактора инициации цветения речь могла бы идти о макромолекулах (возможно, даже о мРНК), которые транспортируются от клетки к клетке в меристему побега и там включаются в регуляцию генов (межклеточный транспорт макромолекул, см. 7.4.4.1).
1 Здесь идет неточное изложение теории М.Х.Чайлахяна (см. примечание к разделу 7.7.1.3). — Примеч. ред.
Если создать световой режим, благоприятный для цветения КДР, но препятствующий цветению ДДР, а затем прервать темновой период короткой вспышкой света, то КДР остается вегетативным, а ДДР цветет (рис. 7.75). С другой стороны, если кратковременно прерывать темнотой индуктивный световой период, благодаря которому ДДР переходит к цветению, а КДР остается вегетативным, это никак не повлияет на флоральную индукцию. Таким образом, решающей для фотопериодической индукции цветения является не продолжительность непрерывного дня, а продолжительность непрерывной «ночи». Возможно, для КДР следовало бы говорить о растениях длинной ночи, а вместо ДДР — о растениях короткой ночи, однако термины КДР и ДДР укоренились в литературе. Для воздействия на очень чувствительные КДР достаточно лишь минутной вспышки, прерывающей ночь. Напротив, для того чтобы вызвать образование цветка у ДДР вовремя слишком долгого темнового периода, например, у тепличных растений зимой, освещение часто приходится давать в течение нескольких часов. Как у КДР, так и у ДДР физиологический эффект от вспышки сильно зависит от момента времени внезапной подачи освещения в течение темнового периода. В опытах с резкими вспышками света, прерывающими продолжительный период темноты, индукция цветения проявляется в различные моменты времени (рис. 7.76).
Таблица 7.7. Примеры циркадных суточных ритмов у растений
Группа растений |
Организм |
Ритм |
Цианобактерии |
Synechococcus |
Обмен веществ |
Фотосинтезирующие жгутиконосцы |
Gonyaulax potyedra |
Люминесценция, уровень фотосинтеза, рост |
Водоросли |
Euglena gracilis |
Фототаксис |
Rydrodictyon reticulatum |
Фотосинтез, дыхание |
|
Oedogonium cardiacum |
Спорообразование |
|
Acetabularia major |
Уровень фотосинтеза |
|
Грибы |
Sclerotinia fructigena |
Конидиеобразование |
Daldinia concéntrica |
Выбрасывание спор |
|
Pilobolus sphaerosporus |
Взрыв спорангиев |
|
Neurospora crassa |
Рост, споруляция |
|
Папоротникообразные |
Selaginella serpens |
Структура пластид |
Семенные растения |
Phaseolus multiflorus |
Движение листа |
Kalanchoe blossfeldiana |
Движение лепестков |
|
Avena sativa |
Рост колеоптиля |
|
Kalanchoe fedtschenkoi |
Выделение СО2 в темноте |
Рис. 7.75. Действие короткой вспышки света вовремя темнового периода на образование цветков у короткодневных (КДР) и длиннодневных (ДДР) растений — эффект прерывания ночи

Рис. 7.76. Периодически изменяющаяся индукция цветения в опыте с короткими вспышками света как доказательство суточного ритма (А — по R. Bbnsow; В — по Н. Ciaes, А. Lang):А — короткодневное растение Kalanchoe bloss- feldiana содержали 9 ч на свету и затем в постоянной темноте. В различное время темновой фазы (ось абсцисс) части растений давали свет в течение 2 ч и определяли время до закладки соцветий (ось ординат). Фазы различной чувствительности к свету периодически повторялись; В — экземпляры длиннодневного растения Hyoscyamus niger освещали в течение 2 ч различное время продолжительного темнового периода и затем определяли процент вступивших в цветение растений. Чувствительность к свету здесь также периодически колеблется
Из-за продолжительности периода этого ритма, составляющей примерно одни сутки (24 ч), говорят о циркадном ритме (лат. circa — вокруг, около; dies — день). Он управляется эндогенными автономно осциллирующими физиологическими часами, сложным биохимическим механизмом, способ функционирования которого известен лишь частично (см. 7.7.2.3). Не только фотопериодически индуцированные процессы развития, но и многие другие циркадные процессы (табл. 7.7) контролируются физиологическими часами, которые представляют собой как бы эндогенную систему измерения для определения «внутреннего времени» организма.
7.7.2.3. Суточный ритм и физиологические часы
Циркадные ритмы встречаются у про- и эукариот и были найдены у цианобактерий, грибов и зеленых растений в большом разнообразии (табл. 7.7; рис. 7.77). Среди них встречаются циркадные изменения многих видов метаболической активности, а также расположения органов, процессов роста и дифференцировки с периодом около суток. Именно эти явления лежат в основе уже упомянутых процессов развития (см. 7.7.2.2) управляемых фотопериодом. Поэтому циркадные ритмы являются выражением адаптации организмов к заданной вращением Земли вокруг своей оси регулярной смене дня/ночи и к связанным с ним сезонным изменениям.
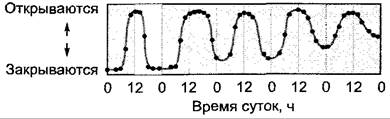
Рис. 7.77. Циркадный суточный ритм. Продолжительные ритмичные, с затухающей амплитудой, движения лепестков Kalanchoe blossfeldiana в полной темноте
Между тем известны многочисленные гены, активность которых изменяется с характерным суточным ритмом. Сюда относится большинство генов ферментов обмена веществ цианобактерии Synechococcus (например, нитрогеназа и др.), у аскомицета Neurospora crassa— ген глицеральдегид-3-фосфатдегидрогеназы, у зеленых растений — гены карбоангидразы (Сhlamydomonas), нитратредуктазы (табак, Аrabidopsis thaliana), каталазы (кукуруза, Аrabidopsis), АЦК- оксидазы (Stellaria longipes), RubisСО-активазы (томат, яблоня, Агаbidopsis) и хлорофилл-a/b- связывающих белков светособирающего комплекса LНСII (пшеница, томат, Arabidopsis, Сhlamydomonas).
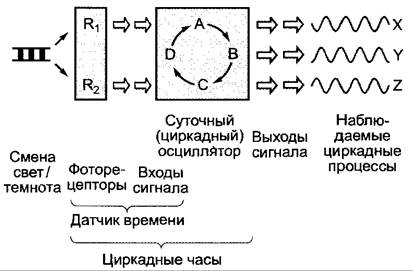
Существенным признаком циркадных ритмов является их контроль с помощью эндогенного осциллятора, который, со своей стороны, синхронизируется по фазам сменой дня и ночи; в некоторых случаях дополнительно действуют также смена температуры и другие раздражители. Датчик времени (смена дня и ночи или температуры) и эндогенный осциллятор образуют вместе физиологические часы; они управляют, в конечном счете, наблюдаемыми суточными ритмами биохимических процессов, которые можно, следовательно, воспринимать как «стрелки часов» (рис. 7.78).
Рис. 7.78. Схема внутренних суточных часов. Входами или соответственно выходами сигнала служат, предположительно, комплексные, связанные друг с другом сигнальные пути. Отдельные компоненты циркадных осцилляторов были охарактеризованы молекулярно (ср. рис. 7.80)
Циркадные ритмы характеризуются следующими тремя признаками.
1. Циркадные ритмы происходят неделями и месяцами даже при неизменных внешних условиях (постоянный свет или постоянная темнота, константная температура и влажность). У высших растений ритмы сохраняются в основном 1 — 2 недели; суточная ритмичность выделения кислорода, наблюдаемая у одноклеточной водоросли Acetabularia сохраняется до 8 месяцев. Амплитуда колебаний циркадных процессов при постоянных условиях медленно снижается (см. рис. 7.77). Это объясняется ослаблением связи между физиологическими часами и управляемым ими процессом в отсутствие датчика времени. Ритмический процесс, однако, часто может снова запускаться одним-единственным сигналом датчика времени.
У одноклеточных динофлагеллат, которые вызывают свечение моря, например, у Gonyaulax polyedra, после трех лет аритмичной культуры на постоянном свету достаточно одной-единственной смены интенсивности света, чтобы снова «подтолкнуть» к суточному ритму свечения. Если, например, проростки бобов держать в постоянной темноте или при постоянном свете, начиная с прорастания, то циркадные движения листьев начинаются только при условии замены постоянного света темнотой (или соответственно постоянной темноты на свет).
2. Длина периода циркадных колебаний, происходящих в неизменных условиях внешней среды («свободных» колебаний), составляет не точно 24 ч (см. рис. 7.76), даже если она синхронизируется в естественных условиях точно на 24 ч. Она составляет, например, для движения листьев Рhaseolus multiflorus (при 25 ° С) 27 ч; для эндогенного ритма выделения СO2 листьями Вryophyllum — 22,4 ч; для экспрессии СAB-гена Агаbidopsis thaliana, кодирующего хлорофилл- а/b-связывающий белок светособирающего комплекса LНСII (см. 6.4.3), в постоянной темноте — 30 ч, при постоянном свете — 24,5 ч. Эти «свободные» ритмы отражают периодичность эндогенного механизма осцилляции, который синхронен с внешним датчиком времени (например, сменой свет/темнота 24-часового дня). Это подтверждается также тем, что соответствующими экспериментальными условиями физиологические часы можно синхронизировать в широких пределах (от 6 до 36 ч) и с другой продолжительностью периодов (например, на 20 ч циклом 10 ч света/10 ч темноты).
Внешние датчики времени (например, смена света и темноты или температуры, а также периодические изменения состава культуральной среды) можно использовать для синхронизации ритмов роста и развития всех клеток у культур одноклеточных организмов (например, водорослей). В синхропных культурах все клетки делятся одновременно и соответственно одновременно удваиваются ДНК, одновременно образуются споры и т.д., поэтому эти культуры очень удобны для исследования физиологических процессов на уровне клеточных популяций (не отдельных клеток).
3. Циркадные ритмы протекают с компенсацией температур. В то время как скорость реакций отдельных энзиматических процессов при повышении температуры на 10 °С примерно удваивается-утраивается (Q10= 2 — 3, см. 6.1.6.4), значения Q10 суточных ритмов находятся в пределах 0,8 — 1,4 (например, для Arabidopsis thaliana при температуре выше 20 °С в пределах 1,0 — 1,1). Это объясняется не тем, что участвующие в физиологических часах реакции независимы от температуры, а тем, что независимость достигается определенным механизмом компенсации, участники которого и способ их функционирования известны пока не полностью.
Напротив, поиск участников физиологических часов идет вполне успешно. Хотя все известные до сих пор эндогенные осцилляторы работают, по-видимому, по однотипному принципу (речь идет о системах с обратной связью генов транскрипционных факторов, которые регулируются собственными продуктами; о регуляции генов см. 7.2.2.3), однако участвующие гены у цианобактерий, грибов, зеленых растений и животных друг другу не гомологичны. В связи с этим правильнее было бы говорить о множестве физиологических часов: они могли многократно возникать в ходе эволюции независимо друг от друга.
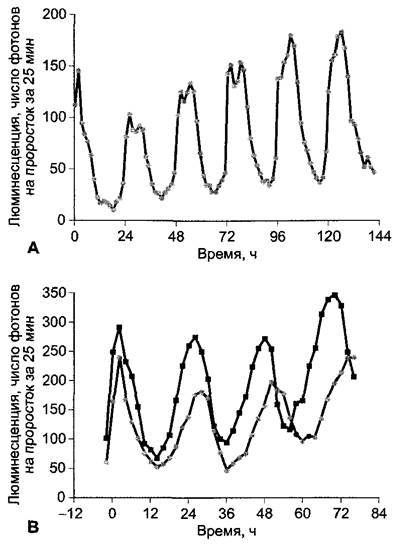
Лучше всего исследованы суточные осцилляторы у Drosophila (циркадному ритму подчинен, например, выход имаго из куколки), аскомицета Neurospora crassa (циркадная регуляция спорообразования) и цианобактерии Synechococcus. Расшифровка механизма осцилляции у высших растений особенно успешна у Arabidopsis thaliana: недавно был получен ряд мутантов, у которых обнаружены нарушения в работе физиологических часов и прежде всего суточного осциллятора. Отбор мутантов проводили среди трансгенных растений (см. бокс 7.3), которые экспрессировали бактериальный ген люциферазы под контролем циркадно активирующегося промотора уже упомянутого СAB-гена. В присутствии добавленного извне люциферина (субстрата люциферазы) эти растения ритмично люминесцируют, что обусловлено ритмично изменяющимся количеством люциферазы в растении. Люминесценцию можно обнаружить с помощью очень чувствительных видеокамер (рис. 7.79)1.
1 У мутантов по эндогенному осциллятору (физиологическим часам) наблюдается изменение периодичности люминесценции. — Примеч. ред.
Рис. 7.79. Эндогенный циркадный ритм транскрипции репортерного гена бактериальной люциферазы под контролем САВ-промотора в трансгенных растениях Arabidopsis thaliana. Хотя люминесценция представляет собой меру ферментативной активности люциферазы, она дает очень точную картину соответствующей активности транскрипции гена люциферазы, так как белок фермента нестабилен и очень быстро разлагается. Растительный промотор взят от САВ-гена, который кодирует хлорофилл-а/b- связывающий белок светособирающего комплекса ФС II — LHCII (см. рис. 6.54). САВ-ген находится под строгим контролем транскрипции со стороны физиологических часов. А — люминесценция 5-дневных проростков при постоянной температуре (22 °С) и смене 12-часового освещения (50 — 60 мкмоль м-2 • с-1 потока фотонов) и 12 ч темноты. Период ритма составляет 24 ч, что обусловлено синхронизацией с программой освещения. Интересно, что активность люциферазы уже за 3 — 4 ч до начала светового периода начинает подниматься и уже перед концом фотопериода снова падает. Следовательно, синхронизированные по циркадному ритму день/ночь часы управляют физиологическими процессами, опережая вступление в фазу освещения или соответственно темноты; таким образом, растение заранее готовится к предстоящему метаболизму (фотосинтез во время освещения), что может оказаться более эффективным регуляторным механизмом, чем постоянный синтез или инициация синтеза белков только при освещении, особенно если из-за малого биологического времени полураспада эти белки должны постоянно образовываться заново. В — автономный циркадный ритм активности люциферазы в растениях, которые после смены свет/темнота (12 ч + 12 ч), начиная с нуля часов росли при постоянном свете. Растения дикого типа (серые символы) показывают период эндогенного ритма 24,5 ч, фотопериодический мутант toc 1 (англ. timing of cab expression, черные символы) имеет укороченный период 21 ч
Современные представления о способе действия суточного осциллятора просуммированы в обобщенной и упрощенной схеме, которая основана на данных по Neurospora (рис. 7.80). Не ясна еще связь последующих процессов, ведущих к отдельным наблюдаемым циркадным феноменам на осцилляторе (осцилляторах?); сигнальный путь (сигнальные пути?) от акцепторов раздражения (например, фоторецепторов, см. рис. 7.78) до осциллятора также в значительной степени непонятен. Напротив, растительные фоторецепторы были в последние годы подробно охарактеризованы, снова благодаря анализу мутантов и клонированию мутировавших генов.
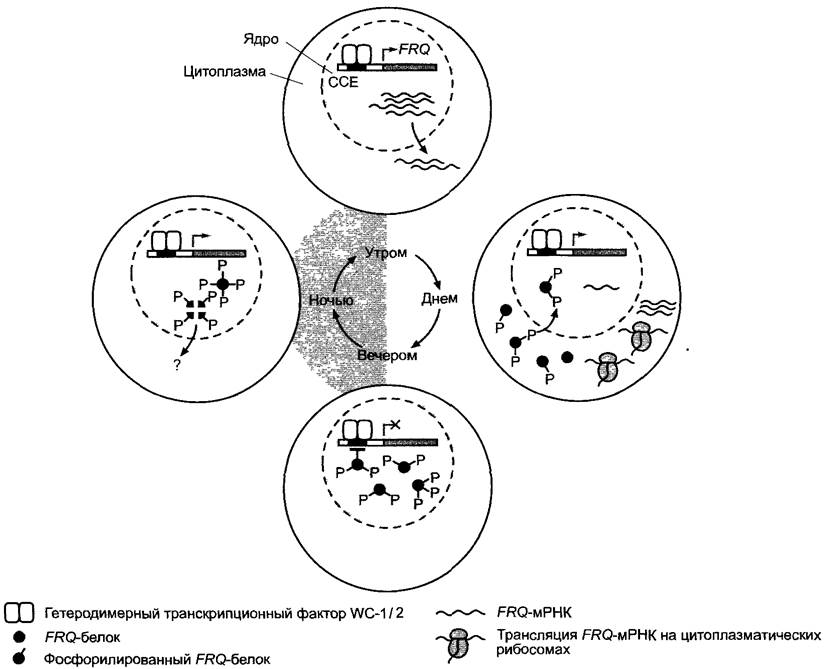
Рис. 7.80. Гипотетическая функциональная модель циркадного осциллятора Neurospora crassa. Система состоит из двух транскрипционных факторов WC-1 и WC-2 (англ. white coliat; названы по фенотипу мутанта, потому что мутант не образует на свету каротиноиды и остается бесцветным), которые образуют гетеродимер и активируют транскрипцию «гена часов» FRQ (англ. frequency — назван по фенотипу мутанта), генный продукт которого, FRQ-белок, является негативным регулятором действия WC-1 и WC-2, что таким образом ингибирует его собственное образование. В промоторах «генов часов» (англ, dock genes) были найдены важные для ритмичной экспрессии цис-элементы, СЕ-элементы (ССЕ — от англ. circadian clock element). Модель представляет собой отрицательную петлю обратной связи, длина периодов которой в основном определяется медленно протекающими внутриклеточными процессами транспорта (транспорт FRQ-mPHK из ядра в цитоплазму, транспорт фосфорилированного FRQ-белка из цитоплазмы в ядро). В начале цикла (на рисунке вверху) факторы WC-1/2 активируют транскрипцию FRQ-гена, FRQ-mPHK накапливается сначала в клеточном ядре и затем все больше транспортируется в цитоплазму. Там FRQ-белок синтезируется и фосфорилируется (справа). Фосфорилированный FRQ перемещается в клеточное ядро и постепенно репрессирует там транскрипцию своего гена, так что она в конце концов прекращается (внизу). FRQ-белок со временем фосфорилируется все сильнее. Высокофосфорилированный FRQ нестабилен и протеолитически разрушается. Со снижением концентрации активного FRQ-белка в клеточном ядре ниже порогового значения, необходимого для ингибирования транскрипции, транскрипция FRQ-гена снова запускается (слева). В постоянных внешних условиях процесс в целом обладает суточным периодом. Во внутреннем круге показано примерное расположение отдельных процессов при синхронизации осциллятора сменой свет/темнота 12 ч + 12 ч в течение 24-часового цикла. Предполагают, что на свету гиперфосфорилирование FRQ-белка, а, следовательно, и его протеолитическое разрушение ингибируются
7.7.2.4. Фоторецепторы и сигнальные пути управляемого светом развития
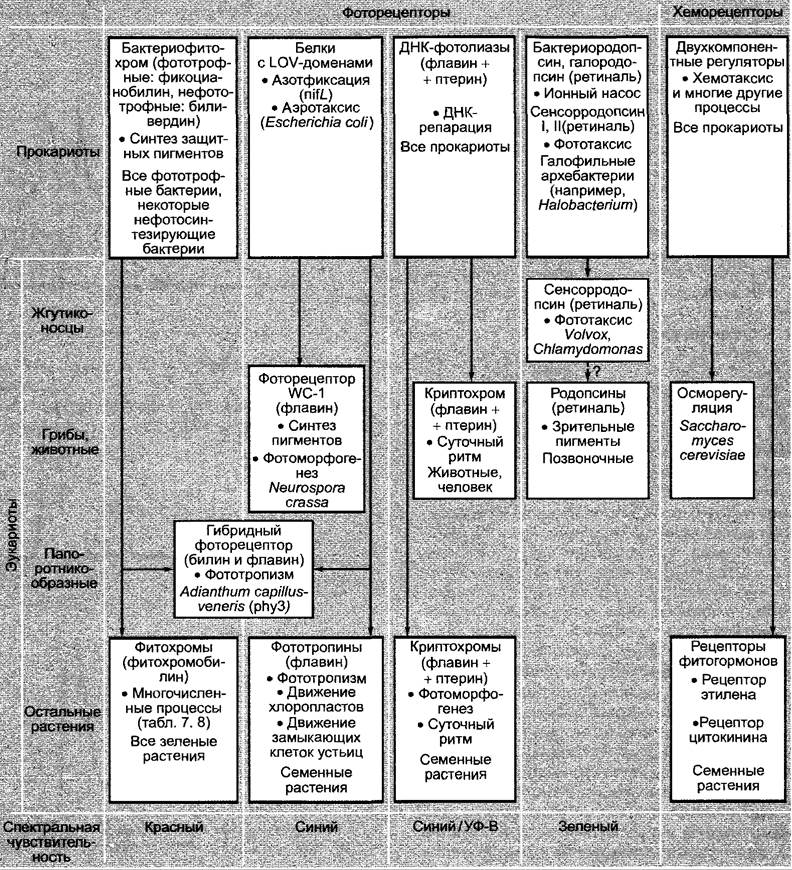
У грибов длины волн < 520 нм стимулируют фотоморфогенез (синяя, УФ-область), у эукариотических растений регулируемые светом процессы лишь частично зависят от синего и/или УФ-света, здесь гораздо большую роль играет красный свет. Между тем на молекулярном уровне были охарактеризованы ответственные за восприятие света фоторецепторы покрытосеменных. Это прежде всего фитохромы, которые поглощают в красной области спектра и частично в синей и УФ-области, а также криптохромы, ответственные, главным образом, за поглощение синего и УФ- света (криптохромы названы так потому, что их долгое время не могли биохимически определить, они были охарактеризованы только путем клонирования их генов у мутантов по физиологическому ответу на синий свет). Фоторецепторы участвуют, однако, не только в управлении зависящими от света процессами развития, которые с определенного момента времени необратимы и в целом также называются фотодифференцировкой. Фитохромы и криптохромы управляют также многими обратимыми процессами фотомодуляции, которые все вместе противопоставляются фотодифференцировке. Наряду с фитохромами и криптохромами существуют другие фоторецепторы для управления фототропизмом (см. 8.3.1.1), открытием устьиц (см. 8.3.2.5; 6.5.7) и фототаксисом (см. 8.2.1.2); сведения о них представлены в табл. 7.8. Дальнейшее описание мы ограничили фитохромами и криптохромами, другие фоторецепторы рассмотрены при обсуждении соответствующих физиологических процессов.
Типичные фитохромы встречаются во всех зеленых растениях, начиная с водорослей. Это гомодимерные хромопротеиды; каждый мономер состоит из апопротеина с молекулярной массой 120—129 кДа; он несет молекулу фитохромобилина, ковалентно связанную с тиоловой группой остатка цистеина. Синтез фитохромобилина, незамкнутого тетрапиррола, имеющего большое структурное сходство с фикоцианобилином цианобактерий (см. рис. 6.51), протекает в хлоропластах (см. рис. 6.112), синтез апопротеина — в цитоплазме. Апо- протеин и хромофор соединяются в цитоплазме в голопротеин (рис. 7.81), который затем димеризуется. Фитохромопротеины действуют при этом как билинлиазы: они стимулируют автокаталитически ковалентное соединение хромофора и переходят таким образом в голопротеин. Разные фитохромы различаются в апопротеиновой части, хромофор у всех идентичен; таким образом, нельзя дифференцировать различные фитохромы в растении даже на основе их спектральных свойств1.
Фитохромоподобные фоторецепторы были найдены недавно и в прокариотах. Они распространены во всех фотоавтотрофных прокариотах (например, цианобактериях и пурпурных бактериях) и встречаются, кроме того, в немногочисленных нефотоавтотрофных бактериях (например. Pseudomonas aeruginosa, Deinococcus radiourans). Эти бактериофитохромы связывают in vivo у фотоавтотрофных прокариот фикоцианобилин ковалентно через цистеин, у не-фотоавтотрофных — образующийся при распаде гема биливердин через гистидин. Бактериофитохромголопротеины абсорбируют также красный или соответственно дальний красный свет и демонстрируют фотообратимость (см. ниже). Они участвуют в регуляции бактериального синтеза пигментов, особенно каротиноидов, которые образуются как защитные пигменты от слишком интенсивного облучения на ярком свету. Мутанты с нарушенным образованием бактериофитохрома растут на свету плохо. Бактериофитохромы являются рецепторными компонентами типичных бактериальных двухкомпонентных регуляторов. При освещении они авто- фосфорилируются с использованием АТФ по остатку гистидина. Фосфатная группа переносится оттуда на остаток аспартата во втором, регуляторном, белке, который в фосфор илиро- ванной форме представляет собой активный транскрипционный фактор, напрямую вступающий во взаимодействие с целевыми генами (в случае бактериофитохрома — с генами биосинтеза пигментов, регулируемыми светом), и активирует их транскрипцию. Фитохромы эукариотических растений представляют собой, по- видимому1, также активируемые светом проте- инкиназы; хотя они не проявляют гистидинки- назной активности, но являются серин/треонинкиназами.
1 Тем не менее спектральные свойства различаются в зависимости от апопротеина. Так, фитохром А имеет более широкое плечо в красной части спектра по сравнению с фитохромом В, хотя положение максимумов совпадает. — Примеч. ред.
Таблица 7.8. Примеры фоторецепторов и регулируемых светом процессов у низших и высших растений
Тип фоторецептора |
Хромофорная группа (группы) |
Спектральная чувствительность |
Пример1 |
Регулируемые процессы |
Фитохром класса I |
Фитохромобилин |
R, (В) |
phyA (At) |
Индуцируемые дальним красным светом фотомор- фозы этиолированных проростков (VLFR2). HIR2 — ответы фотоморфогенеза этиолированных проростков (с cryl). |
Фитохром класса II |
Фитохромобилин |
R |
phyB, С, D, Е (At) |
HIR2 — ответы фотоморфогенеза на свету. Фотопериодически управляемые морфозы (например, индукция цветения) (с сгу2). Фотообратимые К/Д К-ответы при низких интенсивностях света (LFR2) (например, зависимое от света прорастание семян). Реакция избегания тени. Фотомодуляция (например, положение листовых органов в периоде день/ночь). |
Криптохром |
Птерин, флавин |
В, UV-A |
cry1 (At) |
HIR2 — ответы фотоморфогенеза этиолированных проростков (с phyA). |
Птерин, флавин |
В, UV-A |
cry2 (At) |
Фотопериодически управляемые морфозы (с phyB). |
|
Фототропин |
Флавин |
В |
phot1, phot2 (At) |
Фототропизм высших растений. Открывание устьиц у высших растений. |
Сенсор-родопсин |
Ретиналь |
G |
Хламиопсин |
Фототаксис у Chlamydomonas и других Chlorophyceae. |
Напрямую светочувствительный транскрипционный фактор |
Флавин |
В |
WC-1 |
Биосинтез каротиноидов и споруляция у Neurospora crassa. |
Неизвестный |
Флавин |
В |
— |
Фототропизм Phyсоту ces. |
Неизвестный |
Флавин |
В |
— |
Фототаксис Euglenci. |
1 Для At Arabidopsis thaliana, следуя действующей для этого вида традиции, апопротеины обозначаются прописными буквами, голопротеины (= апопротеин + хромофор) строчными буквами (пример: PHYA — апопротеин фитохрома A, phyA — голопротеин фитохрома А).
2 VLFR, LFR и HIR — см. табл. 7.10. R — красный; В — синий; G — зеленый; UV-A — длинноволновый ультрафиолетый (320 — 390 нм).
Рис. 7.81. Схема строения голопротеина фитохрома и светозависимая изомеризация хромофора фитохромобилина. N-концевой домен апопротеина несет хромофор фитохромобилин, ковалентно связанный через тиоэфирный мостик с цистеином; С-кон- цевой домен важен для передачи сигнала и демонстрирует протеинкиназную активность. Мутации в области регуляторных функций ведут к инактивации фитохрома. В С-концевом домене расположены также части белка, ответственные за димеризацию и протеолитическое разложение после убиквитинирования. При обратимом переходе Рк⇄ Рдк хромофор изомери- зуется по метиновому мостику (С-15) между С- и D-кольцом. По двойной связи в Рк имеется Z-, а в Pдк — Е-конформация (Z-, Е-номенклатура, см. учебники по химии)
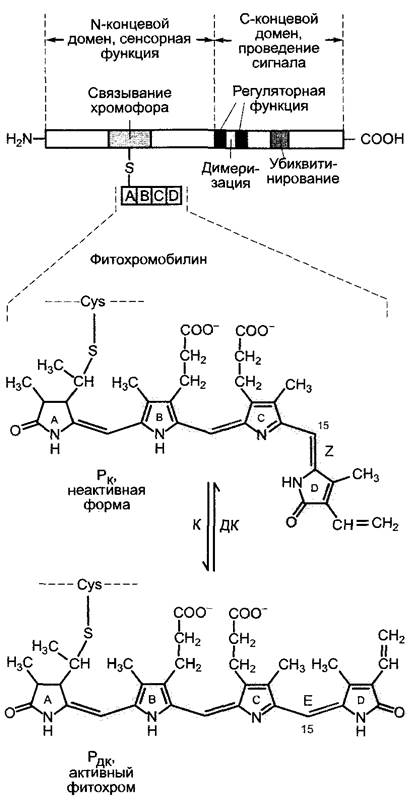
Первичный фотохимический процесс при поглощении кванта света фитохромом ведет к изомеризации двойной связи между пиррольными кольцами С и D (см. рис. 7.81). Этот переход (Z- Е-изомеризация) обратим. Опыты на этиолированных проростках показали, что при выключении света синтезированный фитохром находится в виде Z-изомера метилового мостика, соединяющего C/D-кольца. Этот фитохром имеет пик поглощения в красной части спектра (рис. 7.82) и поэтому обозначается как Рк (HR, нем. Hellrot, 650 — 680 нм, ![]() = 667 нм; англ. Pr, г = red)1. называется также Р660 по поглощаемой длине волны (660 нм), которая используется в эксперименте для активации фитохромной системы. Ркявляется физиологически неактивной формой фитохрома. При освещении красным светом (в эксперименте, например, монохроматическим светом с длиной волны 660 нм) хромофор изомеризу- ется в Е-форму. Фитохром Рк переходит при этом в активную форму, которая по его максимуму поглощения в дальнем красном свете называется также Рдк (DR, нем. dunkelrot, 710 — 740 нм,
= 667 нм; англ. Pr, г = red)1. называется также Р660 по поглощаемой длине волны (660 нм), которая используется в эксперименте для активации фитохромной системы. Ркявляется физиологически неактивной формой фитохрома. При освещении красным светом (в эксперименте, например, монохроматическим светом с длиной волны 660 нм) хромофор изомеризу- ется в Е-форму. Фитохром Рк переходит при этом в активную форму, которая по его максимуму поглощения в дальнем красном свете называется также Рдк (DR, нем. dunkelrot, 710 — 740 нм,![]() = 730 нм, или Р730, англ. Pfr, fr = far red) (см. рис. 7.82).
= 730 нм, или Р730, англ. Pfr, fr = far red) (см. рис. 7.82).
1 Немецкие названия не совсем удачны: hellrot (светло-красный) и dunkelrot (темнокрасный) отражают скорее яркость красного цвета, но не его положение в спектре. Более удачны английский red — красный и far red — дальний красный, т. е. сдвинутый в сторону больших длин волн относительно красного (ближе к пурпурному). — Примеч. ред.
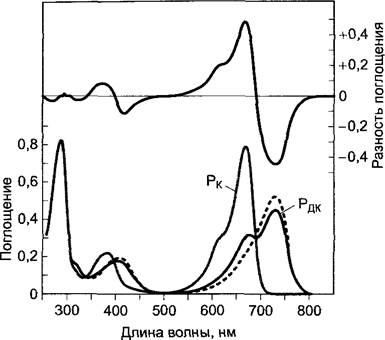
Рис. 7.82. Спектры поглощения Рк и Рдк (внизу), а также дифференциальный спектр двух пигментов [Е(РК)-Е(РДК)] (вверху). Показанные спектры были определены для фитохрома этиолированного проростка овса, фитохрома класса I, такого, как рhуА Агаbidopsis thaliana (см. текст). Спектры других фитохромов, также класса II (например, рhуВ), спектроскопически неотличимы от фитохрома класса 1. Пунктирная линия дает спектр Рдк, когда вносят поправку для еще имеющейся в фоторавновесии доли Рнк (20%) после насыщающего облучения красным светом
В результате освещения дальним красным светом (в эксперименте, например, монохроматическим светом с длиной волны 730 нм) Рдк может снова обратимо переходить в неактивную Рдк-форму. Для активации или соответственно инактивации фитохрома достаточно уже коротких световых импульсов. При непосредственно следующих друг за другом импульсах красного или дальнего красного света характеристика последней вспышки света определяет, в каком направлении пойдет физиологический процесс. Фотообратимостьявляется важным критерием для физиологического доказательства участия фитохромной системы (см. рис. 7.75; рис. 7.83; табл. 7.9), но фотообратимость наблюдается не во всех процессах, контролируемых фитохромом (табл. 7.10).
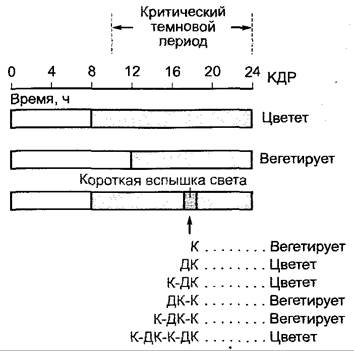
Рис. 7.83. Физиологическое доказательство участия фитохромной системы в индукции цветения у короткодневного растения Xanthium strumarium. Опыты показывают, что для фотопериодической реакции важна продолжительность не непрерывного освещения, а непрерывного темнового периода. Импульс света внутри темнового периода действует как непрерывный длинный день. Участие фитохромной системы подтверждается тем, что активен красный свет и процесс можно обратить путем последующего облучения дальним красным. КДР — короткодневное растение.
Спектры поглощения Рк и Рдк значительно перекрываются (см. рис. 7.82), поэтому при освещении даже монохроматическим светом длиной волны 660 нм или 730 нм постоянно имеется фоторавновесие между Рк и Рдк, которое варьирует в зависимости от соотношения К: ДК между 2,5 % Рк и 97,5 % Рдк (после облучения монохроматическим светом с длиной волны 730 нм) и 80 % РДк и 20 % Рк (после облучения монохроматическим светом с длиной волны 660 нм). Некоторые физиологические процессы (например, индукция прорастания некоторых семян светом1 при использовании крайне низких фотонных потоков, VLFR-процессы, см. табл. 7.10) вызываются малыми количествами Рдк, имеющимися даже при облучении дальним красным светом (2,5 %). Подобные процессы, следовательно, уже нельзя повернуть вспять с помощью ДК-облучения; они, напротив, индуцируются не только красным, но и дальним красным светом.
1 Здесь использован термин Lichtkeimer, т.е. «нуждающийся в свете для прорастания». — Примеч. ред.
Таблица 7.9. Обратимость индукции прорастания семян салата (Lactuca sativa cv. Grand Rapids) с помощью сдвига соотношения Рк: Рдк в фитохромной системе путем облучения красным (К) или дальним красным (ДК) светом.
Последовательность облучения |
Доля прорастания, % |
К |
70 |
К + ДК |
6 |
К + ДК + К |
74 |
К + ДК + К + ДК |
6 |
К+ДК+К+ДК+К |
76 |
К + ДК + К + ДК + К + ДК |
7 |
К + ДК + К + ДК + К + ДК + К |
81 |
К + ДК + К + ДК + К + ДК + К + ДК |
7 |
Облучение в течение 5 мин интенсивностью 1 В • м-2 К или, соответственно, 5 В • м-2 ДК. Как и у других тканей, нельзя вызвать фотоиндукцию и реверсию в сухой ткани. Семянки освещают в набухшем состоянии. Напротив, соответствующее состояние индукции фитохрома сохраняется на протяжении фазы покоя.
В естественных местах обитания растений, в отличие от эксперимента, нет монохроматического света, т. е. в среде постоянно присутствует спектральный континуум в разной мере, обогащенной К и ДК. Правда, они значительно варьируют в зависимости от ситуации. Соотношение
![]()
составляет при максимальном дневном солнечном свете (в полдень) около 1,13, снижается, однако, в утренних и вечерних сумерках до менее 1 (0,9 —0,8) и в почве, например, под слоем листвы или мульчи принимает также низкое значение (<0,9). Намного ниже соотношение К : ДК в тени листвы (<0,2), т.е. здесь благодаря сильной абсорбции хлорофилла (см. рис. 6.46) в красной части спектра ДК особенно высока. Поэтому и отраженный зелеными растениями свет обладает высокой долей ДК.
Вследствие значительного перекрывания спектров поглощения Рк и Рдк при сдвиге соотношения К : ДК очень сильно изменяется состояние активности фитохрома (см. рис. 7.82). Поэтому фитохром является идеальным фоторецептором для восприятия сумерек (что важно для фотопериодических реакций и циркадных процессов), для установления затенения в почве (например, у проростков) и для восприятия «зеленой тени» (реакция избегания тени). «Нейтральная тень», например, тень каменной стены, напротив, не действует. На солнечном свете при соотношении К : ДК > 1 более половины фитохрома находится в активной РдК-форме. Поэтому солнечный свет действует как К. В особых случаях (например, у низших растений, см. 8.3.1.1) молекулы фитохрома в клетке правильно ориентированы в пространстве и регистрируют из-за своих дихроических свойств плоскость колебаний поляризованного света.
По стабильности на свету фитохромы можно разделить на два класса: фитохромы I класса, типичные для покрытосеменных и отсутствующие у споровых, и фитохромы II класса,встречающиеся у всех фотоавтотрофных про- и эукариот (рис. 7.84).
Рис. 7.84. Различия между фитохромами I и II класса на примере фитохромов А — Е Аrabidopsis thaliana. В некоторых случаях фитохром А взаимодействует с рецептором синего света криптохромом 1 (сгу1) (реакции фотоморфогенеза на свет высокой интенсивности, см. текст), фитохром II класса рhуВ, напротив, — с криптохромом 2 (сгу2, фотопериодизм, см. текст). Как активный фитохром А (рhуАдК), так и активный фитохром В (рhуВдК) участвуют в ингибировании транскрипции РНУА на свету. UQ — убиквитин
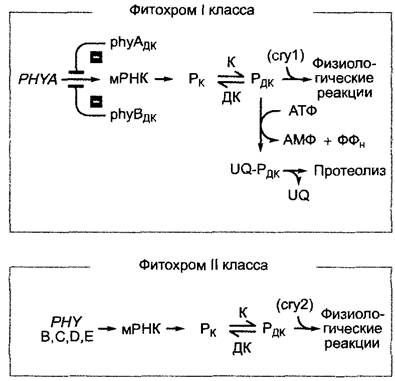
Фитохром I класса на свету нестабилен и быстро протеолитически расщепляется при участии системы убиквитина (происходит протеолиз Рдк-формы) (см. 7.3.1.3; рис. 7.44); одновременно его новый синтез ингибируется репрессией транскрипции на свету. Фитохром I класса преобладает в этиолированном проростке и встречается у двудольных, особенно в области зародышевой почечки, у проростков злаковых в колеоптилях и примордиях листьев. Он отвечает за первую фазу фотоморфогенеза этиолированных проростков и взаимодействует здесь в высокоинтенсивной реакции (HIR, см. табл. 7.10) с рецептором синего света / ближнего УФ криптохромом I (рис. 7.85; бокс 7.5), но затем быстро разлагается и больше не обнаруживается в позеленевшем растении на свету. Фитохром I класса, кроме того, отвечает за прорастание семян, вызываемое дальним красным светом очень низкой интенсивности. Его функция в развитии растения, очевидно, ограничена первым контактом этиолированного проростка или набухших семян со светом (см. табл. 7.10). У Агаbidopsisthaliana существует только один-единственный фитохром I класса: фитохром А (рhуА, номенклатура; см. табл. 7.8; бокс 7.2), апопротеин которого (РНУА) кодируется PHYА-геном.
Таблица 7.10. Класиффикация фитохромных ответов с физической точки зрения
Признак |
Реакции на сверхнизкие интенсивности освещения (VLFR1) |
Реакции на низкие интенсивности освещения (LFR1) |
Реакции растений на освещение высокой интенсивности (HIR1) |
|
этиолированные |
выросшие на свету растений |
|||
Фотообрати мость |
Нет |
Да |
Нет |
Нет |
Реципрокностъ |
Да |
Да |
Нет |
Нет |
Максимумы поглощения спектров действия |
R, В |
R, FR |
FВ, B,UV-А |
R |
Фоторецептор |
рhуА |
phyB |
рhуА + сгу1 |
рhуВ |
Примеры |
✵ Стимуляция светом прорастания некоторых семян (например, Агаbidopsisw); ✵ стимуляция роста колеоптиля и ингибирование роста мезокотиля этиолированных проростков овса |
✵ Стимуляция светом прорастания некоторых семян (например, Lactuca, Arabi- dopsisw); ✵ реакция избегания тени; ✵ фотопериодически вызванные морфозы (участвуют phyB + сгу2); ✵ циркадные суточно-периодические реакции (например, движения листьев) |
✵ Ингибирование растяжения гипокотиляw; ✵ рост семядольных листьев; ✵ индукция синтеза антоциана у проростков двудольных; ✵ разгибание апикальной петельки |
✵ Ингибирование растяжения гипо- котиляw |
1 VLFR (англ. very Iow fluence response); LFR (англ. Iow fluence response); HIR (англ. high irradiance response);
w Соответствующие спектры действия даны на рис. 7.85. Для обозначения фоторецепторов использовалась общепринятая традиция для Àrabidopsis thaliana (см. табл. 7.8).
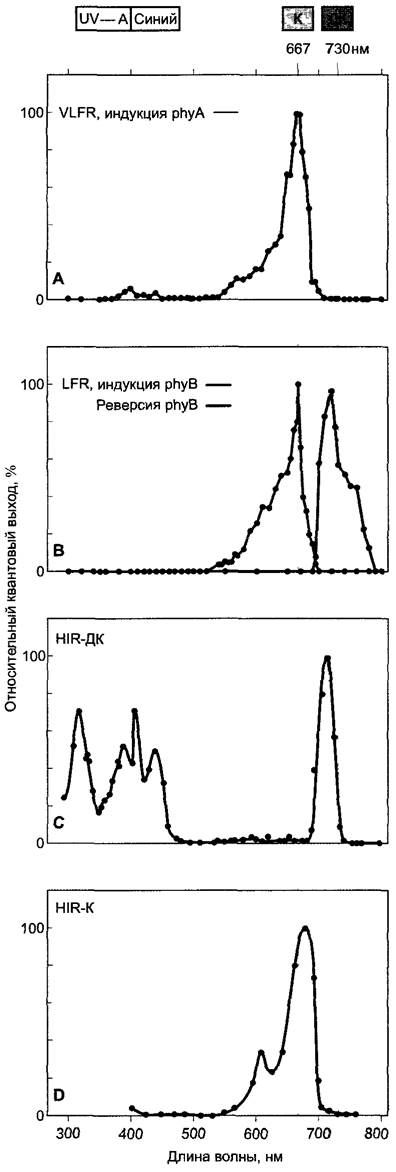
Рис. 7.85. Спектры действия фотоморфозов растений (А, В — по T.Shinomura, M.Furuya, с любезного разрешения; С — по К.М. Hartmann; D — по C.J.Beggs, Е. Schflfer).
Спектры действия фотобиологических процессов, которые зависят от потока фотонов, получают путем облучения объекта исследования монохроматическим светом различных длин волн при равном потоке фотонов (моль фотонов м-2), определяя различные физиологические параметры (например, долю прорастания). Спектры действия при ответах, которые зависят от интенсивности света, получают аналогично, варьируя длину волны при постоянной интенсивности света (моль фотонов • м-2 • с-1, единицы фотобиологии: см. бокс 6.2). А — реакция сверхнизкого потока (VLFR) на примере прорастания семян phyB-дефицитного мутанта Arabidopsis thaüana. phyA-ответ вызывается красным светом и уже не может стать обратимым при последующем облучении дальним красным (например, 730 нм). VLF-реакция phyA демонстрирует характерную, хотя и слабую активность также в синей части спектра; В — реакция низкого потока освещения (LFR) прорастания семян phyA-дефицитного мутанта Arabidopsis thaliana; phyB-ответфотообратим, синий свет совершенно не действует; С — реакция на высокую интенсивность дальнего красного света (ДК) на примере ингибирования растяжения гипокотиля у этиолированных проростков салата. В спектре действия наряду с пиками в синей и УФ-А-части, которые происходят от криптохрома, присутствует пик поглощения дальнего красного света, который указывает на фитохром I класса (соответственно phyA у Arabidopsis thaliana) ; D — реакция на высокую интенсивность красного света (К) на примере ингибирования роста гипокотиля у выросших на свету проростков Sinapis alba.Синий свет не действует, пик активности в красной области спектра объясняется фитохромом II класса (соответственно phyB Arabidopsis thaliana)
Бокс 7.5. Эволюция растительных рецепторов
Растения реагируют на множество эндогенных (см. 7.6) и экзогенных (см. 7.7, 8.2, 8.3) раздражителей. Только в последние годы удалось расшифровать молекулярное строение некоторых растительных рецепторов. Знания о фоторецепторах уже довольно обширны, но о хеморецепторах мало что известно. Для всех до сих пор функционально охарактеризованных рецепторов растений было показано, что они возникли в процессе эволюции из прокариотических предшественников, которые еще можно обнаружить у живущих сегодня прокариот (рис. А). Следовательно, сенсоры для внешних сигналов у растений, насколько известно, имеют прокариотическое происхождение. В последнее время были также идентифицированы прокариотические предшественники (родопсин, криптохром) определенных рецепторов животных.
Рис. А. Эволюционные связи растительных фото- и хеморецепторов. Следующие термины кратко объяснены в разделах 7.6, 7.7, 8,2, 8.3: белки с LOV-доменами — группа белков, выделенных из прокариот; их активность регулируется факторами окружающей среды, а именно светом, кислородом или окислительно-восстановительными процессами (LOV — англ. light, oxygen, voltage). Все эти белки содержат нековалентно связанный флавин (ФАД), который может возбуждаться путем поглощения света или окислительно-восстановительными процессами. В возбужденном состоянии у рецептора фототропизма фототропина происходит фосфорилирование аминокислотного остатка своей собственной полипептидной цепи (автофосфорилирование). WC-1 — обозначение мутанта аскомицета Neurospora crassa (англ, white collar). Этот альбиносный мутант несет дефект во флавинсвязывающем LOV-домене апопротеина. У мутанта нарушаются все регулируемые синим светом процессы, например, синтез каротиноидов, фототропизм перитециев, суточный ритм конидиеобразования. WC-1 является фактором транскрипции, регулируемым напрямую светом
Высшие растения обладают несколькими фитохромами II класса (Arabidopsis — четырьмя: рhуВ, рhуС, рhуD и рhуЕ, апопротеины которых кодируются генами от РНУВ до РШБ. До сих пор хорошо исследован только рhуВ, преобладающий фитохром II класса). Фитохромы II класса на свету стабильны и встречаются в растении как на свету, так и в темноте. Они представляют собой фоторецепторы «классических» фотообратимых фитохромных ответов (см. рис. 7.83; 7.84; табл. 7.8; 7.9) и ответственны за фитохромопосредованные реакции растущего на свету растения (фотопериодическая регуляция; циркадные процессы, например, настии листьев; реакции избегания тени; движение хлоропластов у водорослей, см. 8.2.2).
Спектры действия (см. рис. 6.46) часто позволяют оценить участие определенных фоторецепторов в индуцируемом светом процессе (см. рис. 7.85). Точную информацию в последние годы получают при исследовании мутантов, у которых отсутствуют определенные фоторецепторы (или комбинации фоторецепторов) или которые экспрессируют их иначе, чем растения дикого типа.
Управляемые фитохромом процессы можно разделить на три класса на основе необходимых для их вызывания потоков фотонов: VLFR-ответы (англ. very low fluence responses, 0,1 — 100 нмоль-квантов • м-2), LFR-ответы (англ. low fluence responses, 1 — 1 000 мкмоль квантов • м-2) и HIR-ответы (англ. high irradiance responses, которые вызываются долгим или постоянным облучением светом высокой интенсивности). Для VLFR- и LFR-ответов внутри определенных границ действует правило реципрокности, согласно которому произведение интенсивности облучения I (поток фотонов, моль • м-2 • с-1) и времени (с), т. е. (поток фотонов квантов • моль • м-2) является определяющим для силы физиологического ответа; в области пропорциональности можно работать либо с низкой интенсивностью облучения и большой его продолжительностью, либо с высокой интенсивностью и соответственно с меньшей продолжительностью. Напротив, HIR-ответы (отсюда их название) скорее пропорциональны интенсивности света и вызываются только при высокой интенсивности, но не продолжительным облучением слабым светом. Примеры физиологических ответов представлены в табл. 7.10.
Поглощающие синий свет (390 — 500 нм)/ УФ-А (320 — 390 нм) криптохромы являются хромопротеидами, которые схожи с фо- толиазами, однако не обладают фотолиазной активностью. Фотолиазы встречаются у бактерий, архебактерий и эукариот; они катализируют в индуцируемой синим/УФ-А- светом реакции расщепления пиримидиновых димеров, возникающие в ДНК вследствие облучения УФ-В (200 — 300 нм), и действуют таким образом как ферменты репарации ДНК. Они обладают двумя светопоглощающими пигментами: птерином и флавином (флавин частично восстановленный, в виде флавосемихинон-радикила, ФАДН). Птерин отвечает за поглощение света и переносит свою энергию возбуждения на флавин, окислительно-восстановительный потенциал которого из-за этого становится отрицательным. В возбужденном состоянии флавин катализирует восстановительное расщепление пиримидинового димера. Криптохромы должны нести также птерин и полувосстановленный флавин, поэтому предполагают, что они после поглощения света запускают (еще неизвестный) окислительно-восстановительный процесс.
У Аrabidopsis thaliana были открыты два гена криптохромов. На основании фенотипического анализа мутантов было получено, что криптохром 1 (сгу1) вместе с фитохромом I класса (рhуА) важен для начала фотоморфогенеза у этиолированного проростка, в то время как криптохром 2 (сгу2) вместе с фитохромом В через физиологические часы, по-видимому, участвует в восприятии фотопериодического сигнала. Сгу2-подобные фоторецепторы были недавно открыты также у животных и человека, где они должны регулировать суточный ритм.
В значительной мере еще невыясненным является вопрос о сигнальных путях управляемого светом развития. Недавно было найдено, что после освещения из цитоплазмы транспортируются в клеточное ядро как рhуА, так и рhуВ. Рецептор сгу2, по-видимому, постоянно находится в клеточном ядре, локализация сгу1 неизвестна. Правда, сгу1 взаимодействует напрямую с рhуА и перемещается при освещении либо в комплексе с ним в клеточное ядро, либо сгу1 уже находится там, как сгу2. Фитохромы обладают протеинкиназной активностью на своем С-терминальном домене (ср. рис. 7.81). Реакции фосфорилирования и, предположительно, окислительно-восстановительные реакции активированных криптохромов могли бы быть отправными точками сигнальных каскадов реакций, которые после освещения запускают фоторецепторы в клеточном ядре, в результате изменяется активность регулируемых светом генов. Известны многочисленные гены, транскрипция которых регулируется светом. Особенно подробно были исследованы гены (кодируемой ядром) малой субъединицы рибулозо-1,5-бифосфат-кар- боксилазы/оксигеназы (англ. Ribulose-1,5- biphosphat-Carboxylase/Oxygenase, RBCS, S = small — малый) и хлорофилл-a/b-связывающих белков (англ. Chlorophyll-а/b- binding protein, САВ-гены). При этом в промоторах этих и других регулируемых светом генов были выявлены цис-элементы, которые, хотя и требуются для светорегуляции, но еще не достаточны, так как такие же элементы имеются и в некоторых не регулируемых светом генах: так называемые GT-области (5'-GGTTAA-3'), G-боксы (5'-CACGTG-3') и 1-боксы (5'-GATAA-3')* На примере регулируемых светом генов также показано, что специфичность контроля транскрипции обеспечивается путем сложных взаимодействий цис-элементов и связывающихся с ними транскрипционных факторов.
Недавно был в общих чертах выяснен механизм действия phyB. После освещения активная Рдк-форма phyB транспортируется из цитоплазмы через ядерные поры в клеточное ядро и активирует там транскрипцию phyB-регулируемых генов (рис. 7.86). Подобные механизмы, вероятно, лежат в основе действия и остальных фитохромов и, возможно, криптохромов. Со временем, вероятно, обнаружится множество различий в деталях регуляторных механизмов, поскольку число регулируемых светом генов и их промоторов довольно велико.
Рис. 7.86. Модель контроля активности генов фитохромом В. Активный фитохром В (Рдк) перемещается в клеточное ядро и активирует там транскрипцию путем связывания с G-бокс-связывающим транскрипционным фактором PIF3 (англ, phytochrome interacting factor) и голоэнзимом РНК- полимеразы II, благодаря чему начинается транскрипция генов двух напрямую регулируемых phyB транскрипционных факторов MYB- типа (ССA1, LHY). Со своей стороны, их продукты активируют в заключение многочисленные гены, которые напрямую от света не зависят, но их продукты тем не менее требуются для физиологического ответа растения на раздражение светом. Реформа фитохрома В не в состоянии вступать в комплекс с PIF3
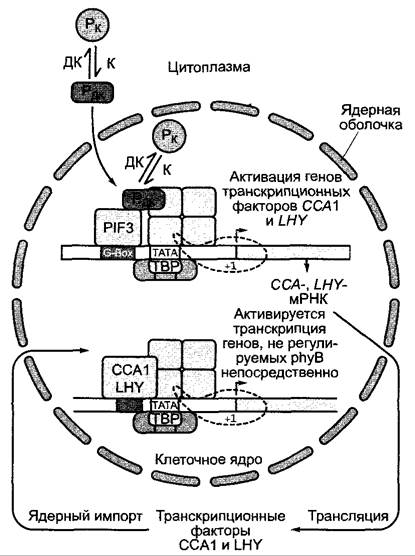
Наряду с влиянием факторов температуры и света (см. 7.7.1, 7.7.2) известны и другие морфологические адаптации, вызванные избытком или недостатком воды, силой тяжести, раздражением от прикосновения или обеспеченностью питательными веществами.
Обеспеченность водой часто очень сильно отражается на внешнем виде и структуре растений. На засушливых почвах наблюдают типичный карликовый рост (нанизм), в сухом воздухе — утолщение кутикулы, сокращение числа устьиц на единицу площади, более сильное опушение и более интенсивное образование сосудов и укрепляющих элементов (ксероморфозы). Во влажной атмосфере, напротив, междоузлия и черешки листьев часто удлиняются, площадь листьев становится большей, листья тонкими и почти цельнокрайними, опушение редким и число устьиц на единицу площади повышенным (гигроморфозы).
Правда, не все встречающиеся при засухе ксероморфные признаки являются следствием недостатка воды. Так как, например, часто встречающийся в местах обитания растений недостаток питательных веществ, прежде всего азота, может вызвать схожие морфозы.
Влияние питания (трофоморфозы) легче всего можно изучить на примере развития гетеротрофов. Так, например, гриб Basidiobolus ranarum в питательном растворе, который содержит сахар и пептон (пептидная смесь, возникающая из ферментативного или химического частичного гидролиза белков), образует разветвленные гифы с перегородками, в то время как в среде с сахаром и солями аммония возникают округлые толстостенные клетки, которые делятся нерегулярно во всех плоскостях. У многих растений, в первую очередь у низших, на образование репродуктивных органов и продолжительность вегетативного роста также могут влиять условия питания.
У высших растений решающую роль для роста и развития также играет взаимная конкуренция за свет, воду и питательные вещества, прежде всего в загущенных посевах.
Иногда даже один только физический контакт с какими-нибудь предметами окружающей среды может иметь морфогенетическое действие (тигмоморфозы). Так, некоторые водоросли при прикосновении с подложкой образуют ризоиды, усики Parthenocissus — прикрепительные диски (см. рис. 4.69, С), побеги Cuscuta — предшественники гаусторий (аппрессории). Усики, которые охватывают опору, утолщаются в месте соприкосновения. Свободно свисающие изначально тонкие воздушные корни эпифитных видов Ficus при касании почвы кончиком корня начинают вторично расти в толщину и образовывать стволоподобные подпорки (см. 11.2). Некоторые грибы развивают в темноте нормальные «шляпки» только тогда, когда их плодовые тела коснулись какого-нибудь предмета. Вероятно, во всех этих случаях химическое действие со стороны задетого субстрата не играет никакой роли.
Сила тяжести, как и свет, может не только стимулировать ростовые движения растения в пространстве — тропизмы — (см. 8.3.1.2), но также вызывать глубокие морфогенетические эффекты (гравиморфозы). Так, не только полярность (см. 7.3.3), но и дорсивентральность некоторых органов определяется совместно с силой тяжести, однако одновременное действие света чаще перекрывает действие силы тяжести (анизофиллия: см. рис. 4.67). Так, например, дорсивентральность ветвей тиса и ели реализуется под влиянием силы тяжести. Некоторые зигоморфные цветки, например, у Epilobium, Gladiolus или Нетегоcallis, становятся радиально-симметричными, если их почки подвергают радиально равномерному ускорению, например, на клиностате (см. рис. 8.19). В тех же условиях подавляется скручивание (ресупинация) завязей орхидей. Образование древесины под давлением или растяжением также является гравиморфозом.1
1 При механической нагрузке характер откладываемой камбием древесины меняется. Размеры сосудов и волокон ксилемы уменьшаются, но в результате ткань становится более прочной. Неравномерное отложение древесины может приводить к смещению ветвей в пространстве, позволяющему оптимально распределить механическую нагрузку по побеговой системе. — Примеч. ред.
Многообразны влияния других живых существ на развитие и обмен веществ растения. Эти биотические взаимодействия представлены в отдельной главе, так как эта область исследований все больше развивается в самостоятельную дисциплину внутри физиологии (аллелофизиология, см. гл. 9).