БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
7. ФИЗИОЛОГИЯ РАЗВИТИЯ
7.6. Контроль развития с помощью фитогормонов
Ранее в этой книге неоднократно говорилось о том, что многие процессы развития регулируются фитогормонами. Гормонами называют низкомолекулярные сигнальные вещества, которые синтезируются у всех или у многих растений и в низких концентрациях (≤ 10-6 М) вызывают характерные физиологические реакции. Места образования и действия гормона, как правило, разделены в пространстве. Фитогормоны служат, таким образом, для межклеточной регуляции в многоклеточном организме так же, как гормоны животных и человека, но, в противоположность последним, фитогормоны редко регулируют обмен веществ уже дифференцированного организма (примеры: контроль замыкающих клеток абсцизовой кислотой, см. 7.6.4 и регуляция прорастания гиббереллином, см. 7.6.3); чаще фитогормоны сами контролируют в значительной мере процессы роста и дифференцировки и при этом взаимодействуют комплексно (что пока не изучено). Кроме того, активный гормон часто образуется вблизи или даже непосредственно в месте действия, и транспорт (если он вообще требуется) происходит только на очень короткие расстояния, которые могут быть преодолены с помощью диффузии. В подобных случаях фитогормоны ведут себя аналогично известным паракринным или автокринным сигнальным веществам животных: паракринные факторы влияют на клетки в непосредственной близости к месту синтеза, автокринные — на производящую их клетку. Другое отличие от гормонов животных состоит в малой ткане- и органоспецифичности фитогормонов, поэтому они часто характеризуются широким спектром действия. Отсюда становится ясно, что фитогормон является только раздражителем. Природа вызванного процесса зависит от соответствующего состояния дифференциации клетки, т. е. от набора активных, способных и неспособных к активации генов.
Концентрация каждого фитогормона в месте его действия точно регулируется. Она является результатом синтеза, распада, конъюгации, запасания и притока или соответственно оттока. При этом чувствительность тех или иных органов к определенным фитогормонам может очень сильно различаться. Не только недостаточное обеспечение фитогормонами (как, например, у мутантов с дефектами биосинтеза), но и чрезмерное их поступление (часто может достигаться лишь в эксперименте) ведут к характерным нарушениям развития.
Наряду с пятью группами уже давно известных фитогормонов (ауксины, цитокинины, гиббереллины, абсцизовая кислота и этилен) в последние годы появились другие классы веществ с фитогормоноподобным действием — брассиностероиды и жасмонаты; помимо этого, существует много физиологически активных веществ с более специфичными функциями и ограниченным распространением внутри растений. Синтетические аналоги многих фитогормонов находят применение в выращивании декоративных и сельскохозяйственных растений, а также в культуре растительных клеток.
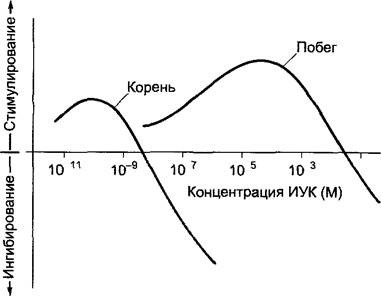
По Тhimann1 ауксины (лат. augere, расти) являются природными или синтетическими соединениями, которые хотя и в очень различных концентрациях (рис. 7.31) стимулируют рост растяжением клеток и тем самым рост в длину побега или корня; в более высоких концентрациях они ингибируют рост. Стимуляция роста особенно заметна в биотесте при использовании тканей, обедненных ауксином, например, цилиндров колеоптилей злаков. Важно, что к ауксинам вещества относят не по химической структуре, а по их характерному действию.
1 Ауксины были независимо исследованы Тиманном (Германия), Вентом (Нидерланды) и Холодным (Россия). Авторы упоминают только немецкого первооткрывателя. — Примеч. ред.
Рис. 7.31. Рост побега и корня в длину в зависимости от концентрации индолил-3-уксусной кислоты (ИУК) в среде (схематично) Опыты были проведены на обедненных ауксином сегментах органов
7.6.1.1. Многообразие ауксинов
Наиболее распространен в растениях ауксин индол-3-уксусная кислота (β-индолилуксусная кислота, ИУК, англ. indoleacetic acid, IAA, рис. 7.32). Это соединение встречается, по-видимому, у всех про- и эукариот, однако только у высших растений служит сигнальным веществом. Другие ауксины, такие, как фенилуксусная кислота (у табака), индолакриловая кислота и галогенпроизводные индолуксусной кислоты (у бобовых), не имеют всеобщего значения (рис. 7.32). Из синтетических ауксинов часто применяются 2,4-дихлорфеноксиуксусная кислота (2,4-Д), 1-нафтил- уксусная кислота (НУК) и индол масля пая кислота (ИМК), из которых в растении путем β-окисления может образоваться ИУК. Общим для всех активных ауксинов является наличие карбоксильной группы (диссоциирующей при физиологических значениях pH) и частичного положительного заряда на расстоянии 0,55 нм от отрицательного заряда диссоциированной карбоксильной группы.
Рис. 7.32. Естественные и синтетические ауксины

Главными местами образования ИУК в высшем растении считаются, с одной стороны, эмбриональные ткани (меристемы, зародыши) и фотосинтезирующие органы (особенно растущие листья), но к биосинтезу ИУК также способна корневая система.
Установление механизмов биосинтеза ИУК складывалось тяжело и считается еще не законченным Экстрагируемые из тканей количества ИУК крайне низки (например, 24 мкг • кг-1 — в колеоптиле кукурузы, 69 мкг • кг-1 — в розеточных листьях Агаbidopsis thaliana, около 350 мкг • кг1 — в кончике корня кукурузы). Соответственно низка активность ферментов биосинтеза ИУК. Чтобы провести исследование метаболизма, часто в ткани извне добавляют меченные изотопами предшественники в концентрациях, которые намного превышают концентрации эндогенно имеющихся метаболитов ауксина. Это несет с собой опасность нефизиологических побочных реакций.
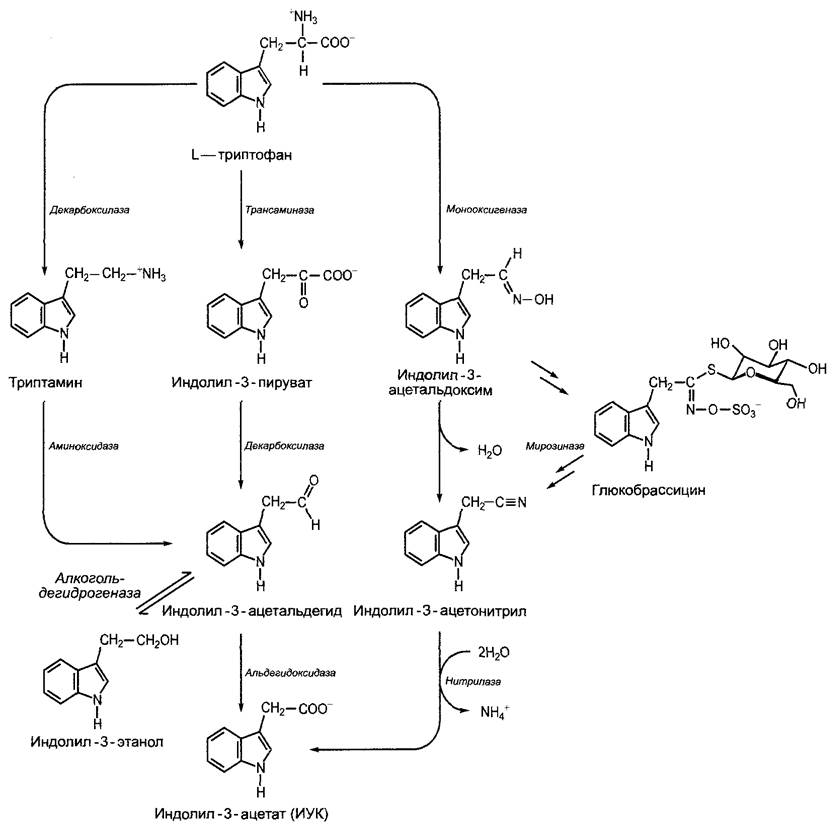
ИУК образуется из L-триптофана1. Биосинтез может (в зависимости от растения и ткани) осуществляться различными путями (см. рис. 7.33), но о ферментах и механизмах регуляции известно еще очень мало.
1 Указанный путь не единственный. Обсуждают также возможность синтеза ИУК, минуя триптофан, из более ранних предшественников. — Примеч. ред.
Рис. 7.33. Биосинтез индолил-3-уксусной кислоты (ИУК) из L-триптофана. Главный путь ведет через индолил-3-пируват, путь через триптамин имеет второстепенное значение. Индолил-3-этанол считается временной запасающей формой предшественника ИУК индолил- 3-ацетальдегида. У Капустных индолил-3-уксусная кислота образуется через индолил-3-ацетонитрил. Высвобождение индолил-3-ацетонитрила из распространенного у Капустных глюкозинолата глюкобрассицина способствует, возможно, образованию ИУК. В клетке ИУК находится практически полностью диссоциированной, в виде индолил-3-ацетата (значение рКа для ИУК = 4,8)
Малая часть обеспечения растения ИУК может происходить от эпифитных бактерий и микроорганизмов (бактерий и грибов) ризосферы, причем в ризосфере микробиологическое производство ИУК основано на триптофане, который выделяется корнями растений. При образовании опухолей корончатого галла (см. бокс 9.2), которые возникают вследствие переноса нескольких генов почвенной бактерии Аgrobacterium tumefaciens, вызывающей заболевание, в ядерный геном хозяйской клетки, переносятся также два гена, продукты которых в трансформированных клетках открывают дополнительный, не контролируемый растительной клеткой, путь биосинтеза ИУК из триптофана через промежуточный продукт индолил-3- ацетамид (см. бокс 9.2). В опухолях корончатого галла содержание свободной или конъюгированной (см. ниже) ИУК сильно повышено.
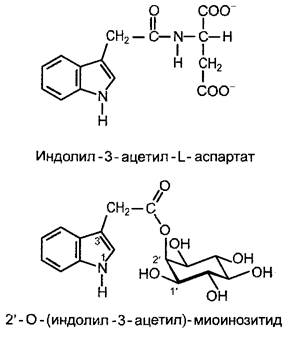
Регуляция обеспечения тканей ИУК осуществляется не только через синтез, но и через инактивацию ненужных гормонов. Определенные продукты инактивации ИУК после конъюгации с сахарами (особенно с глюкозой) откладываются в вакуолях. Но ИУК может также конъюгировать и запасаться в виде конъюгатов с аминокислотами (и тем самым удаляться из места действия). Эндогенно встречаются главным образом ИУК-амиды с аспартатом (рис. 7.34) и глутаматом. Добавленная извне ИУК переводится растительными клетками преимущественно в конъюгаты сахарами (прежде всего с глюкозой). Могут также встречаться высокомолекулярные запасающие формы (например, в семенах). ИУК-конъюгаты, обеспечивающие необратимый распад избыточного гормона, могут служить и для сохранения гомеостаза, а также для временного запасания ИУК и как транспортная форма фитогормона. Так, при прорастании злаков ИУК транспортируется в виде 2'-O-(индолил- 3-ацетил)-миоинозитида (рис. 7.34) в кончики колеоптиля, где фитогормон гидролитически высвобождается. В культуре клеток из добавленного в среду ауксина (ИУК или более стабильных синтетических ауксинов, см. рис. 7.32) быстро образуются конъюгаты с сахарами.1Они служат, вероятно, для долгосрочного обеспечения ткани ауксином, т. е. представляют собой запасные формы ауксинов.
1 Образование конъюгатов синтетических аналогов ауксинов дискуссионно. Не все аналоги являются субстратами для ИУК-гликозидаз. Так, 2,4-D почти не вовлекается в метаболизм. — Примеч. ред.
Рис. 7.34. Структурные примеры конъюгатов индолил-3-уксусной кислоты
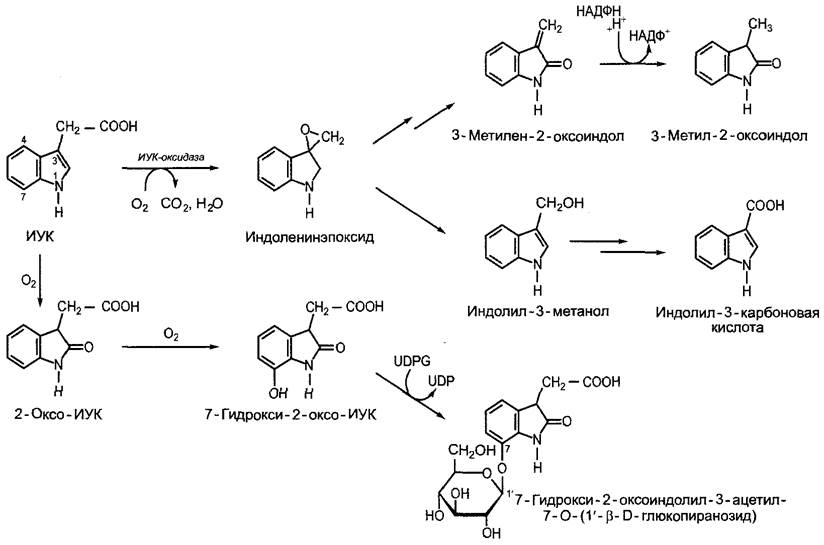
Распад ИУК (рис. 7.35) происходит окислительным путем, причем в зависимости от вида растения некоторая последовательность реакций может различаться. Распространен катаболизм до 3-метилен- 2-оксоиндола, З-метил-2-оксоиндола и индолил-3-карбоновой кислоты, который катализируется относительно неспецифичной пероксидазой; последняя в свою очередь активируется монофенолами (например, тирозином, пара-гидроксибензойной кислоты) и Мn2+, а инактивируется дифенолами (например, кофейной кислоты) (ИУК-оксидаза). У некоторых видов (Pinus sylvestris, Vicia faba, Zea mays) ИУК при получении ацетильной боковой цепи переводится в 7-гидрокси-2-оксо-ИУК, которая откладывается в форме легко водорастворимого O-β-D-глюкопиранозида; соединение встречается в больших количествах, например, в эндосперме кукурузы. ИУК-катаболиты физиологически неактивны, они уже не подчиняются правилу 0,55 нм (см. выше).
Рис. 7.35. Окислительный катаболизм индолил-3-уксусной кислоты. Начатая ИУК-оксидазой последовательность реакций широко распространена в растениях, 2-оксо- ИУК-путь встречается, например, у Pinus sylvestris, Zea mays и Vicia faba
7.6.1.3. Транспорт индолил-3-уксусной кислоты
На большие расстояния ИУК может транспортироваться с током ассимилятов по флоэме (см. 6.8). Кроме того, существует направленный паренхимный транспорт ауксина (полярный транспорт ауксина). В различных изолированных частях побега (колеоптили, ось побега, черешок листа или плодоножка), например, извне добавленная ИУК транспортируется со скоростью 2 — 14 мм • ч-1 полярно базипетально, а именно, независимо от ориентации препарата, так что влияние силы тяжести при этом можно исключить (рис. 7.36). Этот полярный базипетальный транспорт ауксина активный, т. е. зависит от обмена веществ, его можно подавить с помощью ингибиторов (например, 1-нафтилфталамовой кислоты или 2,3,5-трииодбензойной кислоты), в отличие от пассивного акропетального (направленного к верхушке побега) транспорта, который происходит путем диффузии.
Рис. 7.36. Доказательство базилетально го полярного транспорта ИУК в отрезках колеоптиля. Независимо от ориентации отрезка (нормальной или обратной) диффундирующая из агаровых блоков ИУК транспортируется в ткани лишь от апикального конца к базальному (стрелка) и ее можно обнаружить в «блоке-приемнике». Добавленная через базальный конец ИУК путем диффузии немного проникает в ткань, но не транспортируется. Для опыта используют радиоактивно (например, 14С) меченную ИУК, которую можно обнаружить с большой чувствительностью. В агаровых блоках (белых) не обнаруживается радиоактивность
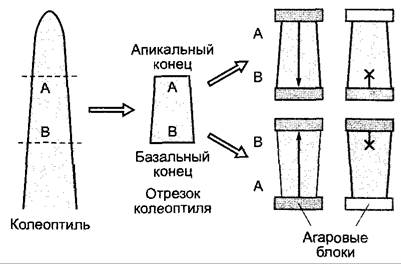
В корне полярный транспорт ИУК протекает в центральном цилиндре акропетально (к кончику корня), часть ИУК транспортируется в экзодерме базипетально (от кончика в направлении основания корня). Скорости очень близки к скороcтям транспорта в побеге (4 — 10 мм • ч-1). О значении полярного транспорта ауксина при формировании оси во время эмбриогенеза говорилось выше (см. 7.4.1).
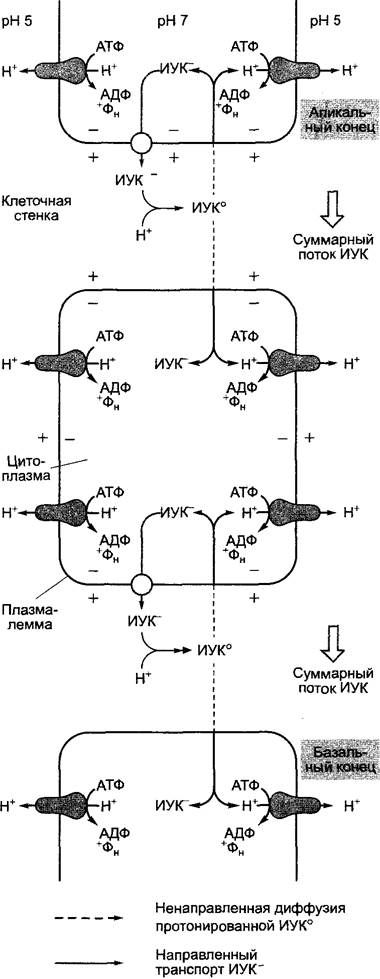
Механизм полярного транспорта ауксина еще неизвестен. Согласно хемиосмотической модели (рис. 7.37), на базальном конце клетки в плазмалемме сконцентрированы транслокаторы (переносчики ИУК), которые выводят из клетки индолил-3-ацетат (ИУК-). При этом используется энергия электрохимического градиента, который сохраняется (см. рис. 6.4; 6.5) на плазмалемме постоянно за счет транспортирующей ионы водорода АТФазы. Из-за низкого значения pH в апопласте часть выделенной индолил-3-уксусной кислоты (~50 %) не диссоциирована. Недиссоциированная ИУК легко диффундирует через клеточные мембраны и таким образом возвращается путем диффузии обратно в клетку. Процесс диффузии протекает ненаправленно. Согласно этой модели, определенное направление суммарного процесса поддерживается исключительно благодаря полярному расположению переносчиков ИУК, прямое обнаружение которых еще только намечается.1 Создает сложности и тот факт, что в апопласте, как правило, господствует массовый ток воды, способствующий транспирации, направленный против вектора транспорта ИУК (см. 6.3.1.2; рис. 6.32). В определенных условиях направление полярного транспорта в растении изменяется, например, под влиянием силы тяжести или при одностороннем освещении (см. 8.3.1.1) либо соответственно во время эмбриогенеза (см. 7.4.1).
1 Приведенные сведения устарели. В последние годы у Arabidopsis найдены белки-переносчики ИУК: AUX1 (отвечает за пассивный вход, influx) и PIN1 (отвечает за активную транслокацию наружу, efflux). — Примеч. ред.
Рис. 7.37. Хемиосмотическая модель полярного транспорта ИУК
К множеству физиологических эффектов ИУК относятся в первую очередь следующие.
Стимуляция деятельности камбия для увеличения числа ксилемных элементов. С помощью очень чувствительных масс- спектрометрических методов было показано, что в зоне камбия концентрация ИУК выше, чем в окружающей ткани (рис. 7.38). Предполагается, что градиент ауксина вносит вклад в позиционную информацию, которая влияет на судьбу образуемых камбием флоэмных или соответственно ксилемных инициалей при дифференцировке. ИУК могла бы рассматриваться здесь, таким образом, скорее, как морфоген, чем как фитогормон (см. 7.3.3, 7.4).
Рис. 7.38. Радиальный градиент концентрации индолил-3-уксусной кислоты в камбиальной зоне Pinus sylvestris иуказано соответствующее количество фитогормона в диске ткани площадью 1 см2 и толщиной 30 мкм, который был вырезан из блока ткани тангенциально по длине замораживающим микротомом. Дальнейшие исследования показали, что с дифференцировкой флоэмы или ксилемы связана не столько абсолютная концентрация ИУК в камбии, сколько радиальное распределение фитогормона. В сторону дифференцировки ксилемы радиальный градиент ИУК в направлении меньше, чем в сторону флоэмы. Поперечный срез, использованный как фон для графика, позволяет визуально оценить содержание ИУК в соответствующих слоях ткани

Стимуляция образования и развития семян и плодов. Начинающая действовать ИУК поставляется сначала пыльцой. Позже она образуется развивающимися семяпочками, выделяется в окружающие ткани завязи и стимулирует здесь прежде всего клеточный рост. Первая фаза роста завязей (перед цветением) чаще характеризуется сильным ростом с помощью деления при сравнительно небольшом растяжении клеток. Деления прекращаются у многих видов (например, у томатов и смородины) после цветения, и последующий рост объясняется только растяжением клеток, но оно вызывается только в том случае, если опыление произошло (рис. 7.39). Клетки могут стать такими большими, что они видны невооруженным глазом (например, у арбуза Citrullus vulgaris).
Рис. 7.39. Рост завязи Cucumis a'nguria. В неопыленных цветках после цветения рост замедляется (спад вызван усыханием), в то время как опыленные завязи показывают типичную сигмовидную кривую роста

Если опыление не произошло, то цветки, как правило, опадают; если же оно произошло, то лепестки и тычинки увядают, но начинается образование плодов. Для первой фазы роста плодов («закладки плодов») в большинстве случаев факт оплодотворения не является необходимым; достаточно опыления, часто даже чужеродной пыльцой, которая не может произвести оплодотворение. Очень богатая ауксином пыльца действует, выделяя ИУК. Поэтому опыление часто можно заменить нанесением ИУК (или других ауксинов) на рыльце. У большинства плодов опыление вызывает только закладку плодов, но не последующий их рост. Он начинается только после прошедшего оплодотворения и регулируется опять через ауксин. Здесь источником ауксина становятся развивающиеся семяпочки. Поэтому у многих плодов (например, винограда, яблок, груш, томатов, смородины) величина выросшего плода обычно пропорциональна числу развивающихся семян. У некоторых видов: (например, томатов, смородины, табака, инжира) закладка и рост плодов может вызываться без предварительного опыления (партенокарпия) путем обработки рылец ИУК (или синтетическими ауксинами). Образуются бессемянные плоды. Такой прием используется на тепличных томатах, чтобы достичь одновременной закладки плодов (и синхронизированной уборки).
У спонтанно возникающих партенокарпических и потому также бессемянных плодов (например, разновидностей томатов, огурцов, инжира, апельсинов, бананов и ананасов) развитие происходит частично без опыления, частично после опыления и оплодотворения с последующим абортированием зародышей. Необходимый для притока веществ и роста плодов синтез ауксинов в семяпочках или соответственно других частях завязи не требует у этих растений, очевидно, никаких или лишь небольших коррелятивных влияний извне.
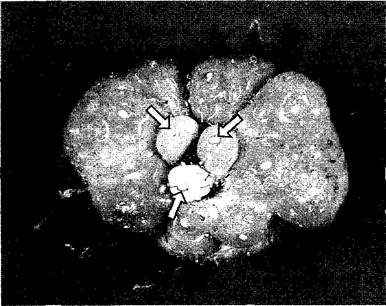
Экспериментально стимулирующее действие ИУК можно четко показать на землянике. Если преждевременно удалить развивающиеся после опыления орешки, то на этом месте подавляется разрастание мясистого цветоложа (рис. 7.40); если удалить все плодики, то оно подавляется полностью, однако начинается вновь, если вместо удаленных плодиков на цветоложе наносят раствор ауксина. Связь роста плода с произошедшим оплодотворением и начавшимся развитием семян очень важна: значительный приток веществ для дальнейшего развития плодов происходит только тогда, когда он биологически оправдан. Как и при других процессах роста, ауксины при росте плодов являются не единственными действующими гормонами. Есть данные, что развивающиеся семена наряду с ауксинами выделяют в окружающие ткани также гиббереллины, которые участвуют в контроле развития плодов. У некоторых видов обработка гиббереллинами, (но не ауксинами!) вызывает партенокарпию (например, у видов Рrunus). Наконец, плоды, которые во время роста еще демонстрируют клеточные деления, при активном росте делением содержат наиболее высокие концентрации цитокининов (например, яблоня, томат, банан).
Рис. 7.40. Развитие многоорешка земляники. Цветоложе не становится мясистым в тех местах, где вследствие нарушения опыления не начинается развитие плодов. В центре показанной земляничины развиваются только три орешка (стрелки). Лишь в непосредственном окружении этих плодов цветоложе разрастается. В этом случае орешки выделяют фактор роста индолил-3-уксусную кислоту, которая сильно стимулирует рост клеток цветоложа
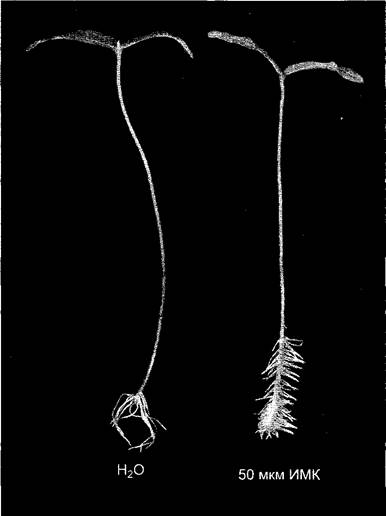
Стимуляция закладки боковых и адвентивных корней — ризогенез (рис. 7.41). Как и в случае действия ИУК на деятельность камбия этот процесс показывает, что ауксин может стимулировать деления клеток.
Рис. 7.41. Стимуляция ауксином образования адвентивных корней у черенков маша. Черенки помещали на 7 дней в 50 мкМ раствор индолил-3-масляной кислоты (справа) или воды (слева). Индолил-З-масляная кислота (ИМК — от indolebutyric acid, IBA) после поглощения клеткой превращается в индолил-3-уксусную кислоту — в этом состоит принцип действия ИМК. Контрольные растения образуют малочисленные длинные адвентивные корни, а обработанные ИМК дают много коротких, так как ИУК, дополнительно образованная тканью из ИМК, ведет к повышению общей имеющейся концентрации ИУК, благодаря чему стимулируется закладка новых адвентивных корней, хотя рост их в длину подавлен
Индукция регенерации в культуре клеток. Процесс, протекающий при участии цитокинина, описывается подробнее в разделе 7.6.2.3.
Ингибирование прорастания боковых почек с помощью выделяемого верхушечной почкой ауксина (апикальное доминирование) (см. 7.5). Цитокинин действует как антагонист ауксина и стимулирует прорастание боковых почек.
Ингибирование опадения листьев, цветков и плодов. Пока достаточное количество ИУК транспортируется из листовой пластинки, цветка или развивающегося плода
через черешок листа или соответственно цветка, дифференцировка отделительной ткани в основании черешка (abscission zone) подавлена. При недостаточном обеспечении ауксином (например, после окончания развития листьев, при отсутствии опыления или соответственно оплодотворения) абсцизовая кислота (см. 7.6.4) и особенно этилен (см. 7.6.5) вызывают дифференцировку отделительной ткани и вследствие этого опадение соответствующего органа.
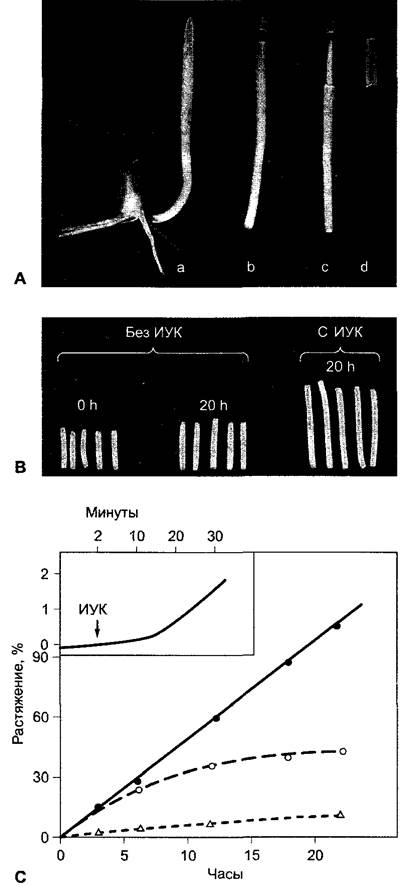
Стимулируемый ауксином рост растяжением был исследован особенно подробно. Нанесение ауксина на интактные растения практически не влияет на рост побега и, как правило, оказывает ингибирующее действие на корни. Это объясняется оптимальным обеспечением интактных тканей ауксином. Однако у ряда сортов гороха, которые различаются по высоте, была показана прямая связь между концентрацией ИУК и скоростью роста в длину. В других случаях подобная связь не найдена. У бедных ауксином сегментов побега и колеоптиля при нанесении ИУК происходит, напротив, сильный и зависящий от концентрации фитогормона рост растяжением (рис. 7.42). Рост начинается после некоторого латентного периода (lag-фаза) продолжительностью -10 мин и продолжается в присутствии осмотиков, которые поглощаются клетками (например, сахароза, КСI), от нескольких часов до суток и более.
Рис. 7.42. Стимуляция роста растяжением колеоптилей с помощью ИУК: А — предварительная подготовка отрезков ко- леоптилей у кукурузы. Кончик колеоптиля снабжает орган ИУК. Поэтому отрезки колеоптиля (В) обеднены ИУК и показывают лишь слабый рост растяжением, который объясняется остатками эндогенной ИУК. В присутствии ИУК в инкубационной среде значительно стимулируется рост отрезков колеоптилей растяжением; С — зависимость растяжения отрезков колеоптиля овса, индуцированного ИУК (10 мкмоль ИУК, pH 6), от времени в отсутствие (о) или соответственно в присутствии (•) 2%-й сахарозы в инкубационной среде (д — сахароза без ИУК). Стимулированный ауксином рост растяжением начинается после lag-фазы около 8 — 10 мин (см. график вверху слева)
Движущие силы для роста клетки могут быть описаны уравнением водного потенциала (см. уравнение 6.15) при пренебрежении гравитационным потенциалом, который не играет заметной роли в измерениях на уровне отдельной клетки:
![]()
Клетка в чистой воде вбирает воду из своего окружения до тех пор, пока производимое вследствие эластичного напряжения стенки внутреннее давление р (тургор) не будет скомпенсировано осмотическим давлением -П (р = П,![]() = 0). Таким образом, равновесие между клеткой и водным раствором с отрицательным водным потенциалом наступит, если
= 0). Таким образом, равновесие между клеткой и водным раствором с отрицательным водным потенциалом наступит, если![]() и тем самым
и тем самым![]() Рост всегда связан с необратимым увеличением объема, т. е. поглощением воды, и происходит тогда, ког-
Рост всегда связан с необратимым увеличением объема, т. е. поглощением воды, и происходит тогда, ког-
да формирующийся вследствие осмотического проникновения воды тургор превосходит максимально возможную эластичную деформацию клеточной стенки, так что наступает необратимое (пластичное) растяжение клеточной стенки. Поэтому определенная скорость роста — результат обусловленного тургором пластичного растяжения клеточной стенки, проникновения воды и поглощения осмотиков (прежде всего, КСI) или соответственно внутриклеточного образования осмотиков (прежде всего, углеводов) для сохранения осмотического потенциала. Как правило, процесс роста возможен только для клеток с первичной стенкой (см, 2.2.12) и связан с постоянным новым синтезом клеточной стенки (целлюлоза и компоненты матрикса); благодаря этому контролируется также пороговый потенциал для пластичной деформации, что препятствует разрыву клеточной стенки.
При изодиаметрическом росте эти процессы протекают равномерно по всей поверхности клетки; при росте в длину клетка растягивается вдоль оси, которая, предположительно, определяется расположением целлюлозных микрофибрилл. У клеток до начала роста эти микрофибриллы, окруженные матриксом, не имеют заметного предпочтительного направления (рассеянная текстура) (см. рис. 2.72, В). Расположение целлюлозных микрофибрилл определяется, очевидно, цитоскелетом (рис. 7.43).
Рис. 7.43. Сильно упрощенная схема стимуляции клеточного растяжения с помощью ИУК. Активация транспорта ионов водорода в апопласт приводит к ослаблению водородных связей, особенно между целлюлозой и гемицеллюлозой; отчего повышаются пластичность и растяжимость клеточной стенки (1). Подкисление одновременно активирует (предположительно) ферменты в клеточной стенке, которые необходимы для де- и реполимеризации полимерных компонентов матрикса клеточной стенки. Переориентация кортикальных микротрубочек в клетке, а вместе с тем и вновь синтезированных целлюлозных фибрилл (см. рис. 2.72) в клеточной стенке приводит к проявлению продольной оси растяжения клетки (двойная стрелка) (2). Под действием ИУК наконец усиленно синтезируется новый материал клеточной стенки (3)
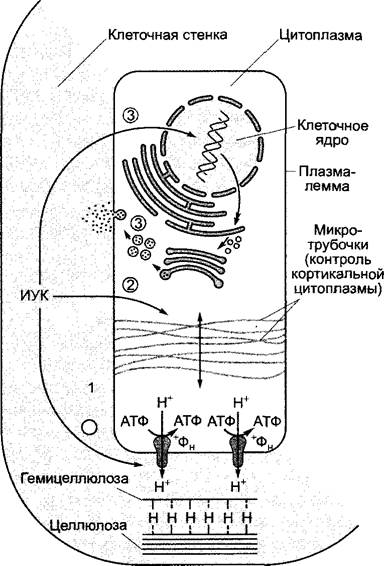
Увеличение скорости роста, вызываемое, например, ауксином, обусловливает повышение движущей силы для проникновения воды («сосущей силы») и поэтому может осуществляться через подъем осмотического потенциала или/и пластичной деформации клеточной стенки. Все данные свидетельствуют, что внесение ауксина повышает пластичную деформацию первичной стенки. Молекулярные процессы изучены мало (рис. 7.43).
Согласно гипотезе кислого роста, добавленная извне ИУК индуцирует в бедных ауксином сегментах колеоптиля или соответственно побега сильное подкисление апопласта (у колеоптилей от pH = 5,5 до pH≤ 4,5), которое объясняется массовым выходом ионов водорода из клеток. Это подкисление, которое можно однозначно доказать экспериментально, обусловливает lag-фазу действия ауксина и, согласно гипотезе, вызывает следующие процессы.
✵ Водородные связи между компонентами клеточной стенки ослабляются. Они существуют, главным образом, между цел
люлозными микрофибриллами и наслоенными молекулами гемицеллюлозы (ксилоглюканы у двудольных растений, см. рис. 2.64). Действительно, недавно был описан белок клеточной стенки, который в кислой среде становится активным и катализирует разрушение водородных связей между целлюлозой и ксилоглюканом. Добавление этого белка, названного экспансином1, очень четко повышает рН-зависимую пластичную деформацию изолированных клеточных стенок.
1 От англ. expansion — экспансия, расширение, рост растяжением. — Примеч. ред.
✵ Активируются ферменты, которые разрушают (и заново соединяют) ковалентные связи полимеров клеточной стенки, так что под влиянием тургора компоненты клеточной стенки могут смещаться относительно друг друга. К этим ферментам можно отнести ксилоглюканэндотрансгликозидазу (ХЕТ), разрушающую ковалентные связи в гемицеллюлозных полимерах и заново их создающую. Благодаря де- и реполимеризации связанных друг с другом компонентов матрикса (структурная модель; см. рис. 2.68) не только повышается пластичная деформация клеточной стенки, но и становится возможным добавление к ней новых экскретируемых структурных элементов.
Механизм вызванного ауксином подкисления апопласта неясен. Вероятно, здесь должна участвовать Н+-АТФаза Р-типа (см. рис. 6.4; 6.5), транслоцирующая ионы водорода, которая активируется ИУК с помощью еще неизвестного механизма и/или количество которой в плазмалемме должно повышаться благодаря ИУК. Очень эффективный механизм активации этой АТФазы был открыт только недавно (см. рис. 9.15): Н+-АТФаза является мишенью фузикокцина, токсина фитопатогенного гриба Fusicoccum amygdali, который вызывает сильный рост растяжением на колеоптилях и влияет также на другие процессы с участием Н+-АТФазы (движение устьиц, см. 8.3.2.5). Маловероятно, чтобы ауксин влиял на Н+-АТФазу по тому же механизму.
Гипотеза кислого роста поддерживается следующими данными:
✵ кислые буферы стимулируют рост клеток растяжением, как и ИУК, однако без наступления lag-фазы;
✵ нейтральные буферы устраняют стимулированный рост ИУК растяжением, так как принимают на себя выделенные клеткой Н+-ионы;
✵ ингибиторы Н+-АТФазы ингибируют индуцируемый ауксином рост растяжением.
Вызванный кислыми буферами рост растяжением продолжается лишь короткое время, однако действие ауксина (см. рис. 7.42) значительно более продолжительно. Это доказывает, что гипотеза кислого роста охватывает только одну часть действия ауксина.
По современным данным ауксин наряду со стимуляцией переноса Н+-ионов в апопласт участвует в следующих процессах:
✵ стимулирует образование и передвижение компонентов клеточной стенки;
✵ вызывает переориентацию расположенных в периферической (кортикальной) цитоплазме микротрубочек, из-за чего образованные целлюлозо-синтазой целлюлозные микрофибриллы располагаются предпочтительно перпендикулярно продольной оси растяжения клетки (в этом направлении сопротивление растяжению падает).
Способность клетки к росту в длину, наконец, утрачивается из-за того, что вследствие растяжения клеток целлюлозные микрофибриллы смещаются и становятся все более параллельными к продольной оси. Начинается образование вторичной стенки путем аппозиции целлюлозных слоев, в которых волокна лежат параллельно. Пластичная деформация тем самым прекращается, клетка сохраняет только эластичные свойства, которые делают возможным лишь ограниченное обратимое растяжение.
7.6.1.5. Молекулярные механизмы действия ауксинов
Регулируемые ауксином физиологические процессы протекают путем изменения экспрессии генов; при этом быстро отвечающие гены (первично или напрямую регулируемые гены) отличаются от медленно отвечающих генов (вторично или опосредованно регулируемые гены). Последние, как полагают, контролируются
продуктами первично регулируемых ауксином генов, из которых некоторые являются транскрипционными факторами. В промоторах первично регулируемых ауксином генов, активность которых уже через 5 — 10 мин после внесения ауксина сильно увеличивается, можно идентифицировать чаще несколько ауксин-чувствительных элементов (англ. auxinresponsive element, ARE); это участки последовательности длиной -25 — 30 п.н., которые состоят соот
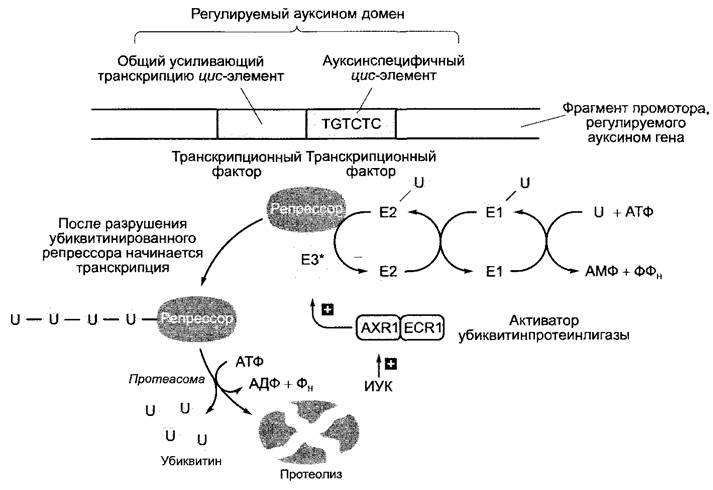
ветственно из ауксинспецифичного и общего активирующего транскрипцию элемента. Согласно последним, хотя еще частично гипотетическим представлениям, ИУК индуцирует убиквитинирование (см. 7.3.1.3) и тем самым — протеолитический распад репрессорного белка, после удаления которого начинается транскрипция напрямую регулируемых ауксином генов (рис. 7.44). В убиквитинировании участвует активаторный белок АХR1; мутация в соответствующем гене ведет к потере способности клеток реагировать на ауксин (AXR, англ. auxin resistant — фенотип ахr- мутанта).
Рис. 7.44. Гипотетическая модель активации генов с помощью индолил-3-уксусной кислоты (ИУК). ИУК активирует локализованный в клеточном ядре гетеродимерный комплекс белков AXR1 и ECR1, который, со своей стороны, активирует убиквитинпротеинлигазу (ЕЗ*). Она способствует убиквитинированию специфичных репрессорных белков, препятствующих транскрипции регулируемых ауксином генов, и индуцирует тем самым разрушение репрессоров протеасомой (см. 7.3.1,3). Распад убиквитинированных репрессоров ведет к началу транскрипции соответствующих генов. Убиквитинконъюгационная система состоит в основном из убиквитинактивирующего фермента (Е1), который переносит убиквитин на убиквитинконъюгирующий белок (Е2), от которого убиквитин при содействии субстратспецифичной убиквитинпротеинлигазы (ЕЗ) переводится на белковый субстрат. Образуются многократно убиквитинированные белки, которые быстро разрушаются протеасомой, высвобождая убиквитин, если они несут 4 или более молекул убиквитина. В клетке имеется несколько ферментов ЕЗ-типа; часто речь идет о гетероолигомерных белковых комплексах, которые нуждаются в активации (ЕЗ*) с помощью гетеродимерного активатора. Этот активатор имеет сходство с Е1 - ферментом; один компонент соответствует N-концевой части, а второй — С-концевой части Е1 -энзима. В случае регулируемых ауксином генов эту роль играет AXR1/ECR1-комплекс. Нарушение функции AXR1, например, вследствие мутации в АХR1-гене, вызывает потерю способности реагировать на ауксин. Белок был назван по мутанту ахг1 (англ. auxin resistant — устойчивый к ауксину), ECR1 (англ. E1-C-terminus related — похожий на С-конец убиквитинактивизирующего белка Е1): белок был открыт на основе этого сходства
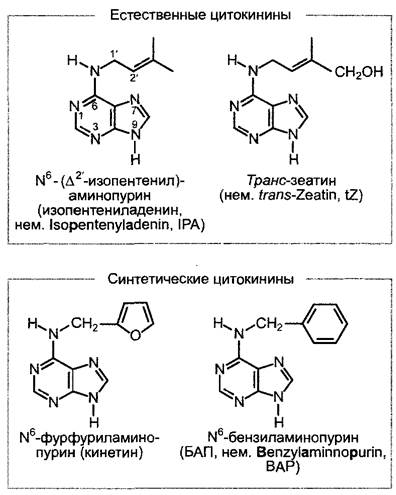
Цитокинины — это N6-замещенные пурины (рис. 7.45), которые были открыты на основании их стимулирующего действия на деление клеток (цитокинез — клеточное деление).
Рис. 7.45. Примеры естественных и синтетических цитокининов. Естественные цитокинины имеются в клетке не только в виде свободных оснований, как показано, но также в виде рибозидов и рибозил-5’- монофосфатов (см. рис. 7.46)
7.6.2.1. Многообразие цитокининов
В опытах по культуре ткани сердцевины табака на средах определенного состава было найдено, что добавление одной лишь индолил-3-уксусной кислоты стимулирует только растяжение клеток, но недостаточно для активации клеточных делений. В результате систематического поиска фактора, стимулирующего клеточные деления, сначала была обнаружена сильная активность в автоклавированных препаратах ДНК. Активное соединение было затем идентифицировано как N6-фурфури- ламинопурин (рис. 7.45). Оно возникает при автоклавировании ДНК в результате гидролиза, отщепления фосфата и перемещения дезоксирибозы из первоначального положения (1' —> 9) (ср. рис. 1.4) в положение при отщеплении воды (5' —> 6). Это вещество, названное кинетином, не встречается в растениях, однако природные цитокинины также являются N6-замещенными производными аденйна. Важнейшие из них N6-изопентениладенин (IРА) и транс-зеатин (tZ); они встречаются в растении в виде свободных оснований, рибозидов или рибозил-5'-монофосфатов. В качестве активных цитокининов выступают лишь свободные основания, в первую очередь транс-зеатин, преобладающий цито- кинин также в большинстве тканей. В физиологических работах, например, с культурами клеток, предпочитают синтетические цитокинины (см. рис. 7.45) из-за их более высокой стабильности.
Ранее мы упоминали, что N6-замещенный аденин, например, IРА, как редкое основание входит в состав определенных тРНК (см. рис. 1.10). Возможно, что в тканях с высоким содержанием РНК при распаде тРНК возникает цитокинин, но физиологическое значение этого процесса неясно. Так, в определенных тРНК встречается как редкое основание также зеатин, однако в виде цис-изомера, в то время как в виде свободной формы встречается исключительно транс-зеатин. Первоначальное предположение о стимулирующем действии цитокинина на метаболизм мРНК и белков, основанное на его встраивании в тРНК, не подтвердилось, после чего стало ясно, что М6-замещенный аденин возникает в тРНК только благодаря последующему пренилированию аденина (см. 1.2.4).
N6-замещенные аденины, найденные уже у бактерий, встречаются также у грибов. Они могут иметь физиологическое значение у фитопатогенов (например, Аgrobас-
tenum tumefaciens, см. бокс 9.2) и симбиотических бактерий (например, Рhyllobacterium rubiacearum) или у микоризных грибов (см. 9.2.3). Так, вызванная Rhodococcus fasciansфасциация побега обусловлена ци- токининами, выделяемыми этим актиномицетом.
Физиологическое действие цитокининов и сами соединения были обнаружены, начиная от мхов, у всех групп наземных растений, однако лучше всего они исследованы у высших растений.
7.6.2.2. Метаболизм и транспорт
Не считая возможного высвобождения цитокининов при распаде тРНК, вклад которого в обеспечение ткани цитокининами, однако, сомнителен, цитокинины образуются путем переноса остатка диме- тилаллила от диметил аллилпирофосфата1 на аденозин-З'-монофосфат. Затем идут дальнейшие превращения, к которым относятся гидроксилирование и последующее насыщение боковых цепей, с одной стороны, и возможное при каждом таком соединении удаление фосфатного остатка и рибозы, с другой стороны (рис. 7.46). Наряду с изопентениладенином, зеатином и дигидрозеатином в растении имеются их рибозиды и риботиды, однако, как уже было упомянуто, цитокининовой активностью обладают только свободные основания.
1 Находится в равновесии со своим изомером изопентенилпирофосфатом соответственно. — Примеч. ред.
Рис. 7.46. Основные реакции метаболизма цитокинина
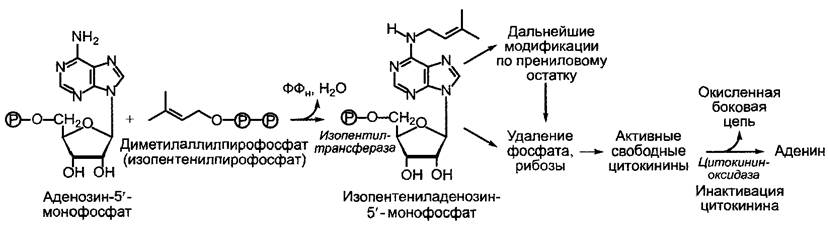
Апексы корней рассматриваются как основное место образования цитокининов. Из корней цитокинины с ксилемньш потоком распределяются в растении; основная транспортная форма — транс-зеатин- рибозид (tZR). В пасоке винограда, например, было обнаружено 5 — 100 мкг • л-1 цитокинина. В тканях не существует полярного транспорта цитокининов, следовательно, диффузия представляет собой единственный механизм транспорта на короткие расстояния.
Однако местами образования цитокининов наряду с корнями считаются очень молодые листья и развивающиеся семена1. Ауксин апикальной почки подавляет, очевидно, биосинтез цитокинина или импорт цитокинина в те пазушные почки, развитие которых вследствие апикального доминирования подавляется. После удаления апикальной почки, прежде чем начинается рост молодых побегов, содержание цитокинина в побеге сильно возрастает, особенно в пазушных почках. Если заменить апикальную почку агаровым блоком с ауксином, аккумуляция цитокинина подавляется и апикальное доминирование сохраняется.
1 Прежде всего корневой полюс зародыша. — Примеч. ред.
Цитокинины могут переводиться в различные конъюгаты с сахарами (гликозиды), которые могут быть запасными, транспортными или инактивирующими формами. Распространенный механизм инактивации — окислительное удаление пренилового остатка цитокининами у основания (цитокининоксидазная реакция): из IРА образуются аденин и З-метил-2-бутеналь, из транс-зеатина — аденин и З-гидроксиметил-2-бутеналь.
Как все фитогормоны, цитокинины также влияют на многочисленные физиологические процессы и взаимодействуют при этом с другими фитогормонами.
Свойство цитокининов стимулировать деление клеток уже упоминалось выше. На нем основывается важнейший биотест на цитокининовую активность — тест на получение каллуса из сердцевины табака. На определенных питательных средах прирост биомассы стерильно выращиваемых каллусных тканей пропорционален концентрации цитокинина. Правда, стимуляция клеточных делений связана с наличием ауксина в питательных средах. Как цитокинины, так и ауксины требуются для прохождения клеточного цикла, а именно, для начала репликации ДНК и митоза (см. 7.3.2, рис. 7.19, А).
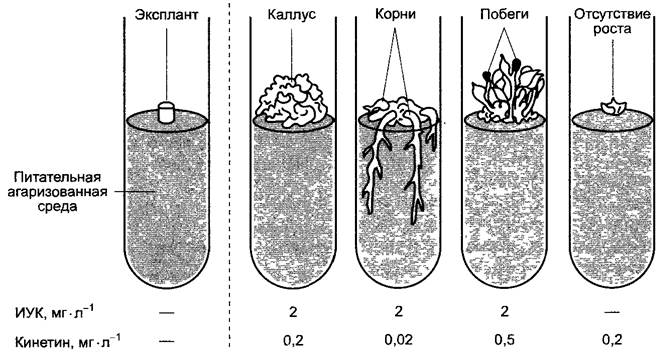
Вызванный ауксином и цитокинином рост клеточных культур зависит не столько от абсолютных концентраций обоих фитогормонов, сколько от их соотношения. Если повысить концентрацию ауксина относительно концентрации цитокинина, то происходит регенерация (ризогенез) корней; если, напротив, повысить концентрацию цитокинина относительно концентрации ауксина, то регенерируют побеги (рис. 7.47). При регенерации растений из культуры клеток индуцируют, как правило, сначала образование побега и затем укореняют побеги на среде для индукции ризогенеза. Соотношение ауксина и цитокинина при эмбриогенезе, вероятно, оказывает решающее влияние на формирование органов у развивающегося зародыша.
Рис. 7.47. Зависимость роста и органогенеза фрагмента ткани (экспланта) из сердцевины стебля табака от содержания ИУК и кинетина в питательной агаризованной среде. Слева — состояние в начале опыта; справа — после культивирования в течение нескольких недель. Органогенез определяется в основном соотношением концентраций двух ростовых веществ
Опухоли на дифференцированных растениях также характеризуются нарушением соотношения ауксин/цитокинин и чаще также абсолютными сильно повышенными концентрациями обоих фитогормонов. Это справедливо для уже упомянутых опухолей корончатого галла, вызываемых Аgrobacterium tumefaciens (см. бокс 9.2). Среди бактериальных генов, интегрирующихся при возникновении опухоли в ядерный геном растения, находится ipt-ген, кодирующий изопентенилтрансферазу (IРТ), которая катализирует начальную реакцию биосинтеза цитокинина так же, как она протекает в растении (рис. 7.46). Опухоли корончатого галла, таким образом, являются ауксин- и цитокининнезависимыми, поэтому их можно неограниченно размножать на питательной среде без добавления этих фитогормонов. Если у бактерий поврежден ipt-тен, то возникает избыток ауксина: вместо опухоли на растении образуется корневая тератома; если удаляют один из двух (или оба) ауксиновых генов, то возникает избыток цитокинина и образуется побеговая тератома, совершенно аналогично регенерации в эксперименте, достигаемой путем сдвига соотношения ауксин/цитокинин в культуре клеток (рис. 7.47). В принципе, под тератомой понимают опухоль, в которой можно распознать дифференцированные ткани и/или органы.
Генетически обусловленные опухоли возникают у различных межвидовых гибридов, прежде всего внутри рода Nicotiana и Brassica. Эти опухоли не инфекционные, они объясняются комбинацией двух не полностью совместимых геномов, совместное действие которых ведет к нарушениям нормальной программы развития. Так как генетически обусловленные опухоли в культуре in vitro также ауксин- и цитокининнезависимы и содержат большие количества этих фитогормонов, здесь, по-видимому, имеет место гормонально обусловленное нарушение контроля клеточного цикла.
Цитокинины — антагонисты ауксинов при нарушении апикального доминирования. Предположительно, образование «ведьминых метел», т. е. прорастание многих боковых почек (например, у хризантем, петуний, ив, лиственниц после поражения Rhodococcus fascians, ранее называемой Corynebacterium fascians), также стимулируется уже упоминавшимся синтезом цитокинина в бактериях. Видовое название «fascians» восходит к фасциации — образованию лентовидных расплющенных побегов, которые представляют собой растущие одновременно множественные боковые побеги. Это симптом поражения Rhodococcus fascians (лат. fascis — пучок), также связанный с апикальным доминированием.
Цитокинины стимулируют:
• растяжение клеток при развитии листа;
• развитие хлоропластов у покрытосеменных (которое при добавлении цитоки-
нина проходит в значительной мере также в темноте);
• индукцию почек на каулонеме лиственных мхов (см. 11.2), из которых затем дифференцируется гаметофит.
Замедление процессов старения, особенно в листьях, — очень важная функция цитокининов. При старении речь идет (по определению) о процессе развития, который, если его не остановить или не обратить, неизбежно ведет к смерти всего организма или отмиранию его органов.
По характеру старения растения в целом различают монокарпические виды, которые только однажды цветут и плодоносят, и поликарпическне виды, образующие цветки и плоды неоднократно.
Монокарниками являются все одно- и двулетние виды, а также ограниченное число многолетних, которые могут в течение ряда лет расти вегетативно, но после цветения и плодоношения отмирают (например, агава, бамбук или имеющая возраст более 300 лет Сorypha umbraculifera). У этих монокарпических видов (в противоположность поликарпическим) старение и смерть тесно связаны с образованием органов размножения. Если предотвратить у однолетних или двулетних растений, например, у сахарной свеклы, образование цветков, то они могут жить много лет.
Коррелятивное сочетание старения с образованием органов размножения не объясняется или объясняется по крайней мере не только тем, что развивающиеся цветки и прежде всего плоды с их значительной потребностью в веществах забирают у остальных частей растения жизненно необходимые вещества: у двудомного шпината, например, цветение мужских растений вызывает такое же старение листьев, как цветение и плодоношение у женских растений. Поэтому более вероятно, что старение и смерть обусловливают другие взаимодействия между органами размножения и остальным растением. Возможно, существуют факторы старения, которые выделяются цветками и плодами, или высокая потребность цветков, плодов и семян в цитокинине из корня вызывает дефицит в остальных частях растения.
У поликарпических видов нормальная смерть наступает, по всей видимости, не в результате неизбежного, запрограммированного старения меристем, а скорее из-за трудностей с обеспечением их водой, солями, питательными веществами и биологически активными веществами. Апикальные меристемы часто можно практически неограниченно держать живыми путем постоянного непрерывного размножения черенками (например, у пирамидального тополя и у многих культурных растений, в частности у земляники, бананов и роз) или in vitro. Таким образом, смерть обусловлена здесь лишь коррелятивными факторами.
Очень большого возраста могут достичь многие деревья. Согласно достоверным подсчетам годовых колец, возраст тополя и вяза, например, может достигать 600 лет, дуба — до 1000 лет, липы — 800 — 1 000 лет, Sabina tibetica — более 1200 лет, Fitzroya cupressoides в Чили — более 2000 лет, мамонтовое дерево (Sequoiadendron gi- ganteum) — до 4000 и Pinus longaeva (= Р. aristata) — до более 4 800 лет. Многие обычные среднеевропейские деревья достигают несколько сотен лет, и даже такие невзрачные растения, как Vacciniummyrtillus, могут достигать 28 лет. С помощью молекулярно-биологических методов у альпийской Carex curvula возраст продолжительно живущего клона был установлен на уровне примерно 2000 лет. Этот клон осоки перенес, следовательно, времена очень различного климата на одном и том же месте. Нужно отметить, что у долго живущих растений происходит постоянное обновление клеток: у деревьев, например, не только в верхушечной меристеме, но и прежде всего в камбии. Продолжительность жизни отдельных растительных клеток, например, клеток сердцевинного луча древесины в деревьях или клеток паренхимы суккулентных кактусов, редко достигает более 100 лет, если не происходит своего рода «омоложение» путем клеточного деления и роста. Но большинство клеток не достигают столь большого возраста. Медленное, но неотвратимое старение идет даже в состоянии покоя, который у семян и спор достигается путем значительного усыхания. Хотя обмен веществ почти полностью прекращается, из опыта известно, что способность к прорастанию едва ли сохраняется дольше, чем 100 — 200 лет. Живущие очень долго семена находят у бобовых, мальвовых, лотосов (Nelumbo nucífera); для последних иногда приводят продолжительность жизни до 1000 лет. Также семена многих видов сорняков (например, Spergula arvensis, Chenopodium album) должны оставаться жизнеспособными при полном отсутствии дыхания сотни лет. Приводимые данные о всхожести так называемой «пшеницы мумии» из египетских гробниц, ложны, так как пшеничное зерно сохраняет всхожесть максимум 10 лет. Семена тропических растений, не приспособленные к преодолению неблагоприятных климатических периодов, часто остаются живыми даже меньше года.
Отдельные органы многолетнего растения — листья, цветки и плоды — имеют значительно более короткую продолжительность жизни, чем все растение. У древесных растений, гемикриптофитов и геофитов (см. 4.2.4) осенью регулярно отмирают все надземные части растения.
У листьев различают последовательное старение и синхронное старение. В первом случае стареют (и умирают) только самые старые листья, в то время как во втором случае, например, при осеннем опадении листвы летнезеленых растений, все листья внезапно подвергаются старению. Старение листьев — организованный процесс, при котором минеральные вещества, в первую очередь фосфор, азот и сера, после распада органического вещества переводятся в подходящую транспортную форму и через флоэму доставляются к запасающим тканям или соответственно органам (флоэмный транспорт, см. 6.8.3).
Старение характеризуется уменьшенной интенсивностью дыхания и фотосинтеза, замедлением всех анаболических процессов обмена веществ, прежде всего синтеза РНК и белков, и ускорением процессов распада, например, хлорофилла, РНК, белка. В стареющие листья усиленно поступают продукты распада и здесь блокируются синтезы; эти листья становятся поставщиками дополнительных аминокислот, ионов, перемещаемых по флоэме. Функцию акцепторной ткани у летнезеленых растений осенью выполняет прежде всего запасающая паренхима ствола и корня, у последовательно стареющих листьев — молодые листья, еще находящиеся в процессе развития.
Осенний распад хлорофилла у летнезеленых растений происходит очень быстро: «волна пожелтения» шагает в Западной Европе от полярной области на юг со скоростью 60 — 70 км в день и длится в данном месте лишь 2 — 3 дня. В тропиках окрашивание листвы и листопад в начале засухи также происходят всего лишь за несколько дней. Быстрый распад хлорофилла до бесцветных продуктов физиологически необходим, потому что окрашенные промежуточные продукты могли бы оказывать фототоксичное действие. По разным оценкам, на суше ежегодно разлагается около 300 млн т хлорофилла. Сюда добавляются еще около 900 млн т в океанах в результате отмирания короткоживущих водорослей. Еще около 200 млн т каротиноидов распадается ежегодно до бесцветных продуктов. Хлорофилл исчезает, как правило, на несколько дней раньше каротиноидов, поэтому часто наступает перекрашивание листьев из зеленого цвета в желтый. У отдельных видов наблюдается, кроме того, еще и синтез антоциана1 («золотая осень»).
1 Придает листьям красную окраску. — Примеч. ред.
Процесс последовательного старения листьев обусловлен, по-видимому, преимущественным накоплением балластных ионов и метаболических шлаков, в то время как синхронное старение регулируется фотопериодически (см. 1.1.22) и ускоряется низкими температурами. В обоих случаях старение контролируется гормонально: оно происходит при растущем содержании фитогормонов, стимулирующих старение (абсцизовая кислота, см. 7.6.4 и особенно этилен, см. 7.6.5) и снижении содержания цитокининов, а также ауксинов и гиббереллинов.
У некоторых растений (например, Rumex, Tropaeolum, Taraxacum) старение можно приостановить прежде всего гиббереллинами (см. 7.6.3), в то время как в листьях древесных растений действуют также ауксины (см. 7.6.1).
Важнейшими фитогормонами, ингибирующими старение листа, являются цитокинины. Это можно особенно четко показать на отрезанных листьях, которые в отсутствие естественных источников цитокинина (в первую очередь без обеспечения цитокинами корня) стареют ускоренно, особенно в темноте. При добавлении цитокинина процесс старения значительно замедляется. Например, если цитокинин нанести на половину листа, старение замедляется только на месте применения, в необработанной половине листа оно коррелятивно ускоряется.
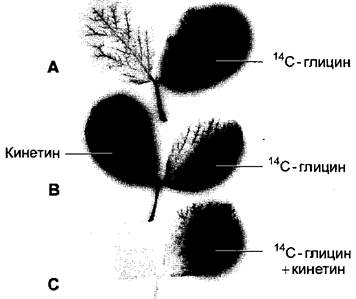
Благодаря применению различных комбинаций цитокинина и флоэмно-мобильных метаболитов (например, аминокислоты глицина) было показано, что питательные вещества перемещаются в растении от места низкой к месту высокой концентрации цитокинина («аттрагирующее действие» цитокинина) и значительно меньше транспортируется из хорошо обеспеченных тканей («удерживающее действие» цитокинина) (рис. 7.48). Очевидно, концентрация цитокинина управляет, среди прочего, донорно-акцепторными отношениями1 в растении и тем самым также направлением флоэмного транспорта. Хорошо обеспеченные цитокининами ткани становятся акцепторными и импортируют питательные вещества из своего менее обеспеченного цитокинином окружения. На молекулярном уровне цитокинин индуцирует накопление инвертазы в клеточной стенке. Это ведет к усиленному расщеплению сахарозы и тем самым к улучшенному обеспечению гексозами цитокининбогатых тканей, с одной стороны, и в связи с этим к усиленной разгрузке сахарозы из флоэмы, с другой стороны (см. 6.8.4). Эти процессы важны для возникновения потребителей метаболитов (акцепторов) с помощью цитокинина.
1 Так называемые «source-sink relations» (англ.). — Примеч. ред.
Рис. 7.48. Аттрагирующее и удерживающее действие цитокининов при замедлении старения листьев: А — С — авторадиограммы парноперистых листьев Vicia faba после нанесения глицина, меченного радиоактивным изотопом углерода 14С; В, С — дополнительно обработаны цитокинином кинетином. Авторадиограммы показывают распределение радиоактивности в листьях. Линиями указаны места нанесения соответствующих веществ. А — не обработанный кинетином контроль; радиоактивный 14С-глицин распределяется по обработанному листочку и экспортируется через черешок. Лишь немного радиоактивности находится в необработанном 14С-глицином листочке; В — аттрагирующее действие цитокинина: наступает массовая аккумуляция радиоактивности в обработанных кинетином листочках; С — удерживающее действие цитокинина: если кинетин и 14С-глицин наносили на одно и то же место листа, то экспорт радиоактивности в другие листочки, как и через черешок листа, не происходит
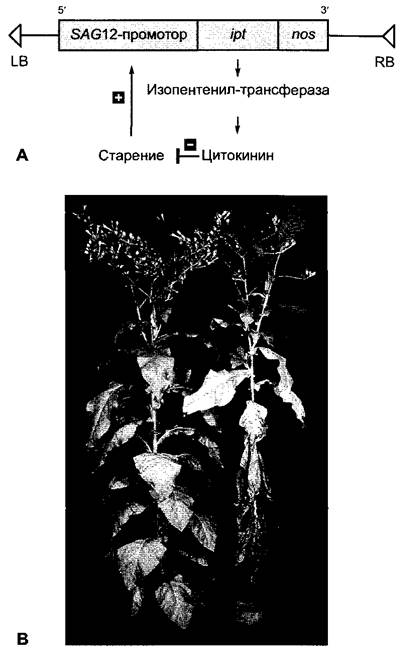
Значение цитокининов для старения листа интактных растений можно также показать в элегантном эксперименте на трансгенных растениях табака (методика, см. бокс 7.3) (рис. 7.49). Эти растения экспрессировали уже упоминавшийся ipt-ген из Agrobacterium tumefaciens под контролем промотора одного из активизирующихся при старении генов табака, SAG12(англ, senescence activated gene). Начавшееся старение ведет к активации промотора. Следствием в трансгенных растениях является образование изопентенилтрансферазы и тем самым усиленный синтез цитокинина. Благодаря этому процесс старения замедляется и активность промотора снова снижается. Как поясняет рис. 7.49, эта саморегулирующаяся система действительно ведет к значительному замедлению последовательного старения листьев табака. Означает ли это возможность создания улучшенных с помощью генетической инженерии растений с повышенной урожайностью, покажет время.
Рис. 7.49. Замедление старения листьев путем регулируемого синтеза цитокинина в трансгенных растениях табака: А — схема генно-инженерной конструкции. Введенный в растения табака через Agrobacterium tumefaciens (бокс 9.2) химерный ген состоит из активирующегося при старении промотора SAG12-гена табака, кодирующей области гена изопентенилтрансферазы (ipt) A. tumefaciens и некодирующей области терминации транскрипции из гена нопалинсинтазы (nos) A. tumefaciens на З’-конце ipt-гена. LB, RB — левая или соответственно правая граница Т-района Ti-плазмиды A. tumefaciens; В — у растений, трансформированных химерным геном (слева), старение листьев сильно замедленно в противоположность нетрансформированным растениям табака (справа)
Иногда на постаревших (или уже сброшенных) листьях наблюдаются «зеленые островки»: ограниченные области, очевидно, сильно затянувшегося старения. Это объясняется локальным выделением цитокининов паразитическими бактериями или грибами (например, Erysiphe graminis или Uromyces phaseoli) либо паразитическими личинками насекомых (например, Stigmella argentipedella). У личинок местами биосинтеза цитокинина должны быть губные железы. Паразиты создают себе локальный участок притока питательных веществ и получают «накрытый стол».
Более важный с практической точки зрения и потому часто исследуемый процесс старения созревание плода, которое имеет общие черты со старением листьев, но включает также специфичные процессы и рассматривается позже (см. 7.6.5.2).
7.6.2.4. Молекулярные механизмы действия цитокининов
Как действуют цитокинины, известно лишь в общих чертах, однако многие физиологические эффекты, вероятно, обусловлены регуляцией активности генов. При регуляции клеточного цикла были обнаружены отдельные гены, на которые действуют цитокинины (см. рис. 7.19, А). Под транскрипционным контролем цитокинина находится также ген нитратредуктазы. Рецепторы цитокинина относятся, как и рецепторы этилена (см. 7.6.5.3, рис. 7.63), к семейству двухкомпонентных рецепторных киназ и локализованы в плазмалемме. У Arabidopsisthaliana встречаются два рецептора, похожих по строению друг на друга и на рецепторы этилена, CKI1 и CRE1 (обозначения происходят от фенотипов мутантов: англ, cytokinin-insensitive, cytokinin-resistant)1. Связывание цитокинина с рецепторами стимулирует их фосфорилирование по типичному для двухкомпонентных рецепторных киназ остатку гистидина. Фосфатная группа переносится оттуда на остаток аспартата (как у рецептора этилена) и оттуда на цитоплазматические белки АНР-семейства (англ. Arabidopsis histidine-phosphorelayprotein). Фосфорилированные АНР-белки перемещаются в клеточное ядро и активируют (путем фосфорилирования) группу локализованных там транскрипционных факторов, которые в фосфорилированной форме связываются с промоторами различных целевых генов и инициируют, таким образом, их транскрипцию. Следовательно, на втором этапе переноса сигнала (от АНР-белка) сигнальные пути от рецепторов этилена или соответственно цитокинина различаются.
1 По другой версии — от англ. cytokinin receptor. — Примеч. ред.
Обширная группа гиббереллинов состоит из дитерпенов (см. 6.16.2); общий структурный признак этих гормонов — тетрациклический энт-гиббереллановый скелет (рис. 7.50). До сих пор было описано более 100 структур, однако лишь немногие из них физиологически активны. Они отличаются по своему действию, стимулирующему рост междоузлий, особенно у карликовых сортов с нарушенным биосинтезом гиббереллинов или, соответственно розеточных растений, что используют для очень чувствительных биотестов (см. 7.6.3.3).
7.6.3.1. Многообразие гиббереллинов
Гиббереллины были открыты сначала как болезнетворный фактор гриба, поражающего рисовые растения, Gibberella fujikuroi (несовершенная форма Fusarium moniliforme).Пораженные растения растут чрезмерно сильно в длину и склонны к полеганию из-за слишком слабых механических тканей (поэтому в Японии болезнь
называется «баканоэ» — «болезнь бешеных проростков»). Этот фактор был назван гиб- берелловой кислотой. Однако скоро стали известны многочисленные родственные ему соединения, так что была введена простая система номенклатуры: гиббереллин + А (от англ. acid, кислота) + число. К настоящему моменту известны гиббереллины А1-А116 (GA1-GA116). Гибберелловая кислота из возбудителя баканоэ по этой номенклатуре обозначается GA3. Наряду с Gibberella fujikuroi гиббереллины синтезируются также грибом Sphacelomamanihoti- cola, который вызывает гигантский рост у растений маниока. Синтез гиббереллина у низших растений распространен не столь широко, однако обнаружен у всех высших растений. Состав гиббереллинов может быть различным как у видов растений, так и у различных органов данного растения. Как правило, в растительном организме встречаются несколько гиббереллинов одновременно (у риса, например, 14, в незрелых семенах яблони — 24), однако большинство из них являются либо предшественниками, либо катаболитами активных гиббереллинов. Важнейшие физиологически активные гиббереллины покрытосеменных — гиббереллин A1 (GA1) и гиббереллин А4 (GA4); гибберелловая кислота (GA3) встречается у высших растений редко (например, у ячменя, где она играет важную роль при мобилизации запасных веществ эндосперма, см. 7.6.3.3). Многие регулируемые гиббереллином процессы можно вызвать с помощью GA3, поэтому этот гиббереллин, получаемый из культуральной жидкости Gibberella в больших количествах, чаще используется в эксперименте.
Рис. 7.50. Структуры гиббереллинового скелета (энт-гиббереллан) и некоторых часто встречающихся гиббереллинов. Приставка «энт» — от enantio (оптический), обозначает структуру, у которой инвертированы хиральные центры молекулы. Энт-гиббереллан, таким образом, является зеркальным отражением гиббереллана. Введение этой, казалось бы, излишне сложной номенклатуры стало необходимым после того, как структура появляющегося в биосинтезе гиббереллина каурена оказалась зеркальным отражением каурена, уже описанного к тому времени в связи с другим синтезом, т. е. энт-кауреном

7.6.3.2. Метаболизм и транспорт
Биосинтез гиббереллинов многоступенчатый и протекает в три этапа и в трех различных клеточных компартментах, однако при участии лишь нескольких типов энзимов (рис. 7.51).
Рис. 7.51. Компартментация биосинтеза гиббереллина. Двойные стрелки отражают многоступенчатые последовательности реакций, в результате которых четыре С5-единицы объединяются в геранилгеранилпирофосфат. Дальнейшие объяснения см. в тексте

1. Образование энт-каурена из общего дитерпенового предшественника геранил- геранилпирофосфата (см. 6.16.2). Эта реакция протекает в два этапа через промежуточный продукт энт-копалилпирофосфат и катализируется двумя ферментами — копалилпирофосфатсинтазой и энт-кауренсинтазой, которые относятся к терпенциклазам и локализованы в пластидах. Этот этап биосинтеза гиббереллина ингибируется такими ингибиторами, как хлорхолинхлорид (= Суclocel, ССС) (рис. 7.52). Суclосеl имеет практическое значение при возделывании зерновых (прежде всего, пшеницы) и используется как вещество, замедляющее рост стебля для снижения полегания (полегание — это надлом стебля под действием ветра или соответственно осадков, затрудняющий механизированную уборку урожая).
2. Водонерастворимый чистый углеводород энт-каурен покидает неясным образом пластиды и поэтапно окисляется на эндоплазматическом ретикулуме до энт-кауреновой кислоты, а она — до гиббереллина А53 (СА53). Вся последовательность реакций катализируется ферментами из группы цитохром-Р450-монооксигеназ, содержащими железо в форме гема (общая схема реакций, рис. 7.53). Ингибитором этого этапа биосинтеза гиббереллина является анцимидол (см. рис. 7.52), который также может использоваться для выращивания растений с укороченными междоузлиями.
Рис. 7.52. Ингибиторы биосинтеза гиббереллина
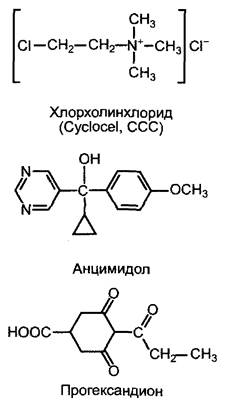
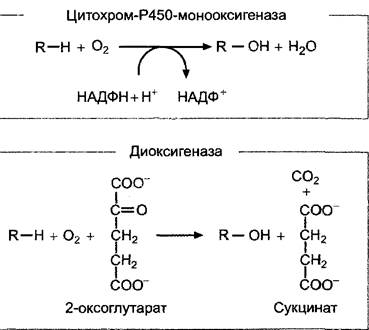
3. Образование активного гиббереллина (чаще всего GА1 из GА53 и его последующая инактивация (не обязательно в той же клетке) протекают в цитоплазме и катализируются диоксигеназами, содержащими негеминовое железо, которые окисляют в качестве второго субстрата 2-оксо- глутарат (общую схему реакций см. на рис. 7.53). При этом сначала окисляется атом С-20 и удаляется в виде СO2, после чего самопроизвольно образуется характерный для активных гиббереллинов скелет из 19 атомов углерода С с лактоновым кольцом (GА20). Активация происходит путем Зβ- гидроксилирования GА20 с помощью фермента GА20-Зβ-гидроксилазы с образованием GА1. С помощью GА1-2β-гидроксилазы активный гиббереллин А1 превращается в GА8, который полностью неактивен. Активности 3β- и 2β-гидроксилазы являются, таким образом, решающими для количества активного фитогормона в клетке. Транскрипция генов этих двух ферментов находится под строгим контролем. Недавно были разработаны специфичные ингибиторы3β-гидроксилазы, которые представляют собой замещенные циклогександионы (например, прогександион, см. рис. 7.52). Они вызывают очень эффективное укорочение междоузлий, которое можно устранить только с помощью GA1, но не GA20 или GA8. Циклогександионы являются конкурентными ингибиторами к косубстрату гидролазы 2-оксоглутарату и препятствуют его перемещению в каталитический центр фермента.
Рис. 7.53. Общие уравнения реакций, катализируемых моно- и диоксигеназами. Оба типа ферментов участвуют в биосинтезе гиббереллинов и во многих других реакциях обмена веществ
Мутанты d1 кукурузы (англ. dwarf, карлик) и lе-мутанты гороха (с которыми еще Грегор Мендель проводил эксперименты по скрещиванию, англ. length — длина) также являются доказательствами того, что в ходе биосинтеза появляется только один- единственный гиббереллин. В качестве активного гиббереллина у кукурузы и гороха выступает GA1: у обоих мутантов утрачена функция 3β-гидролазы, их карликовый рост можно нормализовать только с помощью GA1, но не GA20 или GA8 (можно, правда, как уже было сказано, вместо GА1использовать грибной гиббереллин GA3). У sln-мутантов гороха (англ. slender — тонкий, слабый), которые отличаются чрезмерным ростом в длину, повреждена в 2р- гидролаза, инактивации активного гиббереллина не наступает.
Наряду с рассмотренным здесь основным путем биосинтеза гиббереллина существуют, например, у голосеменных, варианты, которые ведут к гиббереллинам, замещенным в различных положениях. Однако общая схема протекания биосинтеза гибберелинов во всех растениях, как предполагают, одинакова.
Гены многочисленных ферментов биосинтеза гиббереллинов уже клонированы, поэтому их экспрессию в растении можно исследовать точнее и тем самым получить сведения о местах их биосинтеза. Он протекает, очевидно, во многих быстро растущих тканях (меристемы побега, растущие листья, зоны роста побега, кончик корня) и на ранних стадиях образования семян; место образования и действия гиббереллинов в этих случаях пространственно разделить невозможно.
В побеге гиббереллины транспортируются не полярно, в корне иногда наблюдается слабая полярность от кончика к основанию, скорость перемещения 5 — 30 мм • ч-1. На короткие расстояния (например, в зерновках злаковых, см. 7.6.3.3) транспорт происходит, по-видимому, путем простой диффузии. Гиббереллины были обнаружены как во флоэмном соке, так и в ксилемном соке 1; они распределяются в растении с массовым током питательных веществ.
7.6.3.3. Действие гиббереллинов
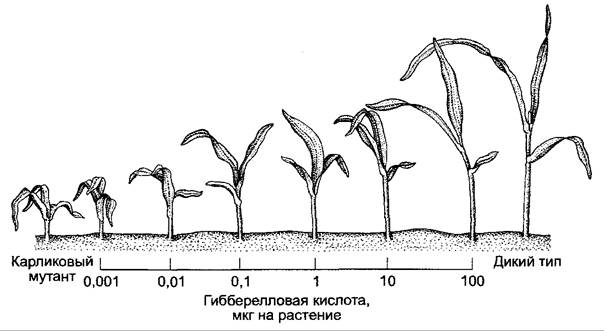
Гиббереллины контролируют множество физиологических процессов: на стадии вегетативного развития — элонгацию оси побега (растяжение междоузлий), при прорастании семян — прерывание покоя (см. 7.7.1.2) и мобилизацию запасных веществ, особенно в зерновках злаков. На стадии генеративного развития гиббереллины могут оказывать влияние на образование цветков, пол цветка и закладку плодов. При этом гиббереллины действуют отчасти сходно с ауксином. Так, и те, и другие вызывают партенокарпию у яблонь и томатов, однако есть много процессов, при которых гиббереллины и ауксины оказывают противоположное действие. Так, гиббереллины стимулируют прорастание клубней картофеля (ауксин ингибирует), ингибируют закладку боковых корней (ауксин стимулирует) и стимулируют рост корня (ауксин стимулирует в очень низких концентрациях и ингибирует в высоких); гиббереллины не оказывают влияние на рост колеоптиля, тогда как ауксины не стимулируют растяжение междоузлий. Различия в регуляции процессов роста междоузлий и колеоптилей являются основой для очень чувствительных и специфичных биотестов на гиббереллины, при которых используются карликовые сорта (например, d1-мутанты кукурузы), где синтез гиббереллинов сокращен или отсутствует (рис. 7.54).
Рис. 7.54. Ростовая реакция проростков карликовых мутантов (dwarf1) кукурузы на однократное добавление различных количеств гибберелловой кислоты (GA3 нанесена в виде водного раствора в пазуху первого листа). Слева — карликовое растение без добавления GA3; справа — растение дикого типа того же возраста (контроль)
Стимуляция растяжения междоузлий гиббереллинами объясняется стимуляцией как клеточного роста, так и клеточного деления. Молекулярные механизмы в значительной степени неизвестны. Правда, гиббереллин индуцирует образование ксилоглюканэндотрансгликозидазы (ХЕТ — см. 7.6.1.4) и снижает тем самым, как и ауксин, пороговый потенциал для пластичной деформации клеточной стенки, так как этот фермент частично гидролизует гемицеллюлозную сеть первичных клеточных стенок. Это должно обеспечить экспансину улучшенный доступ к водородным связям между гемицеллюлозой и целлюлозой, которые под его воздействием разрушаются. В отличие от ауксина под действием гиббереллина не наступает, однако, подкисление апопласта. Различие влияний гиббереллина и ауксина следует также из того, что вклады обоих фитогормонов в стимуляцию роста аддитивны.
При индукции цветения или стимуляции закладки органов цветка, прежде всего у розеточных растений, добавление гиббереллина часто может заменить действие внешнего фактора: например, эффект низких температур (см. 7.7.1.2, 7.7.1.3) или индуктивный фотопериод у длиннодневных растений, не нуждающихся в холоде, таких, как Hyoscyamus nigerили Spinacia olerácea (см. 7.7.2.2). Эти внешние факторы оказывают влияние через повышение эндогенного уровня гиббереллинов. У шпината, например, в условиях, которые индуцируют образование цветка и ветвление на длинном дне (см. 7.7.2.2), постоянно день ото дня повышаются уровни всех промежуточных продуктов от GА53 до активного GА1 и продукта его инактивации GА8 (см. рис. 7.50). Среди прочих процессов свет стимулирует через фоторецептор фитохром (см. 7.7.2.4) транскрипцию генов гиббереллин-С20-оксидазы и гиббереллин-Зβ-гидроксилазы.
На проявление пола у однодомных растений (см. 11.2), например, у огурца, гиббереллины и ауксины оказывают противоположное влияние. В то время как ауксины стимулируют образование женских (пестичных) цветков и тем самым закладку плодов, гиббереллины стимулируют усиленное образование мужских (тычиночных) цветков. Поэтому ингибиторы биосинтеза гиббереллинов (см. рис. 7.52) стимулируют, как и ауксины, образование пестичных цветков и используются в сельскохозяйственной практике для стимуляции закладки плодов у огурцов. У кукурузы, напротив, закладка меристем женского соцветия происходит при более высоком эндогенном уровне гиббереллина, чем индукция мужских цветков. Гиббереллин активирует гены, продукты которых блокируют развитие андроцея. Эта регуляция
пола является примером того, что большинство процессов развития управляется не одним фитогормоном, а сложным взаимодействием различных фитогормонов в сочетании с внешними факторами (см. 7.7).
Роль гиббереллинов при прорастании семян, особенно у Роасеае, изучена особенно интенсивно. Большинство исследований были проведены на ячмене.1 Зерновка Роасеае — сухой плод, у которого семенная кожура и перикарп срослись друг с другом (см. 11.2). Эти ткани окружают остальные ткани семени: зародыш и триплоидную питательную ткань (эндосперм); последняя состоит из центрального крахмалистого эндосперма (чьи клетки в зрелом состоянии отмирают) и алейронового слоя из живых клеток — однослойного (например, у пшеницы) или трехслойного (например, у ячменя). Зародыш прилегает к эндосперму своей семядолей, преобразованной в особый поглощающий орган — щиток.2
1 Прорастание ячменя имеет большое экономическое значение при производстве солода (компонент пива). — Примеч. ред.
2 Природа щитка у злаков дискуссионна. Высказаны мнения, что щиток не является производным семядоли, либо образуется в результате срастания семядоли с другими частями зародыша. — Примеч. ред.
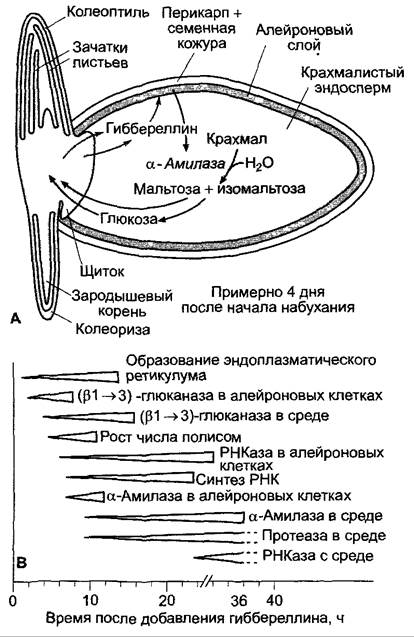
В ходе прорастания благодаря гидролитическому разложению мобилизуется запас крахмала (см. 6.17.1.2). Необходимые для этого ферменты (амилазы) частично выделяются щитком (β-амилазы), однако большей частью образуются по сигналу зародыша в алейроновом слое и выделяются в крахмальный эндосперм (α-амила- зы). Сигналом, идущим из зародыша, служат гиббереллины (у ячменя, очень вероятно, GА3, у пшеницы преимущественно GА1), которые выделяются щитком и диффундируют в эндосперм. Если удалить зародыш, не образуется α-амилаза; однако физиологическое действие зародыша можно функционально заменить низкими концентрациями активного гиббереллина (например, GА3); изолированный алейроновый слой при инкубации в растворах GА3 сам образует и выделяет α-амилазы.
Действие гиббереллинов на алейроновый слой комплексное, и секреции α-амилазы предшествует множество событий (рис. 7.55). Кроме того, образуются многие другие гидролитические ферменты, разрушающие сшивочные гликаны клеточных стенок (глюканазы), запасающие белки (протеазы), или нуклеиновые кислоты (РНКазы). Гиббереллин индуцирует при этом синтез и секрецию ферментов (например, в случае α-амилазы) либо только секрецию, в то время как синтез может проходить и без добавления гиббереллина (определенные глюканазы, РНКазы). Образование ферментов и секреция контролируются, следовательно, независимо друг от друга с помощью гиббереллина.
Рис. 7.55. Индуцируемые гиббереллином процессы при прорастании зерновок: А — состояние примерно через 4 дня после начала набухания. Выделение гиббереллина зародышем начинается примерно через 12 ч после начала набухания, секреция α-амилазы — на 8 — 10 ч позже. Гидролиз крахмала начинается вблизи щитка и идет несколько дней в дистальном направлении; В — последовательность индуцированных гиббереллином событий в изолированных алейроновых слоях ячменя
Молекулярные аспекты образования α- амилазы при индукции гиббереллином выяснены лишь частично (рис. 7.56). Гиббереллин стимулирует активацию генов α- амилазы (энзиматическая активность, представленная здесь упрощенно как α- амилазная, обеспечивается семейством изоэнзимов) и тем самым образование мРНК α-амилазы и следующий за ним биосинтез de novo белка-фермента. Были определены как участвующий в этом процессе транскрипционный фактор, так и гис-элементы промоторов амилаз, ответственные за физиологическую реакцию на гиббереллин (рис. 7.56). Рецептор гиббереллина, по-видимому, находится в плазматической мембране алейроновых клеток.
Рис. 7.56. Модель регуляции образования α- амилазы с помощью гиббереллина. Еще неизвестный сигнальный путь гиббереллина стимулирует инактивацию репрессорного белка, кодируемого GAl-геном'1(англ. gibbereilic a insensitive). Это ведет к инициации транскрипции GA-MYB-гена, который кодирует специальный транскрипционный фактор МУВ-семейства. Транскрипционный фактор GA-MYB связывается с элементами последовательности (вероятно, с ТААСААА-последовательностью) в промоторе генов ос-амилазы, благодаря чему начинается их транскрипция (см. рис. 7.10). Синтезируемая на эндоплазматическом ретикулуме α-амилаза выделяется аппаратом Гольджи. Процесс секреции также зависит от гиббереллина и регулируется через второй, еще мало изученный сигнальный путь
1 В схеме суммированы данные по Arabidopsis и злакам. Ген GAI, в частности, относится к Arabidopsis. — Примеч. ред.

В этом процессе фитогормон также действует не один. Действие гиббереллина можно прекратить путем одновременного внесения абсцизовой кислоты (см. 7.6.4). Изначально высокий уровень абсцизовой кислоты в зерновках при начавшемся прорастании быстро снижается, прежде чем уровень гиббереллина повысится. Поэтому абсцизо- вая кислота, вероятно, участвует в контроле процессов прорастания зерновок in vivo.
Стимуляция прорастания семян с помощью гиббереллина встречается не только у злаков. У семян или соответственно плодов двудольных экзогенно добавленная гибберелловая кислота не только ускоряет прорастание, но и делает его возможным во многих случаях, когда необходимые внешние условия отсутствуют. Так, для прорастания ореха лещины (Corylus avellana) обычно требуется холодный период (около 12 недель при 5 °С). Эту стратификацию можно заменить добавлением гибберелловой кислоты. Семена, для прорастания которых необходим свет (светозависимое прорастание, см. 7.7.2.2), могут частично прорастать в темноте, если они обеспечены гибберелловой кислотой.
Наряду с фитогормонами, оказывающими преимущественно стимулирующее действие на метаболизм и развитие, растения содержат также биологически активные вещества с преимущественно ингибирующим действием. Сюда относятся: абсцизовая кислота (АБК — англ. abscisic acid, ABA), которая изначально была описана как фактор преждевременного опадения плодов у хлопчатника; абсцизин II и дор- мин как фактор, обеспечивающий покой почек. Исследования показали идентичность структуры абсцизина II и дормина.
7.6.4.1. Метаболизм и транспорт абсцизовой кислоты
Абсцизовая кислота встречается у всех низших и высших растений, включая водоросли и грибы, а также у цианобактерий, но ее нет у остальных бактерий и архебактерий. Большие количества АБК образует фитопатогенный гриб Cercospora rosicola (патоген роз). В сосудистых растениях, как полагают, все клетки, несущие пластиды, способны к биосинтезу АБК. Он начинается с окислительного расщепления 9-цис-неоксантина, встречающегося в пластидах виолаксантина, производного ксантофилла. Продукт расщепления ксантоксин переводится в цитоплазме через абсцизовый альдегид в абсцизовую кислоту (рис. 7.57). Следовательно, АБК в сосудистых растениях является апо-каротиноидом.1 В грибах АБК образуется путем циклизации фарнезилпирофосфата (см. 6.16.2), таким образом, его можно назвать сесквитерпеном. Более старое представление, согласно которому этот путь биосинтеза должен происходить также у высших растений, не подтвердилось. Так, мутанты кукурузы с нарушенным биосинтезом синтезируют также значительно меньшие количества АБК (см. 7.6.4.2).
1 Введенные термины призваны подчеркнуть особенности биосинтеза. В русской литературе АБК характеризуют как сесквитерпен, придавая этому термину чисто структурное значение. — Примеч. ред.
Рис. 7.57. Метаболизм абсцизовой кислоты (АБК). Фитогормон образуется у высших растений в результате распада ксантофилла 9-цис-неоксантина, в грибах — через циклизацию фарнезилпирофосфата. У мутантов томата flacca (fiс) и sitiens (sit) нарушено превращение абс- цизового альдегида в АБК. Оба мутанта очень быстро вянут, так как при недостатке воды уже не могут закрывать устьица. Дефект можно устранить путем опрыскивания растений раствором АБК. У viviparous-мутантов vp2 и vp5 кукурузы на ранних этапах биосинтеза каротиноидов имеются нарушения, которые ведут к недостатку АБК и, следовательно, к вивипарии
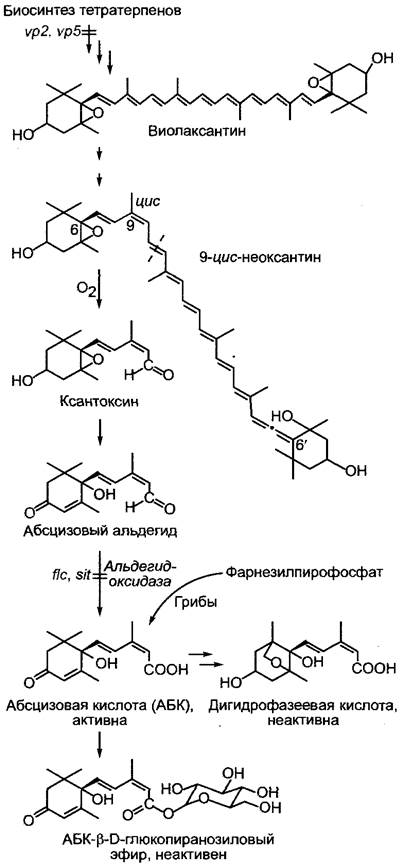
Фитогормон инактивируется путем окисления до дигидрофазеевой кислоты или путем образования сложного эфира с глюкозой.
АБК встречается во всех органах растения. Наибольшие количества АБК отмечены осенью в покоящихся почках, а также в семенах и плодах (прежде всего в тканях плода). В определенных ситуациях, особенно при засухе, недостаточно обеспеченные водой ткани в течение нескольких часов образуют большие количества АБК. Биосинтез фитогормона начинается вследствие снижения тургора ниже порогового значения, а не в связи со снижением водного потенциала (см. уравнение 6.15). В листе при недостатке воды содержание АБК может возрасти более чем в 40 раз. В области корневой системы при снижении тургора вследствие недостатка воды также образуется АБК. Фитогормон транспортируется из корня через ксилему в побег; с транспирационным током он достигает устьиц и индуцирует их закрывание (см. 7.6.4.2;
8.3.2.5). Образующаяся и высвобождающаяся в листе при недостатке воды АБК транспортируется по флоэме и попадает, таким образом, в корень. Там АБК участвует в повышении гидравлической проводимости, благодаря чему повышается водопоглощающая способность корня. Флоэм- ный и ксилемный транспорт абсцизовой кислоты служат, таким образом, для координации водного режима побега и корня. На короткие расстояния АБК, по-видимому, транспортируется путем диффузии от клетки к клетке; выделившаяся в апопласт АБК распределяется с током воды (см. рис. 6.32). В черешках молодых листьев и междоузлиях паренхимный транспорт АБК базипетально поляризован и происходит со скоростью ~3 см • ч-1, т. е. в два раза быстрее, чем ИУК (см. 7.6.1.3). Отранспортной системе ничего не известно.
7.6.4.2. Действие абсцизовой кислоты
Абсцизовая кислота была выделена из преждевременно опавших незрелых коробочек хлопчатника, где она содержится в высоких концентрациях. АБК стимулирует опадение органов при нанесении на черешок листа или плодоножку. Это происходит лишь в определенных условиях (например, когда обеспечение ауксином по
давлено у листьев вследствие удаления листовой пластинки), однако при этом речь идет не о первичном действии АБК. Опадение органов объясняется, скорее, высвобождением этилена, вызванным обработкой1, поэтому название абсцизовая кислота (от abscission — опадение) выбрано неудачно, хотя и стало общеупотребительным.
1 АБК вызывает стрессовый листопад при дефиците воды. В климате средней полосы России и Европы массовый листопад регулируется этиленом, тогда как сезонный листопад в засушливых регионах, как предполагают, контролируется АБК. — Примеч. ред.
Физиологические эффекты АБК можно разделить на две группы:
✵ регуляция состояния покоя растительных органов;
✵ регуляция водного режима растения.
Кроме того, АБК часто выступает как антагонист других фитогормонов. Так, добавленная извне АБК ингибирует вызванный ауксином рост растяжением, индукцию гиббереллином синтеза α-амилазы в алейроновом слое — они также являются антагонистами АБК при переходе к состоянию покоя или соответственно при выходе из него (см. ниже). АБК стимулирует старение листьев, а цитокинины ингибируют этот процесс.
Накопление АБК в семенах или в мякоти плодов из-за своего ингибирующего действия на прорастание является важным фактором покоя семян. Покой семян зависит от анатомического строения семенной кожуры, которая в зрелых семенах, например, затрудняет доступ воды или кислорода. После ее удаления или механического повреждения наступает прорастание. Однако часто покой семян обусловлен физиологически: в отсутствие семенной кожуры даже при благоприятных условиях дальнейшего развития не происходит. С другой стороны, у мутантов с нарушенным образованием АБК (например, у мутантов кукурузы vр2 и vp5, см. рис. 7.57) прорастание семян часто наступает уже на материнском растении (вивипария, отсюда обозначение мутантов viviparous). АБК оказалась эмбриональным фактором покоя семян.
В экспериментах на Arabidopsis thaliana было показано, что генотип зародыша, отличный от генотипа материнского растения, ответственен за покой, зависимый от АБК. Покой семян, таким образом, определяется содержанием АБК зародыша, а не тканей плода. У мясистых плодов, таких, как ягоды, предположительно высокий уровень АБК в мякоти плода способствует предотвращению преждевременного прорастания семян. В некоторых семенах (например, у грецкого ореха, яблони, розы) стратификация (см. 7.7.1.2) уменьшает количество АБК, стимулируя тем самым прорастание. К тому же стратификация часто способствует стимуляции синтеза гиббереллинов. Во многих случаях в эксперименте покой семян, вызванный АБК, можно прервать путем добавления гиббереллина. Было показано, что для перехода в покой или соответственно для прекращения покоя зародыша не так важно абсолютное содержание обоих фитогормонов, сколько соотношение концентраций АБК и гиббереллина.
АБК при прорастании семян не только ответственна за покой зародыша, но индуцирует также образование запасных белков в семенах. В ходе эмбриогенеза после окончания клеточных делений и перед началом этапа растяжения клеток, связанного с накоплением запасных веществ в ткани зародыша или эндосперма, наступает временное сильное повышение концентрации абсцизовой кислоты в семенах. Предполагается, что наряду с индукцией синтеза запасающих белков при повышении концентрации АБК синтезируются также другие белки (например, дегидрины); они служат для структурной защиты клеток в фазе покоя развития семени, когда содержание воды в ткани снижается до 10 % и ниже.
Начало покоя почек обычно (но не всегда) связано с повышением концентрации АБК и часто со снижением концентрации цитокинина и гиббереллина, в то время как в ходе вернализации (см. 7.7.1.3) содержание АБК снова снижается и одновременно повышается концентрация гиббереллина и цитокинина. Если вернализируют побеги в присутствии экзогенной абсцизовой кислоты, то спящие почки, например, у ясеня, не выходят из состояния покоя.
Особое физиологическое значение имеет АБК для регуляции водного режима. При недостатке воды АБК стимулирует закрытие устьиц, повышение гидравлической проводимости корня и стимуляцию роста корня при одновременном ингибировании роста побега. Последний эффект можно рассматривать как долгосрочную адаптацию к хроническому недостатку воды (увеличение поглощающей воду поверхности относительно транспирирующей). Повышение гидравлической проводимости в тканях корня в ответ на недостаток воды в побеге происходит через несколько часов и регулируется, вероятно, АБК, образующейся в побеге и транспортируемой через флоэму в корень (механизм неизвестен). Контроль ширины устьичных щелей с помощью АБК происходит, напротив, в течение минут и позволяет эффективно быстро и обратимо регулировать баланс между транспирацией и тургором во всем листе (см. рис. 6.77) или даже в отдельных областях внутри листа. При локальном недостатке воды промежуток времени от начавшегося нового синтеза АБК до выделения фитогормона клетками мезофилла небольшой, так что сигнальное вещество с транспирационным током быстро достигает целевых клеток, замыкающих клеток устьиц.
С помощью крайне чувствительных методов анализа были определены количества АБК в изолированных замыкающих клетках из хорошо обеспеченных водой (устьица открыты) или соответственно страдающих от недостатка воды листьев (устьица закрыты) Vicia faba: при закрытых устьицах содержание АБК в замыкающих клетках в 20 — 25 раз выше, чем при открытых устьицах (рис. 7.58). Значение АБК для регуляции устьичной транспирации подтверждается опытами с АБК-дефицитными мутантами, которые крайне быстро увядают и не могут закрыть свои устьица. Так, увядающие мутанты томатов flacca (fie) и sitiens (sit) содержат около 10% от количества АБК, находящегося в растениях дикого типа, и могут расти только в насыщенной водяным паром атмосфере. Однако после добавления АБК функция замыкающих клеток устьиц и водный режим нормализуются.
Рис. 7.58. Содержание абсцизовой кислоты в замыкающих клетках Viaa faba при открытых или соответственно закрытых устьицах. Анализ был проведен на отдельных изолированных парах замыкающих клеток (А) при использовании высокочувствительного иммунологического метода, причем в показанных экспериментах 1,2 и 3 (В) для анализа использовались 10, 20 или соответственно 50 препаратов замыкающих клеток из эпидермиса растений при недостатке воды W (устьица закрыты, темные столбцы со стандартными отклонениями) или соответственно 100 препаратов замыкающих клеток из эпидермиса растений, хорошо обеспеченных водой (К — контроль, устьица открыты); 1 фемтограмм (фг) = 10-15 г
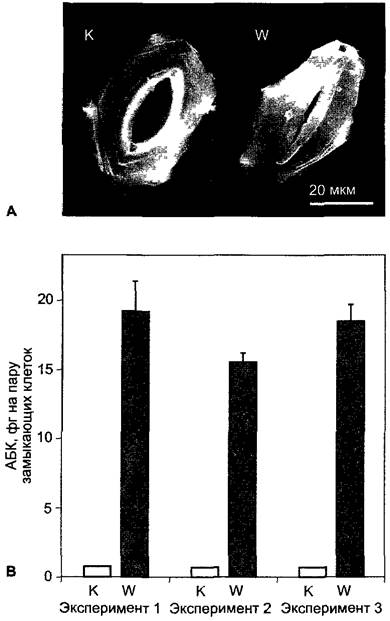
Молекулярный механизм действия АБК на замыкающие клетки известен только частично. Лежащие в основе движения замыкающих клеток процессы подробнее рассмотрены в главе 8 (см. раздел 8.3.2.5 и рис. 8.32; 8.33).
Действие этилена на растения известно уже 100 лет, однако только в 60-е гг. XX в. с развитием чувствительных методов анализа газовой хроматографии было доказано, что все растения постоянно производят и выделяют в окружающую среду небольшие количества этого газообразного вещества с простой структурной формулой Н2С=СН2. Этилен относится к пяти «классическим» группам фитогормонов. Из-за своей летучести он может действовать не только как гормон (сигнальное вещество внутри индивидуума), но и как феромон(сигнальное вещество между индивидуумами одного вида) и даже между индивидуумами различных видов (кайромон).
Постоянный синтез небольших количеств этилена, по-видимому, необходим для нормального роста высших растений. Мутант томатов diаgeotropicа не может образовывать этилен. Он растет диагеотропно (см. 8.3.1.2), а не ортотропно1, но демонстрирует нормальный рост при содержании в атмосфере всего лишь 0,005 мкл этилена на литр воздуха.
1 Диагеотропный рост — рост в горизонтальном направлении, т.е. «одинаковый по отношению к верху и к низу». Его называют еще плагиотропным ростом. Ортотропный — рост в вертикальном направлении, т.е. «прямой по отношению к верху и к низу». — Примеч. ред.
7.6.5.1. Метаболизм и транспорт этилена
Этилен синтезируется бактериями, грибами и растениями из метионина (рис. 7.59) (некоторые бактерии используют как исходный субстрат глутамат или соответственно 2-оксоглутарат). Непосредственный предшественник этилена 1-аминоцикло- пропан-1-карбоновая кислота (АЦК) возникает из S-аденозилметионина. Эта катализируемая ферментом АЦК-синтазой реакция определяет скорость образования этилена; к тому же фермент характеризуется высоким метаболическим оборотом и по этой причине является ключевой точкой регуляции биосинтеза этилена. Образование АЦК-синтазы индуцируется рядом факторов окружающей среды: повреждением и механической нагрузкой, затоплением, засухой и холодом, а также перед началом старения в цветках и плодах. Высокие концентрации индолил-3-уксусной кислоты также способствуют индукции АЦК-синтазы. Предполагают, что многочисленные физиологические эффекты ауксина, которые наблюдались при внесении высоких концентраций ИУК, на самом деле объясняются индуцированным синтезом этилена. Это справедливо для вызванного ИУК образования соцветий у бромелиевых (например, у ананаса) и ингибирования роста при высокой концентрации ауксинов. Кофактором АЦК-синтазной реакции является пиридоксальфосфат, поэтому с помощью ингибиторов пиридоксальфосфатзависимых ферментов, таких как аминооксиуксусная кислота и амино- этоксивинилглицин, можно существенно снизить образование АЦК и тем самым синтез этилена.
Рис. 7.59. Биосинтез этилена из L-метионина и последовательность реакций для регенерации метионина (цикл Янга)
АЦК расщепляется ферментом АЦК- оксидазой (диоксигеназа, см. рис. 7.53) в зависимой от кислорода реакции до этилена и цианомуравьиной кислоты. Последняя самопроизвольно распадается на СО2 и HCN. Цианид (CN-) обезвреживается, превращаясь в β-цианоаланин, который затем превращается в аспарагин и аспарагиновую Кислоту. Часть АЦК конъюгирует с малоновой кислотой, образуя N-малонил-АЦК, который далее накапливается в вакуоли. Малонилтрансфераза регулируется светом через фитохромную систему (см. 7.7.2.4). N - малонил - АЦК далее не расщепляется, поэтому происходит необратимая конъюгация, которая служит для ограничения уровня АЦК и тем самым также для регуляции образования этилена. Этилен как газообразное соединение легко удаляется из растения путем диффузии, так что для удаления активного фитогормона реакции разложения не играют никакой роли.
Важным этапом биосинтеза этилена является регенерация метионина из второго продукта реакции АЦК-синтазы — метилтиоаденозина (см. рис. 7.59). Этот биохимический процесс, названный по имени открывателя циклом Янга, позволяет растениям образовывать этилен на протяжении больших отрезков времени без постоянного синтеза метионина de novo. Это важно, например, в плодах после их отделения от материнского растения.
7.6.5.2. Физиологическое действие этилена
Как все фитогормоны, этилен оказывает влияние также на множество физиологических процессов на различных стадиях развития растения. У этиолированных проростков (растущих при сильном недостатке света) уже незначительные количества этилена (0,1 — 1 мкл на литр воздуха) сильно угнетают рост побега растяжением, что сопровождается усиленным поперечным ростом и нарушением характерного отрицательного гравитропизма. Этот трехсторонний синдром называется тройным ответом (см. рис. 7.62)1. К тому же обработан ные этиленом проростки образуют сильно изогнутую апикальную петельку. Механическая нагрузка (например, вызванная сопротивлением почвы) у этиолированных проростков усиливает продукцию этилена, поэтому тройной ответ можно рассматривать как единый процесс, который позволяет проросткам огибать в почве препятствия или расти вдоль наименьшего сопротивления. Местом максимального биосинтеза этилена у этиолированного проростка является участок апикальной петельки. При освещении образование этилена уменьшается за счет включения фитохромной системы (см. 7.7.2.4). При этом обусловленное этиленом угнетение роста растяжением клеток, расположенных сбоку от петельки, больше не происходит, и петелька исчезает.
1 Triple response в англоязычной литературе. Эффект впервые описан Д. Н. Нелюбовым в 1901 г. — Примеч. ред.
Однако сократившийся у освещенного побега синтез этилена со временем снова повышается с помощью ряда факторов, например, после повреждения (защита — см. 9.4.1) и при механической нагрузке (например, при действии ветра). В последнем случае усиленно образующийся этилен тормозит рост в длину, стимулируя поперечный рост и усиленное образование механических тканей, что в целом приводит к увеличению механического сопротивления растительного организма. Накапливаются данные о том, что оксилипины (см. 7.6.6.2) также участвуют в регуляции этих процессов.
Усиленный апикальный рост оси побега, вызванный этиленом при подавлении роста в длину, идет на клеточном уровне с переориентацией кортикальных микротрубочек из поперечного в продольное расположение. Это вызывает, согласно современным данным, соответствующее изменение ориентации новых синтезированных целлюлозных микрофибрилл в клеточных стенках, поскольку целлюлозосинтазные комплексы в плазмалемме перемещаются по микротрубочкам, расположенным в периферической цитоплазме (см. 6.17.1.1). Механическое сопротивление при росте растяжением перпендикулярно направлению расположения большинства целлюлозных фибрилл, вследствие чего индуцированный этиленом синтез целлюлозных микрофибрилл преимущественно в продольной ориентации ведет к усиленному поперечному клеточному росту.
У многих болотных и водных растений, которые наряду с затопленными (погруженными) органами имеют также надводные органы (например, цветки, листья, включая плавающие листья), этилен стимулирует рост в длину оси побега и образование воздухоносных тканей (аэренхимы — см. рис. 3.8). Это способствует лучшему обеспечению кислородом глубинных органов.1 Определенные сорта риса (глубоководный рис) растут при скорости затопления до 25 см в день и достигают 5 м в длину. Они, таким образом, в состоянии цвести и плодоносить даже при продолжительном затоплении. Предполагают, что концентрация этилена в затопленных органах выше, потому что из тканей путем диффузии выделяется меньше этилена. Проростки некоторых мезофитов (например, зерновых) в условиях почвенного затопления также усиливают рост в длину.
1 Аэренхима улучшает также механические характеристики подводных органов, работая как «поплавок», не дающий течению слишком сильно деформировать тело растения. — Примеч. ред.
Этилен ингибирует рост корней, но важен для развития боковых и адвентивных корней; он участвует в образовании корневых волосков, а также стимулирует в корнях (например, у кукурузы) образование аэренхимы.
У Cucurbitaceae под влиянием этилена сильно повышается доля мужских цветков относительно женских, а у Bromeliaceae этилен индуцирует цветение. Это используется, например, для синхронизации закладки соцветий на плантациях ананаса. В связи с тем, что внесение газообразного этилена нельзя контролировать, здесь (и во многих других случаях, см. ниже) применяется 2-хлорэтилфосфоновая кислота (этефон), которая в водном растворе медленно разлагается до этилена, фосфата и хлорида (рис. 7.60).
Рис. 7.60. Высвобождение этилена из этефона (2-хлорэтилфосфоновой кислоты) в водном растворе

У многочисленных видов внесение этилена прекращает физиологический покой (см. 7.6.4.2), как, например, у зерновок Роасеае, арахиса, луковиц многих Liliaceae (например, тюльпана) и Amaryllidaceae (например, Narcissus) корневищ и клубнелуковиц Iridaceae (например, Iris, Gladiolus) и у пазушных почек некоторых видов (например, картофеля).
Этилен является очень важным регулятором старения и сбрасывания листьев, цветков и плодов.
Многие плоды при созревании, которое можно рассматривать как процесс старения, захватывающий все материнские ткани, проходят фазу интенсивного дыхания (климактерическое дыхание). К плодам с выраженным дыхательным климактерием относятся яблоки, груши, бананы, авокадо, анона, персик и томат, в то время как у других (например, у вишни, винограда, земляники и цитруса) это явление не наблюдается. У климактерических плодов этилен ускоряет созревание, примерно одновременно с интенсивным климактерическим дыханием происходит максимальный эндогенный синтез этилена. Физиологическое значение этилена для процесса созревания плодов было наглядно показано на трансгенных томатах, когда путем антисенскосупрессии (см. бокс 7.4) сильно понижали количество либо АЦК- синтазы, либо АЦК-оксидазы (см. рис. 7.59). Это значительно снизило продукцию этилена и замедляло процесс созревания плодов; однако полное созревание плодов у трансгенных томатов возможно лишь при добавлении этилена.
У съедобных зоохорных плодов (см. 11.2, распространение семян и плодов) в ходе процесса созревания наступает гидролиз крахмала до сахаров, распад органических кислот в процессе дыхания, изменяется цвет в результате распада хлорофилла и синтеза антоцианов и/ или каротиноидов. Наконец, благодаря частичному разрушению клеточных стенок и срединных пластинок ткани плода становятся мягкими, происходят все процессы, которые увеличивают привлекательность и съедобность плода. Образование многих ферментов, участвующих в этих процессах (например, хлорофиллазы, полигалактуроназы), индуцируется этиленом.
В сельскохозяйственной практике обработка растений томатов этефоном вызывает одновременное созревание плодов, что облегчает уборку. Многие плоды (например, бананы) убирают в еще несозревшем состоянии и во время транспортировки на судне-рефрижераторе их держат в атмосфере, где содержание этилена поддерживают на низком уровне, пропуская воздух через бронированный угольный фильтр1. Одновременно к воздуху примешивают СO2 (он действует как антагонист этилена). Путем повышения температуры, удаления СO2 и обработки этиленом в нужное время перед поступлением в продажу запускают процесс созревания.
1 Имеется в виду активированный уголь. — Примеч. ред.
Как правило, под влиянием этилена усиливается также старение органов цветков. Так, у многих цветков (например, у орхидей) после опыления быстро стареют листочки околоцветника — это вызвано высвобождением этилена. У цветков старение интенсифицируется после отделения от материнского растения, поэтому срезанные цветы часто обрабатывают ингибиторами этилена (например, тиосульфатом серебра, действующий фактор —Аg+-ион), чтобы повысить их сохранность. Ингибирование биосинтеза этилена с помощью антисенс-косупрессии ведет к сильному замедлению старения как плодов, так и цветков (например, гвоздики). Напротив, старение листьев стимулируется этиленом слабо: не чувствительные к этилену мутанты Агаbidopsis thaliana (см. 7.6.5.3) демонстрировали полноценное, хотя и незначительное замедление старения листьев.1
1 С одной стороны, так называемое «старение» у Агаbidopsis коррелирует с созреванием плодов, как и у других монокарпических видов, а не с автономным старением листьев (см. 7.6.2.3). С другой стороны, «не чувствительные» к этилену мутанты производят его в полном объеме, а чувствительность снижена. По современным данным, у Агаbidopsis есть как минимум 5 рецепторов к этилену (см. 7.6.5.3), и повреждение одного из них в результате мутации слабо влияет на общую картину (при функционирующих других рецепторах). — Примеч. ред.
Сбрасывание листьев, цветков и плодов, а иногда, как у тополя, также ветвей — это один из этапов нормального процесса развития многолетних растений. Растение может тем самым, во-первых, устранять лишние или больше не функционирующие органы (например, цветки, которые не были опылены и оплодотворены; плоды, в которых прекратилось развитие семян; неработоспособные листья) и, во-вторых, осуществлять распространение зрелых плодов. Структурные и физиологические причины опадения листьев, цветков и плодов очень похожи, причем опадение листьев изучено лучше всего.
Летнезеленые древесные растения теряют свои листья осенью, вечнозеленые и тропические растения — в течение всего года. Опадение листьев в определенных климатических условиях (наступление засухи или физиологической сухости в результате понижения температуры, см. 6.3.3) может быть необходимым, чтобы предотвратить слишком большие потери воды. Кроме того, все листья при длительной транспирации накапливают со временем балластные ионы (например, Са2+ который также уже не может транспортироваться по флоэме обратно, см. табл. 6.10), так что со временем они становятся неработоспособными; поэтому сброс листьев равноценен удалению шлаков.
Опадение листьев (то же справедливо для опадения цветков и плодов) происходит путем образования отделительной ткани у основания черешка листа (рис. 7.61). Она состоит из мелких паренхимных клеток с небольшими межклетниками. Эта ткань, закладывающаяся уже на ранних стадиях развития органов, полностью дифференцируется только в подходящих условиях. Собственно, отделение — процесс активный, требующий синтеза специальных ферментов, в первую очередь целлюлаз и полигалактуроназ. Отделение протекает в зависимости от вида растения либо через растворение срединных пластинок (полигалактуроназами), срединных пластинок и первичной стенки (полигалактуроназами и целлюлазами), либо всей клетки.
Рис. 7.61. Продольный срез через базальную часть листового черешка двудольного растения с развитым, однако еще не дифференцированным отделительным слоем

Дифференцировка отделительного слоя находится под контролем различных фитогормонов, при этом ауксин (ИУК) и этилен играют главную роль. Процесс можно разделить на 3 фазы.
Фаза 1. Пока есть достаточный приток ИУК со стороны листа, клетки отделительного слоя не реагируют на этилен, они нечувствительны. Дифференцировка отделительного слоя подавлена.
Фаза 2. При снижающемся потоке ИУК из листа (например, вследствие начавшегося старения) клетки отделительной ткани становятся чувствительными к этилену.
Фаза 3. Клетки отделительной ткани реагируют на эндогенный этилен образованием целлюлазы, галактуроназы и других гидролитических ферментов. Активность этих ферментов ведет к дифференцировке отделительного слоя (растворение срединных пластинок, клеточных стенок) и далее к опадению листьев. Поэтому преждевременное опадение плодов можно предотвратить, опрыскивая растения растворами ауксина малой концентрации (например, для замедления опадения зрелых плодов цитрусовых)1.
1 У многих цитрусовых плоды опадают не одновременно. Часть из них может опадать даже на второй год после опыления. Опадение плода, таким образом, не обязательно происходит в первый год его развития. Этим пользуются для «длительного хранения спелых плодов на дереве» («Lagemny am Baum»), чтобы без спешки собрать урожай не поврежденных в результате падения цитрусов. — Примеч. ред.
Однако обработка растений высокими дозами ауксина индуцирует биосинтез этилена, что приводит к противоположному эффекту. Так, «Agent Orange» использовали во время войны во Вьетнаме как средство для удаления листьев2. Одна из составных частей «Agent Orange» — синтетический ауксин 2,4,5-трихлор- феноксиуксусная кислота (2,4,5-Т), родственник 2,4-D (см. рис. 7.32).
2 «Agent Orange» — печально известный пример «экологической войны», которую вела армия США против партизан. Опадение листьев помогало отслеживать перемещение вооруженных сил Вьетнама в тропическом лесу. «Agent Orange» оказался мутагеном, его применение уничтожило тысячи гектаров растительного покрова. Пострадали животные и люди. — Примеч. ред.
Из-за многообразия важных для сельского хозяйства процессов, которые регулируются этиленом, распространены коммерческие пре-
параты веществ, разлагающихся с выделением этилена (например, этефон) или его антагонистов (например, Ag+). Этиленом стимулируют процесс течения латекса у Hevea brasiliens, главного поставщика натурального каучука, спрос на который, как и прежде, превышает предложение. Благодаря обработке этефоном в местах среза урожай выступающего из разрезанных молочных трубок латекса можно повысить в три раза по сравнению с необработанными деревьями.
7.6.5.3. Молекулярные механизмы действия этилена
Знания о путях рецепции и передачи сигнала от этилена в последние годы сильно расширились. Основу для этого создали мутанты томатов и Arabidopsis thaliana с нарушениями в сигнальном пути. Благодаря характерным фенотипическим признакам такие мутанты легко обнаружить (рис. 7.62). Речь идет, с одной стороны, об этилен- устойчивых etr- или соответственно ers- мутантах (нем. ethylenresistent), с другой стороны — о мутантах с конститутивным тройным ответом (англ, constitutive triple response — сtг-мутанты).
Рис. 7.62. Фенотипы проростков Агаbidopsis thaliana в возрасте примерно 3 дней после выращивания в темноте в определенных условиях. В противоположность дикому типу еtг1 -мутант не демонстрирует тройной ответ при добавлении экзогенного этилена; напротив, сtr 1 -мутант даже в отсутствие экзогенного этилена уже проявляет тройной ответ. Сокращения см. на рис. 7.63
Этилен связывается с гомодимерными (т.е. состоящими из двух одинаковых субъединиц) рецепторами, которые обладают большим сходством с бактериальными двухкомпонентными рецепторными киназами и локализованы в плазматической мембране. У Arabidopsis thaliana до сих пор известно по крайней мере пять рецепторов этилена, которые иногда встречаются в различных тканях; в других случаях они еше неизвестным способом взаимодействуют, находясь в одной и той же клетке. Этилен связывается с Сu+-ионами, которые являются составной частью рецепторов. Места связывания локализованы в трансмембранных сегментах вблизи N-конца рецепторного белка.
В отсутствие этилена рецепторы подавляют сигнальный путь этилена, активируя кодируемую СTR1-геном протеинкиназу, которая является отрицательным регулятором этого сигнального пути. Если этилен связывается с рецепторами, то рецепторы перестают взаимодействовать с CTR1- протеинкиназой и киназа инактивируется. Следовательно, вызванное CTR1-киназой ингибирование сигнального пути этилена прерывается этиленом и, таким образом, активируется сигнальный путь. Это поясняет, почему Ctr1 -мутанты, которые имеют мутации в гене СTR1, демонстрируют конститутивный тройной ответ: в отсутствие этилена у них постоянно активирован сигнальный путь этилена.1
1 Кроме описанного «ингибиторного» пути в последнее время обнаружены компоненты «активаторного» пути, идущего от рецепторов, связанных с этиленом, к другим участникам (возможно, МАР-киназам). — Примеч. ред.
Установлены некоторые из участников дальнейшей передачи сигнала. CTR1-киназа действует — возможно, через другие промежуточные киназы (усиление сигнала?) — на мембранный белок с еще неизвестной функцией и локализацией, ЕIN2-протеин2 (еin-мутанты этилен-нечувствительны, англ. ethylen insensitive). Его С-концевой домен (рис. 7.63) активирует транскрипционный фактор EIN3, который, со своей стороны, индуцирует экспрессию транскрипционного фактора ERF1 (ERF, англ. ethylene response factor). ERF1 связывается непосредственно с промоторным элементом (GCC-боксом) регулируемых этиленом генов и активирует, таким образом, совместно с общими транскрипционными факторами (см. 7.2.2.2) транскрипцию этих генов.
2 Предполагают его локализацию на ядерной мембране. — Примеч. ред.
Рис. 7.63. Сигнальный путь этилена. Рецепторы этилена (например, ETR1, ERS1) являются гомодимерами, родственными бактериальным двухкомпонентным рецепторным киназам. Этилен связывается с Сu+-ионами в трансмембранной области рецептора и прерывает тем самым взаимодействие рецептора с CTR1 - киназой. В этом участвуют два домена рецептора: гистидинкиназный домен (Н) и аспартил- фосфатный домен (D), который, однако, отсутствует у некоторых рецепторов, например, ERS1. При прерывании взаимодействия с рецепторами этилена CTR1 -киназа, которая в активном состоянии (в отсутствие этилена) ингибирует следующий этап сигнального пути этилена, инактивирована. В отсутствие вызванного CTR1 ингибирования сигнальный путь этилена активируется: EIN2-белок (способ действия которого еще неизвестен) активирует транскрипционный фактор EIN3, который в свою очередь индуцирует транскрипцию гена транскрипционного фактора ERF1. Этот фактор образуется в цитоплазме, транспортируется в клеточное ядро и связывается там с этиленспецифичными цис-элементами (ERE — от англ. ethylene response element) в промоторах регулируемых этиленом генов и активирует таким образом их транскрипцию. ERF — от англ, ethylene response factor; остальные белки носят названия, которые происходят от фенотипов мутантов (ср. текст, см. рис. 7.62): etr (англ. ethylene resistant); ein (англ. ethyleneinsensitive), ctr (англ. constitutive triple response)
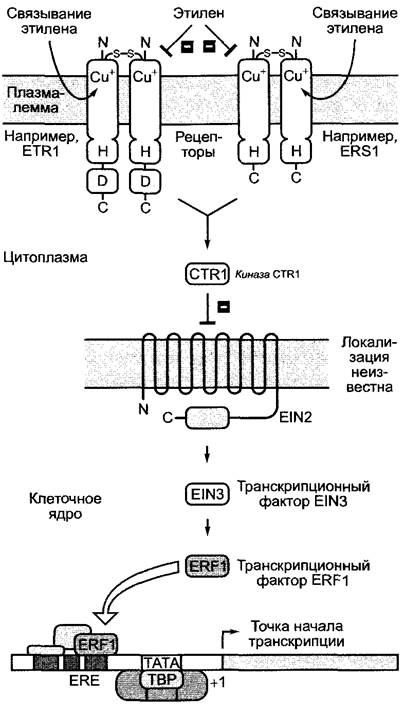
7.6.6. Другие сигнальные вещества с фитогормонподобным действием
Сравнительно недавно1 в растениях были обнаружены многочисленные другие физиологически высокоактивные вещества, научное исследование которых очень интенсивно ускоряется. Иногда они широко распространены в растениях, и их часто относят сегодня к фитогормонам (брассиностероиды — см. 7.6.6.1, оксилипины — см. 7.6.6.2), другая их часть обладает ограниченным распространением и регулирует специальные физиологические функции (примеры этого даны в гл. 9).
1 В 1970— 1980-х гг., т.е. более 20 лет назад. Для сравнения: 1900-е гг. — этилен, 1930-е гг. — ауксин, 1950-е гг. — гиббереллин и цитокинин, 1960-е гг. — абсцизовая кислота. — Примеч. ред.
Эти тритерпены впервые были выделены из пыльцы видов Brassica (от латинского названия объекта происходит термин брассиностероиды). Биосинтез идет через сквален (см. рис. 6.122), из которого образуется фитостероид циклоартенол (рис. 7.64). Мутанты Arabidopsis thaliana с нарушенными определенными этапами биосинтеза брассиностероидов (например, dwf1, cbb1 сbbЗ, англ. dwarf, карлик; cabbage, капуста) имеют крайне низкий рост и похожи по внешнему виду на крошечные растения капусты. Их можно сделать нормальными путем добавления самых малых количеств брассиностероидов, и они вырастают до цветущих и плодоносящих растений (рис. 7.65). Однако нечувствительные к брассиностероидам мутанты (dwf1, cbb2), которые имеют фенотип, схожий с брассиностероидцефицитными мутантами, не восстанавливают нормальный рост при добавлении брассиностеро- идов. Места биосинтеза брассиностероидов до сих пор неизвестны, о транспорте соединений от места синтеза до места действия ничего неизвестно. В случае брасси- ностероидов речь могла бы идти скорее о локально действующих регуляторах роста, чем о фитогормонах в более узком смысле. Рецептор брассиностероидов — это локализованная в плазмалемме растительных клеток протеинкиназа из группы автофос- форилирующихся серин/треонинкиназ. Следовательно, связывание брассиностероидов с рецептором могло бы влиять на состояние активности клетки через каскад фосфорилирования белков. Подробности пока неизвестны.
Рис. 7.64. Образование брассинолида из циклоартенола. Мутанты (dwf1, cbb1, cbb3) Arabidopsis thahana с нарушенным биосинтезом брассиностероидов демонстрируют сильные нарушения в развитии (dwf — англ. dwarf— карлик; cbb — англ. cabbage — капуста)

Рис. 7.65. Мутанты Arabidopsis thaliana с нарушенным биосинтезом брассиностероидов (сbbЗ). В сравнении с диким типом демонстрируют крайне карликовый рост. Их можно нормализовать путем добавления брассиностероидов

В настоящее время убедительно показано, что растения, как и животные, обладают сигнальными веществами, биосинтез которых берет начало от окисленных жирных кислот и которые поэтому все вместе называются оксилипинами. У животных речь идет об образованных из арахидоновой кислоты эйкозаноидах (например, простагландины), у растений, в первую очередь, — о получаемых из α-линолено- вой кислоты октадеканоидах. Среди них наиболее важную группу составляют жасминовая кислота и ее производные жасмонаты.1Метилжасмонат, метиловый эфир жасминовой кислоты, был идентифицирован в 1962 г. как главный компонент аромата жасмина.
1 В переводе используется русская традиция тривиальных названий жасминовая кислота, но: жасмонат (сравните: яблочная кислота — малат, лимонная кислота — цитрат и т.д.). В некоторых изданиях пишут «жасмоновая кислота», что, на наш взгляд, неправильно. — Примеч. ред.
Рис. 7.66. Биосинтез жасминовой кислоты и его регуляция у Агаbidopsis thalina (серые стрелки — факторы, индуцирующие транскрипцию соответствующих генов)
Жасминовая кислота у прокариот до сих пор не найдена, но она встречается у некоторых грибов (например, Lasiodiplodia theobromae), мхов и папоротников, а также у всех высших растений. Биосинтез начинается в пластидах с окисления α-линоленовой кислоты, которая высвобождается из мембранных липидов, и образования первого циклического метаболита, 12- оксофитодиеновой кислоты. В результате восстановления циклопентенонового кольца и укорочения боковой цепи после трех циклов β-окисления из 12-оксофитодиено- вой кислоты в глиоксисомах или соответственно пероксисомах образуется жасминовая кислота (рис. 7.66).
Жасминовая кислота усиленно образуется после повреждения (например, в результате поедания животным) и часто после поражения патогенами и участвует в индукции защитных реакций растения против патогенов (см. 9.3) и травоядных (см. 9.4) . Добавленная извне жасминовая кислота действует как ингибитор роста и стимулирует старение листа. Предшественник жасминовой кислоты в биосинтезе 12-оксофитодиеновая кислота вместе с этиленом и индолил-3-уксусной кислотой участвуют в контроле ростовых реакций растения после механического воздействия (см. 8.3.2.4)