БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
8. ФИЗИОЛОГИЯ ДВИЖЕНИЙ
8.2. Свободные перемещения
Встречаются такие способы перемещения, посредством которых некоторые проростки или корневища медленно передвигаются в субстрате, причем они нарастают передним концом, а на заднем отмирают (например, проростки Cuscuta, см. 4.2.6, рис. 4.38). Но свободные перемещения (локомоции) мы находим прежде всего у низших растений (например, жгутиковых, вольвоксовых, диатомовых, миксомицетов) и бактерий, у особых клеточных стадий, например, у зооспор многих водорослей и грибов, и у свободно перемещающихся мужских гамет, которые встречаются у папоротников и определенных голосеменных (Cycas, Ginkgo, см. 11.2).
Локомоции осуществляются при помощи различных механических принципов:
✵ амебоидное движение (ползание по субстрату или сквозь него; стадии амебы и плазмодия у миксомицетов);
✵ упругое движение (движение с упором) вследствие одностороннего выделения слизи: набухающая в водной среде слизь толкает клетку вперед по субстрату (Desmidiaceae);
✵ скольжение по субстрату (посредством перетекающей плазмы в области шва у пеннатных диатомовых: принцип гусеничной цепи);
✵ ползание многих цианобактерий по выделенной слизи при участии микрофибрилл;
✵ плавание при помощи ресничек или жгутиков.
Лишь для плавательного движения при помощи ресничек или жгутиков известно детали механики движения. Строение ресничек и жгутиков, имеющихся у эукариот, принципиально одинаково (см. 2.2.2.3; рис. 2.16; 2.17). О жгутиках говорят, когда они присутствуют в клетке в единичном или небольшом количестве и относитель-
но величины клетки достигают значительной длины, а о ресничках — когда они многочисленны и имеют малую длину. Бактериальные жгутики представляют собой особые образования. Они устроены совершенно иначе (см. 2.3.2; рис. 2.96) и функционируют по совершенно иному механическому принципу, чем реснички и соответственно жгутики эукариот (рис. 8.1).
Рис. 8.1. Механика движения жгутиков и ресничек: А — пропеллерное движение прокариотического жгутика, который вращается на своем основании в теле клетки, приводимый в движение силой протонного градиента (см. 6.1.4.3). При вращении ротора ионы Н+ поступают в клетку. Переносящие Н+АТФазы, расходуй АТФ, вновь «выкачивают» ионы Н+ из клетки для поддержания протон-движущей силы; В — гребной удар при движении жгутика Monas sp. (Chrysomona- dales, см. 11.2); I — «подготовка» жгутика; II — активный удар. Арабские цифры показывают последовательность отдельных фаз удара, стрелки — направление движения. Тело клетки изображено не в масштабе
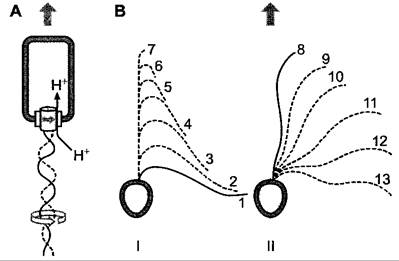
Бактериальные жгутики (структура — см. рис. 2.97) вращаются в клеточной мембране, приводимые в движение энергией трансмембранного протонного градиента (см. 6.1.4.3; исключение Vibrio alginolyticas: Nа+-градиент), наподобие пропеллеров с роторными двигателями. Принцип такого роторного мотора уже был описан при рассмотрении действия АТФ-синтазы хлоропластов и митохондрий (см. рис. 6.63), но жгутиковый мотор устроен по-другому и имеет более сложную структуру. Приводимые в движение Н+-градиентом жгутиковые моторы вращаются с частотой в несколько сотен герц и позволяют достигнуть скорости поступательного движения клеток до 20 мкм • с-1; моторы, приводимые в движение Na+-градиентом, вращаются еще быстрее (в случае Vibrio — более 1 000 Гц, обеспечивая скорость поступательного движения клеток до 200 мкм - с-1). Характерной особенностью жгутикового движения прокариот является чередование фаз пробега и кувыркания. Во время фазы пробега жгутик (или соответственно при наличии нескольких жгутиков их пучок посредством синхронных движений отдельных жгутиков) вращается таким образом, что клетка продвигается сквозь среду. Во время последующей фазы кувыркания жгутики претерпевают кратковременное обращение (реверсию) направления своего движения. Благодаря незначительной инерции клетки наряду с высокой вязкостью среды движение сразу же прекращается, при этом клетка приобретает случайную новую ориентацию в среде и во время следующей фазы пробега движется дальше в этом новом направлении. Типичные промежутки времени лежат в интервалах 1 — 0,1 с. Во время фазы пробега Escherichia coli, например, плывет, используя 4 — 8 жгутиков, встроенных в разных местах, и достигает скорости около 20 мкм • с-1. Раздражители внешней среды влияют на частоту смены пробег/кувыркание, изменяя ее, и таким образом переводят локомоцию в таксис (см. 8.2.1). Для обеспечения поступательного движения с помощью жгутиков клетка нуждается лишь в ограниченных затратах энергии: например, Spirillum потребляет около 0,1 % энергии метаболизма.
В противоположность пропеллерной механике жгутикового движения прокариот жгутик эукариот действует подобно веслу. В простейшем случае один жгутик, ориентированный вперед, в направлении плавания (тягловый жгутик), производит гребные движения в одной плоскости (например, у Euglena, см. рис. 8.6). Если жгутиков несколько (например, два у Chlamydomonas reinhardtii), то их движения должны быть согласованы, чтобы движение клетки было координировано (см. рис. 8.7). Pyrrhophyceae, гетероконтные водоросли, т. е. имеющие два жгутика различной длины (см. рис. 11.70, А), плавают, описывая спираль с широкими оборотами при одновременном вращении тела клетки. У снабженных ресничками эукариот (например, Volvox, сперматозоиды папоротников) реснички, как правило, совершают гребные движения координированно. Встречаются и такие жгутики, которые будучи прикреплены на заднем полюсе клеток, толкают ее сквозь среду. Жгутиковый двигатель очень эффективен. Зооспоры слизевика Fuligo varians достигают скорости до 1 мм • с-1, причем пройденный за секунду отрезок пути стократно превышает длину клетки (около 10 мкм).
Гребное движение ресничек и жгутиков осуществляется в результате опосредованного динеином смещения относительно друг друга периферических дуплетов микротрубочек аксонемного комплекса (см. 2.2.2.3, рис. 2.17; функция динеина — см. рис. 6.6). Поскольку аксонемный комплекс закреплен в базальном теле, жгутик при этом изгибается. Скольжение микротрубочек может включать в определенном порядке также изменяющуюся последовательность двух или более периферических дуплетов по всей длине или отрезков, так что имеют место различные типы движения. Энергию для биения жгутиков поставляет АТФ, которая гидролизуется вследствие конформационного изменения динеина. Аксонемный комплекс реагирует на добавление АТФ, даже будучи изолированным из реснички (например, вследствие разрушения жгутиковой мембраны детергентом и вымывания цитоплазмы). Конечно, жгутиковая мембрана регулирует концентрацию ионов Са2+ внутри жгутика, которая в большой степени ответственна за управление движением. Так, у Chlamydomonas при внутренней концентрации ионов Са2+ выше 10-5 М жгутик меняет способ биения таким образом, что клетка плывет в обратном направлении. Это переключение с толчков на тягу происходит, например, если клетка наталкивается на препятствие. Механический контакт открывает Са2+-каналы в жгутиковой мембране, так что ионы Са2+ из внешней среды поступают в жгутик.
Если свободное перемещение (локомоция) вызывается раздражителем, то употребляют термин таксис. Когда движение происходит в сторону источника раздражения, то имеет место положительный таксис, если оно направлено от этого источника, то таксис считают отрицательным. Целенаправленное движение к источнику раздражения или от него называют топотаксисом. Если свободно передвигающийся организм находит оптимальную область в поле раздражения, но лишь за счет того, что предпочтительным оказывается выбор «правильного» направления в противоположность «ложному», а обратное поведение затруднено, то говорят о фоботаксисе, или реакции испуга. Такие реакции наблюдаются, например, при движении с помощью жгутиков вследствие зависимых от раздражения изменений частоты биений (см. 8.2.1.1, рис. 8.3). В настоящее время для фоботаксиса применяют также термин кинез, а собственно таксисом именуют лишь топотаксис. В случае фоботаксиса (кинеза) клеткой, движущейся в поле раздражения, воспринимаются временные различия интенсивности раздражения, в то время как организмы, способные к топотаксису, реагируют на локальные различия интенсивности раздражения, например, между передним и задним концами клетки.
И наконец, таксисы различают по виду вызывающего их раздражителя (например, хемотаксис, фототаксис). Часто одна и та же клетка воспринимает различные раздражители, например, свет и химический раздражитель.
Хемотаксис дает возможность свободно передвигающимся бактериям и грибам находить источники питания или хозяев и избегать участков с вредными веществами, а также позволяет гаметам осуществлять целенаправленный поиск половых партнеров (табл. 8.1). В первом случае вызывать хемотаксис способны многие вещества. У бактерий были обнаружены более 30 различных хемосенсоров: две трети из них предназначены для привлекающих веществ, одна треть — для отпугивающих. В случае гамонов (привлекающих гаметы веществ) растворимые вещества действуют преимущественно высокоспецифично, так что гаметы даже в присутствии близкородственных видов в том же местообитании способны очень точно находить половых партнеров, принадлежащих к тому же виду.
Таблица 8.1. Примеры важных для хемотаксиса соединений у про- и эукариот
Организм (тип клеток) |
Хемотактики |
Принцип передвижения |
Тип реакции |
Бактерии |
Уксусная кислота |
Жгутики бактерий |
Отрицательный фоботаксис |
О2, многие сахара (например, галактоза), азотсодержащие соединения, фосфат, ионы щелочных и щелочноземельных металлов |
То же |
Положительный фоботаксис |
|
Грибы: |
|||
Миксомицеты (зооспоры) |
Малат |
Жгутики |
То же |
Dictyostelium (миксамёбы в фазу кормежки) |
Фолиевая кислота |
Амебоидный |
Положительный топотаксис |
Dictyostelium (голодающие миксамёбы) |
цАМФ |
То же |
То же |
Allomyces (гаметы) |
Сиренин1 |
Жгутики |
Положительный фоботаксис |
Водоросли (гаметы): |
|||
Chlamydomonas reinhardtii |
Гликопротеиды1 |
То же |
Положительный топотаксис |
Ch. allensworthii |
Лурленовая кислота1 |
—»— |
То же |
бурые водоросли |
Среди прочего углеводороды1 |
—»— |
|
Листостебельные мхи (гаметы) |
Среди прочего сахароза2 |
—»— |
—»— |
Папоротники (гаметы) |
Са-малат2 |
—»— |
—»— |
Lycopodium (гаметы) |
Цитрат2 |
—»— |
—»— |
1 Половые аттрактанты (гамоны), которые образуются женскими гаметами, часто плохо двигающимися или неподвижными, и привлекают мужские гаметы.
2 Половые аттрактанты архегониев; неясно, какие ткани или клетки в архегонии образуют аттрактанты.
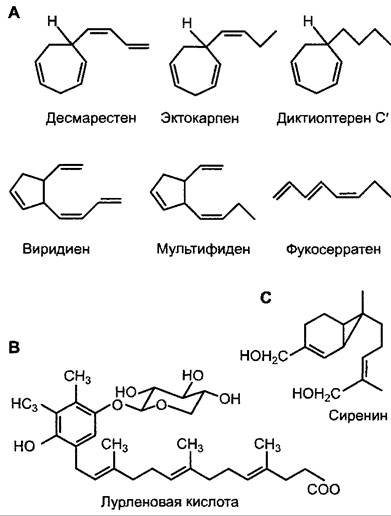
Особенно хорошо изучены гамоны водорослей, прежде всего бурых водорослей (рис. 8.2). Эти ненасыщенные углеводороды часто действуют уже в концентрациях порядка 10-11 • моль • л-1 и синтезируются из полиненасышенных жирных кислот. Некоторые из них также синхронизируют высвобождение гамет. Большинство гамет бу
рых водорослей выделяют широкий спектр этих углеводородов, но лишь один из них является видоспецифичным гамоном вследствие высокой стереоспецифичности. Остальные могут быть приманкой для сперматозоидов других видов, которые, хотя и не способны осуществлять оплодотворение чужих гамет, но таким образом теряют способность к оплодотворению своих собственных гамет. Под действием привлекающих веществ у гетероконтных (имеющих жгутики разной длины и формы) мужских гамет ускоряется биение жгутиков, и в конечном счете они закрепляются своими более длинными жгутиками на женских гаметах.
Рис. 8.2. Примеры гамонов: А — из бурых водорослей; В — из одноклеточной зеленой водоросли Сhlamydomonas allensworthii; С — из живущего в воде гриба Аllomyces(Вlastocladiales). Гамоны бурых водорослей образуются из полиненасыщенных жирных кислот (см. 6.11.1). Сиренин представляет собой сесквитерпен (см. 6.16.2). Лурленовая кислота предположительно происходит из пластохинона хлоропласта (рис. 6.56); сахар является β-D- ксилозой
В последнее время исследуются отрицательный хемотаксис бактерий и положительный хемотаксис амебоидных стадий миксомицета Dictyostelium discoideum.
Перемещение бактерий является следствием фазы «плавания», длящейся около 1 с, и фазы «кувыркания», длящейся около 0,1 с (см. 8.2 1) в гомогенной среде. Если имеется концентрационный градиент для хемотаксично деятельного вещества, то изменяется частота «плавания» / «кувыркания» (рис. 8.3): в направлении возрастания концентрации аттрактанта (привлекающего вещества) возрастает длительность «плавания», поскольку частота «кувыркания» снижается; при наличии же репеллента (отпугивающего вещества) происходят противополож ные явления Таким образом, по градиенту привлекающего вещества со временем большинство клеток собираются в месте максимальной концентрации, а в случае отпугивающего вещества — в месте минимальной концентрации Положительно аэротаксическое поведение многих бактерий (плавание в направлении источника кислорода) является основанием для доказательства фотосинтетического образования O2 в опытах Энгельманна с бактериями (рис 8.4) Молекулярные механизмы действия и управления жгутиковым мотором описаны в руководствах по микробиологии.
Рис. 8.3. Схематическое изображение процесса положительного хемофоботаксиса бактерии и для сравнения — положительного хемотопотаксиса в градиенте концентрации хемотакси- чески активного вещества (эффектора). Более подробно см. в тексте
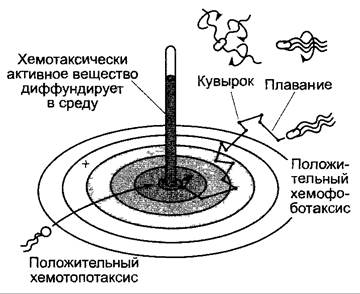
Рис. 8.4. Клетки Spirogyra со скоплением положительных аэротаксических бактерий (выделены черными штрихами) в участке освещения лентовидного хлоропласта (фотосинтетического выделения O2). Освещение промежутка между хлоропластами не ведет к образованию O2, поэтому бактерии в этом участке не собираются

Миксомицет Dictyostelium discoideum при достаточном снабжении питательными веществами существует как одноклеточный организм с амебоидным способом передвижения При дефиците питательных веществ голодающие миксамебы образуют циклический аденозин- 3',5'-монофосфат (цАМФ, рис 8 5) и выделяют его в среду Вещество — аттрактант — воспринимается окружающими его цАМФ восприимчивыми миксамебами и индуцирует их положительный хемотаксис, так что устремляющиеся к нему из окружения амебы образуют центр агрегации, в котором (частично также в зависимости от цАМФ) протекают процессы дифференцировки (жизненный цикл Dictyostelium, см 112, рис 5 3) Образование и выделение цАМФ клеткой и способность ее к раздражению этим веществом циклично чередуются с повторяющимися максимумами и минимумами (длительность фазы приблизительно 6 — 10 мин) Вследствие этого возникает ритмический топотаксис, что можно легко наблюдать в опытах с миксамебами, например в чашках Петри (см рис 8.5) Рецептор цАМФ локализован в клеточной мембране, и его молекулярная структура известна Он имеет сходство с бак- териородопсином — приводимой в движение светом протонной помпой архебактерий (см рис 6 66), с родопсином чувствительных глазков зеленых водорослей, который служит рецептором фототаксиса (см 8 2 1 2), со зрительным пигментом позвоночных животных, родопсином и другими рецепторами клеточной мембраны позвоночных, например со многими рецепторами гормонов, а также с рецепторами обонятельных и воспринимающих вкус клеток Общей чертой этих мембранных рецепторов являются 7 α-спиралей, пронизывающих мембрану, а также сигнальная последовательность, характерная для гетеротримерных G-белков (G означает ГТФ-связывание, см учебники по клеточной биологии) Это позволяет предположить, что хеморецепторы и зрительные пигменты позвоночных произошли из хеморецепторов и рецепторов фототаксиса галобактерий и низших эукариот (см 7 5).
Рис. 8.5. Хемотаксис у Dictyostelium discoideum в фазе агрегации: А — ритмическое изменение образования и выделения цАМФ и восприимчивости клетки к цАМФ (соответственно синхронизированной популяции клеток). На субстрате отражается поведение одиночной клетки (соответственно синхронизированной популяции клеток) в волнообразном движении к центру аттрагирования, к месту, из которого впервые произошло выделение цАМФ (на фотографии виден ряд центров аттрагирования); В — образование цАМФ из АТФ внутри клетки и распад с участием фосфодиэстеразы в среде

Направленное к свету свободное перемещение (фототаксис) наблюдается прежде всего у фотосинтетически активных организмов, которые таким образом подбирают оптимальную для себя интенсивность света. Однако фототаксис встречается и у незеленых жгутиковых, а также у плазмодиев миксомицетов (см 112), которые реагируют сначала отрицательно, но после индукции образования спорангиев все же проявляют положительный фототаксис. И при фототаксисе имеют место фобические и топические реакции. В случае фобической реакции можно различить движения испуга как реакции на внезапное уменьшение (англ step down response) и внезапное увеличение (англ step up response) интенсивности света.
Положительный фотофоботаксис у пурпурной бактерии Chromatium осуществляется посредством того, что движение жгутиков на короткое время останавливается, если интенсивность света внезапно падает. Поскольку тело бактерии практически не обладает инерцией, то мгновенно наступает состояние покоя, однако при возобновлении движения, как правило, меняется его направление. Повышение интенсивности света, напротив, не оказывает влияния на направление движения. В противоположность этому у Rhodospirillum при уменьшении интенсивности света изменяется направление вращения жгутика, следствием чего является поворот в обратную сторону. Если один источник света сильнее другого, то он может быть более привлекательным для Rhodospirillum, когда яркость первого источника превышает яркость второго лишь в 1,01 — 1,03 раза, т. е. чувствительность к различию очень высока. В обоих случаях, как у Chromatium, так и у Rhodospirillum, бактерии в конечном счете собираются в освещенной области, которую они просто не могут покинуть («световая ловушка»).
Спектр действия фотофоботаксиса пурпурных бактерий идентичен спектру действия фотосинтеза. Определяющим для фобической реакции представляется внезапное изменение фотосинтетического транспорта электронов. Это безусловно является решающим для фотофоботаксической реакции ползающих цианобактерий (обращение направления движения при уменьшении интенсивности света), для которых анализ показал, что редокс-состояние пластохинона служит решающей регулирующей величиной для фобической реакции. Отрицательный фототаксис пурпурной серобактерии Ectothiorhodospira halophila индуцируется синим светом. Фоторецептор Рур (англ. photoactive yellow protein) является хромопротеидом с массой 14кДа, у которого светопоглощающая группа представлена остатком пара-кумаровой кислоты, связанным тиоэфирной связью с единственным цистеином белка (коричные кислоты, рис. 6.115); в темноте пара-кумаровая кислота присутствует в форме фенолатного аниона. Поглощение света приводит к выцветанию хромопротеида, поскольку фенолатный анион при протонировании переходит в незаряженную фенольную форму, которая поглощает в ультрафиолете.
У Halobacterium реакции step-down и step- up определяются различными рецепторами: первая реакция — бактериородопсином в пурпурной мембране, которая одновременно служит преобразователем энергии (см. рис. 6.66) и сигнала, вторая реакция обусловлена ретинилиден-протеином, предположительно предшественником при биосинтезе бактериородопсина.
У ползающих организмов, например, цианобактерий (Phormidium) или диатомовых (Navícula), имеется особый вид фототаксиса: эти организмы выбирают из двух возможных направлений то, которое ведет к источнику света; они способны к этому, поскольку могут воспринимать различие освещенности на передней и задней сторонах клетки. У Navícula, например, через определенные промежутки времени происходит автономное обращение выбранного направления движения. Однако если передний конец освещен сильнее заднего, смена направления движения происходит реже, чем в случае, когда на заднем конце интенсивность света выше.
Одноклеточные водоросли со жгутиками проявляют наряду с отрицательными, фотофобными, реакциями при высоких интенсивностях света, как правило, также положительные, фототопные, при более низких интенсивностях света. Спектр действия фототаксиса четко отличается от спектра действия фотосинтеза. Максимум восприимчивости этой реакции лежит в области от зеленого до сине-зеленого света. Это может быть приспособлением к жизни в воде, так как по мере увеличения глубины спектр все более сужается до сине- зеленой области (см. рис. 6.43) и, кроме того, в этой части спектра наименее вероятно затенение другими фотосинтетически активными организмами. Направленное плавание к источнику света при положительном и направленное плавание от источника света при отрицательном фототаксисе являются предпосылками того, что организм получает способность воспринимать как временные изменения интенсивности света, так и направление, откуда свет исходит.
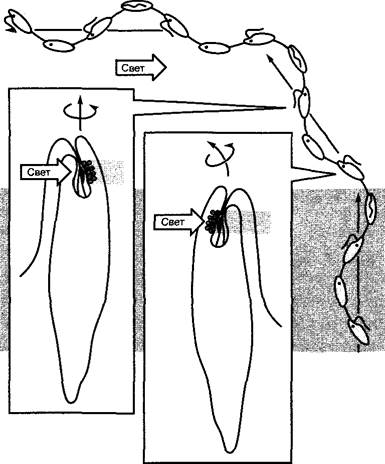
Чувствительность к направлению частично достигается благодаря наличию высокоспециализированных органелл — «глазков». Они состоят из стигмы, несущей светопоглощающие пигменты, и из собственно фоторецепторного региона. Все части «глазка» расположены по отношению друг к другу и к жгутикам характерным образом. Особенно хорошо изучены два модельных организма: Сhlamydomonas (имеет «глазки», типичные для всех локомоторно активных зеленых водорослей) и Еuglena («глазки», типичные для Еuglenophyсеае). У них осуществляются различные принципы движения. Общим является то, что клетки в процессе плавания перемещаются вперед, вращаясь вокруг своей продольной оси, и при этом описывают спираль; таким образом, продольная ось клетки выполняет волчковое движение (тирания) вокруг оси поступательного движения. Фоторецепторные органеллы, по меньшей мере стигма, лежат на периферии клетки, и поэтому при свете, падающем косо по отношению к направлению поступательного движения, положение стигмы в фоторецепторном участке периодически меняется относительно направления падения света.
У Еuglena «глазок» состоит из рыхлого скопления липидных капель в цитоплазме, которые содержат прежде всего каротиноид астаксантин, встречающийся и в царстве животных. Фоторецептор локализован в парафлагеллярном теле жгутикового кармана (см. 2.2.2.3; рис. 1). Хотя его природа еще не окончательно изучена, спектр действия показывает, что хромофорная группа содержит флавин (о получении спектров действия см. 7.7.2.4). Из-за сильного перекрывания спектров поглощения каротиноидов и флавинов при боковом падении света парафлагеллярное тело периодически кратковременно затеняется стигмой (рис. 8.6). Это приводит (вероятно, при участии ионов Са2+) к кратковременному изменению биений жгутиков и таким образом к коррекции курса до тех пор, пока клетка не подплывет к источнику света и стигма не перестанет затенять парафлагеллярное тело (см. рис. 8.6).
Рис. 8.6. Положительный фототаксис у Euglena (по W. Haupt). Вследствие вращения вокруг продольной оси фоторецептор у основания жгутика (парафлагеллярное тело) периодически затеняется стигмой, как показано на рисунке справа, поэтому клетка поворачивается в направлении стигмы (т.е. к источнику света, на рисунке — слева). В последнее время рассматривается также ориентация фоторецепторов относительно плоскости поляризации света как причина их активации, зависящей от угла падения света
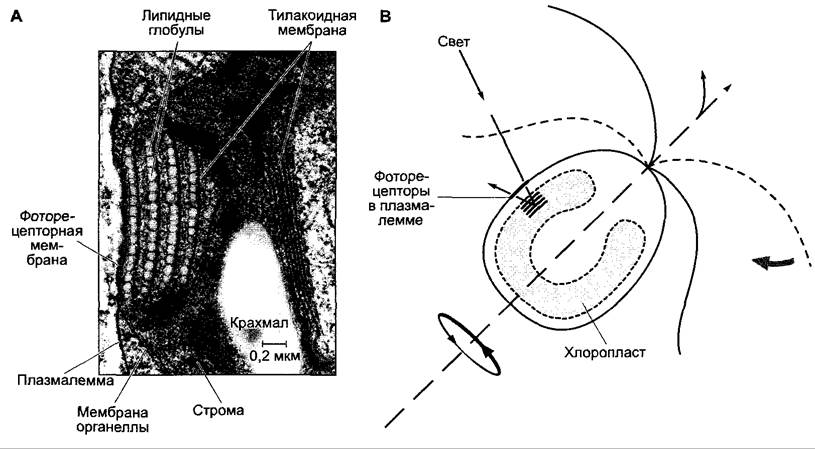
У Chlamydomonas (и, вероятно, вообще у жгутиковых Сhlorophyсеае) «глазок» в хлоропласте, локализованный вблизи клеточной поверхности, состоит из нескольких (до 8) слоев (у Сhlamydomonas reinhardtii их 4) липидных глобул, ориентированных параллельно поверхности клетки, обогащенных каротиноидами. Глобулы имеют однородную величину; они расположены на тилакоидных мембранах и удерживаются промежуточными слоями без липидных капель на строго определенных расстояниях (рис. 8.7). Фоторецепторы расположены в плазмалемме над «глазком».
Рис. 8.7. Положительный фототаксис у Chlamydomonas (А — оригинал L.A.Staehelin, с любезного разрешения L.A.Staehelin; В — по К.W.Foster, R.D.Smyth, с дополнениями): А — электронно-микроскопическая фотография среза через стигму показана в таком же расположении, как и в изображаемой клетке (левая сторона обращена наружу). Липидные глобулы контактируют с тилакоидом, в промежутках находится строма. Стигма действует как рефлектор (В) и усиливает интенсивность света в участке расположения фоторецепторов, локализованных в цитоплазме. Периодическая активация фоторецепторов при одностороннем освещении происходит вследствие вращения клетки во время плавания и приводит к кратковременному изменению движений жгутика, соседствующего со стигмой. Вследствие этого клетка поворачивается в направлении источника света
Изучение природы фоторецептора методами молекулярной биологии принесло удивительный результат: им оказался родственный зрительному пигменту животных родопсинухромопротеид. Его хромофорная группа представлена изомером ретиналя, имеющегося у животных (рис. 8.8), который, вероятно, как и ретиналь, образуется из каротина и особенно интенсивно поглощает свет на участке спектра от сине- зеленого до зеленого. Хотя апопротеины сенсорного родопсина зеленых водорослей (хламидопсина, названного по Сhlamydomonas) и родопсина животных различаются тем, что белки-родопсины зеленых водорослей на обоих концах (С и N) короче, чем родопсин животных, но в соответствующих участках они обнаруживают явную гомологию (см. 8.2.1.1). В то время как «глазки» эвгленовых служат для затенения, лежащего внутри фоторецептора, высокоструктурированные «глазки» жгутиковых зеленых водорослей имеют противоположное назначение. Они функционируют как рефлекторы, которые усиливают интенсивность света, падающего сбоку на место фоторецепторов: важную роль, играют явления, интерференции падающего с клеточной поверхности и отраженного света, так что максимальное усиление интерференции падающего перпендикулярно расположению каротиноидных слоев «глазка» и соответственно отраженного света происходит при длинах волн в сине-зеленой и зеленой области. Проходящий через клетку свет, напротив, значительно ослабляется вследствие снятия интерференции на месте сенсорного родопсина. Периодическое возбуждение фоторецепторов приводит (у этих клеток также при участии ионов Са2+) к кратковременному изменению движений жгутиков (у Сhlamydomonas это жгутик, соседствующий с глазком) и в результате — к коррекции курса до тех пор, пока происходит периодическое активирование сенсорного родопсина светом, падающим сбоку и отраженным глазком (см. рис. 8.8). Предполагают, что фоторецептор хламидопсин идентичен Са2+-активируемому каналу, или, иными словами, в случае с сенсорным родопсином мы имеем дело с Са2+-каналом, непосредственно регулируемым светом.
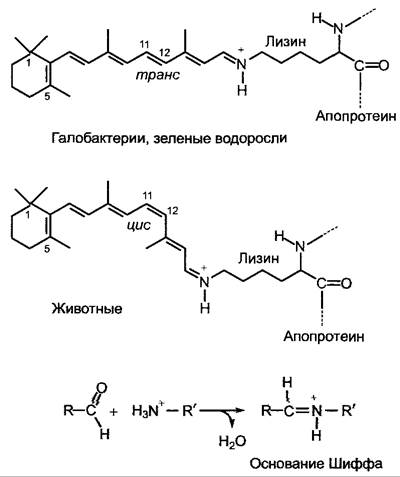
Рис. 8.8. Структура связанного с белком ретиналя, хромофорной группы родопсина, у гало- бактерий, зеленых водорослей и животных в отсутствие света.
Ретиналь в родопсине ковалентно связан с помощью своей альдегидной группы с ε-аминогруппой лизинового остатка апопротеина в форме основания Шиффа (на сером фоне: образование основания Шиффа из альдегида и амина). Ретиналь галобактерий и зеленых водорослей в темноте присутствует в виде все-транс- формы и изомеризуется из 13-трансформы в 13-цис-форму; у животных он присутствует в 11 -цис-форме и изомеризуется при освещении во все-транс-форму. Как следствие должна каждый раз изменяться и конформация апопротеина. Есть мнение, что у Сhlamydomonas активированный сенсорный родопсин (хламидопсин) даже образует Са2+-канал, и поступление Са2+ в клетку приводит к торможению биения жгутика на стороне, обращенной к свету
Помимо химических и световых раздражителей некоторые из свободно передвигающихся организмов реагируют также на изменения влажности (гидротаксис), на раздражения прикосновением (тигмотаксис), на земное тяготение (гравитаксис) или изменения температуры (термотаксис). Плазмодии Dictyostelium способны воспринимать температурные градиенты даже порядка 0,05 °С см-1. Основой для этого чрезвычайно чувствительного «биотермометра» могут быть фазовые переходы (жидкий — кристаллический) мембранных липидов. Если организм воспринимает различные раздражители окружающей среды и реагирует таксисом, клетки должны учитывать все внешние сигналы. Так, у Escherichia coliотрицательный термотаксис, вызванный низкими температурами, компенсируется хемотаксическими веществами или даже сверхкомпенсируется, а положительный термотаксис, индуцированный высокими температурами, напротив, компенсируется отпугивающими веществами.
Примечательной особенностью некоторых бактерий, обитающих в иле пресных или соленых водоемов, является способность ориентироваться в магнитном поле (магнетотаксис). В магнитном поле Земли это приводит к движению вниз, в ил, так как вертикальная составляющая поля, как правило, сильнее горизонтальной. Сенсором магнитного поля служит цепь, насчитывающая до 100 окруженных мембраной кристалликов магнетита (Fe3O4), с длиной края до 50 нм, которая функционирует подобно стрелке компаса (рис. 8.9).
Рис. 8.9. Бактерия Magnetobacterium bavariсиm из озера Химзее, проявляющая магнетотаксис. Палочковидная бактерия с жгутиками (на препарате не видны) содержит до 1 000 упакованных в многочисленные пучки палочковидных магнетосом, состоящих из магнетита (Fe3O4). Глобулы состоят из элементарной серы и не имеют значения для магнетотаксического поведения. Магнетосомы обеспечивают ориентировку клетки и ее движение по вектору магнитного поля. Однако также предполагают, что силы отталкивания между тяжами магнетосом имеют значение для стабилизации тела клетки

8.2.2. Внутриклеточные движения
Внутри клетки часто изменяется местоположение цитоплазмы, ядра и органелл. Эти внутриклеточные движения во многих отношениях сходны со свободными перемещениями одноклеточных организмов.
Наблюдаемое во многих клетках движение цитоплазмы часто вызывается только внешними раздражителями (например, светом, температурой, повреждением клетки, химическим раздражением), зависит от активного обмена веществ (иными словами, от АТФ) и достигает скорости 0,2 — 0,6 мм в минуту (в клетках междоузлий Nitella — до 6 мм в минуту при высокой температуре). В движении не участвует самый внешний слой цитоплазмы, прилегающий к плазмалемме (эктоплазма). Поскольку полярность клетки не изменяется вследствие течения цитоплазмы, она может быть закреплена в эктоплазме или также в плазмалемме. За течение цитоплазмы ответственны структурные белки, которые зависимы от АТФ, заякорены один на другом, как, например, при движении жгутиков, движении плазмодиев или сокращении мышц. Неизвестно, имеет ли течение цитоплазмы (которое наблюдается далеко не всегда и не во всех клетках) физиологическое значение или оно необходимо только при обмене веществ внутри клетки или между соседними клетками.
Клеточные ядра способны изменять свое местоположение внутри клеток. Они движутся преимущественно к участкам самого интенсивного роста клеток или особо повышенной локально метаболической активности. Так, в клетках с выраженным верхушечным ростом (корневые волоски, пыльцевые трубки) клеточные ядра находятся вблизи растущих кончиков; в поврежденных клетках они часто располагаются возле клеточной стенки, обращенной к ране; при грибной инфекции (см. 9.3.4) они движутся к местам внедрения грибных гиф, где протекают особенно интенсивные клеточные защитные реакции. В непосредственном соседстве с меристемоидами (например, рядом с инициалами устьиц) клеточные ядра перемещаются в направлении меристематических клеток, что предположительно связано с градиентом определенных веществ (см. 7.4.2).
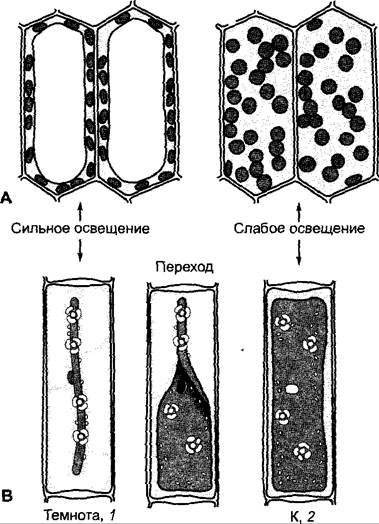
Характерны движения хлоропластов, зависимые от света (например, в талломах водорослей, листочках мхов, заростках папоротников, а среди высших растений это особенно выражено у водных растений), которые обеспечивают этим органеллам оптимальное положение или перемещение в места с оптимальным освещением. При положении слабого освещения хлоропласты находятся возле освещенных передних и задних клеточных стенок и обращены к свету своими наибольшими поверхностями (максимальные возможности поглощения квантов света), в то время как при сильном освещении они передвигаются к боковым стенкам и подставляют свету наименьшие из возможных поверхностей — поперечные (положение сильного освещения) (рис. 8.10) вероятно, чтобы избежать повреждения, вызванного световым излучением (см. 6.4.8).
Рис. 8.10. Движения хлоропластов внутри клетки: А — расположение хлоропластов в листочке мха при сильном и слабом освещении соответственно (направление света перпендикулярно плоскости рисунка); В — положение пластинчатого хлоропласта в клетке Mougeotia scalaris. При освещении клетки, находившейся до того в темноте (1), короткими (1 мин) вспышками красного света (К) хлоропласт принимает положение слабого освещения (2). Фотообратимость реакции при чередовании освещения К и ДК (красным и дальним красным светом) указывает на участие фитохромной системы; направление света перпендикулярно плоскости рисунка. Поворот хлоропласта занимает около 30 мин
Спектры действия, зарегистрированные у мхов, показывают, что фоторецептором в реакциях на сильное или слабое освещение служит флавин или флавопротеид. Особенно хорошо изучены реакции на свет у пластинчатых хлоропластов в нитевидных талломах водоросли Моugeotia (см. 11.2); выявлено, что в реакциях на слабое освещение участвует фитохром, а в реакциях на сильное освещение наряду с фитохромом принимает участие еще один рецептор синего света. Согласно этим данным, реакцию на слабое освещение можно индуцировать красным светом, а затем вновь снять эту индукцию, включая непосредственно после этого дальний красный свет; таким образом, мы имеем дело с реакцией II класса (см. 7.7.2.4). У покрытосеменных положение хлоропластов определяется рецепторами синего света группы фототропинов: фототропин 1 управляет ответной реакцией на слабое освещение, фототропин 2 — ответной реакцией на сильное освещение (фототропин, см. 7.7.2.4; 8.3.1.1; 8.3.2.5; бокс 7.5).
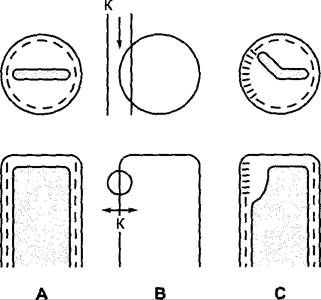
Опыты с освещением с использованием линейно поляризованного света показали выраженный дихроизм поглощения фитохрома у Мougeotia. Под дихроизмом понимают зависимость поглощения света молекулой от направления электрического вектора световой волны. Дихроизм становится явно заметным, когда такие молекулы располагаются высокоупорядоченно, а препарат освещается монохроматическим, линейно поляризованным светом с различным направлением колебаний, причем измеряют поглощение и соответственно биологическое действие. Кроме того, точечное освещение плазмалеммы и нижележащей эктоплазмы красным светом влияет на локальную реакцию хлоропласта, который «отворачивается» от места освещения и частично переходит в положение сильного освещения (рис. 8.11). Дихроизм фитохрома указывает на высокоупорядоченное расположение фоторецепторов в этой клетке; локальная эффективность освещения периферической цитоплазмы, которая наблюдается также в большинстве других систем с поворачивающимися хлоропластами, означает, что фоторецепторы локализованы в эктоплазме.
Рис. 8.11. Часть клетки Моugeotia в поперечном разрезе (вверху) и ее вид сверху (ниже): А — до, В — вовремя и С — после освещения поляризованным красным (К) светом (направление света указано обычной стрелкой, плоскость поляризации — двусторонней стрелкой). Положение хлоропласта и состояние активности фитохрома (штрихи) отражены на А и С. Параллельные верхней поверхности клетки штрихи соответствуют Фк, а поперечные штрихи — Фдк (активный фитохром). Расположение фитохрома, изображающее дихроичные свойства, схематизировано и не отражает истинного, еще неизвестного расположения хромофорных молекул
На месте образования активного фитохрома (Фдк) У Моugeotia повышается внутриклеточная концентрация Са2+ вследствие его усиленного поглощения клеткой Са2+ и повышенного освобождения из везикул вблизи наружной мембраны хлоропласта. Это ведет к сокращению микрофиламентов, прилегающих к наружной мембране хлоропласта (возможно, с участием актина), и в результате этого к движению.