БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
8. ФИЗИОЛОГИЯ ДВИЖЕНИЙ
8.3. Движения живых органов
Если обусловленное изгибанием движение прикрепленного организма или его отдельных органов вызвано односторонним раздражением и определено его направлением, то такое движение называют тропизмом (см. 8.3.1). Изгибы возникают, как правило, вследствие различной интенсивности роста противоположных сторон органа, очень редко причиной являются изменения тургора. Если же, в противоположность этому, способ и направление движения определяются лишь строением реагирующего органа, а раздражитель служит только пусковым механизмом (независимо от того, действует ли он односторонне или со всех сторон), то говорят о настии. В основе настий (см. 8.3.2) лежат в большинстве случаев обратимые изменения тургора, реже они определяются различной интенсивностью роста противоположных сторон органа. Настии и тропизмы противопоставляются автономным движениям органов (см. 8.3.3), управляемым внутренними механизмами.
Как тропизмы, так и настии целесообразно далее разделить по виду вызывающего их раздражителя.
При положительном тропизме ответная реакция направлена к источнику раздражения, при отрицательном — от него. Если движение направлено под определенным углом к источнику раздражения, то говорят о плагиотропизме, если этот угол составляет 90°, то движение называют диатропизмом (а также трансверсальным, или поперечным, тропизмом). Поскольку в основе тропизма лежит дифференциальный рост, то он проявляется лишь у растущих органов, и способность проявляться исчезает вместе с ростом. В основном в реакциях тропизма участвует рост растяжением, гораздо реже — например, при изгибе вверх стеблей, Наклоненных горизонтально, — включаются также клеточные деления. При положительном тропизме, как правило, интенсивнее растет сторона органа, обращенная от источника раздражения; это наблюдается как у высших растений, так и в некоторых одноклеточных системах (например, у спорангиеносцев Рhycomyces и Рilobolus). Однако у клеток с явно выраженным верхушечным ростом, как, например, у хлоронемы папоротников и пыльцевых трубок, вследствие бокового раздражения может тормозиться верхушечный рост и индуцироваться новый апекс, обращенный к источнику раздражения и продолжающий рост с резким изгибом. Таким образом, в приведенных примерах при положительном тропизме быстрее растет сторона, обращенная к раздражителю.
8.3.1.1. Фототропизм и скототропизм
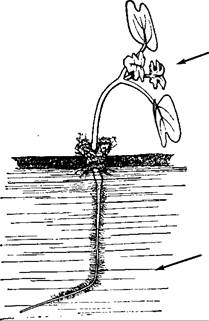
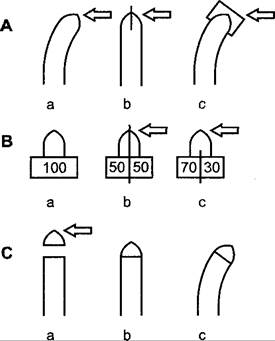
Вследствие одностороннего освещения многие органы растений перемещаются в положение, дающее преимущество, например, для оптимального использования света при фотосинтезе. Положительным фототропизмом обладают большинство побегов (рис. 8.12) и многие черешки листьев, одноклеточные спорангиеносцы некоторых мукоровых грибов (например, Рhycomyces и Рilobolus) и плодовые тела некоторых видов Соprinus. Отрицательный фототропизм встречается реже, например, у цепляющихся и воздушных корней (например, плющ, ароидные), ризоидов печеночных мхов и заростков папоротников, снабженных аппрессориями усиков дикого винограда, гипокотиля омелы и в исключительных случаях (например, у Sinapis, рис. 8.12) у зародышевых корней; однако большинство корней не проявляют фототропизма. Плагиофототропно реагируют многие боковые ветви, диафототропно — листовые пластинки (см. рис. 8.12) и талломы печеночных мхов. Иногда фототропный тип реакции изменяется в ходе развития. Цветоножки (например, Linaria суmbalaría, Cyclamen persicum, Tropaeolum maius) до оплодотворения имеют положительный, а после оплодотворения — отрицательный фототропизм, так что плоды оказываются укрытыми в щелях забора или подобных местах, пригодных для прорастания.
Рис. 8.12. Проросток горчицы в водной культуре, односторонне освещенный справа (стрелки). Побег обладает положительным фототропизмом, корень — отрицательным (является исключением!). Листовые пластинки расположены перпендикулярно направлению света, диафототропно.
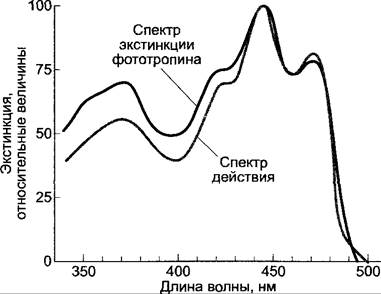
У протонем мхов и хлоронем папоротников, у которых реакция фототропизма основывается на перемещении точки роста, фоторецептором является система фитохрома.Опыты с освещением линейно поляризованным светом позволили заключить, что так же, как и в случае поворота хлоропласта (см. 8.2.2), молекулы фоторецептора расположены в эктоплазме в высокой степени упорядоченно. У всех фототропных реакций, основанных на различиях роста освещенной и затененной сторон, обнаруживается одинаковый спектр действия с одним пиком в ультрафиолетовой области (370 нм) и тремя пиками с максимумом активности в синей области (рис. 8.13). Поскольку пик в УФ напоминает поглощение флавина, а в синей области — поглощение каротиноидов (см. рис. 6.46; 6.47), природа участвующего в поглощении хромофора долго оставалась неясной. Но все же недавно при последовательном применении мутантов фоторецепторы были идентифицированы, сначала у Arabidopsis thalianа, а затем и у других видов.
Рис. 8.13. Спектр действия фототропизма (серая кривая, первый положительный изгиб колеоптилей овса), а также спектр экстинкции рекомбинантного (клонированного под сильным промотором в Escherichia coli) фототропина овса после добавления хромофора ФМН (реконструкция in vitro)
Удалось выделить мутанты Аrabidopsis thaliana, которые, хотя и не показывают зависимой от синего света реакции фотоморфогенеза (торможение роста колеоптиля у этиолированных проростков при ярком освещении, сгу1 -мутант, см. 7.7.2.1), но все же еще обладают нормальным положительным фототропизмом. Другой мутант уже не обладал фототропизмом при слабом освещении, но еще было выражено нормальное торможение удлинения гипокотиля (nph1-мутант, от английского non phototropic hypocotyl). Это дало возможность сделать вывод, что существуют по меньшей мере два отдельных рецептора синего света, ответственных, с одной стороны, за запуск фотоморфогенеза и, с другой стороны, — за запуск фототропизма; следовательно, рецептор, ответственный за фототропизм, не может быть идентичным криптохрому (см. табл. 7.8). В настоящее время известно, что фототропизмом управляют два структурно родственных друг другу рецептора синего света: фототропин 1 (кодируется геном NPH1) и фототропин 2 (кодируется геном NPL1, от англ. NPH — like). Фототропин 1 реагирует на свет низкой интенсивности, фототропин 2 — на высокую интенсивность света. У двойного мутанта (nph1/npl1) фототропизм отсутствовал. У голосеменных фототропины управляют также движениями хлоропластов и замыкающих клеток устьиц.
Управляющие фототропизмом рецепторы фототропин 1 и фототропин 2 являются хромопротеидами; их апопротеины имеют молекулярную массу около 120 кДа и в качестве хромофоров содержат флавинмо- нонуклеотид (ФМН), связанный нековалентно. Спектр поглощения фототропина с большой точностью соответствует спектру действия фототропизма, так что каротиноиды, вероятно, к этому не имеют отношения (см. рис. 8.13).
Фототропины представляют собой протеинкиназы и автофосфорилируются в присутствии АТФ (вероятно, по остаткам серина и треонина) в реакции, прямо зависящей от синего света. Принято считать, что это состояние соответствует состоянию активированного рецептора. Последующий сигнальный путь еще не известен. Предполагают, что активированное состояние фототропина регулирует распределение ауксина в органе и что дифференциальный рост на затененной стороне происходит под влиянием соответствующего асимметричного распределения ауксина (см. ниже; ауксин, см. 7.6.1).
Фототропная реакция особенно интенсивно изучалась на колеоптилях злаков, на гипокотилях и эпикотилях проростков и на спорангиеносцах Phycomyces. Во всех случаях обнаружена сложная зависимость реакции от полученного ими количества света (производное интенсивности света [В • м-2] и времени освещения [с]; В • м-2 • с = Дж • м-2). У лучше всего изученных колеоптилей овса (рис. 8.14), которые могут в данном случае служить типичным примером, при малых количествах света (в области приблизительно 10-1 —102 Дж • м-2) проявляется положительный фототропизм, интенсивность которого при дальнейшем повышении количества света вновь снижается до нуля, чтобы при превышении значения 104Дж • м-2 вновь продемонстрировать резкий переход к положительному фототропизму (говорят о первой и второй положительной фото- тропной реакции). При очень высоких количествах света располагается вторая область индифферентности, а далее происходит третья положительная фототропная реакция, которая имеет место лишь в условиях опыта и не играет роли при естественной интенсивности света. Для фототропизма при естественном дневном свете актуальна область второй положительной реакции; проростки в почве реагируют при определенных условиях на очень слабый и кратковременно падающий свет в области первой положительной фототропной реакции. Она лучше всего изучена экспериментально.
Рис. 8.14. Кривая доза-эффект фототропной реакции колеоптилей овса (кривая доза-эффект — по B.Steyer; гипотеза фототропина — по М. Salomon, M.Zacherl, W. Rbdiger). Растения освещали от 1 до 120 с 8 • 10-2 В • м-2 (черный сегмент графика) или от 1 с до 3 ч 3,5 В• м-2 (серый сегмент графика). Количество света в Дж • м-2 = В • м-2 • с. Схематические рисунки отражают современное представление о фосфорилированном состоянии рецептора фототропизма, фототропина (заштриховано) в зависимости от примененного количества света (область от а до d). Дальнейшие пояснения см. в тексте

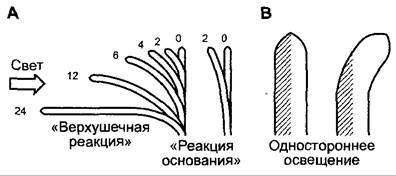
Порог раздражения первой положительной реакции у колеоптилей овса находится приблизительно при 10-1 Дж • м-2, а приблизительная пропорциональность между достигнутым фототропным изгибом и примененным количеством света сохраняется до 102 Дж • м-2. Время реакции составляет (в зависимости от внешних условий, например, температуры) 25 — 60 мин, а продолжительность реакции (время от начала до завершения изгиба) — приблизительно 24 ч (рис. 8.15).
Рис. 8.15. Фототропизм колеоптиля: А — ход фототропного изгибания при одностороннем освещении (стрелка). Слева — первая положительная реакция («верхушечная реакция») колеоптиля овса, справа — вторая положительная реакция («реакция основания»); В — одностороннее освещение колеоптиля. Свет падает перпендикулярно плоскости бумаги на половину органа, в то время как вторая остается в темноте (заштрихована). Объект изгибается не в направлении источника света (к наблюдателю), но в плоскости бумаги соответственно различиям в яркости между освещенной и неосвещенной половиной (более сильный рост на затемненной стороне)
Если рассматривать фототропизм у клеток с верхушечным ростом (см. выше), то положительный фототропный изгиб осуществляется вследствие усиленного роста затененной стороны относительно освещенной. Участок максимальной восприимчивости света, как правило, лежит апикально по отношению к зоне изгиба. Что-
бы вызвать первую положительную реакцию у колеоптиля (рис. 8.15, А), требуется освещение самой верхушки (0,25 мм). В связи с тем, что реакция происходит и при освещении лишь этого участка, следовательно, требуется проведение сигнала от места восприятия света до места реакции изгиба. Первый положительный изгиб начинается с верхушки и постепенно распространяется до основания («верхушечная реакция»). Второй положительный изгиб происходит сначала вблизи основания колеоптиля («реакция основания») и в этом случае также особенно восприимчива верхушка колеоптиля (-0,5 мм), но в меньшей мере восприимчивы также все нижележащие части органа. В обоих случаях участвует фототропин 1; опосредованная фо- тотропином 2 реакция возможна лишь при более высоких количествах света (3-й положительный изгиб).
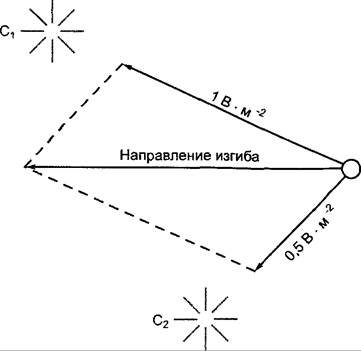
Более старые растения воспринимают одностороннее освещение в верхушке побега, причем чаще пластинкой молодых листьев. У Tropaeolum черешки листьев фототропически чувствительны. Если свет поступает на способный к фототропической реакции орган от 2 боковых источников света под различным углом и различной интенсивности, то в большинстве случаев происходит изгиб в сторону равнодействующей, которую можно получить из параллелограмма сил — из направления и количества раздражения (рис. 8.16).
Рис. 8.16. Фототропный изгиб по закону равнодействующей при одновременном освещении источниками света различной силы (С1, С2). Силы освещения, направленные от каждого источника только на объект (здесь виден сверху), даны как векторы силового параллелограмма
Однако при фототропизме воспринимается не направление света, а различие в интенсивности освещения между световой и теневой стороной. Это можно показать, например, путем так называемого одностороннего освещения (см. рис. 8.15, В). Необходимые различия в интенсивности освещения между двумя сторонами возникают из-за рассеивания или поглощения света («теневые пигменты», например, каротиноиды в верхушке колеоптиля) внутри органа. Различная интенсивность света в различных местах органа могла бы прямо коррелировать у колеоптилей со степенью фосфорилирования фототропина, который встречается преимущественно в кончике колеоптиля и в значительно меньшем объеме — в основании колеотиля (см. рис. 8.14). Гипотеза фосфорилирования дает также возможность объяснения комплексной зависимости фототропической реакции от световой энергии. Очень низкой интенсивности света и короткого времени облучения хватает только для того, чтобы достаточно активировать фототропин 1 световой стороны в районе кончика колеоптиля. Здесь образуется градиент фосфорилирования фототропина. С ростом интенсивности или продолжительности освещения все больше фосфорилируется фототропин и на теневой стороне кончика колеоптиля: различие в фосфорилировании исчезает. Если интенсивность света повышают дальше, то также реагирует, наконец, имеющийся в значительно меньшей концентрации или более рассеянный (подробности пока неизвестны) фототропин 1 основания колеоптиля, сначала на световой, а затем, с дальнейшим ростом интенсивности или продолжительности освещения, также на теневой стороне. Формирующийся (и наконец, снова исчезающий) градиент фосфорилирования регулирует второй фототропный изгиб («реакция основания», рис. 8.15, А). Теперь предполагается, что фототропин напрямую или через цепь сигналов регулирует транспорт ауксина. В соответствии с этим представлением градиент фосфорилирования фототропина вызывает асимметричное распределение ауксина в органе, и это в свою очередь должно вызывать различные скорости роста световой и теневой стороны. Для колеоптилей приведены экспериментальные доказательства ауксиновой гипотезы фототропизма; для других органов высших растений ситуация ясна не до конца, совершенно не изучены и механизмы фототропизмов низших растений.
Рис. 8.17. Поперечный транспорт ауксина при фототропизме колеоптилей. Стрелки — направление освещения. А — доказательство необходимости беспрепятственного латерального транспорта. Стеклянная пластинка, помещенная перпендикулярно к направлению света (b), препятствует транспорту и изгибанию, помещенная параллельно к направлению света (с) — не препятствует; В — улавливание диффундирующего из отделенных верхушек колеоптилей ауксина с помощью агаровых блоков в контроле (а), при наличии препятствия (b), без препятствия (с); числа — относительное содержание ауксина. Одностороннее освещение при беспрепятственном поперечном транспорте ведет к усиленному оттоку ауксина на обращенной к свету стороне. К сопоставимому результату приводит снабжение верхушки радиоактивной ИУК извне и последующее измерение радиоактивности в блоках; С — проведение сигнала посредством продольного транспорта ауксина: а — одностороннее освещение вызывает поперечный транспорт ауксина в отделенной верхушке; b — верхушка снова помещена на основание; с — асимметричное распределение ауксина передается в основание и ведет там к изгибанию (ср. с моделью фосфорилирования фототропина — рис. 8.14)
Одностороннее освещение колеоптилей этиолированных проростков злаковых в области первого или второго положительного изгиба приводит, с одной стороны, к поперечному перемещению ауксина от освещенной стороны на теневую сторону органа в области кончика колеоптиля и, с другой стороны, к подавлению базипетального транспорта ауксина (см. 7.6.1.3) на световой стороне (рис. 8.17). Вызванная асимметрия в распределении ауксина в кончике колеоптиля растет затем благодаря полярному транспорту ауксина до основания и приводит к более сильному росту на богатой ауксином теневой стороне. Разница в росте всего лишь в 2 % на лежащих напротив друг друга сторонах органа приводит уже к изгибу в 10°. Проведение сигнала при фототропизме состоит соответственно в асимметричном транспорте ауксина, поэтому ингибиторы полярного транспорта ауксина (например, 2,3,5-три- иодбензойная кислота, TIBA) нарушают также фототропную реакцию.
У тропических лиан (например, у ароидного растения Monstera gigantea) побеги направленно стремятся к своему опорному стволу благодаря ростовому изгибу в сторону наиболее темного сектора на горизонте. Поскольку побеги нарастают на опорный ствол со всех сторон, речь идет не об отрицательном фототропизме, а о росте в направлении тени, т. е. о скототропизме. Если побег достиг опорного ствола, то скототропная чувствительность превращается в положительный фототропизм, который уводит растение к свету в области кроны. Механизм скототропизма неизвестен.
Многие растения способны посредством ростовых изгибов перемещать свои органы в определенном направлении относительно вектора ускорения силы тяжести (g = 9,81 м • с-2). Эту реакцию называют гравитропизмом (ранее употребляли термин «геотропизм»). Например, деревья на крутом склоне растут таким образом, что продольная ось ствола устанавливается в направлении силы тяжести, а не перпендикулярно локальному участку земной поверхности. Выведенные из нормального положения осевые органы, например, цветоносы, изгибаются до тех пор, пока снова не примут вертикальное положение; стебли злаков, которые полегли под действием погодных условий, могут вновь подниматься путем изгибания в местах узлов.
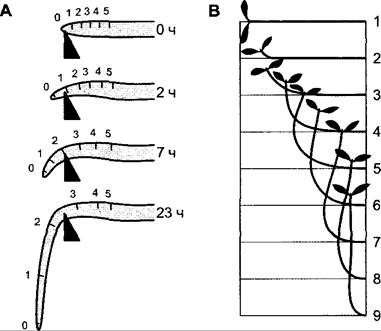
Положительно гравитропными, т. е. растущими в направлении к центру Земли, являются главные корни (рис. 8.18, А), а также ризоиды водорослей, печеночных мхов или проталломов папоротников. Отрицательным гравитропизмом обладают главные побеги (рис. 8.18, В), спорангиеносцы мукоровых грибов и плодовые тела многих шляпочных грибов. Боковые корни первого порядка растут преимущественно горизонтально (диагравитропизм) или косо вниз под определенным углом (плагиогра- витропизм). Многие боковые ветви и листья, как и корневища, также реагируют диагравитропно или плагиогравитропно. Боковые корни второго порядка в большинстве случаев невосприимчивы к направлению действия силы тяжести (агравитропны), также, как и боковые ветви «плакучих форм» (например, плакучей ивы). Подобно фототропизму, гравитропизм у некоторых растений может переключаться в ходе развития или вследствие изменения условий среды.
Рис. 8.18. Гравитропизм: А — положительный гравитропизм зародышевого корня; указано время в часах от экспериментального перемещения в горизонтальное положение. Нанесенные на корень метки 0—5 показывают прирост в длину отдельных отрезков корня в ходе реакции. Общая реакция в зависимости от вида растения требует от двух до нескольких часов; В — отрицательный гравитропизм зародышевого побега. Последовательность чисел обозначает отдельные стадии реакции, которая в зависимости от вида растения требует от двух до нескольких часов
Так, например, верхняя часть цветоножки бутона мака положительно гравитропна («кивающий бутон»), но гравитропизм изменяется на отрицательный перед раскрыванием цветка. У многих видов (Holosteum umbellatum, Calandrinia, Arachis1 и др.) цветоножки отрицательно гравитропны, но, превратившись в плодоножки, становятся положительно гравитропными, а у Lilium martagón все происходит наоборот. Если, например, у ели или пихты спилить отрицательно гравитропный главный побег, то верхние боковые ветви, исходно диа- или плагиогравитропные, переориентируются отрицательно гравитропно. Одна из них, как правило, принимает функцию и положение главного побега, в то время как другие возвращаются в исходное положение (апикальное доминирование, см. 7.6.1.4).
1 У арахиса зарывание плодов в землю осуществляется за счет роста основания завязи, но не цветоножки. — Примеч. ред.
Пониженная зимняя температура, к примеру, делает диагравитропными побеги некоторых полевых сорняков (Senecio vulgaris. Sinapis arvensis, Lamium purpureum и др.), которые летом отрицательно гравитропны. Таким способом они обеспечивают себе защиту снежным покровом. Диагравитропные корневища Adoxa или Circaea под действием света становятся положительно гравитропными, и им удается снова вернуться в почву. Подземным побегам Aegopodium роdagraria для такого изменения достаточно 30 с освещения красным светом. Диагравитропные побеги Vinca, Lysimachia nummularia и др. при затемнении превращаются в отрицательно гравитропные.
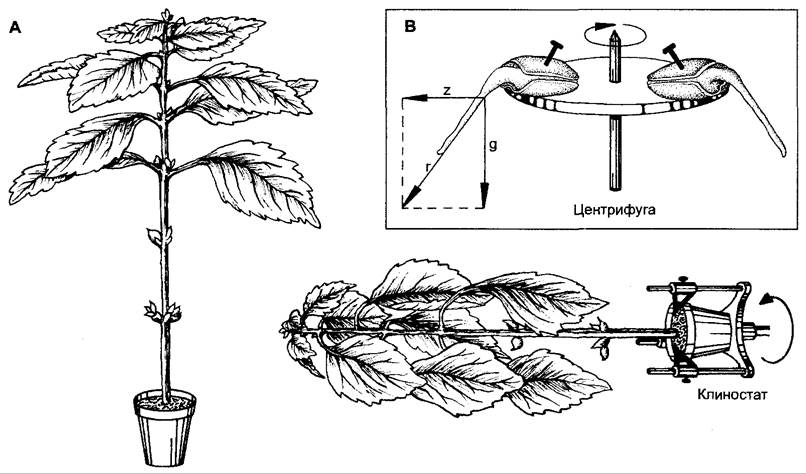
То, что гравитропные изгибы являются реакцией на ускорение масс, что в норме вызывается односторонне действующей силой тяжести, можно показать различными способами. Во-первых, ускорение, создаваемое центрифугой (z), действует таким же образом, как и ускорение силы тяжести (g рис. 8.19, Б). Поскольку обе силы имеют одинаковый порядок величин, то снова действует закон результирующей (см. рис. 8.16): сила тяжести и сила центрифугирования воспринимаются растением как равноценные. С другой стороны, можно снять гравитропный изгиб, если исходно ортотропно выращенное растение медленно вращать вокруг его продольной оси (на клиностате, рис. 8.19, А). Когда скорость вращения достаточно велика, чтобы исключить одностороннее восприятие силы тяжести, а с другой стороны, достаточно мала, чтобы не позволить силе центрифугирования оказаться действенной (несколько оборотов в минуту), то компенсируется действие поля силы тяжести.
Рис. 8.19. Доказательство действия ускорения масс как основного раздражителя при гравитропизме: А — нормально ориентированное (слева) и выращенное на клиностате при медленном (несколько оборотов в мин.) вращении относительно продольной оси (справа) растение Coleus. При устранении односторонне действующей силы тяжести не происходит отрицательного гравитропного изгиба побега и возникает эпинастия листьев, которая в ином случае компенсировалась бы отрицательным гравитропизмом; В — применимость закона результирующей силы при одновременном действии ускорения, создаваемого центрифугой (z), и ускорения силы тяжести (д). Направление роста совпадает с направлением результирующей силы (г)
Гравитропные изгибы также, как правило, основываются на различной интенсивности роста противоположных сторон органа. Следовательно, и в этих случаях, как и при фототропных реакциях, реагируют зоны, способные к росту: расположенная непосредственно за апексом корня зона его роста или соответственно побега и гипокотиля или эпикотиля проростков (см. рис. 8.18). Поскольку зона растяжения короткая, то ход изгибания корней относительно простой. У побегов изгиб начинается в верхней части и затем распространяется все дальше в базальном направлении; при этом гравитропный изгиб кверху превосходит вертикальное направление, после чего следует обратный изгиб. Изгибание продолжается до тех пор, пока побег после нескольких колебательных движений не установится точно в вертикальном положении. Эти колебательные движения лишь частично вызваны новым (противопоставленным) гравитропным раздражением; частично они происходят независимо от силы тяжести (например, также и на клиностате), причем управляющий механизм еще неизвестен.
В определенных случаях после гравитропного раздражения уже выросшие части растения могут вновь возобновлять рост: так, у стеблей злаков, выведенных из вертикального положения, начинают усиленно разрастаться нижние стороны узлов, так что стебель снова поднимается (рис. 8.20). На клиностате равномерно усиливается рост узлов, т.е. в этом случае еще воспринимается раздражение силой тяжести. Стволы, ветви и корни деревьев также способны проявлять гравитропные реакции (но очень медленные), выражающиеся в усиленном росте в длину и толщину при участии камбия. При этом гравитропно раздражаемый камбий образует специфическую, анатомически особо дифференцированную «реакционную древесину», у хвойных деревьев на нижней стороне (древесина давления), у лиственных — на верхней стороне (древесина растяжения). Формирование реакционной древесины происходит также при отсутствии роста в длину и изгибании (например, после удаления верхушечной почки); таким образом, ее образование индуцировано не деформациями давления или растяжения. В большей степени причиной гравитропного изгиба является образование реакционной древесины.
Рис. 8.20. Гравитропное изгибание вверх горизонтально наклоненного (А) и соответственно вращаемого в горизонтальном положении вокруг своей продольной оси на клиностате (В) узла злака в сравнении с нестимулированным объектом (С). Эксперимент проводят на отделенном отрезке побега. Если сравнивать В и С, видно, что горизонтальное положение при одновременном вращении вокруг продольной оси стимулирует рост узла в длину. Гравитропная стимуляция (А) приводит к сильному удлинению нижней стороны узла, верхняя сторона укорочена

Время презентации для гравитропизма может быть очень малым и составлять несколько минут (например, 3 мин для гипокотиля Helianthus). В минутном диапазоне может лежать также время реакций (колеоптиль овса — 14 мин, корни кресс-салата — менее 20 мин). Побеги же часто начинают реагировать более чем через час, а узлы злаков — лишь через несколько часов. Порог раздражения в случае продолжительного раздражения находится при ускорении масс около 10-2g (g — ускорение силы тяжести), суммирование подпороговых раздражений может, как и в случае фототропизма, приводить к видимой реакции.
При раздражениях, незначительно превышающих порог, как и в случае фототропизма, действует закон количества раздражения (уравнение 8.1), т.е. в определенных границах равноценно, действует ли более сильное раздражение кратковременно или более слабое, но продолжительно: решающую роль играет количество раздражения R, т.е. произведение интенсивности раздражения I и времени воздействия t. При малых количествах раздражения наблюдается также пропорциональность между количеством раздражения и интенсивностью реакции. Это легко можно исследовать путем действия дозируемых центрифужных сил (см. рис. 8.19) или по отклонению от вертикали при угле меньше прямого. В последнем случае действует лишь небольшая часть силы тяжести, пропорциональная синусу угла отклонения от вертикали (закон синуса). Во многих случаях отклонение от вертикали уже на 1 — 2 угловых градуса корректируется гравитропной ростовой реакцией. Деревья, например, не только на крутых, но и на очень пологих склонах растут вертикально, т.е. параллельно вектору ускорения силы тяжести, а не перпендикулярно локальной поверхности.
Восприятие ускорения силы тяжести происходит у колеоптилей (также хорошо изученных) в паренхиме апекса (-3 мм), у корней в центральной части корневого чехлика (калиптре), а у побегов, вероятно, в зонах растяжения всех еще растущих междоузлий (в этом случае в клетках крахмалоносных влагалищ). Если удалить корневой чехлик, то рост корня в длину слегка усиливается, но гравитропная раздражимость полностью исчезает (рис. 8.21, А, В); это показывает, что гравитропизм в данном случае основывается на тормозящем действии. О том же свидетельствует и изгибание не стимулированных гравитропно корней, у которых калиптра удалена лишь с одной стороны (рис. 8.21, С). У Arabidopsis мутант scarecrow (англ. — пугало) не образует крахмалоносных влагалищ и эндодермы (в области корневой шейки крахмалоносное влагалище переходит в эндодерму). Побег этого мутанта агравитропен, но корень реагирует нормально.
Рис. 8.21. Корневой чехлик как орган, воспринимающий силу тяжести, в котором образуется ингибитор роста корня. По сравнению с нестимулированными корнями (А) у корней без корневых чехликов (В, вверху) обнаруживается некоторое усиление роста в длину, но не гравитропизм, который связан с наличием корневого чехлика, или калиптры (В, внизу). С — удаление части корневого чехлика с одной стороны приводит к изгибу кончика корня. Сторона без калиптры растет быстрее, чем интактная сторона, что позволяет сделать заключение о выделяемом корневым чехликом факторе или комплексе факторов, тормозящем рост корня в длину

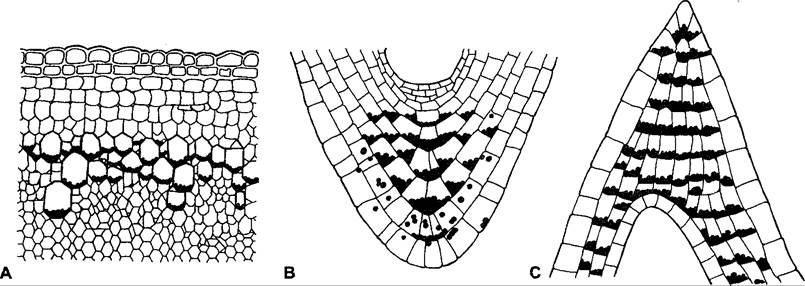
В клетках или тканях, участвующих в восприятии ускорения силы тяжести, как правило, заметно выражена асимметрия внутриклеточного распределения органелл: обладающие меньшей удельной плотностью «легкие органеллы» (например, вакуоли) располагаются в верхней части, а удельно более плотные «тяжелые органеллы» (клеточные ядра и особенно амилопласты, у ризоидов Chara — кристаллы сульфата бария, или «блестящие тела») занимают физически нижнюю сторону. Такие специфические тяжелые частицы называют статолитами (у растений, имеющих пластиды, это уже упоминавшиеся амилопласты), клетки, несущие статолиты, именуются статоцитами, а состоящая из них ткань — статенхима; оседание статолитов в клетке связывают с восприятием ускорения масс (рис. 8.22). Даже у растений, которые вследствие длительного содержания в темноте или генетических дефектов накапливают мало крахмала или вовсе не имеют его, гравитропная реакция полностью не исчезает, хотя выражена гораздо слабее. У таких «бескрахмальных» растений все еще обнаруживается определенное оседание лейкопластов в качестве статолитов. Следовательно, «статолитным крахмалом» не следует пренебрегать как компонентом, имеющим значение для способности клетки воспринимать ускорение масс; он может вносить вклад в повышение удельной плотности амилопластов и соответственно в улучшение гравитропной чувствительности.
Рис. 8.22. Положение статенхимы: А — в побеге (крахмалоносное влагалище), В — корневом чехлике, С — в кончике колеоптиля. Статоциты содержат амилопласты в качестве статолитов. Окружающая статоциты центральная ткань корневого чехлика называется также колумеллой. В эмбриогенезе она происходит, как и покоящийся центр, из базальной клетки двухклеточного зародыша, в то время как периферический корневой чехлик и остальная часть зародыша являются потомками апикальной клетки1
1 Речь идет только о зародышевом корешке, но не о боковых или адвентивных корнях. — Примеч. ред.
В чем, собственно, состоит механизм восприятия, пока неясно. Предложены различные гипотезы.
• Топографическая модель: решающим является асимметричное распределение статолитов в клетке.
• Кинетическая модель: решающим является продольное скольжение статолитов в процессе их перемещения в клетке вследствие гравитропной стимуляции.
• Деформационная модель: решающим является давление на клеточные структуры или их растяжение.
Сделать окончательный выбор между моделями пока не представляется возможным. Однако в случае ризоидов Chara, у клеток с крайне интенсивным апикальным ростом, многое говорит в пользу топографической модели (рис. 8.23), в то время как для большинства клеток, особенно статоцитов высших растений, более адекватной представляется деформационная модель.
Рис. 8.23. Схема ультраструктуры ризоида Chara foetida, проявляющего положительный гравитропизм (А). Отшнуровывающиеся от диктиосом аппарата Гольджи везикулы (секреторные везикулы) с компонентами клеточной стенки и мембраны перемещаются в периферическую область в апикальном направлении, окружая группу «блестящих тел», приблизительно из 50 частиц сульфата бария (BaSО4), служащих статолитами, и обеспечивают на кончике равномерный прирост поверхности со всех сторон. В — горизонтальное положение ризоида: переместившиеся статолиты блокируют перемещение везикул Гольджи на нижнюю сторону, которая вследствие этого отстает в росте от интенсивно растущей верхней стороны. Следствием является положительный гравитропизм
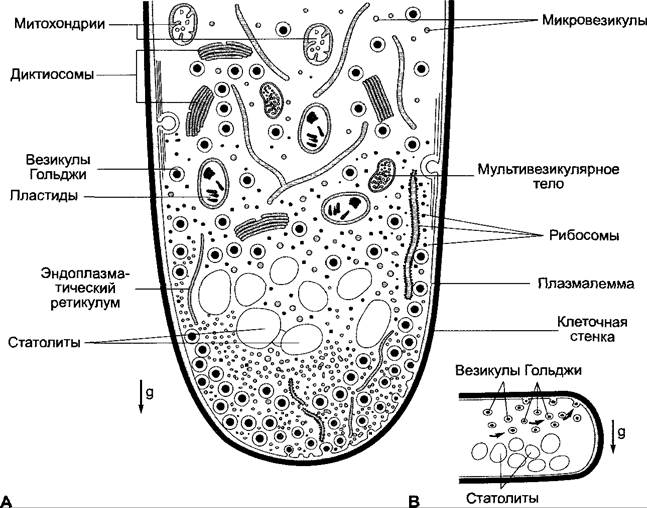
Согласно топографической модели, у Chara расположение статолитов («блестящих тел») направляет поток отшнуровывающихся от диктиосом секреторных везикул (пузырьков Гольджи), поставляющих материал для мембран и клеточных стенок в апикальную область клетки, так что результатом является равномерный поверхностный рост кончика. Перемещение статолитов при отклонении от вертикали (горизонтальное расположение на рис. 8.23, В) соответственно этому представлению вызывает изменение направления потока везикул на физически верхнюю сторону, рост которой благодаря этому стимулируется.
Для объяснения связи между ускорением масс и обменом веществ клетки предложены различные деформационные модели.
✵ Давление оседающих органелл, в особенности статолитов, на клеточные структуры, такие, как эндоплазматический ретикулум (в некоторых кончиках корней, например, у кресс-салата), и соответственно снижение давления путем перемещения статолитов при гравитропной стимуляции управляет биохимическим процессом первичного восприятия силы тяжести.
✵ Статолиты «висят» на нитях цитоскелета и растягивают или соответственно ослабляют их натяжение при своих перемещениях в клетке; биохимический первичный ответ регулируется цитоскелетом посредством механического сопряжения.
✵ Весь протопласт действует как статолит и растягивает клеточную мембрану (плазмалемму), которой он покрыт; биохимический первичный ответ запускается натяжением плазмалеммы. Статолиты действуют как балласт и повышают гравитропную восприимчивость клетки (модель плазмалеммного контроля).
Модель плазмалеммного контроля на сегодняшний день представляется наиболее согласующейся с экспериментальными данными. Она учитывает те факты, что существуют клетки, не содержащие видимых статолитов, но реагирующие на ускорение масс (например, клетки междоузлий Chara и спорангиофор Phycomyces) и, как уже упоминалось, не содержащие крахмала мутанты показывают, хотя и гораздо более слабую, но все же заметную гравитропную реакцию. К тому же общая масса протопласта значительно больше массы всех статолитов, соразмерно выше и кинетическая энергия, которая может употребляться для запуска клеточной ответной реакции.
Во многих случаях (например, у корней) гравитропная реакция протекает лишь при наличии внеклеточных ионов Са2+. Обсуждается вопрос, влияет ли деформация клеточной мембраны на клеточный уровень кальция (например, открывание механочувствительных каналов в растянутой клеточной мембране может привести к усилению потока ионов Са2+ в клетку на физически нижней стороне). В вертикальном положении радиально-симметричный орган (корень, побег) должен быть симметричным относительно продольной оси; однако при отклонении от вертикали, вероятно, возникает асимметрия, которая может исправляться путем корректирующей ростовой реакции (рис. 8.24, А). Предполагают, что при этом, как и при фототропизме, изменяется направление потока ауксина (зависит от ионов Са2+). В деталях эта схема еще весьма гипотетична, но имеются многочисленные свидетельства участия ауксина в ростовых реакциях высших растений.
Рис. 8.24. Латеральная поляризация при гравитропизме корня: А — гипотетическая модель процесса в кончике корня, направленного по вектору силы тяжести (д). Этот процесс протекает при ориентации продольной оси органа в направлении вектора силы тяжести симметрично продольной оси (слева). При отклонении органа от вертикали (в центре и справа) это может привести к асимметрии в распределении молекул. Предполагают участие ионного транспорта (возможно, Са2+), который вызывается давлением статолитов на физически нижнюю часть клетки и соответственно плазмалеммы (показано распределение статолитов в двух клетках колумеллы). Следствием этого должно стать переключение транспорта ауксина в обратную сторону (см. текст). Согласно этому представлению (В), повышенная концентрация ауксина в базальной части органа уже превосходит оптимальную, что приводит к торможению роста растяжением. Более подробные пояснения в тексте

Согласно ауксиновой гипотезе гравитропизма, у высших растений при гравитропной стимуляции поток ауксина смещается на физически нижнюю сторону. На колеоптилях это прямо показано опытным путем (рис. 8.25, А, В); смещение обнаруживается в кончиках колеоптилей. Усиленный приток ауксина на физически нижнюю сторону в зоне роста колеоптиля ведет к усилению роста в длину, а вследствие уменьшения притока ауксина на физически верхнюю сторону скорость роста ее снижается. Смещение потока ауксина в побегах можно показать косвенно (например, в гипокотилях сои, рис. 8.25, С). У растений существует ряд генов, активность которых быстро и сильно индуцируется ауксином (ген SAUR, англ. smallauxin up-regulated). Методом гибридизации in situ с радиоактивно меченной РНК, содержащей последовательность оснований, комплементарную к исследуемой мРНК (англ. antisense-RNA — антисмысловая РНК), показано, что в вертикально растущих проростках SAUR — мРНК равномерно распределена в паренхиме зоны роста. Уже через 20 мин после перемещения горизонтального положения проростков на препаратах обнаруживается заметное увеличение количества мРНК на физически нижней стороне и лишь очень малое количество SAUR — мРНК на физически верхней стороне. Через 45 мин начинается заметная гравитропная реакция (рис. 8.25). Эти результаты показывают, что перемещение ауксина на физически нижнюю сторону органа предшествует началу дифференциального бокового роста. За участие ауксина в гравитропных реакциях побегов говорит и тот факт, что ряд мутантов Arabidopsis thaliana, обладающих ауксинрезистентным фенотипом (например, аих 1, ахr2, англ. auxin resistant), которые не реагируют на ауксин, являются агравитропными. Для гена AUXI было показано, что он кодирует фермент, сходный с переносчиками аминокислот. Предполагают, что это переносчик ауксина, требующийся для направленного транспорта фитогормона.
Рис. 8.25. Данные в пользу ауксиновой гипотезы гравитропизма в области побега: А — доказательство продольного и поперечного транспорта ауксина при гравитропизме колеоптиля. Горизонтальное положение кончиков колеоптилей приводит к перемещению ауксина на физически нижнюю сторону. В относительных единицах даны количества ауксина (определено биотестом), переходящие в агаровые блоки из кончиков колеоптилей, инкубируемых в горизонтальном положении (внизу) и в вертикальном (вверху); В — доказательство транспорта ауксина из отрезанных (1), затем горизонтально инкубированных (2) и возвращенных на место (3) кончиков колеоптилей. Во время инкубации (2) распределившийся в кончиках колеоптилей асимметрично ауксин (заштриховано) определяет неравномерный рост сторон колеоптиля (4); С — косвенное доказательство асимметричного распределения концентраций ауксина в гравитропно стимулированном гилокотиле сои. Доказательство получено путем определения количества мРНК, образованной при транскрипции SAUR-гена (см. текст). Для этого гипокотили растений, помещенных вертикально, а также растений, положенных горизонтально на 20, 45 и 90 мин, разрезали вдоль, поверхности срезов прикладывали к нейлоновой мембране для переноса мРНК и определяли связанную на мембране SAUR-мРНК методом гибридизации с радиоактивно меченной комплементарной РНК (так называемой антисмысловой РНК). У вертикально растущих растений SAUR-мРНК равномерно распределена в паренхиме зоны роста, но уже через 20 мин горизонтального положения значительно больше SAUR-мРНК обнаруживали на нижней стороне органа. Отрицательный гравитропный изгиб становился заметным лишь через 45 мин. Результаты интерпретируются таким образом: вследствие поперечного транспорта ауксина из верхней половины органа в нижнюю SAUR-гены повышают активность на нижней стороне и понижают ее на верхней стороне гипокотиля (при этом постулируют, что мРНК не транспортируется!)
Вероятно, (хотя экспериментально недостаточно показано), что и положительная гравитропная реакция главного корня в значительной степени регулируется ауксином (см. рис. 8.24, В) и в ее основе лежит перемещение ауксина на физически нижнюю сторону органа. В корнях проростков идет полярный транспорт ауксина в центральном цилиндре в направлении кончика корня. Поток ауксина поворачивается в корневом чехлике, так что в коре корня индолил-3-уксусная кислота (ИУК, см. 7.6.1.3) транспортируется в обратном направлении от кончика к основанию корня. Согласно этой модели ИУК при гравитропной стимуляции усиленно направляется на физически нижнюю сторону органа. Поскольку корни очень восприимчиво реагируют на добавление ИУК извне и при передозировке отвечают значительным торможением роста (см. рис. 7.31), предполагают, что повышение эндогенной концентрации ИУК на физически нижней стороне корня ведет к торможению растяжения клеток в зоне роста.
Как плагио-, так и диагравитропные реакции боковых ветвей и листьев происходят вследствие наложения отрицательного гравитропизма (вызывает усиленный рост нижней стороны) и эпинастии (вызывает усиленный рост верхней стороны). (Автономную?) эпинастию можно наблюдать, например, при устранении гравитропной стимуляции на клиностате (см. рис. 8.19), следовательно, она не вызывается ускорением масс.
Внешние факторы, которые в опыте способны вызвать тропические реакции, такие, как электрические раздражения (гальванотропизм), раневые раздражения (травмотропизм)или температурные раздражения (термотропизм), в природе не играют никакой роли или имеют подчиненное значение для ориентирования органов растений. Но что имеет значение, во всяком случае для определенных групп растений, — это раздражения прикосновением (тигмотропизм) и химические раздражения (хемотропизм).
Велико число растений, чувствительных к механическим раздражениям, вызываемым прикосновением. Многие проростки (прежде всего этиолированные) на прикосновение к одной стороне (в опытах вызывается, например, трением шероховатой деревянной палочкой) реагируют ростовым изгибом в направлении прикосновения. По всему миру произрастают тысячи видов вьющихся и лазящих растений. У них различные органы выполняют задачу восприятия контактных раздражений и тем самым — нахождения необходимой опоры (часто другого растения), чтобы подниматься по ней. Так они эффективнее достигают света и растут быстро, преодолевая большие расстояния (например, лианы), не нуждаясь в развитии массивных механических тканей. Восприимчивыми к контактам могут быть черешки листьев (например, у видов Tropaeolum, Clematis или Fumaria), кончики листьев (Gloriosa),воздушные корни (Vanilla), стебли (Ipomoed), соцветия (Vitis, Parthenocissus) и листья или пазушные побеги (например, усики растений сем. Fabaceae или Cucurbitaceae). Особенно примечательны тигмические реакции усиков. Но при этом в основном наблюдаются все же не тигмотропные, а тигмонастические движения. Поэтому мы рассмотрим их при описании настий (см. 8.3.2.4).
Под хемотропными реакциями подразумеваются ростовые изгибы, вызванные негомогенным распределением растворенных или газообразных химических соединений в окружении растущего органа, причем направление изгибов определяется концентрационными градиентами этих соединений. Нередко вещество, вызывающее хемотропизм, в более низких концентрациях действует как привлекающее, а в более высоких — как отталкивающее.
Можно привести многочисленные примеры хемотропных реакций низших растений, в частности при гаметангиогамии мицелиальных грибов. При этом выделяемые половыми партнерами гамоны (привлекающие вещества гамет) действуют таким образом, что скрещивающиеся партнеры хемотропно нарастают друг на друга; например, у Mucor (Mucorales) — летучие соединения, у Achlia (Oomycota) — стероид антеридиол, который участвует также в дифференциации половых органов. Многие грибные гифы прежде всего на стадии прорастания растут положительно хемотропно в направлении градиента питательных веществ (действенны сахара, аминокислоты, белки, ионы аммония и фосфат), но отрицательно реагируют на кислоты и продукты собственного обмена веществ («удручающие вещества»). Рост копуляционных отростков Spirogyra по направлению друг к другу (см. 11.2, рис. 11.104, В) также должен основываться на хемотропизме. Хемотропные реакции, индуцированные собственными веществами организма, называются «аутохемотропизмом». Такая реакция лежит в основе отклонения спорангиеносцев Phycomyces от смежных твердых поверхностей, которое осуществляется без соприкосновения с ними и, вероятно, базируется на сниженной диффузии («заторе») газообразного этилена в непосредственной близости от препятствия. Этилен образуется спо- рангиеносцами в больших количествах.
У побегов высших растений хемотропные реакции играют роль лишь в исключительных случаях. Так, проростки Cuscuta растут ориентированно к своим растениям-хозяевам. Вероятно, хемотропным действием обладают выделяемые хозяевами летучие соединения (спирты, эфиры, эфирные масла, а возможно, и водяной пар). Хемотропные реакции могут иметь значение и при поиске гаусториями паразита специфических тканей хозяина (например, ситовидных трубок).
Предполагается, что рост пыльцевых трубок через рыльце и столбик пестика предопределяется преимущественно анатомически. Однако при прорастании пыльцы определенную роль могут играть и положительно гидротропные реакции (в направлении возрастающей концентрации воды), а также и отрицательно аэротропные (в направлении убывающей концентрации кислорода). Похоже, что лишь в непосредственной близости к семяпочке пыльцевые трубки направляются хемотропно действующими веществами, выделяемыми семяпочкой.
Корни также способны к положительному хемотропизму, например, на фосфатные ионы, на возрастающее парциальное давление О2 (положительный аэротропизм в направлении хорошо вентилируемых участков почвы; структура почвы — см. 6.2.3) и на возрастающую влажность почвы (положительный гигротропизм). Таким способом корни деревьев находят малейшие дефекты в подземной канализационной сети и затем образуют в водопроводных трубах закупоривающие их «корневые пробки». Кроме корней и пыльцевых трубок положительным гигротропизмом обладают ризоиды мхов и заростки папоротников, а также проростки Cuscuta, которые благодаря этому находят своих хозяев по транспирации. Некоторые паразитические грибы гигротропно направляются к устьицам, через которые они проникают в листья. Вследствие этого частота инфицирования значительно (до 90%) сокращается при закрытых устьицах. Наконец, чувствительные волоски листьев Drosera с радиальным строением, расположенные на поверхности листа, положительно хемотропны, например, по отношению к ионам NH+4, и поэтому закрываются над жертвой, пойманной клеящими желёзками (см. 9.1.2). Краевые чувствительные волоски листьев, построенные дорсовентрально, проявляют хемонастическую реакцию (см. рис. 8.28, G).
В основе всех известных на сегодняшний день хемотропизмов лежат ростовые процессы. О восприятии и проведении сигналов при хемотропизме ничего не известно.
Настии, как и тропизмы, представляют собой вызываемые определенными раздражителями движения живых органов, но в отличие от тропизмов (см. 8.3.1) их ход задается планом строения. Настии подразделяются в зависимости от вида раздражителя: термо-, фото-, тигмо-, хемо- и сейсмонастии, а в случае замыкающих клеток устьиц также гигронастии. Часто, но не всегда, настии осуществляются благодаря обратимым изменениям тургора.
Некоторые цветки (например, тюльпаны, крокусы, маргаритки) открываются при повышении температуры и закрываются при охлаждении. Чувствительность к температуре весьма значительна: цветки крокуса реагируют на различия температуры начиная уже от 0,5 °С, цветки тюльпана — от 1 °С. Термонастия осуществляется благодаря различиям роста нижней и верхней сторон основания листочка околоцветника (температурный оптимум для роста растяжением верхней стороны лежит выше). Масштаб движения определяется скоростью изменения температуры: чем быстрее оно происходит, тем интенсивнее движение. Листочки околоцветника долго остаются реакционноспособными, у тюльпана они удлиняются при одном-единственном движении до 7 %; на протяжении всего времени цветения полный прирост вследствие повторяющейся термонастической реакции может превысить 100 %.
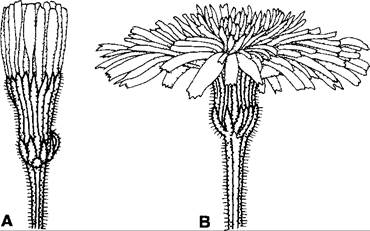
Колебания интенсивности света также могут — прежде всего опять-таки у органов околоцветника и листьев — приводить к настическим ростовым движениям, у листьев некоторых видов (например, Mimosa) также к управляемым тургором листовым движениям, за которые ответственны листовые подушечки. Фотонастии можно обнаружить у лепестков многих кувшинок, кактусов и кисличных, а также у корзинок многих сложноцветных растений сем. Asteraceae (рис. 8.26), у которых краевые язычковые цветки ведут себя как отдельные «лепестки». В большинстве случаев освещение вызывает открывание, затенение (часто бывает достаточно проходящей тени облака) или затемнение — закрывание цветков. Растения, цветущие ночью (например, Silene nutans), реагируют противоположным образом. В процессе роста листья совершают фотонастические движения (например, виды Impatiens), тогда как у листьев, завершивших рост, они происходят лишь при наличии листовых подушечек (например, Oxalis, Mimosa).
Рис. 8.26. Соцветие-корзинка Leontodón hispidas (сем. Asteraceae): А — в темноте закрыта; В — на свету открыта
Механизм работы листовых подушечек выяснен лишь частично. Речь идет об «осмотических моторах», принцип функционирования которых предположительно близок к сейсмонастиям (см. 8.3.2.4). Считают, что настии, обусловленные обратимыми изменениями тургора, в том числе, например, настические движения замыкающих клеток устьиц, основываются на общих биохимических принципах (см. также 8.3.2.5).
Опыты с освещением показывают, что многие фотонастические движения протекают при участии фитохромной системы, а именно фитохрома класса II (см. 7.7.2.4), поэтому проявляется классическая фотообратимость: красный свет/дальний красный. У Mimosa (рис. 8.27) восприятие ночного (темнового) состояния индуцируется вспышкой красного света (К), а вспышка дальнего красного света (ДК) ему препятствует. Следовательно, чтобы вызвать движение, требуется активный фитохром. Молекулярные процессы, происходящие при вызванном активным фитохромом изменении активности клеточных переносчиков ионов (возможно, ионных каналов, проводящих К+, СI-, а при определенных обстоятельствах также Са2+) и являющиеся предпосылками для тургорных движений, еще не раскрыты.
Рис. 8.27. Листочки 1-го порядка Mimosa púdica через 30 мин после перехода от белого света к темноте. Непосредственно после окончания освещения белым светом листочки в приведенном здесь порядке в каждом случае в течение 2 мин освещали красным светом (К) и дальним красным светом (ДК); (действие фитохромной системы см. 7.7.2.4). Листочки закрываются лишь в том случае, когда при наступлении темноты преобладает активный фитохром (Фдк, после освещения красным светом)

В то время как радиально построенные срединные железистые волоски листьев Drosera (рис. 8.28, G) проявляют хемотропизм, дорсивентрально построенные краевые железистые волоски отвечают на локальное раздражение хемонастией, при которой происходит смещение к середине листа. Таким образом они приводят добычу в соприкосновение с другими железистыми волосками, которые, по обстоятельствам, изгибаются лишь позже. Здесь также действуют органические соединения, выделяемые жертвой, и ионы NH+4. Усиление реакции достигается посредством одновременно передаваемой восприимчивости железистых волосков к прикосновениям. Механические раздражения обычно исходят от животного-добычи, которое удерживается на листе клейкими выделениями желёзок на головках волосков.
8.3.2.4. Тигмонастии и сейсмонастии
Тигмонастии, или движения, вызываемые прикосновениями (контактными раздражителями), ход которых зависит от плана строения данного органа, широко распространены в растительном царстве. Их можно разделить на две группы.
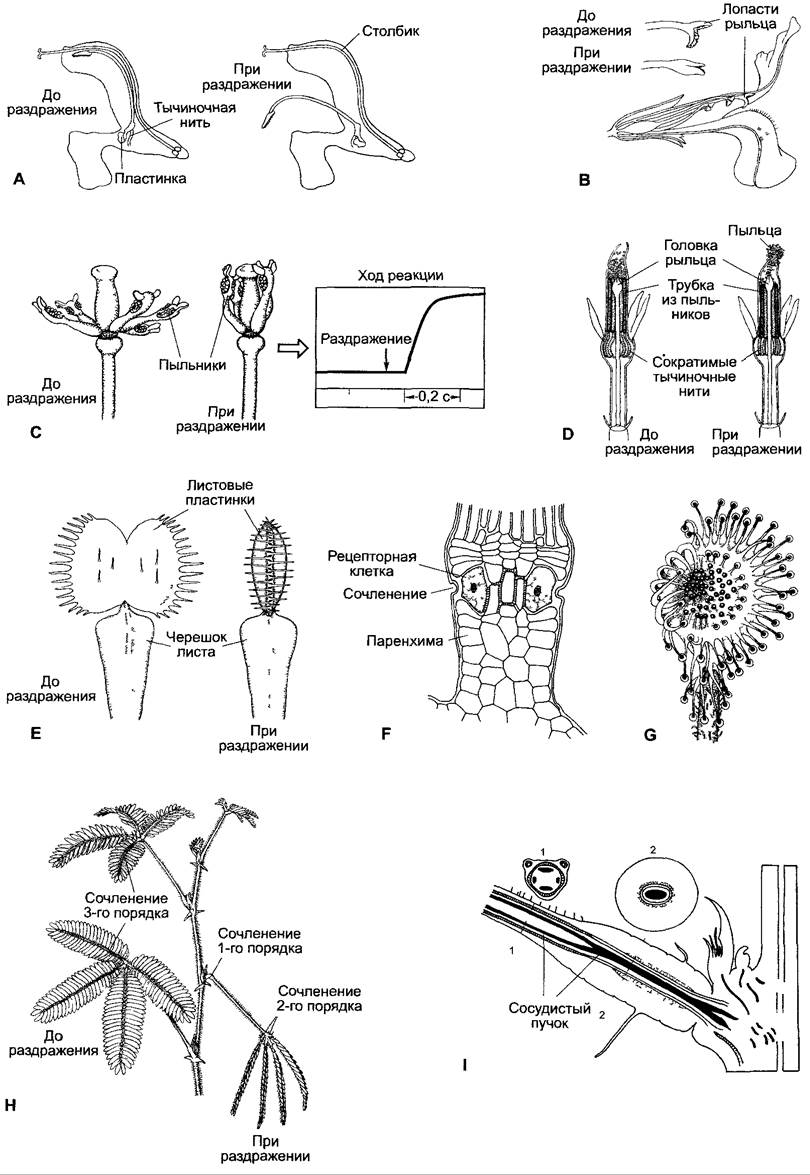
Первая группа охватывает движения, протекающие очень быстро и основанные на изменениях тургора (рис. 8.28). Эти движения могут быть вызваны и бесконтактным (но гораздо более сильным) раздражителем — сотрясением, поэтому именуются также сейсмонастиями. Однако в природе, как правило, контактный раздражитель в качестве физиологического стимула реакции более актуален, чем сотрясение. К этой группе настий относятся быстрые листовые движения мимозы Mimosa púdica (рис. 8.28, Н, I); предназначенные для ловли насекомых захлопывания листьев венериной мухоловки Dionaea muscipula (рис. 8.28, Е, F); вызываемые опылителями движения тычинок, служащие для стряхивания пыльцы на опылителя (например, направленные у барбариса Berberis и опун- ции Оpuntia внутрь, у спарманнии Sparmannia — наружу, у видов Centaurea — сократимые тычиночные нити, рис 8 28, А, С, D), воспринимающие раздражения рыльца пестиков (например, у видов Mimulus, Catalpa, Torema, у которых лопасти рылец при прикосновениях захлопываются и при этом снимают пыльцу с задевшего их насекомого, рис 8 28, В).
Рис. 8.28. Быстро протекающие настии цветков (A—D) и листьев (Е—I) А — шлагбаумный механизм у шалфея лугового (Salvia pratensis) Обе тычиночные нити срослись с трубкой венчика Один из связников образует с пыльниками пластинку другой сильно удлинен и вместе с пыльниками вдается в верхнюю губу Когда насекомое в поисках нектара задевает пластинку, плечо рычага длинного связника опускается и пыльца высыпается на спину насекомого, В — цветок Mimulus luteus (срезан так, что видны тычинки и рыльце пестика в покое), выше — вид сбоку нераздраженного и раздраженного рыльца, С — цветок Berberis vulgaris (околоцветник удален) В раздраженном состоянии пыльники прилегают к рыльцу Диаграмма временной ход реакции тычиночных нитей, D — цветок из центральной части корзинки Centaurea jacea (срез) В раздраженном состоянии тычиночные нити сокращаются до 30% Сокращение после раздражения вызывает перемещение сросшихся в трубку пыльников вниз, и работающий как поршень столбик пестика рыльцем выдвигает пыльцу, находившуюся в трубке пыльников Теперь пыльца может налипнуть на насекомое, Е — лист Dionaea muscipula с 3 чувствительными ресничками на каждой половине листовой пластинки, F — продольный срез через основание чувствительной реснички, G — лист Drosera rotundifolia, вид сверху, левая сторона раздражена Краевые чувствительные реснички проявляют настические реакции, внутренние — тропические Н — побег Mimosa púdica один лист раздражен При сотрясении или раздражении листочков сложных листьев они складываются попарно один на другой наискось кверху вторичные листовые черешки сближаются боками и, наконец, первичный черешок (рахис) также откидывается вниз При сильном раздражении возбуждение может распространиться и по побегу вверх и вниз на расстояние до 50 см Листья, до которых дошло возбуждение, реагируют в следующей последовательности листовая подушечка (сочленение) 1 -го порядка (в основании первичного рахиса листа), затем листовые подушечки 2-го и 3-го порядка, I — продольный срез через первичную (1-го порядка) подушечку Mimosa púdica и поперечные срезы через места, обозначенные 1 и 2 Проходящий в участке подушечки центральный тяж сосудистого пучка облегчает движение сочленения Теряющая тургор при раздражении паренхима нижней стороны подушечки (моторная ткань) называется также экстензором (разгибателем), а паренхима верхней стороны, тургор которой увеличивается, — флексором, так как повышение тургора в этой ткани сопряжено с изгибанием (лат flexio — изгиб), в то время как повышение тургора в экстензоре — с распрямлением листового черешка (лат extendere — растягивать)
Ко второй группе относят более медленные реакции, вызываемые прикосновениями, но не сотрясениями, которые наряду с компонентом, управляемым тургором, всегда включают ростовые процессы. Сюда входят прежде всего движения усиков (если речь не идет о тигмотропизмах, см 8 3 13).
Характерным для быстрых тигмонастий первой группы, вызываемых и сотрясениями, является то, что происходит реакция по типу «все или ничего» Если сила раз
дражения превосходит пороговое значение, реакция следует во всей полноте Таким образом, в большинстве случаев не обнаруживается пропорциональности между величинами раздражения и реакции (рис 8 28, С) Время реакции (от начала раздражения до начала движения) составляет у Dionaea и Berberís при оптимальных условиях 0,02 с, у Mimosa — 0,08 с, сейсмонастические движения продолжаются у Dionaea и Berberis более 0,1 с, у Mimosa — 1 с, у Mimulus — 6 с Восприятие раздражения всегда связано с деформацией клеточных структур Воспринимающие раздражение клетки расположены на основаниях тычиночных нитей или на лопастях рылец, в «чувствительных щетинках» на внутренних сторонах листьев-ловушек у Dionaea млн листовых подушечек у Mimosa Эти «чувствительные щетинки» подобно рычагам усиливают деформацию воспринимающих раздражение клеток в основаниях щетинок. У Mimosa подобно рычагам могут действовать при прикосновении листочки сложного листа, вызывая реакцию. Вероятно, раздражение сотрясением во всех случаях при достаточно сильном сотрясении вызывает достаточно сильное действие рычага (например, посредством движения тычиночной нити) и таким образом преодолевается порог раздражения. Реакционноспособные ткани (говорят также о моторных тканях, имея в виду те, которые после раздражения претерпевают быструю потерю тургора) идентичны у тычиночных нитей и лопастей рылец с клетками, воспринимающими раздражение. Но у Dionaea и Mimosa чувствительные клетки и моторные ткани расположены раздельно: у Dionaeaза настическое движение листа отвечают ткани, находящиеся в средней жилке листа на верхней стороне, а у Mimosa — в листовых подушечках (пульвинусах) 1-го порядка (на основаниях листовых черешков с нижней стороны), 2-го порядка (на основаниях черешков сложного листа с верхней стороны) и 3-го порядка (на основаниях листочков сложного листа с верхней стороны; рис. 8.28, Н). В этих случаях сигнал должен проводиться от места рецепции к моторной ткани. Проведение сигнала здесь имеет электрическую природу, а у Mimosa, предположительно, участвует также химический компонент (см. ниже).
В настоящее время исследователи исходят из того, что в моторных тканях все настии, определяемые тургором, протекают по сходному механизму или даже одинаково. Однако опыты проводили преимущественно на Mimosa. Считается, что из моторных клеток происходит выход КС1, иногда очень быстрый, за которым следует осмотически сопряженный с ним выход воды. В листовых подушечках Mimosa жидкость, выходящую в апопласт и заполняющую межклетники, можно легко обнаружить по потемнению нижней стороны листовой подушечки 1-го порядка.
Реакция моторной клетки начинается с очень быстрого повышения проницаемости плазмалеммы для хлорида (рис. 8.29). Вследствие выхода ионов СI- из клетки происходит деполяризация мембраны, т. е. значительная отрицательная величина электрического мембранного потенциала (у разных объектов он находится в пределах от -80 до -100 мВ, внутренняя среда клетки отрицательна по отношению к внешней поверхности) изменяется на 100 мВ и более, иногда достигая положи-
тельных величин. Деполяризация приводит к открыванию калиевых каналов, которые обусловливают однонаправленное движение ионов К+ из клетки. Таким образом происходит реполяризация электрического мембранного потенциала, вплоть до величины покоя. Эффект может усиливаться одновременным закрыванием потенциалзависимых К+-каналов, обеспечивающих вход К+ в клетку, которые могут открываться лишь при достаточно большом отрицательном мембранном потенциале. Быстрая потеря KCI снижает осмотический потенциал клетки, вода выходит в апопласт. Электрическими процессами определяются все характеристики потенциала действия. Обсуждают также возможность того, что в системах, у которых место восприятия раздражения удалено от моторной ткани (у Dionaea, Mimosa), передача сигнала осуществляется потенциалами действия, создаваемыми потоками К+ и СI-. Эти потенциалы действия могут распространяться от одной клетки к другой, насколько позволяют их симпласты, соединенные мостиками плазмодесм. Предполагают также возможность проведения импульса по ситовидным трубкам флоэмы. Скорости передачи сигнала во всех случаях значительны и могут достигать у Mimosa 3 — 10 см • с-1, у Dionaea 6 — 20 см • с1. Эти величины лежат уже в области скоростей проведения в нервах низших животных (у беззубки лишь 1 см • с-1).
Рис. 8.29. Схема возникновения потенциала действия на плазмалемме раздражаемой клетки. В состоянии покоя ионы К+ и СI- постоянно поступают в клетку и вновь выходят из нее путем диффузии. Для поглощения ионов используется энергия протон-движущей силы (6.1.4.3, 6.1.5). Сумма всех ионных потоков через плазмалемму составляет потенциал покоя, в зависимости от типа клетки и физиологического состояния от -80 до -180 мВ (на внутренней стороне клеточной мембраны он более отрицателен, чем на наружной). После раздражения очень быстро возрастает проницаемость мембраны для ионов СI-, мембрана деполяризуется (потенциал становится более положительным и при определенных обстоятельствах даже приобретает положительные значения). Реполяризация мембраны происходит путем последующего повышения проницаемости мембраны для ионов К+ при одновременном снижении проводимости для ионов СI-. Это ведет к временной слабой гиперполяризации мембраны (потенциал становится отрицательнее, чем потенциал покоя). В конечном счете потенциал покоя вновь восстанавливается и проницаемости достигают исходного уровня

Неясным остается первичный процесс механоэлектрического сопряжения. В замыкающих клетках (см. 8.3.2.5), которые среди растительных клеток охарактеризованы лучше всего с точки зрения электрофизиологии, более медленное настическое движение осуществляется посредством принципиально очень сходных (идентичных?) ионных потоков. В этом случае известно, что на начальном этапе закрывания устьиц деполяризующий поток хлорида переносится СI--каналами плазмалеммы, которые открываются вследствие повышения цитоплазматической концентрации ионов кальция. В замыкающих клетках освобождение кальция индуцируется, например, выделяющимся при водном стрессе фитогормоном абсцизовой кислотой (см. 7.6.4). Вероятно, но точно не показано, что в воспринимающих раздражение клетках тигмо- и сейсмонастических органов деполяризующий поток хлорида также индуцируется ионами кальция. Ионы Са2^ могут поступать в цитоплазму при деформации клеток через ме- ханочувствительные Са2+-каналы из апопласта или из внутриклеточных депо (ЭР, вакуоли). Такие каналы должны участвовать также и в механизме восприятия (см. 8.3.1.2), но до сих пор их не удалось идентифицировать на молекулярном уровне.
В настическом движении участвуют не только моторные клетки с пониженным тургором, но и ткани, лежащие, напротив. Это можно особенно отчетливо наблюдать на листовых сочленениях, или подушечках (например, у Mimosa, см. рис. 8.28, I). Утрата тургора моторной тканью приводит к снижению водного потенциала (![]() , см. уравнение 6.15) в клетках противоположного края органа, так как гидростатическое давление в них снижается вследствие потери упругости моторной тканью. Это вызывает поступление воды в клетки: в то время как моторные ткани отдают воду, противолежащие клетки поглощают ее и набухают, усиливая настическое движение. Если дальнейшее раздражение отсутствует, то орган через некоторое время возвращается в исходное положение, причем за счет активных процессов поглощения ионы вновь транспортируются в моторные клетки и тургор восстанавливается (время восстановления тургора у Mimosa составляет около 15 — 20 мин, у Dionaea — несколько часов, у тычиночных нитей Berberís или Centaurea — около 1 мин). После этого возможны новое раздражение и реакция. Однако листовые ловушки насекомоядных растений в случае успешной ловли остаются закрытыми гораздо дольше (неделями), и этот период в некоторых случаях (Dionaea) еще усиливается вследствие более длительных ростовых процессов. Хемонастическое действие при этом оказывают органические вещества пойманных животных, пока их трупы не будут полностью лизированы растительными пищеварительными ферментами. При определенных обстоятельствах ловушка впоследствии вообще не открывается.
, см. уравнение 6.15) в клетках противоположного края органа, так как гидростатическое давление в них снижается вследствие потери упругости моторной тканью. Это вызывает поступление воды в клетки: в то время как моторные ткани отдают воду, противолежащие клетки поглощают ее и набухают, усиливая настическое движение. Если дальнейшее раздражение отсутствует, то орган через некоторое время возвращается в исходное положение, причем за счет активных процессов поглощения ионы вновь транспортируются в моторные клетки и тургор восстанавливается (время восстановления тургора у Mimosa составляет около 15 — 20 мин, у Dionaea — несколько часов, у тычиночных нитей Berberís или Centaurea — около 1 мин). После этого возможны новое раздражение и реакция. Однако листовые ловушки насекомоядных растений в случае успешной ловли остаются закрытыми гораздо дольше (неделями), и этот период в некоторых случаях (Dionaea) еще усиливается вследствие более длительных ростовых процессов. Хемонастическое действие при этом оказывают органические вещества пойманных животных, пока их трупы не будут полностью лизированы растительными пищеварительными ферментами. При определенных обстоятельствах ловушка впоследствии вообще не открывается.
В качестве примера длительных тигмонастий, которые не могут быть вызваны сейсмическими раздражителями, следует обсудить особенно примечательные реакции усиков лазающих растений, которые обхватывают опору. Хорошо изучены сложные усики тыквенных, особенно переступня, Bryonia (рис. 8.30).
Рис. 8.30. Переступень (Bryonia dioica): А — часть побега с усиками на разных стадиях развития (приблизительно 1/Зх). Самый верхний (самый молодой) усик еще свернут наподобие часовой пружины, в середине усик, примерно день назад обхвативший опору. Тигмонастическая реакция полностью завершилась. Стрелка указывает на точку, в которой произошло изменение направления закручивания (в данном случае единственную); внизу слева усик с возрастным закручиванием. «Чувствительные поры» во внешних стенках эпидермиса; В — на поперечном срезе; С — вид сверху

Усики тыквенных гомологичны боковым побегам. У Bryonia дорсивентрально построенный участок усика, который осуществляет движение, гомологичен кроющему листу, а радиально-симметричная и постоянно вытянутая базальная часть усика гомологична боковому побегу. Пазушная почка усиков Bryonia выпала, но у других тыквенных (например, у Cucurbita) она присутствует и также образует усик («разветвленные усики»).
Усики Bryonia, на ранней стадии свернутые наподобие часовой пружины, развертываются в процессе развития и становятся чувствительными к механическим раздражениям. Как кончики побегов, так и усики совершают автономные круговые движения (круговые нутации). Это увеличивает шансы растения встретить препятствие. Обычно наиболее чувствительна к прикосновениям верхняя треть усика. Усики Sicyos и Momordica изгибаются при прикосновении как к верхней, так и к нижней стороне, и нижняя сторона становится вогнутой. Усики Bryonia и Pisum, как и многие другие, реагируют на прикосновения только к верхней стороне. Однако раздражение верхней стороны прекращает реакцию нижней стороны на раздражение. Таким образом, верхняя сторона такого усика также чувствительна к механическим раздражениям, и в этих случаях также безусловно имеет место настическая реакция. Наконец, имеются виды (например, Cobaea scandens, виды Сissus), усики которых построены как морфологически, так и физиологически радиально, поэтому они могут изгибаться во всех направлениях, причем вогнутой всегда становится сторона, испытывающая раздражение. Следовательно, здесь имеет место тигмотропизм.
Усики реагируют не просто на раздражение давлением, но на раздражение трением. Поток воды, дождь, постоянное давление или прикосновение гладкой палочкой не стимулируют реакцию усиков, но ее вызывает поток воды с суспендированными частицами гипса или прикосновение шероховатой палочкой. Изгибание вызывает даже движение шерстяной ниточки весом всего лишь 2,5 • 10-7 г (0,25 мкг) (человеческое осязание не воспринимает такое раздражение).
Следовательно, усик реагирует не просто на давление, но на пространственное и временное различия в давлении. С восприятием раздражения связывают примечательные пузыревидные выпуклости, различимые на микроскопических препаратах как сходные с порами образования внешней стенки эпидермальной клетки («чувствительные поры», см. рис. 8.30). Однако они имеются не во всех усиках, а иногда находятся только на их нижней стороне, хотя раздражение воспринимает и верхняя сторона. Поэтому здесь мы имеем дело скорее с усилителем раздражения, чем с механорецептором. В пользу этого говорит тот факт, что «чувствительные поры» характерны лишь для самых восприимчивых усиков.
При прикосновении к опоре усик Bryonia, как и усики других растений, проявляющие настические реакции, изгибается к морфологически нижней стороне. При благоприятных условиях у восприимчивых усиков (например, у Bryonia, Sicyos, Cyclanthera) время реакции может составлять менее 30 с, но у других видов (например, Corydalis claviculata) до 18 ч. Быстрые реакции основываются на потере тургора на морфологически нижней стороне и его повышении на противоположной стороне. При кратковременном раздражении, если, например, не удается успешно обхватить опору, усик в течение 30 — 60 мин вновь распрямляется (аутотропизм) и может реагировать повторно. Если же опора захвачена, то продолжающееся изгибание приводит к многократному обвиванию опоры кончиком усика. В этой реакции у молодых усиков участвует также быстрый рост растяжением кончика усика, у полностью выросших органов задействовано лишь изгибание, обусловленное тургором.
Более базальные части усика также претерпевают закручивание (см. рис. 8.30), вследствие чего все растение эластично упруго притягивается к опоре. У Bryonia скручивание происходит путем замедления роста растяжением на нижней стороне усика, в то время как рост верхней стороны продолжается, а при определенных обстоятельствах даже ускоряется. Из-за механических свойств эта реакция должна включать один или несколько этапов обращения направления закручивания (см. рис. 8.30, А) между лево- и правовращающими витками, чтобы уменьшить деформирующее напряжение. В конечном счете вследствие механического раздражения происходит также формирование упрочняющих элементов и часто образуются утолщения (тигмоморфозы), в результате чего закрепление стабилизируется.
В настоящее время имеются лишь приблизительные представления о передаче сигнала от воспринимающего раздражение кончика усика к его основанию; она начинается на всей их длине почти одновременно с изгибанием приблизительно через 1,5 — 2 ч после того, как кончик усика успешно обхватил опору. Обусловленное тургором контактное изгибание кончика усика вокруг опоры может осуществляться благодаря кальцийзависимой реакции; способ действия может быть сходным с таковым при быстрых тигмо- и сейсмонастиях (см. рис. 8.29). В базальных частях раздражаемого усика удалось зарегистрировать электрические токи с помощью поверхностных электродов. Следовательно, в определенных обстоятельствах сигнал передается в виде электрических импульсов. В индукции базального изгиба, обусловленного различным ростом сторон, вероятно, участвуют фитогормоны. Применяя этилен, ауксин или октадеканоиды (например, жасминовую кислоту, см. 7.6.6.2), можно вызвать тигмонастическую реакцию усиков Bryonia без прикосновения. Имеются указания на то, что после механического раздражения в них выделяется 12-оксофитодиеновая кислота (см. 7.6.6.2, рис. 7.66) и что это вещество является эндогенным индуктором1ростовой реакции (но вряд ли служит проводником сигнала).
1 В отечественной литературе вещества этого класса (оксилипины) принято считать вторичными мессенджерами, стоящими в сигнальном пути между индуктором (первичный мессенджер) и ответными реакциями внутри клетки. — Примеч. ред.
8.3.2.5. Настические движения замыкающих клеток устьиц
Данный вопрос рассматривается отдельно не только из-за большого значения, которое имеют движения устьичных клеток для газообмена большинства наземных растений, но и потому, что в последние годы молекулярные процессы, лежащие в основе настических движений, особенно интенсивно изучаются и хорошо поняты. Можно считать, что молекулярные процессы регуляции тургора замыкающих клеток устьиц сходны с процессами, управляемыми тургором, включающимися при других движениях (см. 8.3.2.1 — 8.3.2.4), поэтому они имеют общее значение для контроля тургора растительных клеток в зависимости от обстоятельств.
Соответственно назначению устьиц регулировать сопротивление листьев диффузии таким образом, чтобы (в зависимости от имеющегося запаса воды) поглощение СО2 для его фотосинтетической или темновой фиксации было оптимальным, ус- тьичные реакции можно разделить на фотонастические и гигронастические. Выделяют также термонастическую реакцию, которая представляется экологически целесообразной, поскольку при повышении температуры сильно возрастает потеря воды растением вследствие транспирации. На эти движения, индуцированные внешними условиями, накладывается циркадная ритмика; это значит, что в течение суток проявляется различная готовность реагировать на экзогенные факторы. Реакции открывания устьиц в светлое время также эндогенно предпочтительны. Датчиком времени для этой ритмики является смена дня и ночи (см. 7.7.2.3).
Непосредственной причиной движения в каждом случае служит различие тургора (разд. 6.15) в замыкающих клетках и граничащих с ними эпидермальных клетках, которые могут иметь морфологические особенности и в таком случае имеют специальное название — побочные клетки (см. 3.2.2.1, рис. 3.12). Изменения тургора происходят в основном вследствие изменений осмотического потенциала и сопряженных водных потоков; они связаны также с изменениями объема замыкающих клеток и граничащих с ними эпидермальных клеток; регулирующие факторы в этих двух типах клеток оказывают противоположное влияние на такие изменения. Если осмотическое давление в замыкающих клетках возрастает относительно окружающей среды (т. е. осмотический потенциал становится более отрицательным), это приводит к поступлению воды в клетку, увеличению тургора и объема замыкающей клетки. Если осмотическое давление снижается относительно окружающей среды, вода выходит из клетки, тургор уменьшается, и замыкающая клетка сжимается.
Активным устьичным движениям, основанным на изменениях осмотического потенциала замыкающих клеток относительно примыкающих клеток, противостоят пассивные устьичные движения, происходящие вследствие различной потери воды или различного поглощения воды, т.е. чисто гидропассивные.
Известна такая потеря объема (абсолютная и относительно соседних клеток), когда транспирация замыкающих клеток («перистоматарная транспирация») выше, чем соседних. Замыкающие клетки действуют в таком случае как «датчики» относительной влажности воздуха. В пользу этой функции говорит тот факт, что листья с одинаковым содержанием воды оказывают в сухом воздухе значительно более высокое сопротивление транспирации, чем во влажном. Вследствие индуцированного подобным способом закрывания устьиц транспирация в сухом воздухе более ограничена, и содержание воды в листе выше, чем во влажном воздухе.
Гидропассивные процессы часто лежат в основе быстрого увядания срезанных листьев. У таких листьев обусловленная транспирацией потеря воды эпидермальными клетками наступает быстрее, чем замыкающими клетками, и устьица открываются.
При увеличении объема замыкающих клеток устьица открываются, при уменьшении объема — закрываются. Это обусловлено строением стенок замыкающих и соседних с ними клеток, прежде всего особенностями расположения микрофибрилл в клеточных стенках, которые определяют направление растяжения клеток (рис. 8.31). Изменение объема замыкающих клеток может быть значительным: объем замыкающих клеток Vicia faba составляет при закрытых устьицах 1,3 пл (пиколитр, 1 пл = 10-12 л), при полностью открытых устьицах — 2,4 пл.
Рассмотрим только активные устьичные движения, подлежащие регуляции. В их основе лежат первичные изменения осмотического потенциала замыкающих клеток.
Рис. 8.31. Схематическое изображение направления целлюлозных микрофибрилл в клеточных стенках замыкающих клеток устьиц и смежных (побочных) эпидермальных клеток: А — бобовидные замыкающие клетки коммелиновых; вид сверху на клеточные стенки. Растяжение клеток возможно преимущественно перпендикулярно к направлению микрофибрилл. Бобовидные замыкающие клетки растягиваются преимущественно в направлении продольной оси. Но лежащие поперек продольной оси замыкающих клеток побочные эпидермальные клетки (меньшие) оказывают более значительное сопротивление растяжению замыкающих клеток, чем обе расположенные по бокам (большие) смежные клетки. Таким образом, увеличение в объеме замыкающих клеток при изгибании приводит к их расхождению и, следовательно, к открыванию устьичной щели; В — гантелевидные замыкающие клетки злаковых: замыкающие клетки изображены в оптическом срезе, остальные — как вид сверху. Радиально расположенные микрофибриллы позволяют увеличивать объем клеток лишь путем увеличения их радиуса. На концах замыкающих клеток есть шарообразные вздутия, в результате увеличения которых щель между клетками в центральной части становится больше и устьице открывается
Главным осмотиком замыкающих клеток, как и вообще растительных клеток, служат ионы калия (К+, рис. 8.32). Вакуолярная концентрация калия при открытых устьицах может составлять более 600 ммоль • л-1, при закрытых устьицах она лежит в пределах от 100 ммоль • л-1 и ниже. В качестве противоиона для компенсации электрического заряда используются анионы. У двудольных покрытосеменных противоионом служит преимущественно дикарбоновая яблочная кислота. Анион яблочной кислоты (малат2) накапливается в вакуоли вместе с калием (малат калия). Образование малата в замыкающих клетках происходит путем разложения крахмала до фосфоенолпирувата (ФЕП) в процессе гликолиза, дальнейшего карбоксилирования ферментом ФЕП-карбоксилазой и восстановления продукта реакции — оксалоацетата — до малата. Эту последовательность реакций мы уже рассматривали в связи с САМ-метаболизмом (см. 6.5.9, рис. 6.79). Наряду с органическими анионами осмотиками служат также неорганические ионы, прежде всего хлорид (СI-), особенно у однодольных. У них для компенсации электрического заряда малат заменяется ионом хлорида (СI-) либо полностью (например, у Аliumсера отсутствует используемый в листьях для синтеза крахмала фермент АДФ-глюкозопирофосфорилаза, см. рис. 6.72), либо частично (у кукурузы приблизительно до 40%). Хлорид поступает в замыкающие клетки вместе с калием.
Рис. 8.32. Распределение калия, хлора и фосфора вдоль среза, закрытого (слева) и открытого (справа) устьица нижнего эпидермиса листа Vicia faba в относительных единицах концентрации. Измерение с помощью рентгеновского микрозонда. Среди исследованных элементов лишь для К+ показано заметное увеличение концентрации в замыкающих клетках при открывании устьиц
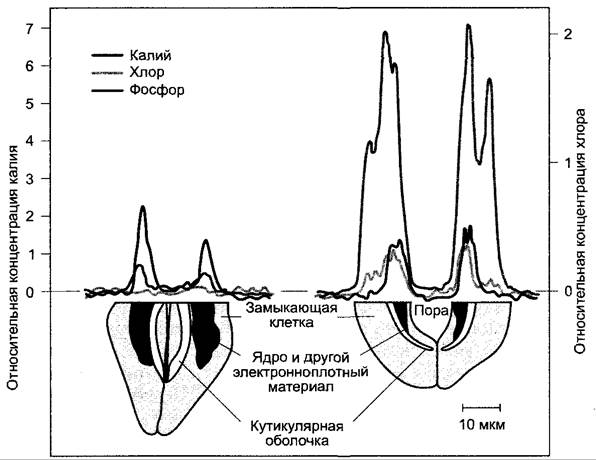
Поглощение К+ замыкающими клетками осуществляется через потенциалзависимые К+-каналы, транспортирующие калий только в клетку, но не из нее, степень открывания этих каналов (см. 6.1) значительно возрастает при достаточно большой разнице электрического мембранного потенциала (внутри клетки он более отрицателен, чем снаружи; упрощенно говорят о гиперполяризации мембраны). Мембранный потенциал создается вследствие активности Н+-АТФазы плазмалеммы («протонной помпы»), которая транспортирует ионы водорода из клетки в апопласт (1 Н+ на гидролизуемую АТФ, см. 6.1.5, рис. 6.4; 6.5). Образующаяся при этом на мембране протон-движущая сила (см. 6.4.1.3) также содействует поглощению замыкающими клетками хлорида, за которое отвечает, вероятно, симпортер 2 Н+/1 СI- (см. рис. 6.5). За выход ионов К+ из клетки ответствен особый К+-канал, регулируемый совершенно иначе. Он пропускает ионы только из клетки наружу, и вероятность его открывания возрастает, когда мембрана деполяризуется (потенциал становится более положительным); при гиперполяризации мембраны этот канал остается закрытым, так что при поглощении клеткой калия не происходит «калиевое короткое замыкание».1Регуляция устьичных движений в принципе может объясняться изменениями активности описанных систем ионного транспорта (рис. 8.33). Поскольку осмотически активные ионы в конечном счете поступают в вакуоли замыкающих клеток, а при закрывании устьиц соответственно выходят из вакуолей, то важен также ионный транспорт, осуществляемый тонопластом. Но эти процессы понятны еще не так хорошо, как процессы плазмалеммного транспорта.
1 Имеется в виду нерегулируемый быстрый поток ионов К+ через мембрану. — Примеч. ред.
Рис. 8.33. Упрощенная последовательность реакций: А — при открывании устьиц, инициированном синим светом, В — при закрывании устьиц под действием АБК. Более подробные объяснения см в тексте
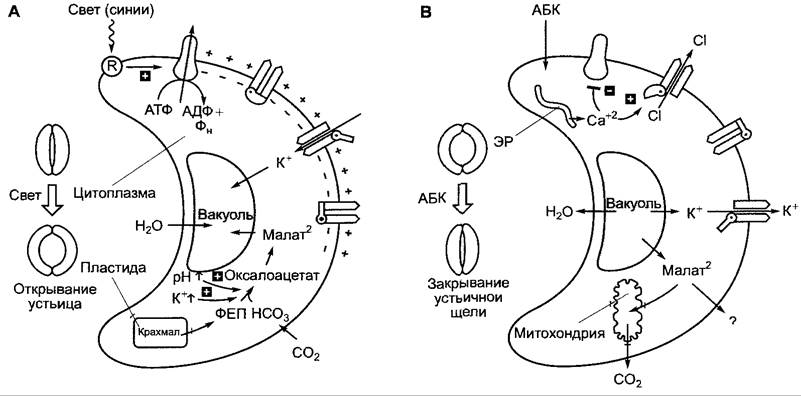
Свет, как правило, индуцирует открывание устьичных щелей. Восприимчивость к нему у замыкающих клеток чрезвычайно высока; чтобы индуцировать открывание, достаточно 25 — 30 пмоль фотонов см-2 • с-1. На спектрах действия этой фотонастии обнаруживаются пики в красной и особенно в синих областях спектра. Открывание устьиц под влиянием красного света осуществляется за счет фотосинтеза. Красный свет здесь является не возбудителем настии, а источником энергии фотосинтеза.1 Собственно регуляция поэтому не осуществляется красным светом, а опосредована концентрацией СO2 в листе — [СO2], которая рассчитывается для замыкающих клеток, хотя определяется по продуктивности фотосинтеза в мезофилле. Фотосинтез замыкающих клеток, имеющих, за некоторыми исключениями (например, Раphiо- реdilum), хлоропласты, в любом случае вносит лишь ограниченный вклад в это понижение [СO2]. Открывание устьиц может происходить не только при освещении, но также в результате темновой фиксации СO2 (например, ночью у САМ-растений, см. 6.5.9) или при экспериментальном снижении [СO2] во внешнем воздухе и на свету. Напротив, повышение [СO2] во внешней среде, как и на свету, может индуцировать закрывание устьиц (хемонастия). В определенных пределах изменение сопротивления диффузии посредством устьичных движений поддерживает на постоянном уровне концентрацию СO2 в замыкающих клетках и пропорционально ей — в межклетниках, или по меньшей мере предотвращает значительные ее колебания. Природа сенсора СO2 и его влияние на осмотический потенциал (при снижении [СO2] в замыкающих клетках осмотический потенциал становится более отрицательным) еще не выяснены детально. Особенно эффективен для фотонастических движений устьиц синий свет Замыкающие клетки без хлоропластов реагируют только на эту часть спектра (например, Рарhiopedilum). Рецепторами синего света являются два фототронина — фототропин 1 и фототропин 2. Принято считать, что дополнительную роль играет также зеаксантин. Однако в этом можно усомниться, поскольку у мутантов с нарушением биосинтеза каротиноидов (известен, например, у Аrabidopsis thaliana) еще проявляется, хотя значительно слабее, зависимость открывания устьиц от синего света.2 Он активирует Н+-АТФазу на плазмалемме, что приводит к гиперполяризации мембранного потенциала и в результате к активированию потенциалзависимых направленных внутрь калиевых каналов Усиливается также поток хлорид-ионов внутрь клетки через симпортер 2Н+/1СI. Активность Н+-АТФазы можно измерить как индуцируемое синим светом подкисление апопласта замыкающих клеток (значения pH снижаются приблизительно от 7 до 5). Возрастающая концентрация К+ и подщелачивание цитоплазмы (вследствие интенсивного выхода Н+ из клетки возрастает значение pH в цитоплазме), как предполагается, активируют ФЕП-карбоксилазу, что ведет к усиленному образованию яблочной кислоты. Малат поступает с калием в вакуоль, ионы Н+, освобождающиеся при диссоциации образованной яблочной кислоты в малат, переводятся Н+-АТФазой в апопласт.
1 Эксперименты с бесхлорофилльными мутантами гороха, проведенные в России, доказывают участие фитохромной системы в регуляции устьичных движений (см. главу 7.7.2.4). — Примеч. ред.
2 Использование мутантов с нарушенным биосинтезом каротиноидов в данном случае сомнительно зеаксантин является одним из пред шественников в биосинтезе АБК Дефицит АБК существенно нарушает устьичные движения и формирует «увядающий» фенотип — Примеч. ред.
Активирование протонного насоса синим светом, вероятно, может осуществляться непосредственно в результате фосфорилирования фермента при участии регулируемой светом киназной функции фототропина (см. 8.3.1.1). Известно, что вблизи С-конца Н+-АТФазы происходит фосфорилирование остатка треонина (см. рис. 9.15, А), далее это ведет к связыванию адапторных белков из группы 14-3-3-белков и сильному повышению ферментативной активности. Токсин фитопатогенного гриба Fasicoccum amygdali фузикокцин снижает диссоциацию комплекса Н+-АТФазы и 14-3-3-белка и таким образом вызывает почти необратимую активизацию протонной помпы. Фузикокцин, токсин увядания, особенно активен по отношению к замыкающим клеткам. Под действием фузикокцина устьица открываются максимально.
При дефиците воды открывание устьиц прекращается, т. е. устьичные щели полностью закрываются. Эта реакция индуцируется фитогормоном абсцизовой кислотой (АБК, см. 7.6.4, рис. 7.58), которая при недостатке воды образуется в листьях, а также в корнях, откуда она и с транспирационным током переносится в замыкающие клетки. АБК первично индуцирует в замыкающих клетках освобождение ионов Са2+ из внутриклеточных компартментов. Возрастание уровня Са2+ от - 100 нмоль • л-1 до более чем 1 мкмоль • л-1 вызывает следующие процессы:
✵ уменьшает активность Н+-АТФазы, вследствие чего снижается трансмембранный концентрационный градиент Н+ и электрический мембранный потенциал становится более положительным (деполяризация);
✵ влияет на связывание ионов Са2+ на каналах, выводящих хлорид, и каналы открываются; ионы СI- пассивно (по направлению своего электрохимического потенциала) выходят из клетки, увеличивая деполяризацию мембраны; индуцируемый ионами Са2+выход хлорида участвует в снижении мембранного потенциала на плазмалемме (деполяризации) и в тех замыкающих клетках, в которых хлорид не запасается в качестве преобладающего противоиона по отношению к К+ (т. е. у двудольных растений).
Деполяризация имеет два следствия:
✵ открытые лишь при гиперполяризации каналы, проводящие К+ внутрь клетки, закрываются и
✵ особенно активные при деполяризованном мембранном потенциале каналы, выводящие К+, обеспечивают значительный отток К+ из клетки; анионы (СI- или малат2-выходят за ним, и клетка теряет воду вследствие осмотического сопряжения; выведенные ионы сохраняются в прилегающих клетках, вода осмотически перетекает за ними; для К+ (а у однодольных также для СI-) это легко показать гистохимически; у двудольных судьба малата, отдаваемого замыкающими клетками, еще не выяснена; возможно, часть малата может разлагаться до СO2 при образовании АТФ в митохондриях в процессе дыхания.
Движения, управляемые не внешними факторами, а эндогенно, называются автономными. Они могут осуществляться посредством ростовых или тургорных движений.
В случае тургорных движений речь идет о движениях листьев с дневной периодичностью, подчиняющихся циркадной ритмике, о которых упоминалось ранее (см.
7.7.2.3), например, у Mimosa и Phaseolus. Они осуществляются листовыми подушечками (листовыми сочленениями), способ функционирования которых также уже описывался (см. 8.3.2.4; рис. 8.28,1; но у Phaseolus они локализованы не в основании листового черешка, а в месте перехода листовой пластинки в черешок).
В случае ростовых движений речь идет о колебательных движениях (нутациях) проростков, осей молодых побегов и соцветий. Происходит неравномерный во времени рост разных сторон органа, что, вероятно, не является выражением физиологической адаптации, а показывает тонкую регуляцию роста растяжением в области побега.
Если орган описывает круговые движения, то говорят о круговых нутациях. Помимо проростков они встречаются у вьющихся и лазающих растений и рассматривались выше на примере Bryonia (см. 8.3.2.4). Круг, очерчиваемый кончиком побега хмеля, может иметь диаметр более 50 см, у Hoya carnosa он достигает более 150 см. Это сканирование пространства облегчает поиск подходящей опоры.
8.3.4. Разбрасывательные и взрывные движения, обусловленные тургором
При тургорных движениях, которые мы рассматривали до сих пор, изменения тургора на определенной стороне ведут к обратимым изгибам органа. В других случаях, преимущественно относящихся к распространению единиц размножения, для движения используются различия тургора между определенными слоями тканей. Эти движения в большинстве случаев не отражают типичный процесс раздражения, но, как правило, являются результатом естественных процессов развития и созревания и бывают необратимыми. Различают механизмы тургорного разбрасывания и тургор- ного разбрызгивания.
Механизмы тургорного разбрасывания основываются на напряжениях ткани. Набухающую ткань предохраняет от максимального поглощения воды и растяжения в длину ткань сопротивления. Если напряжение превосходит определенное пограничное значение (что может многократно усиливаться механическим раздражением), то имеет место взрывоподобное разрушение, причем орган разрывается вдоль подготовленного места растрескивания.
У видов недотроги (Impatiens) тонкостенные паренхимные клетки внешней стенки плода (набухающая ткань) при созревании развивает значительный осмотический потенциал (у I. parviflora отрицательнее: -2 МПа). В результате возникает сила натяжения, которой противодействуют самые внутренние слои внутренней стенки плода, состоящие из вытянутых волокнистых клеток (ткань сопротивления). Пока пять плодолистиков остаются сросшимися в виде трубки, плод сохраняется (мета-)стабильным, несмотря на преобладающее напряжение ткани. Но когда при прогрессирующем созревании срединные пластинки вдоль швов срастания плодолистиков растворяются (отделительная ткань), то после прикосновения или даже спонтанно может наступить компенсация напряжения. При этом в месте прикрепления плодолистиков к плодоножке происходит разрыв, плодолистики свертываются внутрь подобно часовой пружине и еще склеенные семена выбрасываются на расстояние до нескольких метров (у I. parviflora примерно до 3 м, у /. glandulifera до 6 м). Внешние части плода при свертывании удлиняются до 32 %, в то время как волокнистые слои укорачиваются приблизительно на 10 %. Сходные с Impatiens способы разбрасывания семян имеются, например, у растений из семейств тыквенных (Cyclanthera explodens) и крестоцветных (Cardamine impatiens), разбрасывание пыльцы из тычинок происходит, например, у крапивных (рис. 8.34). У рода орхидей Catasetum поллинии (см. 11.2, рис. 11.227, С, D) разбрасываются на расстояние до 80 см.
Рис. 8.34. Urtica dioica, продольный срез через мужской цветок. Пыльник левой тычинки еще зажат под краем недоразвитой завязи, в то время как справа тычиночная нить уже пружинисто распрямилась наружу и высвобождает пыльцу (приблизительно 10х)
Распространены и механизмы тургорного разбрызгивания. Среди высших растений примером может быть бешеный огурец (Ecballium elaterium). Тонкостенные крупные клетки внутри плода образуют набухающую ткань, в которой при созревании осмотический потенциал достигает почти -1,5 МПа. Внешние слои стенки плода образуют ткань сопротивления, испытывающую сильное эластичное растяжение. В конечном счете в месте прикрепления плодоножки формируется отделительная ткань; она разрывается, причем плодоножка вследствие внутреннего давления в плоде отбрасывается как пробка из бутылки шампанского. Одновременно сжимается растянутая до того стенка плода, причем его жидкое содержимое выбрасывается вместе с семенами (рис. 8.35). Семена разлетаются на расстояние более 12 м, в то время как опустошенная оболочка плода в результате отдачи отлетает в противоположном направлении.
Рис. 8.35. Ecballium elaterium, бешеный огурец: А — зрелый плод в момент отделения плодоножки и разбрызгивания мякоти плода с семенами (приблизительно 1/2х); В — продольный срез через еще неотделенный плод (схематично)
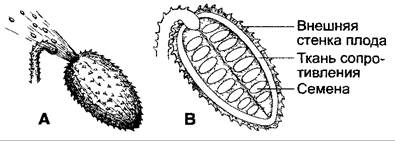
Разбрасывание грибных спор из зрелой сумки осуществляется следующим образом: клеточная стенка, эластично растянутая вследствие тургора (в зрелых сумках около 1 МПа), внезапно разрывается в заранее подготовленном месте кончика сумки (крышечке, см. 11.2, рис. 11.35), сумка сокращается до половины исходного объема, и споры под действием силы сокращения выбрасываются на расстояние от нескольких миллиметров до максимального — 60 см (у Dasiobolus immersus). Решающим при этом, как и в других случаях (например, для пыльцы Urtica), является то, что споры или пыльцевые зерна активным способом преодолевают слой воздуха, находящийся в покое на поверхности органа, где они образованы, и достигают турбулентных слоев воздуха, откуда они вследствие движения воздуха могут пассивно распространяться на дальние расстояния. В некоторых случаях, чтобы сумки разрывались, должны обеспечиваться определенные внешние условия; наряду с достаточной влажностью (для поддержания тургесцентности) некоторые виды нуждаются также в свете (например, у Sordaria curvula действенным является синий свет, фоторецептор еще не идентифицирован). Другие аскомицеты (например, Hypoxylon fuscum), напротив, разбрасывают споры ночью.
Разрывание спорангиев Pitobolus также основывается на похожем механизме. Верхний конец зрелого одноклеточного спорангиеносца (см. 11.2, рис. 11.28) из-за тургорного давления булавовидно раздувается, причем клеточная стенка эластично растянута до 100 %. Лишь та кольцевидная зона, где спорангиеносец как колумелла прогибается внутрь спорангия, неэластична, чем и предопределено место разрыва. При разрывании весь спорангий отбрасывается с начальной скоростью около 6 м с-1 до 2,5 м в сторону или до 1,8 м вверх — благодаря положительному фототропизму в направлении падающего света (см. 8.3.1.1).