БОТАНІКА З ОСНОВАМИ ГІДРОБОТАНІКИ (ВОДНІ РОСЛИНИ УКРАЇНИ) - Б.Є. Якубенко - 2011
XIV.ІНСТРУМЕНТАРІЙ ТА МЕТОДИ ДЛЯ ДОСЛІДЖЕННЯ ВОДНОЇ РОСЛИННОСТІ
Методи визначення характеристик головних угруповань макрофітів водних екосистем [60]
Методи відбору та опрацювання проб фітопланктону Відбір проб.
Отримання репрезентативних даних для оцінки структурно-функціональних характеристик фітопланктону і динаміки їхніх змін вимагає подекадного відбору проб. Важливо, щоб він проводився у чітко встановлений час. Найоптимальнішим є інтервал з десятої до дванадцятої години дня.
Для врахування вертикальної динаміки водоростей і мінімізації похибки, зумовленої їхньою міграцією в товщі води, проби, починаючи з поверхневого горизонту, потрібно відбирати через кожний метр водної товщі. Відібрані проби зливають в один посуд (як правило, це поліетиленове відро місткістю 10,0-12,0 дм ), з якого потім відбирають інтегровані проби (0,5-1,0 дм ). Об’єм інтегрованої проби 0,5 чи 1,0 дм визначається попередньою візуальною оцінкою розвитку фітопланктону: а) за інтенсивного розвитку планктонних водоростей, особливо під час «цвітіння» води, достатньо альгоквоти об’ємом 0,5 дм ; б) за незначної вегетації водоростей, зазвичай у зимовий чи ранньовесняний-пізньоосінній періоди, необхідно відбирати 1,0 дм .
Одну пробу фіксують, а іншу використовують для вивчення водоростей у живому стані. Здійснювати ці роботи вкрай необхідно, оскільки під час фіксування можливе пошкодження деяких морфологічних структур водоростевих клітин (джгутиків, різних виростів тощо), що є характерними систематичними ознаками, особливо у вольвоксових, криптофітових, евгленових і золотистих водоростей. Проби для кількісного визначення фітопланктону відбирають батометром. Найпоширенішим є батометр Руттнера. Детальний опис конструкції батометра та інших конструкцій наводиться у монографії I.A. Кисельова [39]. З огляду на те, що за умов дослідження фітопланктону, як правило, відбирають гідрохімічні, мікробіологічні й токсикологічні проби і найприйнятнішим є об’єм батометра 35 дм . На мілководних станціях, де глибини не перевищують 2,0 м, можливий відбір лише з одного горизонту, як правило 0,2-0,3 м. Проби фітопланктону відбирають і зберігають у скляних пляшках чи поліетиленових флягах, відкаліброваних на 0,5 і 1,0 дм та щільно закритих кришками. Ще в лабораторії посуд інтенсивно миють з використанням миючих засобів (для поліетиленових фляг) чи хромової суміші (для скляних пляшок). Перед наповненням чистий посуд потрібно 2-3 рази промити (100-200 мл) відібраною пробою.
Усі пляшки (фляги) мають бути з етикетками. Можливо кілька варіантів:
а) на посуд масляною або емалевою фарбою наносять цифрову нумерацію;
б) на посуд наклеюють медичний пластир, на якому олівцем або кульковою ручкою роблять відповідний запис; в) перед відбором проби напис робиться безпосередньо на посуді склографом. Етикетку на флязі з пробою підписують на станції відбору проб. Окремо в карточці обов’язкових відомостей (польовий щоденник) дослідники записують усі необхідні дані щодо відбору проби: найменування водойми, номер станції, її координати на водоймі та відповідна географічна «прив’язка» станції, дата відбору проби (число, місяць, рік, час доби), прозорість води, об’єм проби, температура води й повітря, кількість кисню, гідрометеорологічні дані про стан погоди, наявність чи відсутність на поверхні води ознак «цвітіння», спричиненого масовим розвитком водоростей, плівок нафтопродуктів, сміття, візуально відмічених джерел надходження стічних вод у водойму, звалищ сміття в районі природоохоронних смуг досліджуваної водойми.
Консервація проб. Найпоширенішим консервантом є формальдегід. Для консервації у водні проби додають 40%-ний формальдегід з розрахунку 1:100, пляшку щільно закривають кришкою і ставлять у темний ящик. Незважаючи на простоту й доступність цього методу, дія формальдегіду, який є «жорстким» фіксатором, для водоростевих клітин, може призводити їх до деформації, втрати джгутиків, виходження монадних форм (евгленові, динофітові, золотисті) з будиночків, а у зелених хлорококових можливий і лізис клітин. Фактично до 20-25% вихідної кількості водоростей через 35 місяців руйнується під дією формальдегіду. Водночас фіксація ним не впливає на морфологічну структуру діатомових і синьозелених водоростей. Пояснюється це тим, що перші з них мають кремнеземний панцир, а в інших клітини огорнуті слизом.
Розчин Люголя є «м’якшим» фіксатором, що не руйнує морфологічну структуру водоростей, але він не завжди «вбиває» водяну мікрофлору і водяні гриби. Це призводить до того, що через 12 місяців зафіксована проба починає «загнивати» і практично руйнуються клітинні структури.
Етиловий спирт є також «м’якшим» фіксатором. Використовують спирт етиловий ректифікований, який додають до проби у співвідношенні 1:10. Проби фітопланктону, зафіксовані спиртом, не можна зберігати понад 1-1,5 місяця. Надалі неопрацьовані проби починають «загнивати».
Комбінація розчину хромових квасців з розчином формальдегіду оптимально відображає морфологічну структуру планктонних водоростей і забезпечує тривале збереження альгологічних проб незалежно від видового складу фітопланктону.
Згущення проб. Усі існуючі методи згущення проб базуються на одному з трьох фізичних процесів: седиментації, центрифугуванні та фільтрації через мікропористі фільтри.
Метод седиментації. Пляшки (фляги) з альгологічними пробами охайно, без струшування виставляють у темному прохолодному місці. Через 10-12 днів воду над водоростями, що осіли, збирають спеціальним сифоном, залишаючи над осадом шар води 5-8 см. Залишок проби (об’ємом не більш ніж 100 мл) переливають у посуд меншої місткості, відстоюють протягом 5-7 діб і повторно відсифонюють, доводячи кінцевий об’єм до 10 см . Проби переливають у пеніцилінові склянки, додають 2-3 краплі формальдегіду чи розчину Люголя та починають камеральне опрацювання їх.
Метод центрифугування. Найшвидший метод згущення альгологічних проб. Для достатнього осадження фітопланктону потужність центрифуги має становити не менш як 1500-3000 об/хв. Але за даних умов можлива втрата значної кількості водоростей різних таксонів через розчинення осаду та при його перенесенні до лічильної камери.
Метод фільтрації. Портативним, швидким методом згущення альгологічних проб (до 200 разів від об’єму відібраної проби) є метод їхньої фільтрації через дрібнопористі фільтри. Простота апаратного забезпечення: колба Бунзена місткістю 1,0-2,0 дм , фільтрувальна воронка, дрібнопористі фільтри, вакуумна гумова трубка, вакуумний насос, що створює розрідження до 0,5-3,0 атм, дозволяє використовувати метод фільтрації в експедиційних умовах. Різновидністю методу фільтрації з використанням вакуумного розрідження є метод фільтрації під тиском. Недоліком обох методів є втрата під час фільтрування нанопланктонних видів водоростей і можливе пошкодження їхніх морфологічних структур - основних систематичних ознак виду.
Камеральне опрацювання проб. У гідрологічних дослідженнях для опрацювання альгологічних проб використовуються світлові та електронні скануючі і трансмісійні мікроскопи різних марок як вітчизняного, так і зарубіжного виробництва. Основна вимога до мікроскопа - це величина збільшення. Для отримання репрезентативних результатів окуляр має збільшення не менше як К5х, а об’єктив - х20.
Чисельність водоростей підраховують у спеціальних лічильних камерах. Найпоширенішою в альгологічних дослідженнях є камера Нажотта об’ємом 0,01-0,05 см . Використання інших камер, наприклад лічильної камери Горяєва, в якій підраховують формені елементи крові, небажане, оскільки крупні водорості планктону, особливо колоніальні форми, не вміщуються на дні камери. За умов використання камери Горяєва отримані результати значно занижені.
Визначення чисельності видів рослин та їхньої біомаси. Для оцінки кількісної різноманітності фітопланктону обчислюють його чисельність і біомасу.
Чисельність фітопланктону розраховують на 1 дм (1 л) води за формулою:
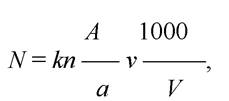
де N - кількість водоростей в 1 дм води досліджуваної водойми (як правило тис. кл/дм3 або млн. кл/дм3 ); к - коефіцієнт, що показує, у скільки разів об’єм використаної камери менший за 1 см ; п - кількість клітин водоростей на переглянутих доріжках (квадратах) лічильної камери; А - кількість доріжок (квадратів) лічильної камери; а - кількість доріжок (квадратів), де підраховувалась кількість водоростей; V - об’єм проби фітопланктону, взятий на водоймі, см3 ; V - об’єм концентрованої проби, з якого розраховують показники фітопланктону, см .
Біомасу фітопланктону визначають розрахунково-об’ємним методом. Його використання передбачає наявність даних по чисельності конкретно виду водоростей у пробі та лінійних розмірів його клітин. Для визначення розмірів водоростей їх прирівнюють до певних геометричних тіл, найподібніших до тієї чи іншої морфологічної форми: куля, паралелепіпед, циліндр, конус, октаедр тощо. Далі вимірюють необхідні параметри: радіус, діаметр, висоту, довжину тощо. Для отримання репрезентативних даних необхідно виміряти параметри не менш як 30 водоростевих клітин одного виду. Одержані дані опрацьовують статистично [9а].
Об’єм клітин визначають за відомими геометричними формулами, використовуючи лінійні розміри конкретної водорості, подібної до певної геометричної фігури. Припускають, що відносна щільність (до води) прісноводних водоростей становить 1,00-1,05. Вирахувану біомасу особин кожного виду множать на його чисельність і наводять у мг/дм , г/м або г/м2.