ХИРУРГИЯ НОВОРОЖДЕННЫХ - 1976
1. ОБЩАЯ ЧАСТЬ
4. Предоперационная подготовка. Анестезия. Ведение послеоперационного периода
Подготовка новорожденного к операции, обеспечение обезболивания и правильное ведение послеоперационного периода имеют огромное значение для результатов оперативного вмешательства.
Предоперационная подготовка
Основными задачами предоперационной подготовки являются создание оптимального микроклимата, предупреждение проявлений геморрагического синдрома, коррекция параметров гомеостаза, предупреждение рвоты и аспирации желудочного содержимого. Проведение перечисленных мероприятий особенно важно у детей с явлениями токсикоза, эксикоза, перитонита, гипертермии и др. Необходимо соблюдать последовательность лечебных мероприятий, начатых в родильном доме и проводимых во время транспортировки новорожденного в хирургический стационар.
Вопросы создания микроклимата, предупреждения и лечения аспирационной пневмонии, расчеты жидкостей для парентерального введения мы излагаем в разделе «Особенности ведения послеоперационного периода».
При поступлении ребенка в отделение оценивают его состояние. Широкое внедрение в клиническую практику методов лабораторной экспресс- и микродиагностики позволяет за короткий период предоперационного обследования новорожденного получить достаточно полную информацию о состоянии его гомеостаза. Опыт работы отделения хирургии новорожденных позволяет считать важнейшими лабораторные исследования для определения:
1) гемоглобина, гематокрита (микрометодами), количества лейкоцитов, тромбоцитов. Определение числа эритроцитов не обязательно, ибо гематокрит является более точным показателем;
2) электролитов плазмы: натрия, калия, кальция;
3) общего белка и фракций;
4) времени свертывания и кровотечения;
5) сахара крови, мочевины, остаточного азота;
6) кислотно-щелочного состояния и газов крови: pH, ВЕ (или щелочного резерва), рСО2, рО2 капиллярной крови.
7) характера мочи (сахар, белок, мочевина, микроскопия осадка).
Рентгенографию грудной клетки производят во всех случаях.
Определение свертываемости крови показано независимо от состояния ребенка. У 80% новорожденных время свертывания крови замедлено. Особенно значительно этот показатель снижен в первые 4 дня жизни вследствие дефицита витамина К и протромбина. Время свертывания крови в первый день жизни равно в среднем 5 мин 20 с, на 4-й день — 5 мин 15 с, на 8-й день — 4 мин 8 с (А. А. Орехова, 1953; Н. В. Потанин, 1965, и др.). Внутримышечное введение викасола (1 — 2 мг/кг в сутки) накануне или непосредственно перед операцией способствует повышению свертываемости крови и предупреждает кровоточивость тканей во время операции и в ближайшем послеоперационном периоде.
Анестезия
Анестезия у новорожденных является наиболее сложным и ответственным разделом педиатрической анестезиологии. К проведению наркоза у самых маленьких детей допускают анестезиолога, имеющего достаточный опыт работы. При отсутствии анестезиолога, как исключение применяют местную анестезию с усиленной премедикацией (фенотиазиновые, нейролептики, анальгетики).
Любую болезненную или сложную процедуру, диагностическое исследование у новорожденного выполняют под общим обезболиванием, а при показаниях — с хорошей релаксацией мышц и адекватной вентиляцией легких. Методики многокомпонентной анестезии, разработанные в клинике, позволили практически полностью ликвидировать летальность новорожденных, связанную с анестезией.
Возможно применение почти всех современных схем многокомпонентной анестезии. Наркоз проводят с учетом анатомо-физиологических особенностей организма новорожденного ребенка. Язык у новорожденного относительно большой, а надгортанник маленький, ригидный, имеет треугольную форму. Эти особенности затрудняют интубацию трахеи. Изогнутым клинком (Макинтоша) не удается вывести надгортанник в поле зрения, поэтому для новорожденных имеется специальный прямой клинок, последняя треть которого изогнута под углом 25-30°.
Лабильность дыхательного центра, слабость дыхательной мускулатуры обусловливают расширение показаний к управляемой вентиляции легких. Оперативные вмешательства длительностью более 30 мин целесообразно проводить под наркозом с управляемой вентиляцией легких.
Специфической для новорожденных является возможность развития гипоксии при проведении управляемой вентиляции. Подобное осложнение наблюдается редко и связано с незаращением овального окна и функционированием артериального протока. В результате управляемой вентиляции легких повышается давление в малом круге кровообращения и возникает сброс неоксигенированной крови через овальное отверстие или артериальный проток. Прекращение управляемой вентиляции легких п перевод больного на самостоятельное или вспомогательное дыхание ликвидируют гипоксию.
Премедикация. Проведение стандартной премедикации, состоящей из анальгетиков (промедол) и холинолитиков (атропин), в условиях современной многокомпонентной анестезии у новорожденных не оправдано. Введение анальгетиков типа промедола у больных с выраженными явлениями гипоксии пли атропина при обезвоживании, тахикардии и гипертермии противопоказано. Антигистаминные препараты применяют при развитии септических процессов. Опыт клиники показал целесообразность расширения показаний к проведению современной многокомпонентной анестезии у новорожденных без премедикации. Внутривенное введение атропина показано лишь при выраженной гипоксии, брадикардии и нарушениях сердечного ритма, возникающих в период анестезин.
Аппаратура для наркоза. Техника анестезии. Для проведения наркоза у новорожденных применяют обычные наркозные аппараты со специальными приставками и системами. В комплектах современных аппаратов для взрослых имеются маятниковые системы. К любому аппарату можно смонтировать систему Эйра для самостоятельного или управляемого дыхания. Отечественная промышленность выпускает серийно циркуляционную приставку «Наркон ДП» к наркозному аппарату для проведения общей анестезии у новорожденных и грудных детей.
Преимущества маятниковой системы заключаются в минимальном сопротивлении дыханию, сохранении тепла и влаги при работе с адсорбером. Недостатком ее является относительно большая величина адсорбера, неудобство фиксации системы у головы больного. Циркуляционная приставка сохраняет преимущества маятниковой системы (сохранение тепла и влаги, минимальное сопротивление дыханию), удобна в работе.
Систему Эйра монтируют из элементов комплекта наркозного аппарата, она имеет небольшой вес и легко крепится. Т-образный тройник практически не оказывает сопротивление дыханию при потоках до 12 л/мин. При проведении управляемой вентиляции легких в систему монтируют манометр или предохранительный кла-
пан, который легко сделать из бобровской банки, наполненной водой. Предохранительный клапан сбрасывает избыточное давление газонаркотической смеси. Недостатком системы Эйра является потеря тепла и влаги при больших потоках сухих и охлажденных газов. Lewis и Spoerel (1961) рекомендуют при проведении наркоза системой Эйра с сохранением самостоятельного дыхания подавать поток газонаркотической смеси, равный двум минутным объемам дыхания больного. При этих условиях подсос воздуха из открытого колена Т-образного переходника не превышает 25 %. В. М. Юрьевич и А. С. Перельмутр (1973) при использовании системы Эйра рассчитывают потоки газонаркотической смеси по формулам:
а) для проведения искусственной вентиляции легких:
Q = v (1 + a),
б) для проведения спонтанного дыхания:
Q = 1,5 v (1 + a),
где Q — суммарный расход газа по дозиметру (газоток) в литрах в минуту; v — минутная вентиляция легких в литрах в минуту, а — отношение времени выдоха ко времени вдоха. Для новорожденных при спонтанном дыхании этот показатель равен 1, а при управляемом дыхании целесообразно его считать равным 2.
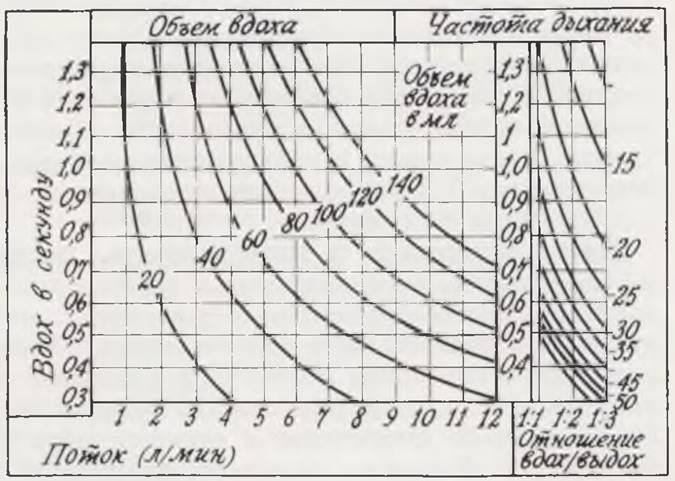
При изменении соотношения вдоха и выдоха Keuskamp (1963) рекомендует пользоваться специальной таблицей для расчета общего газотока по дозиметру (рис. 8).
Рис. 8. Таблица расчета общего газотока по показаниям дозиметра (по Кеuskamp).
Система Риса позволяет проводить управляемое дыхание с помощью мешка. В этой системе сохраняются преимущества системы Эйра, но раздувание легких производят рукой, более плавно, без опасности разрыва легочной ткани большим потоком газонаркотической смеси. Для предотвращения гиперкапнии устанавливают газоток не менее двухминутных объемов дыхания ребенка.
Интубацию трахеи проводят при выключении самостоятельного дыхания миорелаксантами. В клинике детской хирургии ЦОЛИУв разработана методика выключения самостоятельного дыхания перед интубацией трахеи не с помощью миорелаксантов, а путем углубления наркоза фторотаном и проведения вспомогательного, а затем управляемого дыхания. Этот прием позволяет без введения миорелаксантот выполнить ларингоскопию и интубацию трахеи на фоне апноэ и хорошей релаксации мышц. При проведении общей анестезии не фторотаном, а другими анестетиками перед ларингоскопией показано введение деполяризующих миорелаксантов.
Интубацию трахеи под глубоким фторотановым наркозом, но с сохранением самостоятельного дыхания выполняют только в тех случаях, когда введение интубационной трубки в трахею затруднено анатомическими деформациями в области лица и шеи, воспалительным отеком, опухолевидными образованиями в области гортани и трахеи, вызывающими стридорозное дыхание. В этих случаях выключение самостоятельного дыхания миорелаксантами и неудачные попытки интубации трахеи могут привести к тяжелой гипоксии, а деформации и сдавления дыхательных путей затрудняют проведение управляемого дыхания маской наркозного аппарата.
Ларингоскопию выполняют в горизонтальном положении больного. Валик под плечами не обязателен. После введения ларингоскопа до корня надгортанника помощник легким движением снаружи отдавливает гортань кзади. Надгортанник стремятся не захватывать клинком ларингоскопа.
Для интубации применяют трубки гладкие, армированные и переменного сечения типа Коула. По данным В. М. Юрьевича и А. С. Перельмутра (1973), трубки Коула позволяют уменьшить сопротивление выдоху более чем в 2 раза. В последнее время используют пластиковые термопластичные трубки, изменяющие свою конфигурацию по форме гортани и трахеи под влиянием тепла тела ребенка. Пластиковые трубки не раздражают слизистую оболочку гортани и трахеи, уменьшают опасность развития ларингита, трахеита и постинкубационного отека. Для продленной оротрахеальной или назотрахеальной интубации, которая у новорожденных предпринимается с лечебной целью (при угнетении дыхания, обструкции дыхательных
путей), а также для соединения с аппаратом искусственной вентиляции легких и длится более 4 ч, следует применять только пластиковые трубки. В табл. 8 представлены основные размеры трубок для новорожденных.
Таблица 8. Размеры трубок для новорожденных и детей первых 3 мес. жизни
Возраст детей |
Размеры трубок |
|||
наружный диаметр (мм) |
№ по шкале Шарьера |
длина для интубации через рот (см) |
длина для интубации через нос (см) |
|
Недоношенные |
2,5 — 3.5 |
8 — 12 |
8 — 9 |
10 — 12 |
Новорожденные |
3,5 — 4,0 |
12 — 13 |
9 — 10 |
12 — 14 |
1 мес |
4,0 — 4,5 |
13 — 15 |
10 — 11 |
13 — 15 |
2 » |
4,5 — 5,0 |
15 — 17 |
10,5 — 11,5 |
14 — 16 |
3 » |
5,0 — 5,5 |
17 — 18 |
11,0 — 12,0 |
14 — 17 |
Тампонада ротовой полости не обязательна. Трубки крепят двумя полосками лейкопласта.
Абсолютными показаниями для интубации трахеи являются анестезии при операциях в грудной полости, области лица и шеи, а также операции на органах брюшной полости и конечностях продолжительностью более 30 мин. Чем меньше ребенок, тем больше показаний к интубации трахеи и проведению управляемого или вспомогательного дыхания во время анестезии.
После каждого наркоза интубационные трубки очищают в мыльной воде, тщательно промывают водопроводной водой, 30 мин стерилизуют в диоциде, затем в течение 10 — 15 мин промывают проточной водой. За 30 мин до проведения наркоза трубки помещают в раствор фурацилина или риванола (1 : 1000) или в 0,6 % раствор левомицетина, приготовленного на 0,6 % растворе этилового спирта. Непосредственно перед интубацией трубки промывают стерильным изотоническим раствором хлористого натрия. В настоящее время выпускают интубационные трубки разового применения, обработанные гамма-лучами и упакованные в стерильные пакеты. В таких случаях дополнительная стерилизация не нужна.
Выбор анестетика и миорелаксанта. Почти все анестетики, миорелаксанты и схемы проведения анестезии, применяемые у взрослых, могут быть использованы у новорожденных. Наш опыт, насчитывающий более 1500 анестезий у новорожденных, позволяет считать методом выбора анестезию фторотаном с закисью азота и кислородом. Фторотан вызывает минимальное раздражение дыхательных путей и легочной ткани, не вызывает гиперсекрецин слюнных и бронхиальных желез, уменьшает опасность развития пневмонии в посленаркозном периоде. Фторотан может быть применен почти при всех оперативных вмешательствах. Он опасен лишь при выраженной гипотрофии (пилоростеноз) и продолжающемся кровотечении, так как вызывает дилятацию периферических сосудов, которая при значительном дефиците объема циркулирующей крови приводит к падению артериального давления и уменьшению венозного возврата к сердцу. В этих случаях фторотан может быть применен при условии одновременного адекватного переливания крови, плазмы или других коллоидных растворов. Нейролептики позволяют провести анестезию у самых тяжелых больных, с грубыми нарушениями гомеостаза. Средняя доза таламонала (фентанил + дроперидол) для премедикации — 0,06 мл/кг веса ребенка внутримышечно за 40 мин до операции. Для введения в нейролептапалгезию таламонал применяют в дозе 0,2 мл/кг. Анестезию поддерживают повторными введениями фентанила (0,1 — 0,06 мл/кг через каждые 30 мин). Дроперидол применяют в дозе 0,1 — 0,07 мл/кг через каждые 1 — 1 ½ ч. После окончания анестезин вводят дыхательные аналептики налорфин (0,1 — 0,2 мл) или бемегрид (50 — 75 мг) внутривенно.
Применение нейролептаналгезии у новорожденных требует дальнейшего изучения и строгой индивидуализации дозировок препаратов, ибо опыт клиники показал, что по окончании нейролептапалгезии почти у 1/3 новорожденных наблюдалось выраженное угнетение дыхания, нередко требовавшее длительной искусственной вентиляции легких.
Дети первого месяца жизни относительно устойчивы к препаратам типа сукцинилхолина, поэтому для миоплегии необходимы большие дозы в пересчете на 1 кг веса ребенка (табл. 9). Наилучший способ введения миорелаксантов — внутривенный. В экстренных ситуациях или при единичных введениях, например, для проведения кратковременного обследования, можно рекомендовать инъекции сукцинилхолина в язык или подъязычную область. Возможно введение миорелаксантов внутримышечно с лидазой и без нее1.
1 Подробно методика внутримышечного введения деполяризующих миорелаксантов с лидазой описана нами в журнале «Хирургия», 1967, № 7.
Таблица 9. Дозировка миорелаксантов у новорожденных
Препарат |
Способ введения |
||
внутривенно (мг/кг) |
внутримышечно (мг/кг) |
внутримышечно с лидазой (мг/кг) |
|
Сукцинилхолин первое введение |
3 (1% раствор) |
5 (5% раствор) |
3 (5% раствор) |
повторные введения |
1,5 (1% раствор) |
3 (5% раствор) |
2 (5% раствор) |
Тубокурарин первое введение |
0,4 |
0,6 |
0,5 |
Повторные введения |
При каждом повторной введении дозу уменьшают на 1/4 |
||
Основные недостатки сукцинилхолина: кратковременность действия, необходимость частых повторных введений, опасность развития «двойного блока», продленное апноэ при охлаждении ребенка во время анестезии и нарушениях кислотно-щелочного состояния крови (ацидоз).
По данным Payne (1955), В. А. Кованева с соавт. (1970), новорожденные имеют повышенную чувствительность к тубокурарину и реагируют на его введение подобно больным с миастенией. В то же время наличие антидота (прозерина) у этой группы миорелаксантов, возможность редких введений (1 раз в 30 — 40 мин), хороший ганглиоблокирующий эффект не исключают применение тубокурарина. Декураризация прозерином с атропином (внутривенно) обязательна, но только после восстановления первых признаков самостоятельного дыхания. Применение тубокурарина у новорожденных с грубыми расстройствами гемодинамики, акроцианозом, метаболическим ацидозом опасно из-за развития, продленного апноэ после анестезии.
Схема декураризации после применения тубокурарина: внутривенное введение атропина (0,02 мг/кг), через 5 мин прозерин внутривенно (0,05 мг/кг). При недостаточном эффекте прозерин вводят повторно.
Окончание анестезии. После прекращения ингаляции анестетиков проводят дыхание чистым кислородом (100 %) не менее 10 мин, туалет носоротоглотки. При восстановлении тонуса мышц, глотательных и кашлевых рефлексов через интубационную трубку проводят туалет трахеи, выслушивают легкие во время самостоятельного дыхания. Проводят повторную ингаляцию кислорода (5 — 10 мин), в интубационную трубку вводят катетер для отсасывания и удаляют трубку из трахеи под контролем ларингоскопа, одновременно аспирируя слизь из трахеи и ротоглотки. Сразу после окончания анестезии ребенка помещают в кувез, в котором заранее созданы необходимые условия температуры, влажности и концентрации кислорода.
Наиболее частое осложнение анестезии у новорожденных — продленное апноэ, которое развивается при охлаждении ребенка во время операции, недостаточном возмещении кровопотери, жидкости, метаболическом декомпенсированном ацидозе, передозировке анальгетиков, остаточном действии нейролептиков (фентанила), передозировке анестетиков. Возможно угнетение дыхания вследствие гипогликемии, характерной для детей первых дней жизни. Восстановление тонуса поперечнополосатой мускулатуры и появление рефлексов Моро-1 и Моро-2 свидетельствуют о центральном угнетении дыхания, а не о передозировке анестетиков или остаточном действии миорелаксантов. При недостаточном восстановлении самостоятельного дыхания после согревания ребенка, введения бикарбоната натрия и декураризации экстубацию не производят, новорожденного помещают в кувез с интубационной трубкой в трахее. При глубоком угнетении самостоятельного дыхания продолжают вентиляцию легких аппаратом ВИТА-1 до полного восстановления адекватного самостоятельного дыхания.
В табл. 10 представлены основные схемы проведения анестезии у новорожденных.
Таблица 10. Схемы проведения анестезии у новорожденных
Премедикация |
Введение |
Интубация |
Поддержание |
Окончание |
Без премедикации |
Фторотан + закись азота + кислород |
Фторотан + кислород, без релаксантов |
Фторотан + закись азота + кислород, без релаксантов |
Кислород |
Атропин + промедол |
Гексенал внутривенно + закись азота + кислород |
То же с мио Кислород + сукцинил- холин |
релаксантами Закись азота + кислород + тубокурарин |
Кислород + декураризация |
Нейролептаналгезия + закись азота + кислород |
Кислород + сукцинил- холин |
Нейролептаналгезия + закись азота + кислород + релаксанты |
Кислород + аналептики дыхания: налорфин, бемегрид |
|
Циклопропан закись азотакислород |
Кислород + сукцинил- холин |
Циклопропан -+закись азота + релаксанты |
Кислород + декураризация после тубарина |
|
Эфир + закись азота + кислород |
Кислород + сукцинил- холин |
Эфир закись азота + кислород + релаксанты |
Кислород |
1 Атропин противопоказан при гипертермии, тахикардии, обезвоживании.
Особенности ведения послеоперационного периода
В послеоперационном периоде наибольшее значение имеют индивидуальное выхаживание новорожденного и предупреждение возможных осложнений. Основное внимание уделяют созданию оптимального микроклимата, предупреждению и лечению дыхательной недостаточности, пареза кишечника, адекватному обезболиванию, инфузионной терапии.
Микроклимат. Особенно опасно охлаждение ребенка. Неучтенные потери жидкости во время операции в результате раскрытия брюшной или грудной полости (а, следовательно, и охлаждение) составляют у новорожденного около 50 мл/ч. При пониженном питании термоизоляция недостаточна, потери тепла еще больше увеличиваются. Переохлаждение ребенка таит в себе опасность развития пневмонии, склеремы. Оптимальный микроклимат можно создать в кувезе (табл. 11).
Таблица 11. Параметры микроклимата в кувезе в зависимости от веса ребенка
Вес ребенка (г) |
Температура в кувезе (°С) |
Влажность (%) |
До 1400 |
35 — 36 |
90 — 100 |
» 1700 |
32 — 35 |
60 |
» 2000 |
30 — 32 |
60 |
Свыше 2000 |
28 — 29 |
60 |
Длительное пребывание новорожденного без гипоксии в атмосфере с повышенным содержанием кислорода (более 40%) может вызвать поражение зрительного нерва вплоть до полной слепоты (ретролентная фиброплазия), однако при явлениях гипоксии концентрация кислорода может быть увеличена до полной ликвидации гипоксии.
При отсутствии кувеза ребенка помещают в кроватку-грелку или в обычную кроватку, где его обкладывают грелками с теплой водой (34 — 36°) и обеспечивают ингаляцию кислорода.
Предупреждение и лечение дыхательной недостаточности. Одно из наиболее частых осложнений послеоперационного периода — обструктивная дыхательная недостаточность. Для предупреждения ее показана периодическая аспирация стерильным катетером густой мокроты из ротоглотки. После торакальных операций ежедневно проводят ларинго- или бронхоскопию и туалет трахеобронхиального дерева под визуальным контролем. Подобные манипуляции выполняют под фторотановым наркозом. Эффективен массаж грудной клетки — легкое поколачивание копчиками пальцев. Показано также частое поворачивание ребенка в кровати. При выраженной пневмонии назначают антибиотики широкого спектра действия внутривенно.
Нарастание дыхательной недостаточности и некорригируемый метаболический ацидоз служат показаниями к искусственной вентиляции легких (llees, 1971). Однако результаты длительной искусственной вентиляции легких до последнего времени остаются неудовлетворительными. Так, по данным Battersby (1971), из 24 новорожденных, которым в послеоперационном периоде проводили искусственную вентиляцию легких, выжили только двое. Плохие результаты длительной искусственной вентиляции связаны с анатомо-физиологическими особенностями новорожденных и большими трудностями решения конструктивных проблем в аппаратах искусственной вентиляции легких для маленьких детей.
Лечение пареза кишечника. Нарушение пассажа пищевых масс с последующим развитием пареза кишечника и рвоты — частое осложнение послеоперационного периода, особенно после операций па кишечнике. Аспирация рвотных масс приводит к развитию аспирационной пневмонии, поэтому наличие рвоты у новорожденного является показанием к введению зонда в желудок и постоянной эвакуации желудочного содержимого. При отсутствии пластмассовых зондов можно одномоментно вводить тонкий резиновый зонд и аспирировать застойное содержимое каждые 1 1/2 — 2 ч. После аспирации желудок промывают изотопическим раствором хлористого натрия комнатной температуры (40 — 60 мл) и вводят 5 — 10 мл 5% раствора глюкозы или грудного молока. При парезе кишечника показаны осторожное ректальное обследование пальцем, введение газоотводной трубки па 10 мин, каждый час, гипертоническая микроклизма (5 — 10 мл 5% раствора хлористого натрия), ректальное введение 5 — 10мл глицерина. Эффективно периодическое выкладывание ребенка на живот.
Применение анальгетиков. В послеоперационном периоде обязательно назначение анальгетиков. Предпочтение отдают препаратам, не угнетающим дыхание ребенка. Хороший эффект дает введение анальгина до 15 — 20 мг/кг внутримышечно через каждые 4 — 6 ч. Препарат вызывает полную аналгезию и предупреждает развитие гипертермии. После больших травматичных операций допустимо назначение промедола (1 — 1,5 мг) каждые 6 ч в сочетании с антигистаминными препаратами: супрастином, димедролом, пипольфеном.
Борьба с гипертермией. Повышение температуры выше 38° С проявляется клинически одышкой, цианозом, беспокойством ребенка. При повышении температуры выше 39° С возможно развитие генерализованных судорог. При умеренном повышении температуры до 38 — 38,5° С показано назначение пирамидона из расчета 10 мг/кг внутрь или внутримышечно, анальгина до 15 — 20 мг/кг. Можно сочетать эти препараты. При стойкой гипертермии, или дальнейшем ее повышении вводят пипольфен (дипразин) или пропазин (промазин) в дозе 1 — 3 мг/кг внутримышечно. Через 15 — 20 мин после введения этих препаратов производят растирание кожных покровов 50 — 75-градусным спиртом с целью вызвать гиперемию кожных покровов и увеличить теплоотдачу. Этого же можно добиться с помощью круговых горчичников. При неэффективности перечисленных мероприятий показано физическое охлаждение: пузырь со льдом к голове, промывание желудка холодной водой через зонд. При обезвоживании ребенка гипертермия не поддается терапии до восстановления объема циркулирующей крови.
Профилактика и лечение склеремы. Склерема обычно развивается вследствие охлаждения ребенка до операции или во время нее. Нередко причиной склеремы является обезвоживание, длительная гипоксия, нарушение периферической микроциркуляции. Прогноз всегда серьезен. Для лечения важно раннее назначение глюкокортикоидных гормонов: гидрокортизона (4 — 5 мг/кг в сутки) или преднизолона (1 мг/кг в сутки). Непременным условием успешного лечения является длительное содержание ребенка в кувезе.
Особенности ведения больных после торакальных операций. Наиболее важными моментами ведения торакального больного являются хорошая аналгезия в течение 4 — 6 дней послеоперационного периода и предупреждение аспирации. Сразу после операции в желудок вводят зонд до восстановления пассажа по кишечнику. Каждые 2 — 3 ч отсасывают густой секрет из ротоглотки. В кувезе увеличивают влажность до 100% для предупреждения высыхания слизистой оболочки трахеобронхиального дерева. Концентрацию кислорода поддерживают па уровне 40%, но при появлении гипоксии процент кислорода можно увеличить до цифр, ликвидирующих цианоз. Разряжение в отсосе из плевральной полости устанавливают на цифрах 5 — 10 см вод. ст. Ежедневно производят рентгенографию грудной клетки для контроля расправления легкого.
Особенности ведения больных после операций на кишечнике. Зонд в желудке оставляют не менее 48 ч. Периодически аспирируют застойное содержимое. Если через 24 ч после операции не восстанавливается перистальтика, внутримышечно вводят прозерин 0,05 мг/кг трижды с интервалом 30 мин. Можно проводить внутривенное капельное введение прозерина в дозе 0,1 мг/кг в течение 24 ч. Отсутствие самостоятельного стула через 48 ч после операции является показанием к осторожному пальцевому исследованию, промыванию прямой кишки раствором Рингера с глицерином или глицериновой микроклизме. Одновременно проводят вибромассаж грудной клетки для профилактики ателектазов, легкий массаж п движение всеми конечностями не менее 2 раз в сутки.
Инфузионная терапия
Инфузионная терапия у новорожденных является сложной проблемой. Это объясняется незрелостью системы водно-солевого обмена и выделения. Инфузионная терапия проводится с целью покрытия основных потребностей организма и парентерального питания, восстановления дефицита объема циркулирующей крови и регидратации при обезвоживании, коррекции кислотно-щелочного равновесия.
Покрытие основных потребностей организма. Парентеральное питание. Водно-солевой обмен у ребенка интенсивнее, чем у взрослого. За сутки у новорожденного происходит обмен воды, равный 14% веса тела (или 33% внеклеточной жидкости). У новорожденного значительно выше содержание воды в организме, чем у взрослого. Приток эндогенной воды в результате распада и сгорания питательных веществ составляет 14 мл/кг. У недоношенного объем внеклеточной жидкости равен 50%, у новорожденных — 40 %, а у взрослого — только 20 %. Поверхность тела по отношению к весу у новорожденных в 2,5 раза больше, чем у взрослого.
При содержании новорожденного без кувеза величина перспирации составляет от 40 до 100 мл за 24 ч. Повышение температуры тела вызывает увеличение перспирации до 150 — 170 мл. При содержании новорожденного в кувезе перспирация в первые 1 — 2 дня жизни не превышает 15 мл/кг. Почечная функция новорожденного несовершенна. Показатели нормального диуреза приведены в табл. 12.
Таблица 12. Количество мочи в сутки у детей до 1 года
Возраст ребенка |
Количество мочи (мл) |
1 — 2 дня |
30 — 60 |
3 — 10 дней |
100 — 300 |
10 дней — 2 мес |
250 — 450 |
2 мес — 1 год |
400 — 500 |
В первые 5 — 7 дней жизни у ребенка сохраняется низкая потребность в жидкости, особенно это касается недоношенных с весом до 2500 г. Лишь позднее основные потребности увеличиваются до 60 — 80 мл/кг. Для расчета основных параметров инфузионной терапии без учета патологических потерь можно пользоваться табл. 13.
Таблица 13. Суточная потребность новорожденного в основных ингредиентах (по Schulte, Hotes, 1964)
Возраст (ДНИ) |
Вода (мл / кг за 24ч) |
Натрий (мэкв / кг) |
Калий (мэкв / кг) |
Аминокислоты (г / кг) |
Плазма (мл / кг) |
Жиры (г/кг) |
1 — 3 4 — 8 |
40 — 60 80 — 100 |
1 — 1,5 1,5 — 2 |
— 0,5 — 1 |
— 1 — 3 |
2 (с 3-го послеоперационного дня), 1 (недоношенным) |
|
Старше 8 |
100 — 200 |
2 |
0,8 — 1,5 |
2 — 4 |
15 мл ежедневно |
2 — 4 |
Электролиты назначают только после восстановления диуреза. Во время операции и непосредственно после нее применяют изотонический раствор глюкозы без электролитов. В первые 2 дня новорожденным ионы натрия и калия не вводят, если нет потерь через желудочно-кишечный тракт. С 14-го дня жизни ежедневная потребность в калии составляет 2 — 4 мэкв/кг веса тела. Внутривенное введение калия в виде раствора хлористого калия целесообразно в глюкозе с инсулином (на каждые 4 г сухой глюкозы 1 ед. инсулина). Потребность в калии рассчитывают по 7,5% раствору хлористого калия, 1 мл которого содержит 1 мэкв калия. Но при внутривенном введении концентрация хлористого калия не должна превышать 1 %. Для этого на каждые 100 мл раствора глюкозы добавляют не более 13 мл 7,5% хлористого калия. Учет потерь жидкости позволяет своевременно возместить дефицит электролитов. В табл. 14 представлены данные о содержании электролитов в основных жидкостях (соках) желудочно-кишечного тракта у новорожденных и грудных детей.
Таблица 14. Содержание электролитов в секретах пищеварительного тракта (в миллиэквивалентах на 1л)
Электролиты |
Слюна |
Желудочный сок |
Желчь |
Секрет поджелудочной железы |
Тонкокишечный сок |
Калий Натрий Хлор |
30 10 20 — 160 |
4 — 16 45 20 — 160 |
5,2 145 100 |
4,6 141 77 |
5,1 105 99 |
Для новорожденных и недоношенных характерно низкое содержание сахара в крови, что может быть связано с повышением продукции гидрокортизона (Kenny, 1963). В то же время некоторые авторы объясняют гипогликемию голоданием ребенка (Euler, 1964). В первые 3 дня жизни концентрация сахара в крови ниже 30 мг%, в последующие дни — не более 40 мг%. Клинически гипогликемия новорожденного проявляется различными симптомами, в том числе и такими, как цианоз, слабость, апноэ, судороги, кома. Для лечения гипогликемии внутривенно вводят 75 — 85 мл/кг 15% раствора глюкозы в день (Cornblath, 1963). Через 48 ч можно увеличить дозу до 100 мл/кг 10 — 15% раствора глюкозы в 0,25 N солевом растворе. Отсутствие эффекта в течение 12 ч с момента начала введения глюкозы является показанием к назначению гидрокортизона в дозе 5 мг/кг в сутки.
Болезнь и оперативное вмешательство увеличивают процессы катаболизма, поэтому необходимо раннее назначение препаратов, покрывающих энергетические потребности растущего организма. Ежедневная потребность в покрытии основных энергетических затрат составляет 80 — 100 кал/кг. При длительном парентеральном питании введение только растворов глюкозы не обеспечивает достаточного количества калорий. В таких случаях добавляют жировые эмульсии (интралипид 10 — 20%, липофундин 10 %), а белковые потребности покрывают введением кристаллических аминокислот (аминосол, альвезин), плазмы. Липофундин назначают из расчета 1 — 4 мл раствора на 1 кг веса в сутки. Препарат вводят в 3 — 4 приема одновременно с растворами аминокислот. В жировые эмульсии добавляют инсулин из расчета 3 — 4 ед на каждый миллилитр препарата. В настоящее время возможно длительное парентеральное питание, до 400 дней (Wilmore с соавт., 1970).
Восстановление дефицита объема циркулирующей крови. Объем циркулирующей крови (ОЦК) у новорожденного в норме составляет 85 мл/кг, у ребенка 1 мес жизни — 75 мл/кг (Weibenbacher, 1970). Гематокрит с 65 в первый месяц жизни ребенка снижается к 3-му мес до 31. Показатель гемоглобина равен 110 — 112 (17 г%). ОЦК состоит из глобулярного объема (т. е. форменных элементов — эритроцитов, лейкоцитов) и плазматического, или непосредственно плазмы крови. При оценке компонентов ОЦК большое значение придают цифрам общего белка и соотношению альбуминов и глобулинов (альбумино-глобулиновый коэффициент). Нормальное содержание белка у новорожденного составляет 5,5 — 6 г%, альбумино-глобулиновый коэффициент (А/Г) равен 1,5 — 2,5. По мнению Нагtig (1969), недостаточное содержание альбумина приводит к нарушению диффузии жидкости из сосудистого русла в клетки и обратно, резко увеличивает опасность развития шока.
Восполнение кровопотери во время операции целесообразно производить под контролем колориметрических измерений или гравиметрии. Rickham (1969) считает, что у новорожденного во время операции следует возмещать кровопотерю, составляющую не менее 5 — 7% должного ОЦК. Предполагаемую кровопотерю в 10 % ОЦК возмещают с момента начала операции (кожного разреза). Переливают кровь, срок хранения которой не превышает 3 — 5 дней. При массивных вливаниях (более 50 мл) на каждые 25 — 30 мл консервированной крови внутривенно вводят 1 мл 10% глюконата кальция и 1 мл 4% раствора бикарбоната натрия.
Восстановление ОЦК характеризуется нормализацией почасового диуреза (у новорожденных — 5 — 15 мл/ч). В процессе регидратационной терапии большое значение придают динамике центрального венозного давления (ЦВД). Для новорожденных нормальные показатели центрального венозного давления равны 30 — 50 мм вод ст.
Регидратационная терапия при явлениях обезвоживания. Все патологические потери измеряют и возмещают соответствующим количеством глюкозо-солевых растворов («капля за каплю»). При оценке степени нарушеyия водно-солевого обмена учитывают внешний вид больного, гематокрит, такие показатели, как электролиты плазмы, общий белок, остаточный азот, креатинин, суточное и почасовое количество мочи, удельный вес ее. Клинически обезвоживание характеризуется падением веса, снижением эластичности кожных покровов и тургора, уменьшением влажности слизистых оболочек и языка, появлением «лихорадки от жажды», уменьшением наполнения пульса, нарушением сознаyия. В табл. 15 приведена клиническая симптоматика различных степеней дегидратации больного. При проведении инфузионной терапии для регидратации в зависимости от степени обезвоживания можно использовать цифры основных потребностей, приведенные в табл. 13. Чем тяжелее степень обезвоживания, тем больше жидкости и электролитов вводят больному для коррекции нарушений. В зависимости от степени дегидратации основные потребности увеличивают на 40 — 80 — 120%. Легкую (I) степень обезвоживания можно коррелировать введением повышенного количества жидкости через рот, если у больного сохранена функция желудочно-кишечного тракта. Лишь при средней (II) и тяжелой (III) степенях необходимы внутривенные инфузии. Регидратационную терапию начинают с внутривенного введения плазмы или коллоидных плазмозаменителей: полиглюкина, желатиноля, гемодеза. Количество их определяют по формуле: объем перспирации + минимальное количество мочи + 5 — 10% веса тела (в зависимости от степени эксикоза).
Таблица 15. Клиническая симптоматика различных степеней дегидратации (по Hartig, 1969)
Степень дегидратации и операбельность |
Клинические симптомы |
Количество жидкости для регидратации |
Легкая (потеря веса до 5%). Условно операбельны. Через 4 — 6 ч, после подготовки, операбельны |
Раздражительность. Слизистая оболочка рта и язык сухие. Лицо гиперемировано, кожа теплая, тургор несколько снижен, жажда не всегда |
50 мл/кг |
Средняя (потеря веса от 5 до 10%). Экстренно неоперабельны. Через 4 — 6 ч подготовки условно операбельны |
Беспокойство. Испуганное, возбужденное выражение лица. Слизистая оболочка рта и язык очень сухие, запавшие глаза, снижено внутриглазное давление. Кожа бледная с отчетливым снижением тургора. Жажда, лихорадка, тахикардия, спутанное сознание, отчетливая олигурия. Пронзительный крик, запавший родничок |
75 мл /кг |
Тяжелая (потеря веса более 10%). Экстренно неоперабельны. Через 24 — 48 ч подготовки условно операбельны |
Внешний вид тяжелобольного. Отсутствие реакция па окружающее, арефлексия, гипотония. Слизистая оболочка рта и язык очень сухие. Глубоко запавшие блестящие глаза; глазные яблоки мягкие, кожа, бледная, холодная с цианозом и акроцианозом. Крайняя степень потери тургора. Быстрый- мягкий пульс. Тяжелая олигурня или анурия. Паралитический плеус. Повышение тонуса, судороги, высокая температура, запавший родничок, пронзительный крик |
100 — 200 мл/кг |
Легкая (I) степень дегидратации возникает при рвоте, аспирации небольших количеств желудочных и кишечных соков при дренировании желудочно-кишечного тракта. Средняя (II) степень наблюдается при выраженном нарушении пассажа по кишечнику с отсасыванием больших количеств желудочно-кишечного секрета. Тяжелая (III) степень дегидратации связана с полными или почти полными потерями из верхних отделов желудочно-кишечного тракта.
При регидратационной терапии кровь переливают адекватно кровопотере (операционной или предоперационной). При анемии, развивавшейся медленно в преморбидном состоянии, показаны повторные введения консервированной крови в дозе 10 — 15 мл/кг ежедневно или через день до нормализации показателей гемоглобина и гематокрита. Средние дозы плазмы составляют 15 — 20 мл/кг в день с учетом общего количества требуемой жидкости. Из общего количества рассчитанной на сутки жидкости кровь, плазма и другие коллоидные растворы составляют около 1/з, остальные 2/з приходятся на 10 — 15% раствор глюкозы и солевые растворы.
Для равномерного распределения количества вливаемой жидкости на протяжении суток рекомендуют рассчитывать количество капель в минуту по следующей формуле:
Количество жидкости (л)
за 24 ч X 14 = число капель в минуту.
Коррекция кислотно-щелочного равновесия. У новорожденных метаболический ацидоз требует неотложной коррекции. Для этого применяют раствор бикарбоната натрия или органический буфер трисамин (ТНАМ, трисбуфер). В 1 мл 8,4% раствора бикарбоната натрия содержится 1 мэкв бикарбоната. Потребность в щелочном растворе рассчитывают после определения показателей кислотно-щелочного равновесия: pH, ВЕ, ЭВ, рСО2. Затем вычисляют по формуле:
Количество миллилитров 8,4% раствора
NaСОз = ВЕ X вес тела (кг) X 0,5.
При введении 4% раствора бикарбоната натрия в этой формуле опускают коэффициент 0,5. Коррекция ацидоза более эффективна при капельном введении оснований в растворе глюкозы (5 — 10%). Примерная скорость инфузии — 1 капля на 1 кг в минуту. Вначале раствор вводят с двойной скоростью. Контроль кислотно- щелочного равновесия назначают вначале каждые 2 ч, а затем — через 6 — 8 ч. Как только достигнуты нормальные показатели pH, вливание соды прекращают. После коррекции ацидоза возможно развитие гипокальциемии и постацидотических судорог. Поэтому в конце вливания растворов оснований рекомендуют вводить 1 —
2 мг/кг 10% раствора глюконата кальция.
Методы инфузионной терапии. Лекарственные препараты и жидкости новорожденным вводят, как правило, внутривенным путем. Подкожное введение опасно из-за возможности развития гнойно-воспалительных осложнений. При вливаниях длительностью не более суток пользуются обычной пункцией вен головы или конечностей. Приспособление в виде «бабочки» и тонкий переходный катетер облегчают фиксацию иглы в вене. Для длительных внутривенных вливаний применяют пункцию, секцию и пункционную катетеризацию вен.
При пункционной катетеризации вен по методу Сельдингера используют периферические вены конечностей или центральные вены — яремную, подключичную, бедренную. Методика пункционной катетеризации периферических вен уменьшает опасность инфицирования, а отсутствие кожного разреза позволяет повторно использовать вену. Пункционная катетеризация периферических вен полностью не решает проблемы длительных вливаний. После 24 — 36 ч пребывания катетера в периферической вене нередки воспалительные осложнения, что вынуждает удалять катетер. Этого недостатка лишена катетеризация центральных вен. В последние годы мы широко применяем пункционную катетеризацию подключичной вены.
Методика пункции подключичной вены впервые описана Aubaniac в 1952 г., но широкое использование метода началось позднее (Smith, 1965). Пункция подключичной вены возможна независимо от состояния и возраста больного. Клиника располагает опытом катетеризации подключичной вены у недоношенных с весом от 1200 г. Подключичная вена не спадается при самой тяжелой гиповолемии. Исключение составляют случаи анатомических отклонений и аномалий развития крупных венозных стволов. В обычных условиях постоянное анатомо-топографическое положение вены с фиксацией ее позади внутреннего края ключицы и значительный диаметр (у новорожденных 2 — 3 мм) позволяют производить массивные вливания. Быстрый ток крови способствует разведению гипертонических и раздражающих растворов и предотвращает тромбообразование. Местоположение вены уменьшает опасность внешнего загрязнения.
Для пункции и длительной катетеризации подключичной вены используют над- и подключичный доступы. У новорожденных точка пункции расположена по среднеключичной линии, на 0,3 — 0,5 см ниже ключицы. Надключичная точка соответствует тем же анатомическим ориентирам, только находится над ключицей. Пункцию производят иглой с коротким срезом, длиной 4 — 5 см и наружным диаметром 1 — 1,2 мм. Обычно для пункции подключичной вены у грудных детей используют иглу Бира. Иглу со шприцем, наполовину наполненным изотоническим раствором хлористого натрия, продвигают вперед-вверх и внутрь постоянно подтягивая поршень до появления струйки крови. Угол, образованный иглой и ключицей, равен 30 — 40°, угол наклона по отношению к плоскости грудной клетки составляет 20 — 30°. Иногда возникают трудности при введении в вену капронового проводника. По-видимому, из-за малого диаметра и перпендикулярного направления иглы проводник упирается в заднюю стенку вены (подобная ситуация легко моделируется на полиэтиленовых трубках соответствующего диаметра). Для облегчения соскальзывания мандрена в просвет вены медленным движением уменьшают угол наклона иглы по отношению к ключице до 10 — 15°, т. е. располагают иглу почти параллельно ключице. После этого проводник легко продвигается в вену. Насильственное введение мандрена недопустимо, движение его должно быть свободным, без сопротивления, ибо упругий проводник может перфорировать стенку вены. Правильное положение катетера контролируют ежедневно потягиванием шприца из катетера до появления струйки крови. Для предотвращения тромбирования катетер 3 — 4 раза в день промывают раствором гепарина (20 — 30 ед. в 1 мл) или раствором преднизолона (10 — 15 мг).
Методика пункционной катетеризации бедренной и яремной вен одинакова. Точка пункции бедренной вены расположена на 1 см ниже пупартовой связки, медиально от пульсирующей бедренной артерии. Яремную вену пунктируют в средней трети шеи под визуальным контролем.
Нарушения техники пункции и пункционной катетеризации вены могут привести к различным осложнениям. При пониженной свертываемости крови возможно образование больших гематом в местах повторных безуспешных пункций (в плевральной полости, средостении, на бедре, шее). Положение катетера в сомнительных случаях уточняют контрастированием. Контрастное вещество (триотраст, кардиотраст и др.) в количестве 1 — 2 мл вводят в течение 2 — 3 сек. В момент введения последней трети контраста делают снимок. Опасным осложнением является прокол плевры и легкого с развитием пневмоторакса. В этом случае показана пункция плевральной полости с аспирацией воздуха и последующим рентгенографическим контролем. При повторном скоплении воздуха производят торакоцентез и дренирование плевральной полости. При низком или отрицательном венозном давлении возможна воздушная эмболия. Для предупреждения ее центральное венозное давление повышают, поднимая ноги ребенка выше уровня правого сердца (положение Тренделенбурга) или проводят ему управляемое дыхание под небольшим давлением в момент пункции и отсоединения шприца от иглы, находящейся в вене. Вневенное введение жидкостей и лекарственных препаратов при пункциях периферических вен не представляет опасности, но паравенозное введение в области центральных вен приводит к нарушению венозного оттока. Клинически это проявляется отечностью конечности, цианозом. Паравенозное введение не требует специального лечения. Рассасывание введенной жидкости приводит к восстановлению кровотока.
Наиболее опасным является тромбоз центральной вены. Конечность отечна, развивается цианоз, сердечная недостаточность, значительно снижается венозный приток к сердцу. В этих случаях показано срочное контрастирование вены, назначение гепарина с фибринолизином. При неэффективности консервативных мероприятий необходима тромбэктомия.
Катетеризация и пункция центральных вен противопоказаны при понижении свертываемости крови и отсутствии навыков в выполнении этой манипуляции.