ХИРУРГИЯ НОВОРОЖДЕННЫХ - 1976
1. ОБЩАЯ ЧАСТЬ
5. Особенности оперативного вмешательства и обследования
Общие особенности и оперативной техники у новорожденных
Исход оперативного вмешательства у новорожденного ребенка больше, чем у детей других возрастных групп, зависит от тщательности выполнения оперативно-технических приемов и соблюдения технических правил.
Общие принципы выполнения оперативных вмешательств у детей, в том числе и новорожденных, изложены в работах С. Д. Терновского (1959), Г. А. Баирова (1963), С. Я. Донецкого и А. Г. Пугачева (1968), Obermedermeier (1959), Swenson (1970) и др. Из указанных работ можно получить отчетливое представление о том, что надо делать при том или другом пороке развития, и менее отчетливое о том, как надо производить оперативное вмешательство.
Даже в таких руководствах, как «Оперативная хирургия детского возраста» под редакцией Е. М. Маргорнна (1960), «Хирургия пороков развития у детей» под редакцией Г. А. Баирова (1968), «Детская хирургия» (руководство для врачей) С. Я. Долецкого и Ю. Ф. Исакова (1970), особенности оперативной техники у новорожденных освещены недостаточно полно. Единственная работа, в которой кратко изложены основные принципы оперативной техники у детей, относится к 1964 г.1
1 Долецкий С. Я. Особенности оперативной техники у детей. — «Клиническая хирургия», 1964, № 3.
Особенности оперативной техники обусловлены анатомо-физиологическими и анатомо-топографическими особенностями организма новорожденного ребенка.
Новорожденного подвозят в операционный зал в кувезе. Оптимальная температура воздуха в операционной 23 — 27° С. Операционный стол должен быть снабжен приспособлением для постоянного согревания ребенка во время операции в виде автоматически регулируемого электрического обогревателя пли специального одеяла (резинового матраца), в котором циркулирует теплая вода (Eerguson, 1962; Rickham, 1969). Мы отдаем предпочтение простому резиновому матрацу, в который перед операцией наливают согретую до 37° С воду. Матрац завертывают в стерильную простыню. Ребенка обкладывают слоем ваты (свободным остается лишь операционное поле) и укладывают на теплый матрац. Подобный метод позволяет сохранить необходимую температуру тела ребенка в течение 2 ч — срок, достаточный для производства практически всех оперативных вмешательств.
Ребенка укладывают в положение, соответствующее предстоящей операции. Фиксируют электроды диатермокоагуляции и датчики приборов контроля.
Операционное поле обрабатывают путем двукратного смазывания 1 % йодной настойкой и 70° спиртом. С целью уменьшения потери тепла и предупреждения инфицирования раны во время операции большинство зарубежных хирургов (Gross, 1970, и др.) рекомендуют покрывать операционное поле специальным стерильным клеем или пластиковой пленкой, через которую и производят разрез кожи. Этот прием предупреждает возможность инфицирования раны.
При разделении тканей, манипуляциях па органах и наложении швов у новорожденных хирурга не должно оставлять постоянное ощущение, что он имеет дело с очень нежными, хрупкими, порой желеобразными тканями, прикосновение к которым чревато опасностью неадекватного повреждения. Трудность самокритической оценки собственных манипуляций в этих случаях связана с кажущимся благополучием выполненной операции. Когда в послеоперационном периоде возникают осложнения, далеко не всегда отчетливо выявляется их прямая связь с нарушением правил оперативной техники.
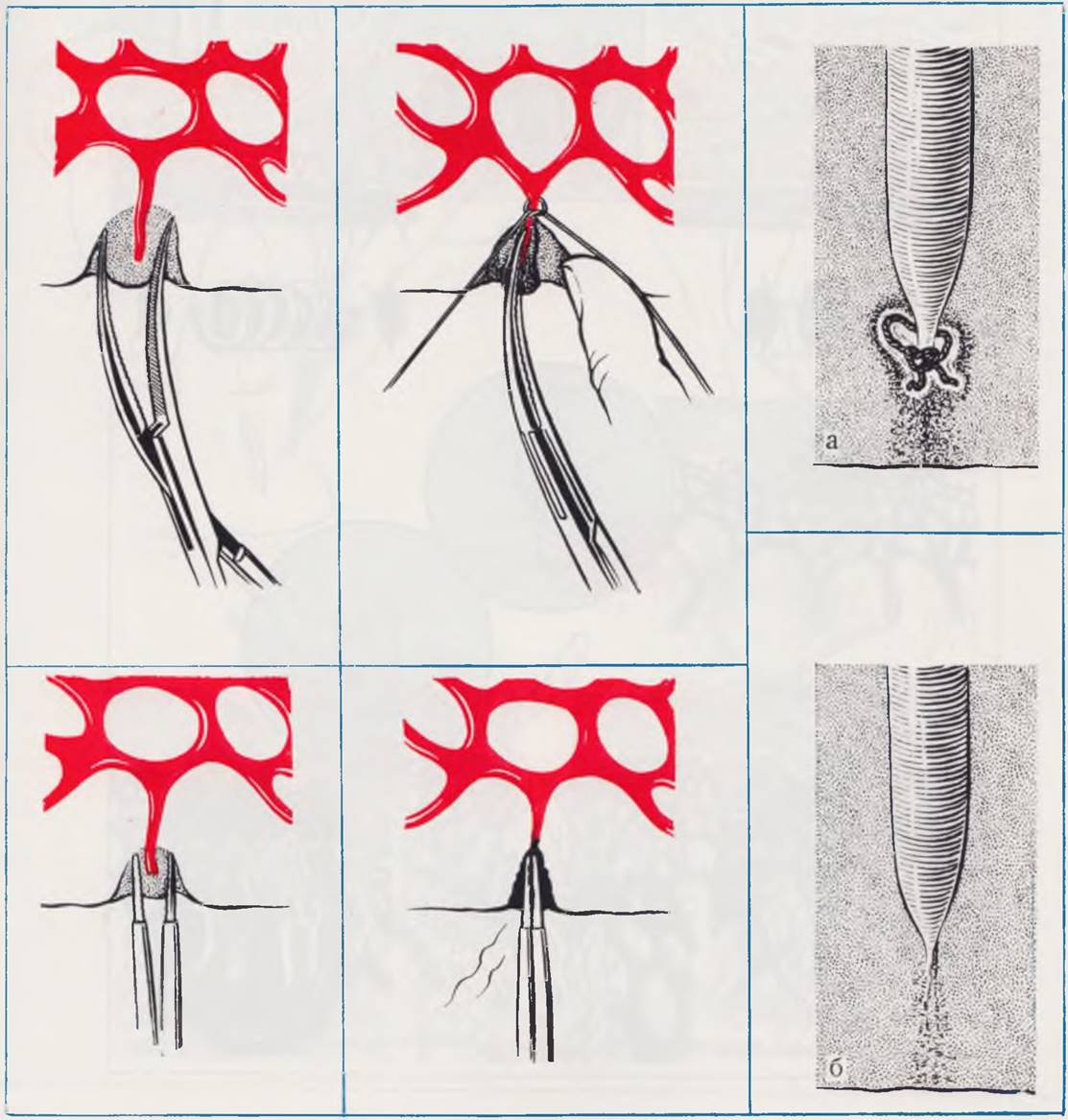
Разрез кожи при операциях у новорожденных проводят в несколько этапов. Быстрое одномоментное разделение тканей на всю глубину не оправдано, кровопотеря и травматический стресс при глубоких грубых манипуляциях усугубляют тяжесть состояния ребенка. Разделение подкожной жировой клетчатки и мышечных слоев осуществляют тонкой диатермической иглой. Важно регулировать силу тока так, чтобы шло «сухое» разделение тканей без обугливания краев раны. При правильном систематическом применении метода электрокоагуляции существенно снижается кровопотеря, меньше выражен послеоперационный болевой синдром, не нарушается репарация тканей. Медленное поэтапное и послойное разделение тканей дает возможность хирургу видеть появляющиеся в поле зрения кровеносные сосуды и проводить перед рассечением «превентивную» электрокоагуляцию. Лучше всего это достигается применением глазного пинцета или специального биполярного электрода, выполненного в виде пинцета. В процессе операции открытую часть раны с целью предупреждения последующего инфицирования покрывают теплыми и влажными марлевыми салфетками. Применение зажимов типа Кохера исключается, они грубы, травмируют захваченные ткани (рис. 9, а, б). Препаровку тканей предпочтительнее проводить острым путем. Тупую препаровку осуществляют осторожными толчкообразными движениями, ограничивающими возможность выхода из нужного анатомического слоя. Разделение тканей в ряде случаев можно облегчить предварительной гидравлической препаровкой 0,25% раствором новокаина. Во избежание новокаиновой интоксикации не следует вводить во время операции более 10 мл раствора. Избыток крови и жидкости удаляют из рапы отсосом, избегая присасывания тканей его наконечником.
Рис. 9. Остановка кровотечения обычным и коагуляционным методом.
Наложение кровоостанавливающего зажима на кровоточащий сосуд обусловливает значительную зону разминания тканей с последующим некрозом. Вокруг лигатуры формируется капсула, развивается длительная перифокальная реакция (а). Применение электрокоагуляции сопровождается возникновением меньшей по объему зоны углеродистого коагулята, который быстро рассасывается, замещаясь соединительной тканью (б).
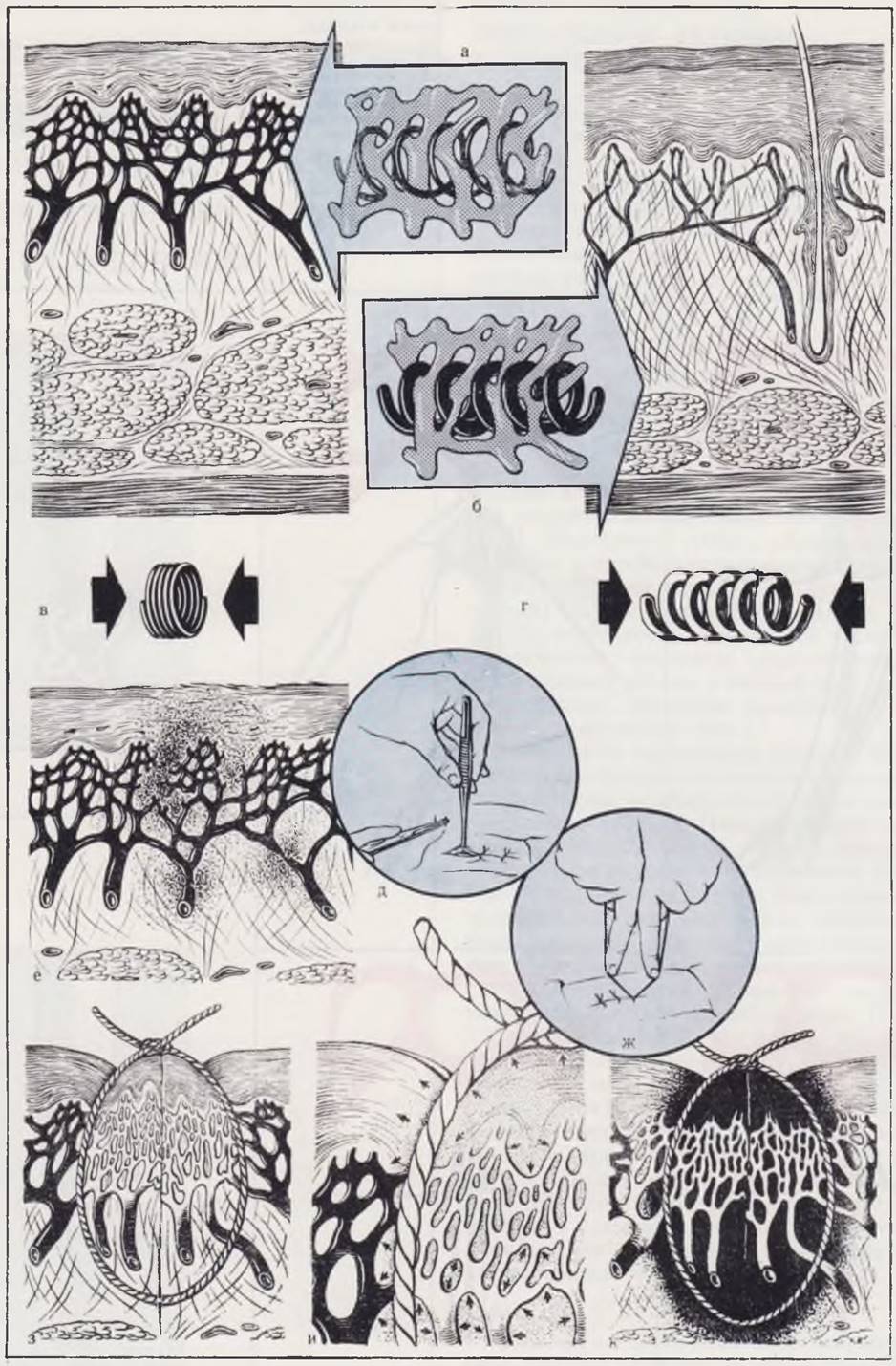
Среди факторов, от которых зависит последующее заживление раны (трофика, гомеостаз, атравматичность вмешательства, применение адекватного шовного материала п др.), особое значение имеет умение хирурга избрать оптимальную дистанцию между швами, оптимальную глубину проведения нити, правильную меру натяжения нитей в момент завязывания узлов (рис. 10).
Рис. 10. Особенности оперативной техники у новорожденного.
В коже новорожденного ребенка (а) в отличие от кожи взрослого человека (б) отмечается обильная, нежная сосудистая сеть, бедный эластический каркас, представленный тонкими волокнами. Эластика новорожденного легко сжимаема и не в состоянии противостоять сравнительно незначительному сдавлению, которое распространяется на сосудистую сеть (в). Эластика кожи взрослого (г) более упруга.
Применение пинцета в хирургии новорожденных (д) сопровождается травмой нежных тканей и в первую очередь
сосудов, что влечет за собой кровоизлияние (е). При наложении швов (ж), когда узлы завязывают до соприкосновения тканей, возникают ишемизация (з) и тканевой отек (и), которые завершаются некрозом (к).
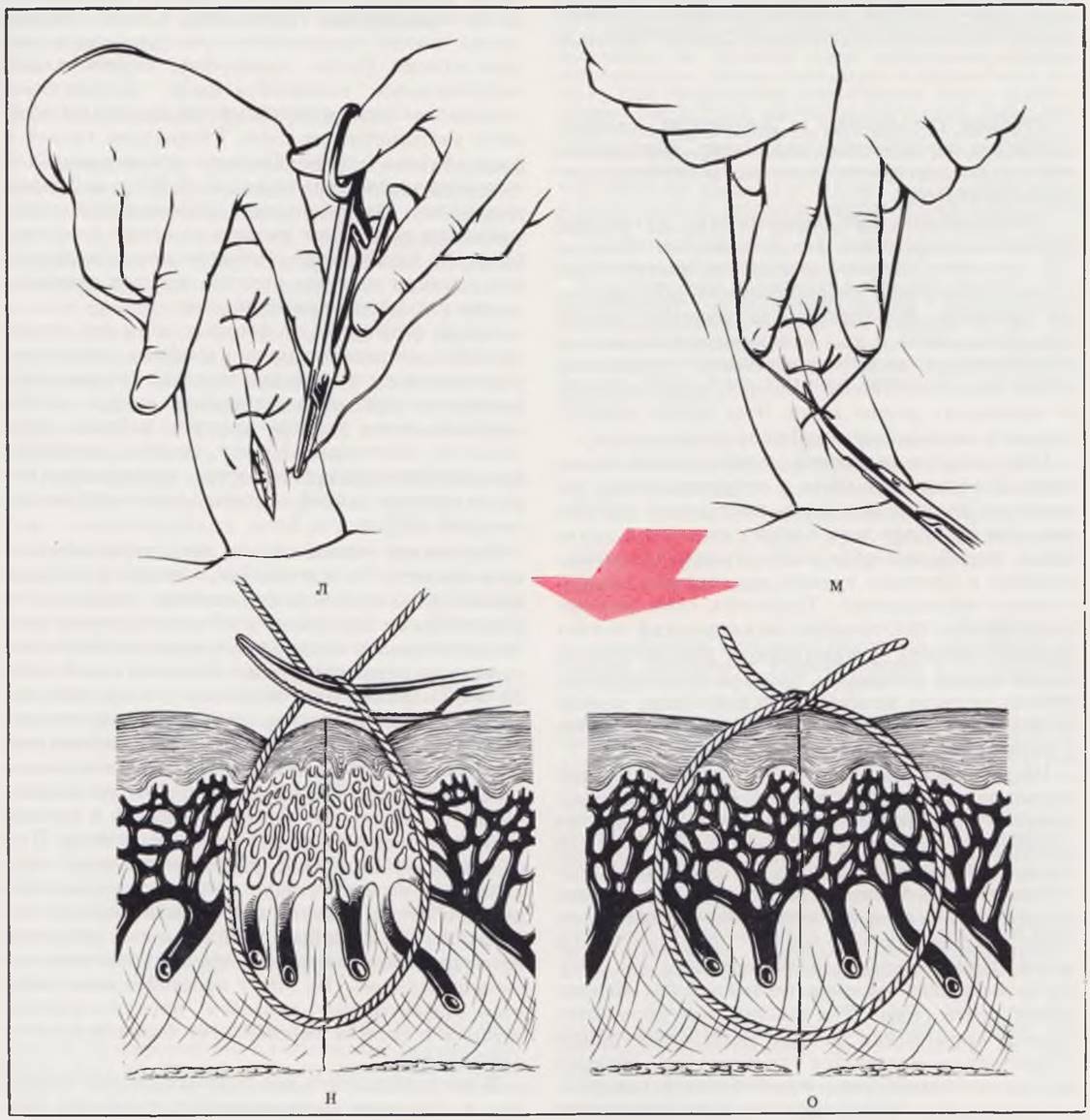
Правильное наложение швов (не только на кожу, но на любые ткани и органы новорожденного, а в первую очередь — на пищевод, прямую кишку, мочеточники, мочевой пузырь) предусматривает отказ от применения пинцета, как «захватывающего» инструмента (л), завязывание узлов с некоторым, строго дозированным запасом (м, н), рассчитанным на полное соприкосновение всех слоев раны после того, как возникнет неизбежный отек (о), но без сдавления сосудов и ишемизации тканей.
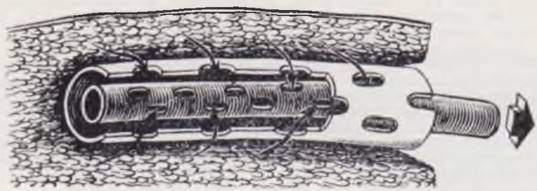
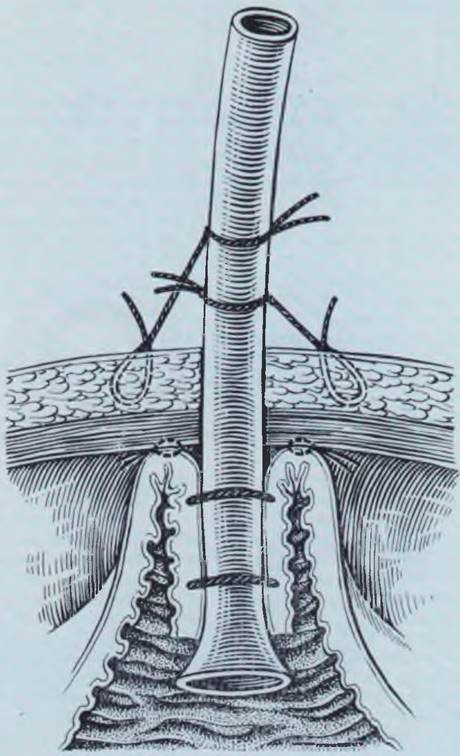
Зашивание кожных краев раны производят по возможности без натяжения, которое ухудшает кровоснабжение и репаративные процессы в райе. В качестве шовного материала лучше всего использовать тонкие синтетические нити или хромированный кетгут на атравматичной игле № 0000 — 00000. При операциях на органах пищеварительного тракта, сосудах, мочевыводящих путях и др. применение атравматичных игл обязательно. При сомнении в полноте гемостаза показано дренирование раны путем введения в подкожную клетчатку па 24 ч топкой резиновой полоски из перчаточной резины. При обширных ранах после удаления больших опухолей, тератоидных опухолей крестцово-копчиковой области и др. на дно раны помещают систему трубок и первые 1 — 2 дня после операции проводят постоянную аспирацию раневого содержимого (рис. 11). Этот простой прием является эффективным способом предупреждения затеков в ране и способствует более быстрому заживлению.
Рис. 11. Дренирование послеоперационных ран.
Активная аспирация из обширных ран, опасных скоплением крови, лимфы, тканевой жидкости проводится с помощью двухпросветных перфорированных трубок, соединенных с системой, создающей отрицательное давление — 20 — 40 мм вод. ст.
В последние годы все большее распространение в хирургии новорожденных получают различного рода пластмассы в виде временных и постоянных протезов (Heiss, 1970; Lister, 1971).
Защита послеоперационной раны с помощью марлевой наклейки у новорожденного неудобна. Наклейка легко отстает, быстро пачкается, смачивается мочой. Мы смазываем послеоперационную рану пастой следующего состава: Brill, griin 2,2 г; Spir. Vini rectif. 96° 10 г; Formalini 10 г; Ol. ricini 5 г; Collodii 100 г.
Паста быстро высыхает и образует плотную, хорошо фиксированную к подлежащей коже эластичную пленку, которая герметична и позволяет вести постоянное наблюдение за состоянием раны.
Оперативные доступы
Стремление к минимальной травматизации тканей и предупреждению возможных осложнений в послеоперационном периоде побуждает хирургов к постоянному совершенствованию оперативных доступов при проведении операций у новорожденных. Принципиально правильным в этих поисках является стремление к рассечению кожи по ходу кожных линий и по переменным направлениям при разделении тканей. Соблюдение указанных принципов позволяет резко уменьшить процент осложнений, связанных с расхождением краев раны, и получить хорошие косметические результаты.
Оперативные доступы к органам грудной полости. При операциях на органах грудной полости у новорожденных детей используют боковую торакотомию. Этот доступ менее травматичен, чем заднебоковой, обеспечивает хороший подход к корню легкого, пищеводу и средостению и не затрудняет работу анестезиолога, не мешая вентиляции легких. Для лучшего заживления рапы кожу рассекают в вертикальном направлении по средней подмышечной линии. Несовпадение направлений разрезов кожи и межреберий является надежной профилактикой расхождения рапы, что имеет особое значение при операциях по поводу острых гнойных заболеваний легких и плевры.
В настоящее время мы применяем два доступа — трансплевральную торакотомию с вертикальным рассечением кожи (при заболеваниях легкого, опухолях средостения) и экстраплевральную торакотомию со смещением кожи (при атрезии пищевода и изолированных трахеопищеводных свищах).
Трансплевральный доступ. Ребенка укладывают на здоровый бок с валиком под нижними ребрами. Руку на стороне операции фиксируют в максимально отведенном положении с помощью липкого пластыря пли мягкой марлевой манжеты.
Разрез кожи проводят по средне-подмышечной линии от нижнего края подмышечной впадины длиной 6 — 7 см (рис. 12, а). Гемостаз осущестляют с помощью диатермокоагулятора и глазного пинцета. Кожу с подкожной клетчаткой тупо отслаивают на 2 — 3 см по направлению к грудине и позвоночнику на уровне соответствующего межреберья (чаще всего четвертого — шестого в зависимости от характера операции). Тупым крючком отводят к позвоночнику широкую мышцу спины (m. latissimus dorsi). После перевязки или электрокоагуляции на этом же уровне а. и v. thoracales laterales переднюю зубчатую мышцу (m. serratus anterior) тупо расслаивают по ходу волокон с помощью двух пинцетов, обнажая межреберье. Межреберные мышцы осторожно рассекают на ограниченном участке скальпелем или диатермокоагулятором; скальпелем надсекают плевру. Дальнейшее рассечение межреберья производят по верхнему краю нижележащего ребра под контролем пальца, введенного в плевральную полость. При повреждении межреберного сосуда кровотечение останавливают диатермокоагуляцией. Ребра разводят с помощью реберного расширителя для новорожденных, предварительно обложив края раны салфетками, смоченными в растворе антибиотиков. При наличии спаечного процесса у больных с нагноением плевральной полости ребра раздвигают только после мобилизации поверхности легкого на достаточном протяжении. В противном случае может произойти разрыв легочной ткани при расширении краев раны.
Ушивание раны производят в обратном порядке. Ребра стягивают 1 — 2 обвивными швами с использованием хромированного кетгута или капрона № 000. На край m. serratus anterior накладывают один ряд редких узловатых капроновых или кетгутовых швов № 0000. Вторым рядом швов ушивают подкожную клетчатку, третьим — кожу.
Описанный доступ дает возможность достаточно свободно манипулировать на всех органах грудной полости. Эластичность тканей новорожденных позволяет обходиться без пересечения и резекции ребер даже при удалении больших опухолей средостения и при обширных плевральных сращениях.
Экстраплевральный доступ. Кожный разрез проводят на 2 см ниже избранного межреберья по боковой поверхности грудной клетки с захождением его краев на 1,5 — 2 см за переднюю и заднюю подмышечные линии (рис. 12, б). Верхний лоскут отслаивают кверху до вышележащего межреберья, над которым производят дальнейшее разъединение тканей грудной клетки. Последнее осуществляется так же, как и при чресплевральном доступе. Наибольшую сложность представляет рассечение межреберных мышц без повреждения плевры. После обнажения плеврального листка влажным препаровочным тупфером равномерными нежными движениями отслаивают париетальный листок плевры от надкостницы верхнего ребра до купола плевры. Средостение обнажают до ворот легкого от позвоночника до грудины. Вторым этапом отслаивают плевру от нижележащих ребер. Дугу непарной вены не перевязывают. Границы отслойки плеврального мешка оказываются достаточными для свободного разведения ребер и манипулирования на органах средостения. После окончания операции расправленное легкое прижимает плевру к грудной стенке, что исключает необходимость дополнительной ее фиксации.
Рис. 12. Оперативные доступы у новорожденных.
Вертикальный разрез кожи при боковом доступе (а). При экстраплевральной торакотомии разрез кожи производят на 2 см нише избранного межреберья (б). Схема верхней (в) и нижней (г) срединной лапаротомии, перекрестные доступы при других операциях на органах брюшной полости (д).
Ушивание торакотомной раны производят так же, как и при трансплевральном доступе.
Боковая торакотомия экстраплевральным доступом, в отличие от трансплеврального, сопровождается меньшей травмой легочной ткани, препятствует высыханию листков плевры и дает возможность избежать инфицирования плевральной полости при осложнениях со стороны пищеводного анастомоза.
Оперативные доступы к органам брюшной полости. Недостаточные репаративные возможности тканей новорожденных, особенно недоношенных, обусловливают при прочих равных условиях больший, чем у детей старшего возраста, процент расхождения ран после операций на органах брюшной полости с последующей эвентрацией. В связи с этим вопросы оперативных доступов к органам брюшной полости приобретают принципиальное значение. В последние годы большинство зарубежных детских хирургов (Rickham, 1969; Gross, 1970) при операциях на органах брюшной полости у новорожденных отказались от срединных доступов в пользу поперечных, которые позволяют значительно снизить процент послеоперационных расхождений краев раны и эвентраций. Классические варианты поперечных доступов предусматривают пересечение в поперечном направлении всех слоев брюшной стенки, в том числе и прямых мышц. Даже при соблюдении правил оперативной техники рассечение мышечных слоев травматично и нередко сопровождается значительной кровопотерей. Менее травматичными и надежно предупреждающими возможные осложнения в послеоперационном периоде являются разработанные в пашей клинике доступы с поперечным рассечением кожи и подкожной клетчатки и последующим разделением мышц по ходу волокон или рассечением апоневроза по средней линии. Такие доступы при операциях па органах брюшной полости у новорожденных мы считаем методом выбора.
При необходимости коррекции большинства пороков развития двенадцатиперстной и тонкой кишок, при перфорации толстой кишки и др. брюшную полость вскрывают крестообразным доступом (рис. 12, в).
Положение ребенка на спине, с валиком под поясницей. Кожу и подкожную клетчатку рассекают в поперечном направлении в 2 — 2,5 см выше пупка. Края разреза выходят за латеральный край прямых мышц в среднем на 1 см с обеих сторон. После тщательной электрокоагуляции кровоточащих сосудов кожу с подкожной клетчаткой отсепаровывают вниз до пупка и вверх до мечевидного отростка грудины. Кровоточащие сосуды коагулируют, захватывая их глазным пинцетом. Края раны разводят тупыми крючками, апоневроз рассекают по средней линии от мечевидного отростка до пупка. Доступ обеспечивает возможность свободно манипулировать на всех органах брюшной полости, за исключением терминального отдела сигмовидной кишки. После окончания внутрибрюшного эта на операции апоневроз и брюшину ушивают одним рядом прочных капроновых швов. Второй ряд швов накладывают на кожу и подкожную клетчатку. При необходимости дренирования брюшной полости дренажные трубки выводят через отдельный прокол. При сомнении в полноте гемостаза в один из углов раны на первые 15 — 20 ч после операции можно ввести тонкий резиновый выпускник. При тщательном гемостазе затеки не образуются.
Рекомендуемый доступ с перекрещивающимися рядами швов позволяет избежать расхождения краев рапы и особенно эвентраций. Последние 4 года мы оперируем новорожденных, применяя исключительно поперечный крестообразный доступ, и не наблюдали эвентраций даже у самых тяжелых септических больных.
Принцип перекрестного доступа с поперечным рассечением кожи и подкожной клетчатки успешно применяют и при других операциях (рис. 12, д) — пластике диафрагмальных грыж, пилоростенозе, гастростомии, аппендэктомии, операциях по поводу паховых грыж, крипторхизма и др. Исключение составляют вмешательства по поводу болезни Гиршпрунга, где применяют парамедианный или поперечный доступ с пересечением правой прямой мышцы.
Преимущества рекомендуемых доступов заключаются и в том, что они дают отличные косметические результаты. Разрезы по ходу кожных складок заживают топким рубцом, который через несколько лет бывает трудно обнаружить. Доступы с перекрестным разделением тканей требуют определенного опыта хирурга. Несоблюдение правил выполнения доступа ограничивает возможность проведения манипуляций и затрудняет выполнение оперативного вмешательства. Доступы к органам забрюшинного пространства такие же, как у детей более старшего возраста.
В заключение отметим, что соблюдение правил оперативной техники у новорожденных позволяет значительно уменьшить число осложнений в послеоперационном периоде и улучшить результаты оперативного лечения.
Остановимся на принципах выполнения наиболее распространенных в хирургии новорожденных специальных исследований и оперативных вмешательств.
Методы исследования органов мочеполовой системы
Необходимость в обследовании мочевого тракта у новорожденных возникает при подозрении па пороки развития мочевых путей, при поражении их вторичным процессом и сочетании врожденных пороков (А. Я. Пытель, 1966; С. Я. Долецкий, 1970; Bischoff, 1964).
Урологическое обследование показано при клинических проявлениях мочевой инфекции, гематурии, азотемии, увеличении почек, поясничных опухолях, постоянном расширении мочевого пузыря. Оценка анатомии и функции мочевых путей необходима при пороках развития нижних мочевых путей (экстрофия мочевого пузыря, эписпадия и т. д.).
Вторичные изменения мочевых путей дают основания для предположения о смещении мочевых путей, возможной обструкции их объемными полостями (гидрокольпос, крестцово-копчиковые тератомы, ретроперитонеальные опухоли и т. д.) и также являются показанием к проведению специальных исследований.
Исследования новорожденных включают весь комплекс методов, применяемых в урологической практике. Проведение их специфично, что связано с анатомо-физиологическими особенностями организма новорожденного. Следует учитывать особенности при определении показаний и противопоказаний к исследованию, выборе метода.
Исследование начинают с осмотра, перкуссии и пальпации. Пальпацию почечных областей проводят в положении ребенка на спине с согнутыми в тазобедренных и коленных суставах ногами. Ценные диагностические данные получают при опухолях почек, гидронефрозе, поликистозе и т. д. Растянутый мочевой пузырь чаще указывает на инфравезикальную обструкцию или неврогенный мочевой пузырь.
Рентгенологические методы исследования. Урорентгенологическое исследование новорожденных начинают с обзорного снимка мочевой системы. Используют современные аппараты, позволяющие производить рентгенографию с малой экспозицией — до 0,03 с, с тем чтобы качество изображения не ухудшали дыхательные движения ребенка. Существенной причиной затруднений при рентгенографии брюшной полости у новорожденных и грудных детей является метеоризм, поэтому обязательна предварительная подготовка ребенка. Вечером накануне исследования назначают гипертоническую клизму из 5 % раствора хлористого натрия. Клизму повторяют утром за 2 ч до исследования. При этом следят, чтобы вместе с раствором в кишечник не был введен воздух.
Обзорный снимок мочевой системы позволяет определить положение, контуры и размеры почек, наличие дополнительных тканей. Уменьшение размеров почек является признаком гипоплазии их, неровность контуров при этом говорит в пользу вторичного сморщивания. Увеличение размеров почек в большинстве случаев обусловлено наличием кист или опухолей почек. Изменение местоположения возникает при дистопии. Обязательна оценка состояния костной системы: у ряда больных обнаруживают spina bifidaocculta, отсутствие крестцово- копчикового сочленения, которые и являются причиной изменения мочевой системы.
Экскреторная урография позволяет получить представление о функции и морфологических изменениях почек. Исследование показано при подозрении па заболевание мочевых путей. Противопоказанием является почечная недостаточность, сопровождающаяся высоким уровнем остаточного азота н низким удельным весом мочи. Применяют трийодистые препараты — 60 — 80% раствор гипака, уротраст, урографин, трийотраст, верографин и т. д. Новорожденным их вводят из расчета 3 — 3,5 мл на 1 кг веса ребенка.
Контрастное вещество вводят в вены головы, шеи, тыла кисти, локтевого сгиба. Целесообразно введение контрастного раствора капельным путем в сочетании с 5% глюкозой из двух баллонов, в одном из которых находится контрастное вещество, а в другом раствор глюкозы. После венепункции в вену сначала вводят раствор глюкозы с добавлением нескольких капель контрастного вещества, определяют реакцию ребенка. Затем медленно (60 капель в минуту) вводят контрастное вещество, регулируя количество и скорость введения. Через соответствующие промежутки времени производят снимки. Во время проявления пленок продолжают вводить капельно раствор глюкозы, а в случае необходимости повторной урографии вновь вводят контрастное вещество, не прибегая к новой венепункции. Первый снимок делают на 3-й мин, повторные — на 8-й и 15-й мин и далее по схеме. При невозможности венепункции контрастное вещество можно вводить внутримышечно, внутрикостно пли подкожно. Простым, но не всегда надежным, является способ кишечного введения по С. Б. Поташниковой. Интраректально ребенку вводят до 40 — 50 мл 60% рентгено-контрастного раствора. Наиболее качественные урограммы получают при внутривенном введении.
Инфузионная урография, получившая распространение в последние годы, основана па дробном введении контрастного раствора, что позволяет получить все фазы уродинамики и избежать проведения ретроградной пиелографии. Контрастное вещество в 10% растворе глюкозы вводят в течение 10 мин внутривенно капельно — 5 — 8 мл на 1 кг веса ребенка. Показания, противопоказания и рентгенотехнические условия те же, что и при экскреторной урографии.
Экскреторная урография у новорожденных позволяет получить отчетливое представление об изменениях не только в почках, но и в мочеточниках, мочевом пузыре, уретре. Другие методы рентгенологической диагностики заболеваний органов мочевыводящей системы у новорожденных применяют лишь тогда, когда данные экскреторной урографии не позволяют поставить диагноз.
Ретроградная пиелография возможна практически только у девочек. Одновременная двусторонняя катетеризация опасна. Вводят 0,5 — 1 мл 20% раствора контрастного вещества. При отсутствии на экскреторной урограмме четких диагностических данных показано ретроградное введение контрастного раствора в уретру и мочевой пузырь.
Уретрография показана при аномалиях развития уретры, клапанах, стриктурах, свищах и т. д. Противопоказанием является воспалительный процесс в мочеиспускательном канале. Различают восходящую и нисходящую уретрографию. Используют 20% растворы контрастного вещества.
Восходящую уретрографию выполняют в положении ребенка на спине. Одна нога его должна быть согнута в коленном и тазобедренном суставах. Для четкого заполнения задней уретры производят нисходящую уретрографию в момент мочеиспускания после предварительного введения в мочевой пузырь 40 — 60 мл 20% контрастного раствора. При невозможности самопроизвольного мочеиспускания врач путем надавливания в надлобковой области заставляет ребенка помочиться.
Цистография. Показанием к применению цистографии являются аномалии развития мочевого пузыря, мегауретер, уретероцеле, опухоли мочевого пузыря. Противопоказанием служит острый воспалительный процесс в уретре и мочевом пузыре.
Техника ретроградной цистографии состоит во введении по катетеру в мочевой пузырь 40 — 60 мл 20% контрастного раствора или кислорода. После введения контрастного вещества катетер извлекают и производят рентгеновские снимки до и после мочеиспускания, что позволяет выявить пассивный и активный рефлюкс.
В норме мочевой пузырь имеет овальную форму, четкие, ровные контуры. При атонии он имеет башенную форму. Выявляется пассивный и активный рефлюкс, шейка пузыря удлинена, расширена. Дивертикулы дают дополнительную тень, опухоли определяются в виде дефектов наполнения.
Проведение цистоскопии у новорожденных крайне затруднено из-за малого диаметра уретры. Техника не отличается от таковой у детей старшего возраста. Исследование проводится под наркозом.
Радиоизотопная ренография. Метод основан на внутривенном введении небольших количеств индикатора — изотопа 131 I, меченного гиппураном. Поглощение радиоактивного вещества почками и выведение его с мочой регистрируются специальными электронными счетчиками, которые отмечают число импульсов в минуту. Получаемая при этом кривая называется изотопной ренограммой. Показания к исследованию ставятся широко: пиелонефрит, гидронефроз, уремия, поликистоз и т. д. Противопоказаний к исследованию практически нет (O’Neill е. а., 1972; Winter е. а., 1968). Радиоизотопная ренография не является ведущим методом исследования, но в комплексе с другими дает ценные сведения для определения функциональной способности почек.
Почечная биопсия. Биопсия почек относится к числу современных диагностических методов, обеспечивающих возможность прижизненного выявления тончайших морфологических и гистохимических изменений органа. Биопсия почек показана при гломерулонефрите, пиелонефрите, системных поражениях почек, гематурии и т. д. Биопсия почек у новорожденных в настоящее время не получила достаточно широкого распространения. Исследование проводится открытым способом с ограниченным обнажением органа.
Помимо перечисленных методик, у новорожденных могут быть применены и другие — ретроперитонеум, томография, почечная ангиография и т. д.
Методы исследования сосудистой системы
Успешное развитие хирургии новорожденных во многом обязано разработке комплекса диагностических сосудистых исследований. Ниже
освещены наиболее частые методы исследования сосудов различных органов.
Артериография. Показанием к исследованию служат заболевания и пороки развития сосудов, сосудистые опухоли. У новорожденных исследование проводят открытым способом, который заключается во введении контрастного вещества в предварительно выделенную из окружающих тканей артерию. При артериографии конечностей используют проксимальные отделы плечевой или бедренной артерии; при аневризмах контрастное вещество вводят непосредственно в аневризму. Применяют 50 — 70% контрастные растворы. Скорость введения 5 — 7 мл/с. Первый снимок делают после введения половины контрастного вещества. Артериография позволяет четко диагностировать характер изменения сосудистой стенки и состояние периферического кровотока.
Венография. Контрастное исследование вен применяют с целью выявления их состояния при ряде заболеваний. Показания: пороки развития сосудов конечностей, опухоли, отеки, варикозное расширение вен. Различают венографию внутривенную (прямую) и внутрикостную (непрямую). При внутривенной венографии контрастируются большей частью только поверхностные вены. Внутрикостную венографию применяют тогда, когда необходимо выявить состояние глубоких вен. Применяют контрастные вещества низкой концентрации — до 35%. Скорость введения 2 — 4 мл/с. Флебография позволяет определить состояние сосудистой стенки, степень облитерации сосуда, протяженность поражения венозной системы.
Спленопортография. Исследование сосудов системы воротной вены у новорожденных проводится исключительно под общим обезболиванием.
Положение больного — на спине, с отведенной вверх левой рукой. Обязательно соблюдение правил асептики. Кожу на месте пункции обрабатывают спиртом. Применение настойки йода не рекомендуется, так как это способствует усиленному поглощению рентгеновских лучей при последующей спленопортографии. Неувеличенную или нерезко увеличенную селезенку пунктируют под общим обезболиванием в момент апноэ в 9 — 10-м межреберье по средней или задней аксиллярной линиям. Для пункции берут иглу с мандреном длиной не менее 10 см, с диаметром просвета не менее 0,8 мм. В случаях значительного увеличения селезенки пункцию проводят через переднюю брюшную стенку на 1 — 3 см ниже края реберной дуги. Первым этапом прокалывают брюшную стенку до характерного ощущения «провала». В этот момент игла попадает в свободную брюшную полость. Затем иглу осторожно проводят кпереди и вводят в ткань селезенки на 1 см. При правильном положении иглы из ее просвета после удаления мандрена каплями выделяется темная кровь. Иглу соединяют с манометром Вальдмана и измеряют внутриселезеночное давление. После этого канюлю иглы соединяют со шприцем, предварительно наполненным подогретым до 37° С раствором контрастного вещества (15 мл 65 — 70% раствора). Хирург, не изменяя положения иглы, быстро, в течение 4 — 5 с, вводит всю дозу контрастного вещества в ткань селезенки. При одномоментной спленопортографии у новорожденных рентгеновский снимок производят на 6 — 7-й с от начала введения контрастного вещества. При наличии сериографа и производстве серийной спленопортограммы первый снимок делают после введения половины контрастного вещества, затем делают 4 — 5 снимков с интервалом в 1 с.
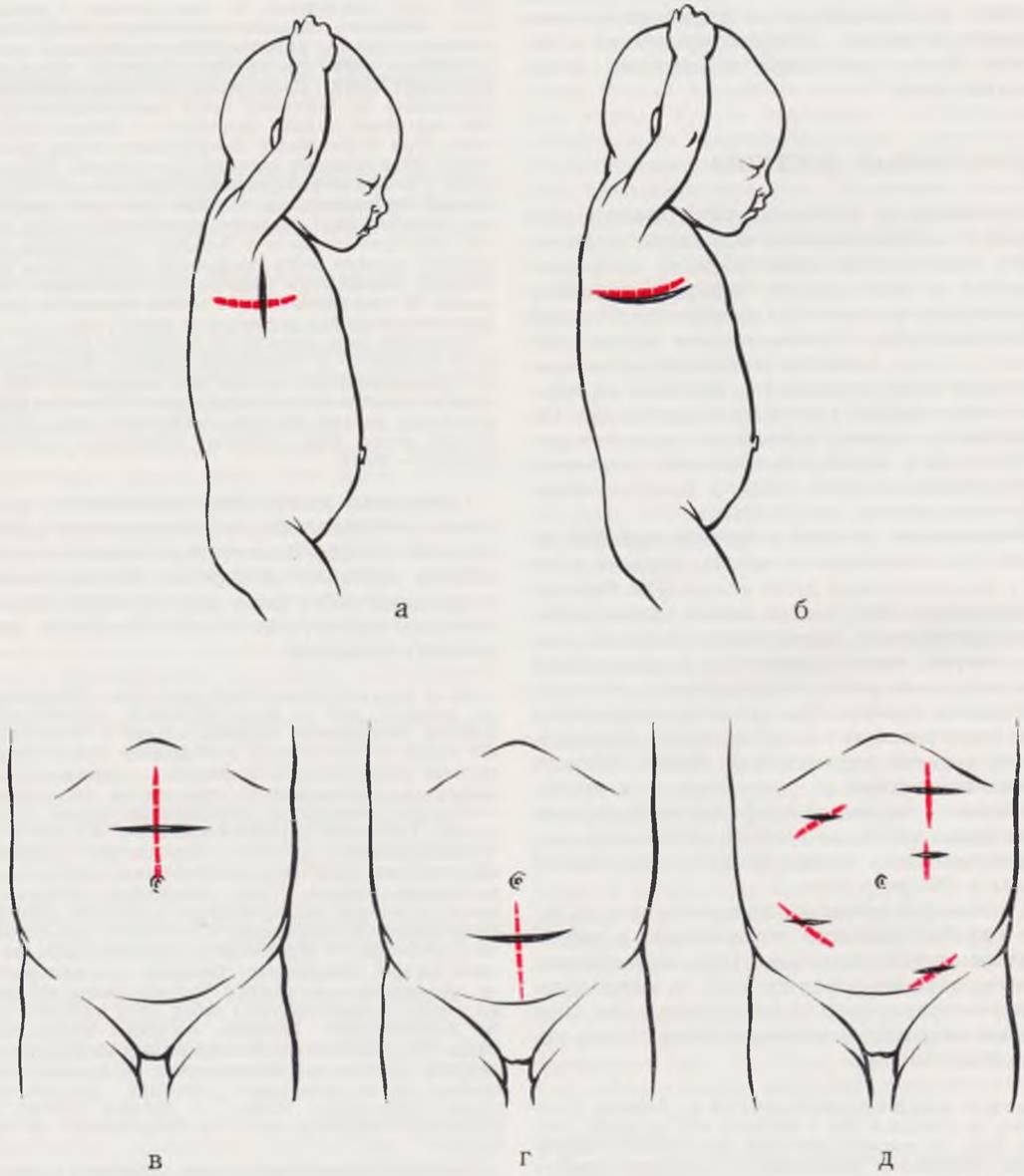
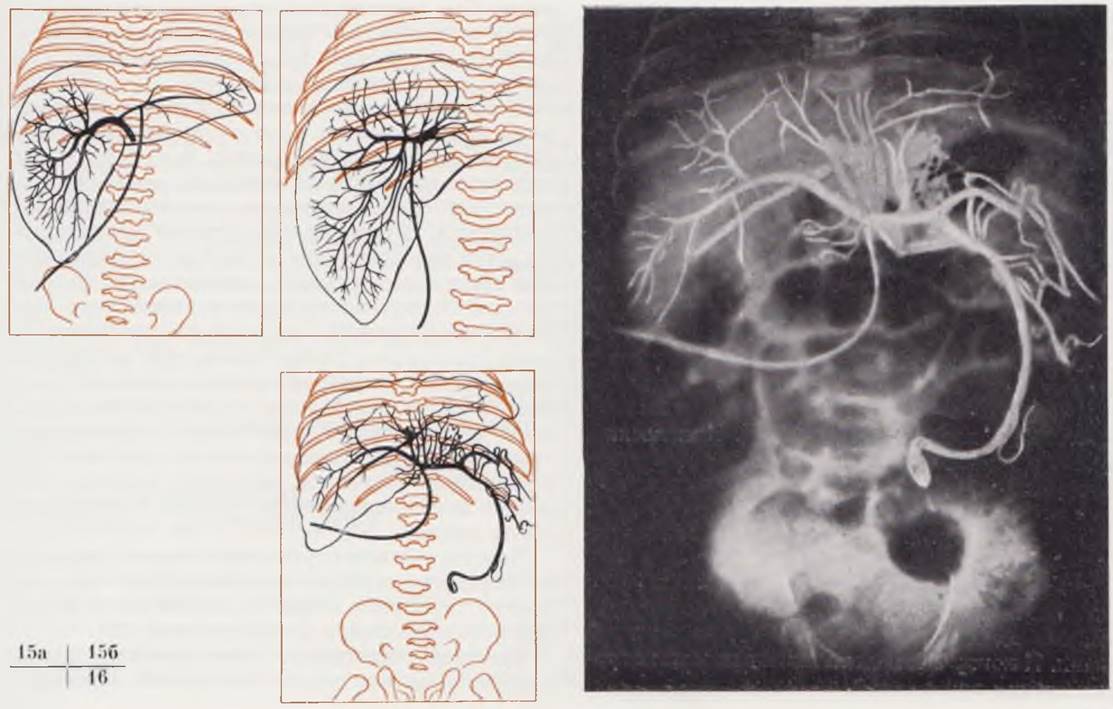
При нормальном портальном кровообращении у новорожденного па спленопортограмме видно депо контрастного вещества в селезенке. Отчетливо контрастируются 1 — 2 ветви, образующие селезеночную вену, ствол селезеночной вены, воротная вена и разветвления ее в печени (рис. 13). Заброса контрастного вещества в ветви воротной вены не наблюдается. При нарушении портального кровообращения и развитии синдрома портальной гипертензии на спленопортограмме в зависимости от формы портальной гипертензии получают изменения, идентичные таковым у взрослых и детей более старшего возраста.
Рис. 13. Нормальная спленопортограмма новорожденного. Депо контрастного вещества в селезенке. Контрастированы селезеночная, воротная вены и внутрипеченочные ветви воротной вены.
При производстве спленопортограммы хирург не гарантирован от возникновения различных осложнений и неудач, среди которых у новорожденных возможен сквозной прокол селезенки с последующим введением контрастного вещества в свободную брюшную полость. Попадание контрастного вещества в брюшную полость не опасно; оно, как правило, быстро рассасывается. Более грозным осложнением является разрыв селезенки с последующим кровотечением. Пункция селезенки под общим обезболиванием в момент апноэ позволяет предупредить подобное осложнение.
Выполнение спленопортографии у новорожденных из-за малых размеров селезенки представляет значительные трудности даже для опытных исследователей, поэтому в последние годы при необходимости измерения давления в портальной системе и контрастирования сосудов системы воротной вены получил распространение метод портоманометрии и портогепатографии через пупочную вену.
Портоманометрия и портогепатография через пупочную вену. Доступ в воротную вену через пупочную применяется не только для проведения портоманометрии и портогепатографии, но и с целью длительного введения в печень различных лекарственных веществ.
Пупочная вона человека залегает между поперечной фасцией живота и брюшиной и, направляясь вверх от пупка, вступает в печень в области пупочной вырезки, где впадает в левую ветвь (98%) или непосредственно в основной ствол (2%) воротной вены (А. Д. Никольский, 1965). К моменту рождения ребенка длина пупочной вены достигает 70 мм, диаметр просвета в месте впадения в воротную — 6,5 мм.
Пупочная вена новорожденного имеет структуру обычного венозного сосуда. Стенки и просвет воны выражены отчетливо. Но уже к 10-му дню после рождения отмечаются атрофия мышечных волокон и разрастание соединительной ткани. К концу 3-й недели жизни явления атрофии стенки вены, особенно около пупка, выражены отчетливо. В течение всего периода новорожденности пупочная вена может быть выделена из окружающей ткани, разбужирована и использована в качестве доступа в сосуды системы воротной вены.
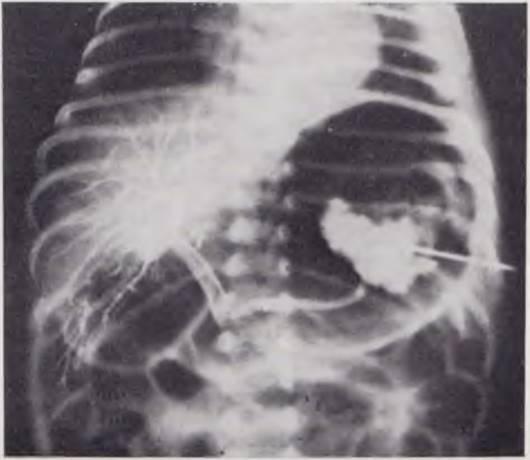
У новорожденных и грудных детей проекция вены на переднюю брюшную стенку соответствует средней липни живота (рис. 14). Экстра-перитонеальная часть пупочной вены у большинства больных выражена достаточно хорошо.
Рис. 14. Проекция пупочной вены на переднюю брюшную стенку у новорожденного (а) и у взрослого (б). К равным обозначена средняя линия.
Исследование проводят под общим обезболиванием в положении ребенка на спине. По средней линии на 3 см выше пупка делают разрез кожи и подкожной клетчатки длиной 3 см. Рассекают апоневроз, в пред- брюшинной клетчатке находят и берут на держалку тяж пупочной вены. Выделение вены проводят внебрюшинно. Стенку надсекают скальпелем до появления просвета. Реканализацию просвета проводят мочеточниковым катетером. Об успешном бужировании говорит появление в просвете вены после извлечения бужа крови, которая при высоком портальном давлении выделяется частыми каплями. В просвет вены вводят пластиковый катетер с канюлей. Измеряют портальное давление. Затем в момент апноэ в вену вводят контрастное вещество (5 мл 65 — 70% раствора). Снимок производят на 4 — 5-й с от начала введения контрастного вещества.
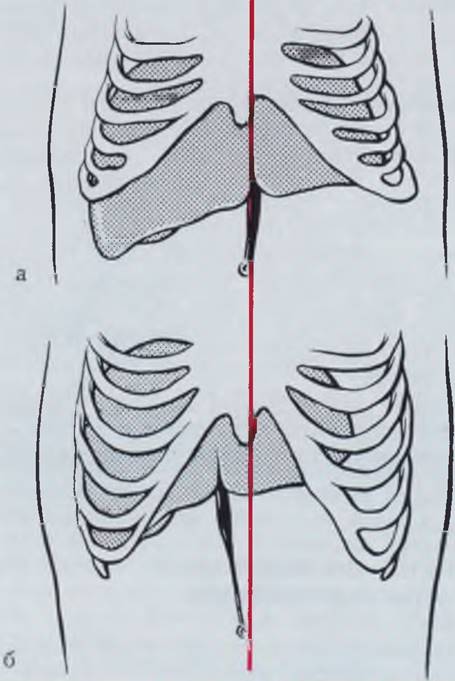
На портогепатограмме через пупочную вену при нормальном портальном кровообращении отчетливо видно место впадения пупочной вены в воротную, удается получить четкое изображение внутрипеченочных разветвлений воротной вены. Как правило, выполняется сосудистая система всех участков печени независимо от того, впадает ли пупочная вена в основной ствол или левую ветвь воротной вены (рис. 15, а, б). Заброса контрастного вещества в ветви воротной вены не наблюдается. Контрастирование сосудов печени на портогепатограммах, полученных при введении контрастного вещества через пупочную вену, более отчетливое, чем на спленопортограммах. В большинстве случаев выполняются ветви воротной вены до 6 — 7-го порядка, причем сосуды, не обрываясь, доходят почти до края печени. Этому способствует меньшее, чем при спленопортографии, разведение контрастного вещества кровью. Более четкое, чем па спленопортограмме, контрастирование мелких разветвлений воротной вены внутри печени повышает разрешающую способность портогепатографии в диагностике небольших очаговых поражений (в частности, опухолей печени), что делает портогепатографито в таких случаях методом выбора.
Рис. 15. Нормальные портогепатограммы через пупочную вену у новорожденных. а — магистральный тип ветвления воротной вены; б — рассыпной тип ветвления воротной вены.
При нарушении портального кровообращения на портогепатограмме отмечается ретроградное контрастирование ветвей воротной вены п путей коллатерального кровотока (рис. 16).
Рис. 16. Портогепатограмма ребенка 6 мес. Рисунок сосудов печени резко обеднен. Выполнены все сосуды воротной системы и массивная коллатеральная сеть. Диагноз: атрезия желчных ходов; билиарный цирроз печени.
Трансумбиликальная аортография — метод контрастирования аорты и ее ветвей. Противопоказания: общее тяжелое состояние ребенка и повышенная чувствительность к йодистым препаратам.
Исследование выполняют под наркозом. Через кожный разрез в паховой области после рассечения апоневроза косой мышцы живота в предбрюшинной клетчатке отыскивают пупочную артерию, которую берут на лигатуру и вскрывают. Зонд вводят в просвет артерии и под контролем рентгеновского экрана устанавливают на нужном месте. В момент апноэ вводят контрастное вещество и производят рентгеновские снимки. После удаления катетера артерию перевязывают.
Трансумбиликальная аортография устраняет необходимость использования какого-либо магистрального сосуда и уменьшает опасность развития сосудистых осложнений.
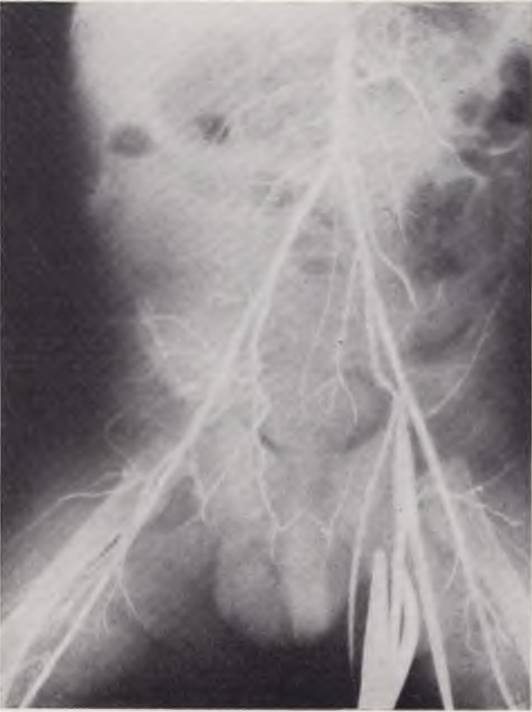
Почечная ангиография. Метод контрастного исследования сосудов почек расширяет возможности топической диагностики при поражении паренхимы почек, почечных сосудов, при ряде заболеваний забрюшинного пространства (рис. 17). Исследование показано при упорной гематурии, гипертонии, подозрении на заболевание почечных сосудов, аномалиях развития почек, гидронефрозе, поликистозе и т. д. Противопоказаниями являются повышенная чувствительность ребенка к йоду, экссудативный диатез, заболевания крови.
Рис. 17. Аортограмма больного 28 дней. Катетер проведен через левую пупочную артерию в аорту. Правая почечная артерия не контрастирована. Диагноз: аплазия правой почки.
Исследование проводят под наркозом. Для катетеризации применяют рентгеноконтрастные катетеры типа Эдмана и Курнана. Контрастное вещество вводят под давлением 5 атм (2 мл 70% раствора на 1 кг веса ребенка). Почечные сосуды контрастируют путем катетеризации аорты через пупочные пли бедренные артерии. У новорожденных предпочтительнее первый способ.
При трансфеморальном способе через разрез кожи в верхней трети бедра послойно обнажают бедренную артерию. Под оба ее конца подводят турникеты. На артерию накладывают П-образный капроновый шов, внутри которого производят продольную артериотомию или пункцию. В аорту до уровня отхождения почечных артерий вводят зонд, который соединяют с пневматическим шприцем. Серийные снимки производят в момент апноэ. После удаления зонда из артерии П-образный шов завязывают. Доступ к почечным сосудам через пупочные артерии назван трансумбиликально и почечной ангиографией (Ю. П. Терехов, Ю. А. Тихонов, В. Г. Акопян, 1966). При этом способе доступ в аорту аналогичен описанному выше при трансумбиликальпой аортографии.
Эндоскопические методы исследования
Своевременная диагностика заболеваний органов грудной и брюшной полостей в настоящее время возможна в результате сопоставления данных анамнеза, состояния больного и данных лабораторных и функциональных исследований. Известное значение в постановке диагноза имеет непосредственный осмотр патологически измененного органа путем применения одного из эндоскопических методов исследования. Наиболее часто применяют ларинго-трахеобронхоскопию, эзофагоскопию, лапаро- и торакоскопию, цистоскопию.
Трахеобронхоскопия. Осмотр трахеи и бронхов у новорожденных проводят с диагностической и лечебной целью. В последние годы в связи с развитием реаниматологии и расширением показаний к ранним оперативным вмешательствам необходимость в проведении бронхоскопии у новорожденных возросла.
Показания. Бронхоскопия у новорожденных показана при нарушении свободной проходимости трахеи и бронхов различной этиологии (аспирация амниотической жидкости, слизи, крови, мекония, содержимого желудка или слюны при наличии трахеопищеводного свища, гноя из пораженных воспалительным процессом участков легкого и др.). Бронхоскопия позволяет диагностировать пороки развития трахеи и бронхов (свищи трахеи и бронхов, агенезию легкого, сужение трахеи и бронхов). Цепные данные получают при трахеопищеводных свищах. В трудных для диагностики случаях трахеобронхоскопия позволяет установить пли отвергнуть диагноз трахеопищеводного свища. С помощью бронхоскопа проводят бронхографическое исследование.
Исследование проводят под общим обезболиванием с помощью дыхательного бронхоскопа Фриделя или отечественного бронхоскопа ДБ (трубки 4 и 5). Бронхоскоп вводят в трахею под контролем ларингоскопа после гипервентнляции легких в состоянии апноэ. Б момент проведения через голосовую щель тубус бронхоскона поворачивают на 90° вокруг оси, чтобы скос трубки тубуса соответствовал длиннику голосовой щели. После введения тубуса в трахею ларингоскоп удаляют. В последующем тубус проводят вперед только при хорошо видимом свободном просвете трахеи. Особенно важно это при проведении бронхоскопии у новорожденных, так как насильственное проведение трубки «вслепую» у маленького ребенка может привести к серьезной травме вплоть до разрыва стенки трахеи. Тубус проводят до бифуркации трахеи. Отсосом освобождают трахею и главные бронхи от содержимого. После этого можно приступать к осмотру. Главные бронхи осматривают при положении конца тубуса над бифуркацией при поворотах головы ребенка в соответствующую сторону. Введение тубуса в нижележащие отделы не рекомендуется, так как диаметр главных бронхов значительно уже диаметра тубуса и попытка провести бронхоскоп в бронхи может закончиться травмой слизистой оболочки или стенки бронха. После осмотра главных бронхов приступают к осмотру трахеи путем постепенного медленного выведения тубуса. Осматривают последовательно переднюю, правую боковую, заднюю и левую боковую стенки. При этом дистальный конец бронхоскопа как бы описывает спиральную линию. Перед удалением бронхоскопа снова отсасывают содержимое из трахеи и из полости рта.
Осложнения при бронхоскопии можно разделить на вызванные манипуляциями, проводимыми во время исследования, и связанные с анестезией. При комбинированном обезболивании с мышечными релаксантами осложнения, связанные с техникой бронхоскопии, возможны только в случаях грубых манипуляций тубусом бронхоскопа, а также при попытках ввести тубус в несоответствующий по диаметру бронх.
Эзофагоскопия. Конструкция современных эзофагоскопов рассчитана на прямой осмотр стенки пищевода на всем протяжении. В нашей стране наибольшее распространение получили эзофагоскопы типа Брюнингса (Brunnings, 1910) с проксимальным типом освещения. Для эзофагоскопии у новорожденных применяют специальные тубусы. Можно пользоваться дыхательным бронхоскопом с тубусом для новорожденных.
Показания. Визуальное исследование пищевода у новорожденных показано при ахалазии, врожденном коротком пищеводе, подозрении на наличие трахеопищеводных свищей.
Положение больного — на спине. Под плечи подкладывают валик. Под интратрахеальным наркозом интубационную трубку ставят в противоположный от предполагаемого места введения эзофагоскопа угол рта (обычно левый). Эзофагоскоп вводят под постоянным визуальным контролем. При пользовании ларингоскопом, клинком которого оттесняют корень языка, вход в пищевод виден отчетливо и введение тубуса эзофагоскопа не представляет затруднений. При отсутствии ларингоскопа вход в пищевод находят с помощью анатомических ориентиров. Первым ориентиром является язычок — uvula. Пройдя uvula, эзофагоскоп переводят почти в вертикальное положение и, придерживаясь средней линии, продвигают его вперед до появления в поле зрения второго анатомического ориентира — надгортанника. Далее конец трубки смещают несколько кзади и вперед, достигают третьего анатомического ориентира — нижнего сжимателя глотки или «пищеводного рта». Последний в момент апноэ, как правило, зияет и свободно пропускает тубус эзофагоскопа. После прохождения «пищеводного рта», эзофагоскоп попадает в шейный отдел пищевода, просвет которого имеет щелевидную форму. Ориентируясь на центр щели, эзофагоскоп медленно продвигают по пищеводу, внимательно осматривают стенку пищевода. Трахеопищеводные соустья в большинстве случаев располагаются по передне-левой поверхности пищевода на 10 — 11 ч. При дыхании иногда удается видеть раздувание свищевого отверстия струей воздуха. Просвет грудного отдела пищевода имеет воронкообразную форму, тубус эзофагоскопа продвигают, ориентируясь на центр воронки. Детальный осмотр слизистой оболочки осуществляют посредством боковых смещений тубуса. В норме слизистая оболочка пищевода бледно-розового цвета с продольными складками. При ахалазии с застоем пищевых масс нередки воспалительные изменения слизистой оболочки. Образование эрозий в период новорожденности наблюдается редко. В отдельных случаях с помощью эзофагоскопии удается распознать удвоение пищевода, его дивертикулы и др. После осмотра слизистой оболочки эзофагоскоп удаляют.
Осложнения при проведении эзофагоскопии в значительной степени связаны с характером и качеством обезболивания и опытом исследователя. Предварительно овладевают техникой эзофагоскопии у взрослых или детей старшего возраста. При недостаточном обезболивании возможен спазм «пищеводного рта» и ранение слизистой оболочки при продвижении эзофагоскопа через спазмированный участок. Травма задней стенки глотки и шейного отдела пищевода возможна при слишком резком запрокидывании головы ребенка.
Применение эндоскопов с волоконной оптикой» значительно расширяет возможности диагностики различных заболеваний.
Лапароскопия. Эндоскопия брюшной полости1 позволяет изучать состояние внутренних органов, объективно документировать их патологические изменения с помощью фотосъемки и проводить ряд дополнительных диагностических манипуляций под контролем зрения. Метод предложен отечественным ученым Д. О. Оттом (1901). У новорожденных лапароскопию применили А. Б. Окулов (1964), Беато (1965).
1 В литературе встречаются различные названия метода: вентроскопия, органоскопия, абдоминоскопия, перитонеоскопия, лапароскопия.
Показания. Лапароскопию применяют в случаях, когда более простые методы исследования недостаточны для выяснения диагноза или уточнения морфологических особенностей патологических процессов в органах брюшной полости.
У новорожденных наиболее часто лапароскопию проводят при заболеваниях органов системы воротной вены (желтухи и асциты неясного происхождения, пороки развития желчевыводящих путей, гепатомегалии и спленомегалии различного генеза), при опухолях органов брюшной полости, отдельных заболеваниях органов малого таза у девочек, при гермафродитизме с целью определения половой принадлежности новорожденного. Более редко предметом лапароскопического исследования становятся заболевания органов забрюшинного пространства и пороки развития кишечника. Возможно использование лапароскопии в диагностике закрытой родовой травмы органов брюшной полости. Вопросы применения метода при острых воспалительных заболеваниях брюшной полости до настоящего времени остаются спорными.
Противопоказания к лапароскопическому исследованию разделяют на общие и местные. Общие включают в себя сердечно-сосудистую и дыхательную недостаточность, снижение протромбинового времени, повышение длительности кровотечения, нарушение свертываемости крови и тромбопению. К местным противопоказаниям относят острое диффузное воспаление брюшины, обширный спаечный процесс в брюшной полости и диафрагмальные грыжи. Перечисленные противопоказания к лапароскопии нужно иметь в виду и при проведении дополнительных диагностических манипуляции под контролем зрения: прицельной биопсии печени, спленопортографии, холангиографии.
Метод состоят из нескольких этапов. Норным этапом накладывают искусственный пневмоперитонеум путем прокола специальной иглой передней брюшной стенки в стандартной точке по средней линии, на 1 см ниже пупка, с использованием страховочной лигатуры (рис. 18, а, б). В брюшную полость вводят закись азота, углекислый газ или гелий. Оптимальное количество газа при наложении пневмоперитонеума определяют уровнем внтурибрюшного давления, которое у новорожденных не должно превышать 20 — 25 мм рт. ст. Оптическую систему лапароскопа вводят в брюшную полость путем прокола троакаром брюшной стенки в стандартной точке, расположенной на 2 — 3 см влево от средней линии и ниже пупка с использованием страховочной лигатуры. Далее проводят осмотр брюшной полости и фотографирование (рис. 19, а. б, в). При необходимости осмотр дополняют внутрибрюшной инструментальной пальпацией органов, проводят прицельную биопсию печени, спленопортографию, холангиографию, показания к которым обосновывают в процессе эндоскопии брюшной полости (рис. 20, а, б, в).
Рис. 18. Техника наложения пневмоперитонеума и введения лапароскопа. а — точки для наложения пневмоперитонеума; б — введение оптической системы лапароскопа под контролем страховочной лигатуры.
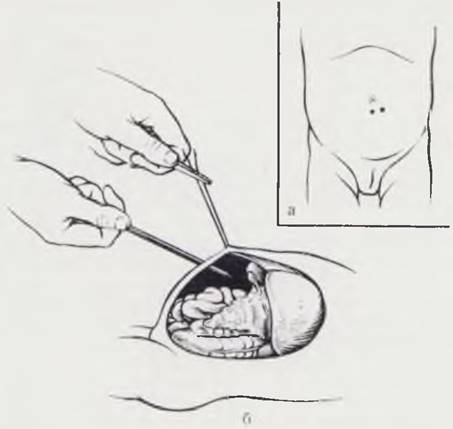
Рис. 19. Положение лапароскопа при осмотре печени и желчного пузыря (а), желудка (6), селезенки (в).
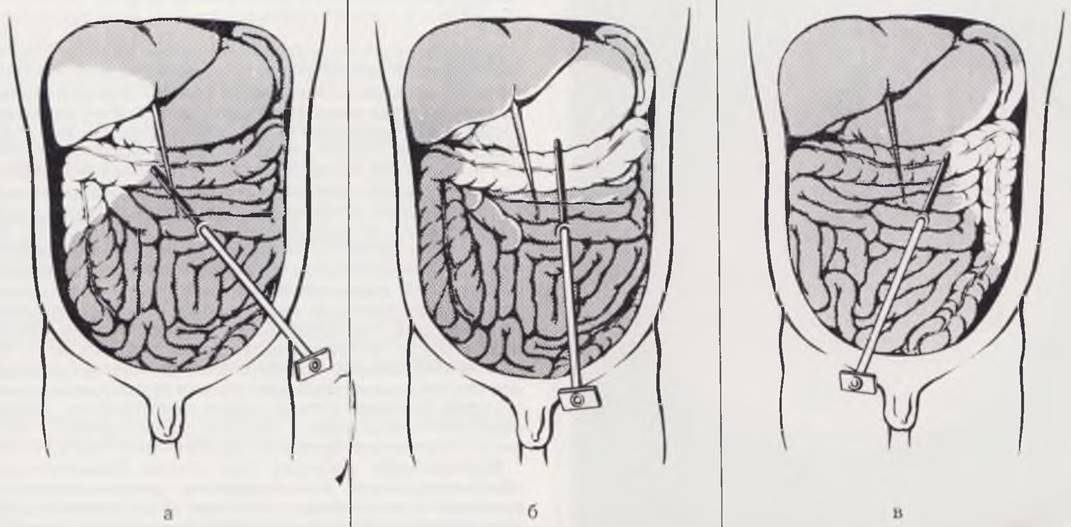
Рис. 20. Манипуляции под контролем лапароскопа. а — инструментальная пальпация и пункция селезенки; б — пункционная биопсия печени; и — фотолапароскопия, пункционная игла введена в правую долю печени. Диагноз: хронический гепатит.
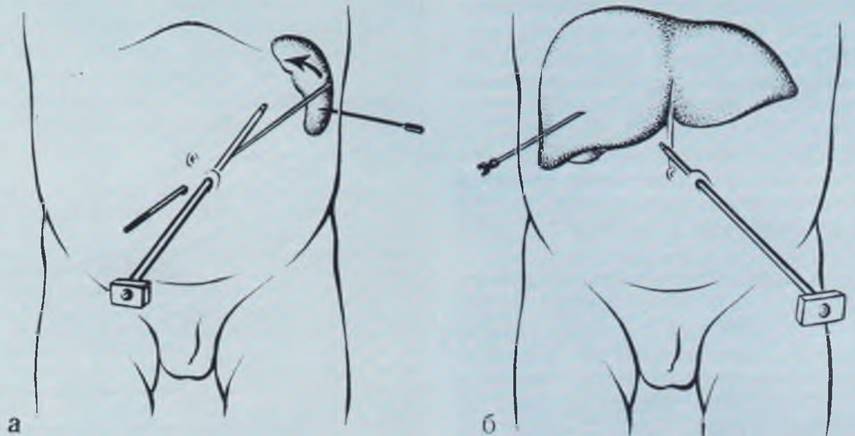
Исследование проводят под общим фторотановым обезболиванием с использованием миорелаксантов в наиболее ответственные моменты манипуляции (проколы передней брюшной стенки, фотосъемка, биопсия, спленопортография, холангиография и пр.).
Осложнения. Первый прокол брюшной стопки для наложения искусственного пневмоперитонеума всегда опаснее последующих проколов. Введение оптики осуществляют, когда передняя брюшная стопка отделена от интраабдоминально расположенных органов выраженной газовой подушкой. Дополнительные проколы для биопсии печени, спленопортографии и пр. производят уже под контролем зрения, что позволяет исключить возможность ранения органов брюшной полости.
Осложнения возможны на каждом этапе лапароскопического исследования. Кровотечение может возникнуть из мест проколов брюшной стенки пли при проникновении концов иглы (для наложения пневмоперитонеума) или троакара (для введения оптики) в подлежащие внутренние органы. Крайне редко встречается газовая эмболия. Она возникает при попадании конца иглы для наложения пневмоперитонеума в кровяное русло или нагнетании газа в паренхиматозные органы.
Эндоскопия брюшной полости сама по себе безопасна. На этом этапе исследования осложнения связаны с применением дополнительных диагностических манипуляций.
Возможность перечисленных осложнений не умаляет значения лапароскопического исследования. Соблюдение методики и техники сложного диагностического вмешательства, тщательное наблюдение за новорожденным в постманипуляционном периоде могут свести к минимуму число осложнений.
Торакоскопия. Этот метод осмотра плевральной полости и находящихся в ней органов предложен в 1910 г. Jacobeaus. У новорожденных торакоскопия стала применяться с 1969 г. (В. Г. Гельдт).
Показания. Исследование производят при плевральных осложнениях легочных заболеваний, спонтанном пневмотораксе и пиопневмотораксе. В редких случаях показания к проведению торакоскопии возникают при кистах и опухолях легкого и средостения. Торакоскопию применяют с диагностической и лечебной целью. При спонтанном пневмотораксе выявляют причину спадения легкого. У больных с пиопневмотораксом определяют степень деструкции легочной ткани, величину бронхиального свища, наличие и характер выпота, степень расправления легочной ткани. При торакоскопии возможно проведение лечебных мероприятий: рассечение спаек, удаление фибрина, промывание плевральной полости и т. д.
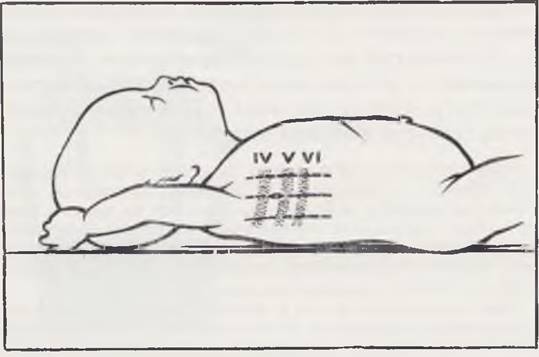
Торакоскопию у новорожденных проводят в операционной под интубационным наркозом фторотаном с закисью азота и кислородом. Положение ребенка — на здоровом боку. Исследование состоит из четырех этапов: наложения искусственного пневмоторакса, введения торакоскопа и осмотра плевральной полости, фотографирования во время торакоскопии и внутриполостной инструментальной пальпации. У детей используют отечественный торакоскоп с боковой оптикой или эндоскоп производства ГДР с боковой оптикой и углом зрения 135°.
Место для плевральной пункции выбирают вдали от патологически измененного легкого и плевры. Воздух в плевральную полость вводят под контролем показаний манометра. Для введения торакоскопа наиболее удобна точка, расположенная по средней подмышечной линии в 6-м или 5-м межреберье (рис. 21). Троакар в плевральную полость вводят, соблюдая осторожность во избежании ранения легкого. После того как произведен торакоцентез, стилет извлекают и через гильзу троакара вводят торакоскоп. Плевральную полость осматривают последовательно, начиная с верхних отделов. Осмотр плевральной полости при пиопневмотораксе сложен из-за ограниченности пространства и наличия фибринозных наложений. Перед исследованием опорожняют плевральную полость от гноя. Ревизию начинают с места наибольшего скопления фибрина, которое косвенно указывает на локализацию деструкции легкого.
Рис. 21. Положение больного при торакоскопии и место введения торакоскопа.
Для получения дополнительных данных о консистенции и подвижности исследуемого органа используют специальный зонд-манипулятор. Через него возможно дополнительное введение газа растворов, отсасывание жидкости (рис. 21, б). Зонд-манипулятор может быть использован для отодвигания легкого, разрушения рыхлых спаек. После окончания торакоскопического исследования газ из плевральной полости удаляют. На рану грудной клетки накладывают шов.
Осложнения возможны на любом этапе. К осложнениям, связанным с обезболиванием, относятся угнетение дыхания, ларингоспазм, затянувшееся апноэ, разрыв буллы во время искусственной вентиляции. При наложении искусственного пневмоторакса возможно попадание иглы в легочную ткань, кровеносный сосуд или брюшную полость. Эти осложнения выявляются с помощью манометра. В процессе самого исследования возможно кровотечение из поврежденных спаек, межреберных сосудов пли сосудов корпя легкого. После удаления торакоскопа и зашивания раны при неполном удалении воздуха из плевральной полости может возникнуть подкожная эмфизема.
При соблюдении правил торакоскопического исследования и осторожном манипулировании торакоскопом и манипулятором осложнений можно избежать.
Техника наиболее распространенных оперативных вмешательств
При различных заболеваниях и пороках развития у новорожденных хирург нередко сталкивается с необходимостью выполнения таких оперативных вмешательств, как дренирование и промывание плевральной полости, трахеотомия, гастростомия и др. Техника этих операций у новорожденных детей имеет специфические особенности, на которых мы остановимся более детально.
Дренирование плевральной полости. Плевральную полость у новорожденных дренируют пни скоплении в ней воздуха, гноя или крови. Необходимость в этой манипуляции чаще всего возникает при абсцедирующей пневмонии, осложненной пиотораксом или пиопневмотораксом, при клапанном спонтанном пневмотораксе, после операций на органах грудной полости и диафрагме.
Введение дренажной трубки осуществляют с соблюдением правил асептики путем торакоцептеза или торакотомии. Для торакоцептеза необходимы троакар, трубка соответствующего диаметра, скальпель, игла с иглодержателем и капроновой (шелковой) нитью для фиксации дренажа к коже. При торакотомии дренаж вводят с помощью кривого зажима с остро заточенными брашнами. Дренирование плевральной полости у новорожденных производят силиконовыми или полихлорвиниловыми трубками с диаметром просвета 2 — 3 мм. Широкий просвет и 4 — 5 отверстий на отрезке дренажной трубки, вводимом в плевральную полость, гарантируют падежную работу системы, аспирацию густого гноя, сгустков фибрина или крови.
Дренирование плевральной полости у новорожденных обычно производят под местной анестезией. Ребенка укладывают в боковое положение на валике, что позволяет расширить межреберья и создать противоупор. Дренаж вводят в 6 — 7-е межреберье по средней или задней подмышечной линии. Следует учитывать высокое стояние диафрагмы при вздутии живота.
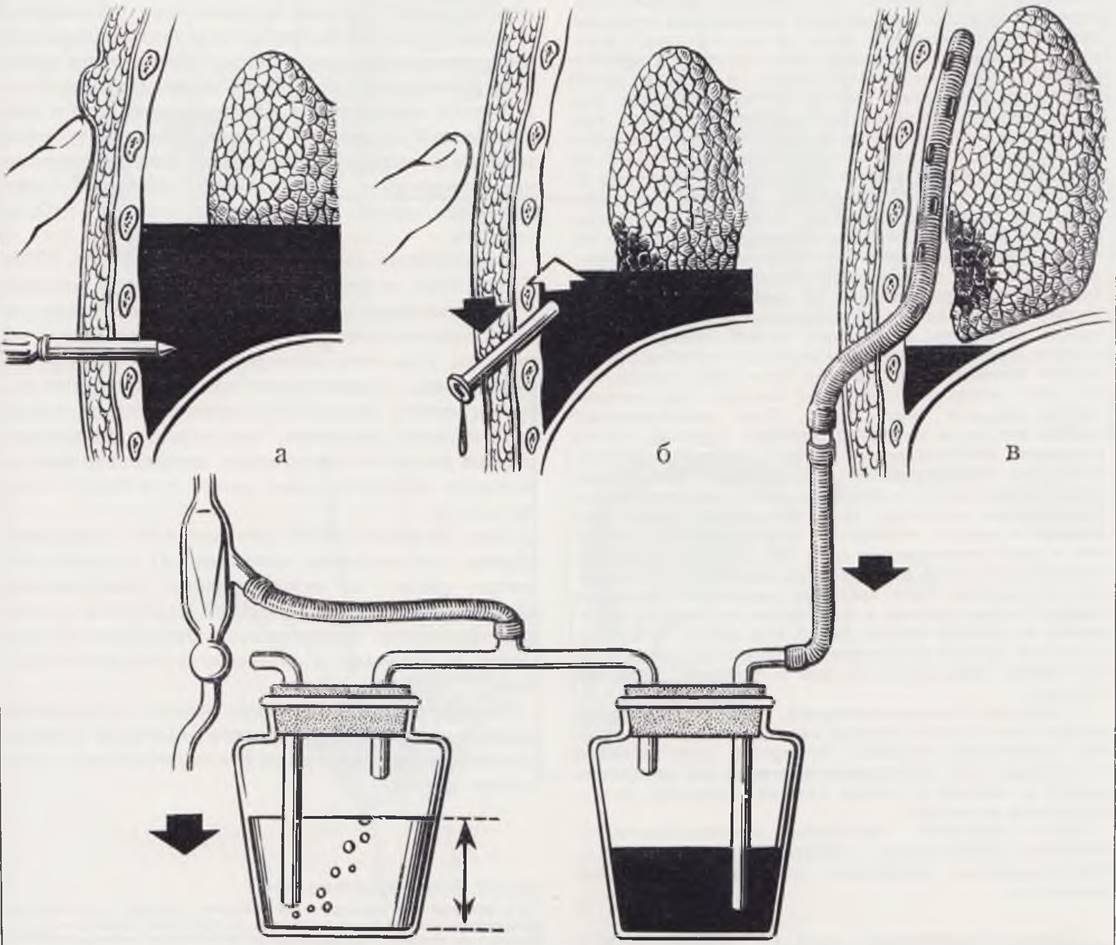
При торакоцентезе разрез кожи длиной 0,5 см производят скальпелем. Стилет троакара с надетой на него канюлей вводят сверлящими движениями по верх
нему краю нижележащего ребра (рис. 22, а), предварительно сместив кожу по отношению к ребру во избежание повреждения межреберной артерии. После перфорации грудной стенки стилет извлекают, а канюлю направляют к куполу плевры (рис. 22, б). Дренажную трубку проводят в плевральную полость до отмеченного уровня и после извлечения канюли фиксируют на коже капроновым швом, наложенным на края разреза. Место торакоцентеза при необходимости герметизируют липким пластырем.
При торакотомии делают разрез кожи длиной 1 см. Конец трубки захватывают зажимом и буравящими движениями проводят в плевральную полость, направляя ее вверх. Трубку устанавливают по метке на необходимую глубину и фиксируют к коже.
При дренировании открытой плевральной полости во время операции трубку захватывают браншами зажима, проведенного через грудную стенку, и выводят изнутри кнаружи под контролем зрения.
Дренажная трубка подключается к системе аспирации (рис. 22, в). Для контроля за положением дренажа после операции целесообразна рентгенография грудной клетки. Оптимальным считается расположение трубки по заднебоковой или задневнутренней поверхности плевральной полости до купола плевры. При осумкованном пиоппевмотораксе положение трубки зависит от локализации полости.
Рис. 22. Дренирование плевральной полости. а — прокол грудной стенки; б — направление введения дренажной трубки; в — установка дренажа и схема подключения его к системе аспирации.
Неудовлетворительная функция плеврального дренажа чаще всего является следствием западения или перегиба дренажной трубки. При перегибе целесообразно подтянуть трубку. При западении конца трубки в синусе возможно неполное расправление легкого и возникновение осумкований в верхних отделах плевральной полости. В подобных случаях следует извлечь трубку и переставить ее в правильное положение. Нередким осложнением является кровотечение из поврежденной межреберной артерии или ткани легкого. При длительном дренировании плевральной полости у новорожденных возникает некроз тканей вокруг дренажной трубки, и система теряет герметичность. Для предупреждения тяжелых осложнений — флегмоны грудной стенки и остеомиелита ребер — по возможности сокращают срок дренирования и при необходимости проводят повторный торакоцентез на здоровом участке. При клапанном пневмо- или пиопневмотораксе в случае узкого просвета дренажной трубки возможно развитие подкожной эмфиземы. С целью его ликвидации дренажную трубку подключают к системе активной аспирации или заменяют трубку более широкой.
Лаваж плевральной полости. Показанием к постоянному промыванию (лаважу) полости плевры у новорожденных детей является гнойный плеврит — эмпиема плевральной полости. Обычно используют антисептики (0,05 — 0,1% раствор риванола), нитрофураны (водный раствор фурацилина 1:5000, 0,1% раствор фурагина К) или антибиотики широкого спектра действия па изотоническом растворе хлористого натрия.
Промывание плевральной полости осуществляют через тонкий полиэтиленовый или полихлорвиниловый катетер — микроирригатор (диаметром 0,4 — 0,7 мм), который вводят во 2-м межреберье по среднеключичной линии через просвет иглы Дюфо или по способу Сельдингера и фиксируют к предварительно смазанной клеолом коже липким пластырем. К микроирригатору подсоединяют капельницу с промывной жидкостью. Количество ее варьирует в зависимости от темпа введения от 1,5 до 2,5 л в сутки. Промывная жидкость аспирируется через дренажную систему, подключенную к водоструйному отсосу. Основное условие — строгое соответствие объема вводимых и удаляемых растворов.
Противопоказанием к наложению системы лаважа являются широкие бронхоплевральные свищи. В этих случаях промывная жидкость, попадая в бронхи больного, вызывает постоянный кашель и рвоту.
Трахеостомия. Показания к трахеостомии у новорожденных возникают при механической обструкции верхних дыхательных путей, крупе, инородных телах, ослаблении кашлевого толчка, нервно-мышечных заболеваниях, поражениях центральной нервной системы и др.
У детей с дыхательной недостаточностью трахеостомия может сочетаться с искусственной вентиляцией.
Трахеостомию у новорожденного проводят под общим обезболиванием на введенной в трахею интубационной трубке. Это обеспечивает спокойное оперирование и значительно уменьшает возможность возникновения осложнений. Проведение операции без обезболивания допустимо лишь в экстренных ситуациях, когда асфиксия возникает не в условиях стационара.
Положение ребенка — на спине, с валиком под плечами и запрокинутой головой (рис. 23, а). Голову ребенка укладывают на баранку и удерживают в срединном положении. Разрез кожи проводят в горизонтальном направлении по одной из шейных складок (рис. 23, б). Подкожную клетчатку и фасции шеи рассекают также в горизонтальном направлении. Производят тщательную остановку кровотечения и разводят края раны. По средней линии пинцетами осторожно разводят в продольном направлении грудино-подъязычные мышцы. При верхней трахеотомии щитовидную железу отодвигают книзу, и она остается в нижнем углу раны, при нижней трахеотомии щитовидную железу отодвигают кверху. Тупым и острым путем осторожно рассекают клетчатку над трахеей. Для свободного манипулирования следует освободить трахею на одно кольцо выше и ниже места предполагаемого разреза. Отступя от средней линии на 1 — 2 мм справа и слева, на трахею накладывают держалки из капроновых нитей (рис. 23, в), которые помогают фиксации трахеи во время операции, а в послеоперационном периоде облегчают введение и выведение канюли. Переднюю стенку трахеи фиксируют держалками и рассекают в продольном направлении два кольца (рис. 23, г). При наличии в трахее интубационной трубки острие скальпеля упирается в нее, чем исключается опасность рассечения задней стенки. С помощью держалок края раны разводят, интубационную трубку извлекают до верхнего края раны трахеи, после чего осторожно вводят в просвет трахеостомическую канюлю (рис. 23, д). Если интубационной трубки нет, то в момент рассечения колец из трахеи с шумом выбрасывается мокрота, слизь с кровью; возможно инфицирование краев раны. Дальнейшие манипуляции затрудняются в связи с постоянным выбрасыванием мокроты. Для облегчения проведения канюли в трахею необходимо предварительное введение в рану расширителя (рис. 23, д). После введения трахеостомической канюли убеждаются в правильности ее стояния. Рану послойно зашивают. Держалки выводят около канюли и фиксируют на марлевых шариках, не обрезая концов нитей. Под щиток трахеостомической трубки подкладывают несколько слоев марли. Трубку фиксируют на шее с помощью марлевых тесемок.
В качестве трахеостомической трубки у новорожденных используют канюлю диаметром 3 мм со съемной внутренней трубкой. Во время искусственной вентиляции для ликвидации пространства между канюлей и трахеей на конец канюли надевают раздувающуюся манжетку.
Рис. 23. Этапы трахеостомии. а — положение больного; б — линии разреза; в — трахея Фиксирована швами-держалками, в просвете трахеи — интубационная трубка; г — рассечение двух колец, интубационная трубка предупреждает повреждение задней стенки; д — интубационная трубка подтянута, в трахею введена канюля.
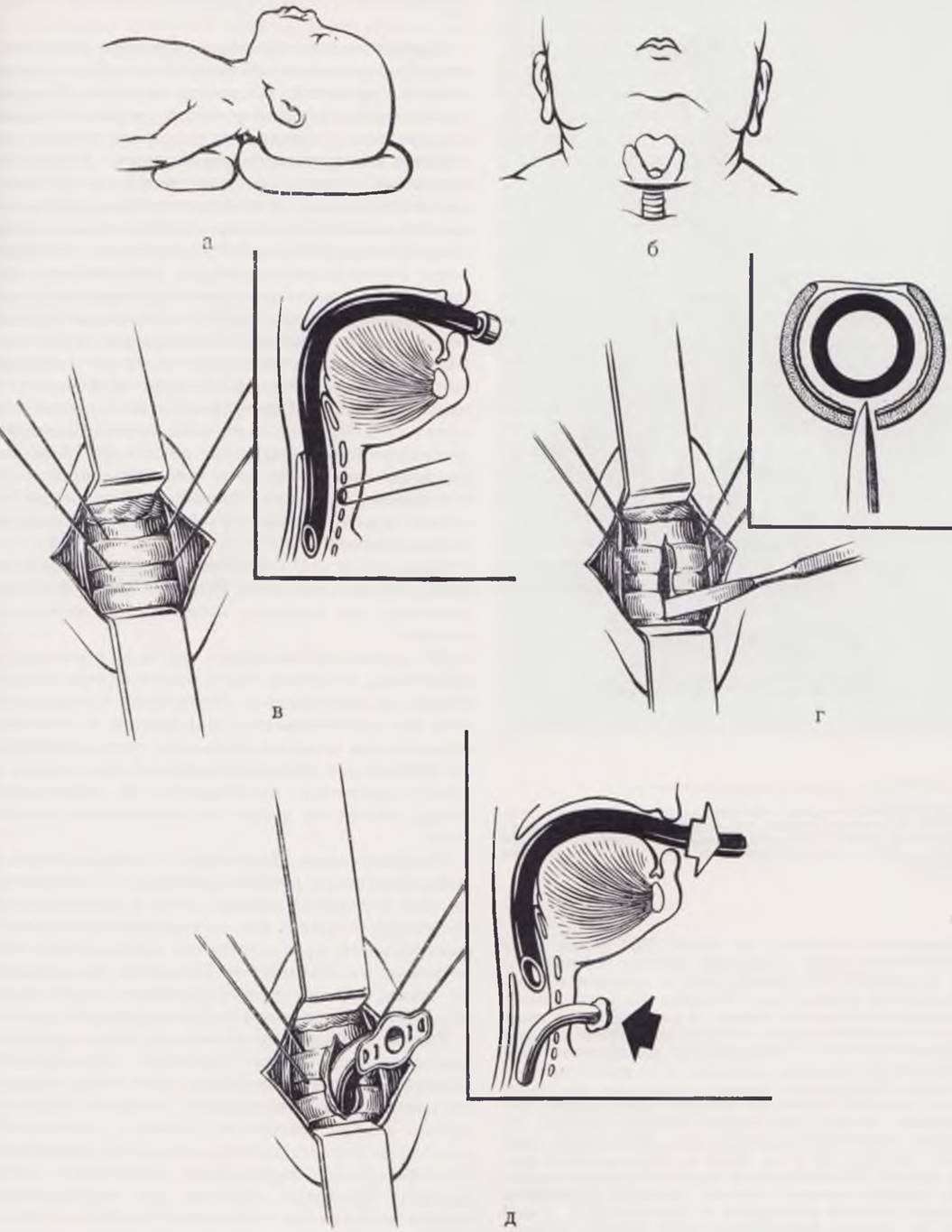
После операции необходим рентгенологический контроль правильности стояния трубки в трахее. Рентгенограммы производят в прямой и боковой проекциях.
Послеоперационный уход за трахеостомированным ребенком описап выше.
За новорожденным с трахеостомой должны ухаживать специально подготовленные опытные сестры.
Осложнения трахеостомии делят на операционные и послеоперационные (Holinger е. а., 1956). Операционные осложнения возникают у новорожденных чаще, чем у старших детей. К ним относятся кровотечения, пневмоторакс, пневмомедиастинум и подкожная эмфизема, ранение задней стенки трахеи и пищевода, остановка дыхания. Поздние осложнения появляются в различные сроки в виде нагноения рапы, ателектазов легких, обтурации канюли, изъязвления трахеи и кровотечений из эродированных сосудов, выпадения канюли, стеноза трахеи, замедленного заживления стомы, трахеомаляции. Длительное стояние трубки затрудняет процесс декапюляции.
Гастростомия. В детских хирургических клиниках нашей страны гастростомия у новорожденных применяется по очень узким показаниям, главным образом с целью обеспечения питания при атрезии пищевода и др. Большинство хирургов относятся к гастростомии как к вынужденной операции. Широко распространено мнение о частых осложнениях при наложении новорожденным гастростом. Нередко они являются одной из основных причин гибели ребенка.
Зарубежные детские хирурги (Rickham, 1969; Gross, 1970, и др.), напротив, ставят показания к гастростомии очень широко и применяют ее при большинстве операций па органах брюшной полости. При этом подчеркивается, что широкое применение гастростомии позволило значительно улучшить результаты лечения таких тяжелых пороков развития, как атрезия пищевода, пороки развития кишечника, диафрагмальные и большие эмбриональные грыжи пупочного канатика и др.
Так, Меескег (1958) считает, что у новорожденных гастростомия показана: а) с целью зашиты выше- и нижележащих анастомозов, б) для декомпрессии брюшной полости и в) при необходимости налаживания энтерального питания у больных с пороками развития пищевода.
Первостепенное значение имеет соблюдение правил наложения гастростом. Методом выбора является наиболее простой в техническом отношении метод.
Положение больного — на спине. На уровне края реберной дуги слева от средней линии в горизонтальном направлении рассекают кожу и подкожную клетчатку. Длина разреза 3 см. Послойно раздвигают мышцы передней брюшной стенки. В рану выводят желудок. На переднюю стенку желудка на границе верхней и средней третей его накладывают два кисетных шва (узлы кисетов должны смотреть в разные стороны). В центре внутреннего кисета скальпелем рассекают стенку желудка через все слои. В рану вводят специальный катетер или тонкий катетер Петцера, на котором завязывают кисетные швы. Не следует затягивать их туго. На 2 см ниже и левее кожного разреза делают дополнительный прокол брюшной стенки, через который выводят катетер. Желудок со стороны брюшной полости фиксируют к брюшине 2 — 3 швами (рис. 24). Катетер фиксируют к краю кожного разреза. Брюшную полость послойно ушивают наглухо. В послеоперационном периоде ребенок лежит на спине,
гастростомический катетер фиксируют к кювезу, не перевязывают, сверху прикрывают марлевой салфеткой.
Рис. 24. Гастростомия у новорожденного. Неосложненное течение обеспечивается двумя нетуго завязанными кисетными швами, тщательной фиксацией желудка к брюшной стенке, надежной фиксацией гастростомической трубки к коже, открытым ведением ее в послеоперационном периоде.
Пристеночное положение катетера при таком способе гастростомии позволяет предупредить травму слизистой оболочки желудка. Выведение катетера через отдельный прокол обеспечивает хорошее заживление рапы, исключает подтекание желудочного содержимого. Постоянно открытый катетер отводит воздух из желудка, что способствует декомпрессии брюшной полости. Возможность введения пищи через гастростому позволяет защитить анастомоз на пищеводе. Защита нижележащих анастомозов осуществляется главным образом путем отвода воздуха. Показано, что одной из основных причин вздутия живота и пареза кишечника после операции на органах брюшной полости является заглатывание ребенком воздуха при сосательных движениях. Предупреждение вздутия желудка способствует снижению внутрибрюшного давления после операций по поводу больших диафрагмальных грыж и эмбриональных грыж пупочного канатика. Кормление проводят по общим правилам через 2 — 4 ч после наложения гастростомы.
После того как потребность в гастростоме отпала, катетер удаляют. Рапа на месте стояния катетера, как правило, закрывается самопроизвольно.
По описанной методике мы накладывали гастростомы 48 детям. Ни в одном случае осложнений не наблюдалось. Показания к гастростомии мы ограничиваем и применяем ее главным образом при атрезии пищевода, когда необходима длительная предоперационная подготовка, и после наложения анастомозов па кишечнике, когда хирург не уверен в надежности анастомоза.
Эзофагостомия. Показания к эзофагостомии у новорожденного ребенка возникают, как правило, при атрезии пищевода, когда в силу тяжести состояния больного или конкретных анатомических условий предполагается двухэтапное оперативное вмешательство. Больного укладывают па спину, под плечи подкладывают валик, голову запрокидывают назад и поворачивают вправо.
Разрез проводят по переднему краю грудино- ключично-сосцевидной мышцы параллельно кожной складке на середине расстояния между верхним краем щитовидного хряща и яремной ямкой. После рассечения кожи и подкожной клетчатки первую фасцию и подкожную мышцу шеи рассекают параллельно переднему краю мышцы. Проводят гемостаз, из окружающих тканей выделяют и отодвигают кпереди m. Sterno-mastoideus. М. оmо-hyoideus, sterno- hyoideus и sterno-thyreoideus также выделяют и отодвигают кнутри. Пятую фасцию шеи на дне раны вскрывают, предварительно прональнировав позвонки и кольца трахеи. Пищевод располагается в промежутке между позвоночником и трахеей. Тупо разделяют околопищеводную клетчатку, обнажают стейку пищевода, которая имеет продольную исчерченность. Протяженность доступного хирургическому вмешательству отрезка пищевода у новорожденного не превышает 2 см. Выделение пищевода облегчается предварительным введением в него эластичного зонда. После изоляции раны салфетками стенку пищевода пересекают в поперечном направлении и подшивают к краям кожной рапы через все слои одним рядом капроновых узловатых швов. При высокой атрезии нередко удается выделить слепой конец пищевода и вывести его наружу, при достаточно низком расположении слепого отрезка целесообразно максимально мобилизовать пищевод для предупреждения образования длинного слепого мешка.
Наш опыт показывает, что существенное облегчение и ускорение операции может быть достигнуто простым приемом — предварительным введением в пищевод металлического уретрального катетера, которое значительно облегчает и ускоряет обнаружение пищевода и выделение его из окружающих тканей.
Прокол (пункция) живота у новорожденных применяется с диагностической целью при подозрении иа наличие гнойно-воспалительных заболеваний или кровотечение в брюшную полость. В последние годы мы часто прибегаем к этой манипуляции в сложных для диагностики случаях. Применение троакара у новорожденных и грудных детей опасно возможностью ранения стенки кишки вследствие постоянного вздутия живота. Поэтому от классической методики мы отказались. Положение ребенка на спине. Брюшную полость пунктируем в точке на средине линии, соединяющей пупок с гребнем крыла подвздошной кости. При признаках локального воспаления брюшины пункцию производим на противоположной стороне. Под местной анестезией 0,25% раствором новокаина (5 мл) концом глазного скальпеля производим точечный прокол кожи. Далее брашнами зажима типа «Москит» осторожно раздвигаем слои брюшной стенки, разрываем брюшину и раздвигаем образовавшуюся рану. Между брашнами инструмента в брюшную полость вводим одетые друг па друга перфорированные полихлорвиниловые трубки. Содержимое брюшной полости вытекает самостоятельно или осторожно отсасываем шприцем. При пользовании описанной методикой осложнений мы не наблюдали.