Фізіологія людини - Вільям Ф. Ґанонґ 2002
Функції нервової системи
Центральне регулювання вісцеральних функцій
Гіпоталамус - Голод
Споживання їжі і насичення
Маса тіла залежить від балансу між надходженням калорійних речовин і витратою енергії. Обидва ці процеси регульовані щоденно і довготерміново.
Надходження поживних речовин регульоване не тільки процесом приймання їжі, а й механізмами, що, як звичайно, стабілізують масу тіла. Це відбувається так. Якщо тварину примусово відгодувати до повноти і згодом дозволити їсти досхочу, то вона добровільно споживатиме їжу в менших кількостях, унаслідок чого її маса зменшиться до контрольного рівня (рис. 14-4). І навпаки, якщо тварина голодувала, а потім їй дозволили їсти досхочу, то вона споживатиме більше їжі, надолужуючи втрачену масу. Загальновідомо, що таке ж трапляється і в людей. У разі дотримання дієти зі зменшенням споживання калорійних речовин можна втратити частину маси, проте після закінчення дієти 95% осіб відновлюють попередню масу. Подібно, під час одужання після хвороби зростає рівень споживання їжі аж до відновлення попередньої маси.
Таблиця 14-1. Підсумок головних регуляторних механізмів гіпоталамуса
Функція |
Аферентні імпульси |
Інтегральні ділянки |
Терморегулювання |
Температурні рецептори шкіри, глибоких тканин, спинного мозку, гіпоталамуса й інших частин головного мозку |
Передня ділянка гіпоталамуса відповідає за тепло. Задня ділянка гіпоталамуса відповідає за холод |
Нейроендокринне регулювання: Катехоламінів |
Лімбічна ділянка, пов’язана з емоціями |
Дорсальна і задня ділянки гіпоталамуса |
Окситоцину |
Рецептори дотику молочної залози, матки і геніталій |
Надзорове і пришлуночкове ядра |
Тиреотропного гормону (тиротропін, ТТГ) за допомогою ТРГ |
Температурні рецептори в немовлят; можливо, інші |
Пришлуночкові ядра і суміжні ділянки |
Адренокортикотропного гормону (АКТГ) і ß-ліпотропіну за допомогою КРГ |
Лімбічна система (емоційні подразники) ретикулярна формація («системні» подразники); клітини гіпоталамуса і передньої частки гіпофіза, чутливі до концентрації кортизолу, що циркулює в крові, надперехресні ядра (добовий ритм) |
Пришлуночкові ядра |
Фолікуло-стимулювального гормону (ФСГ) і лютеінізувального гормону (ГІГ) за допомогою ГнРГ |
Клітини гіпоталамуса чутливі до естрогенів, орган зору, рецептори дотику в шкірі та геніталіях тільки у видів з рефлекторною овуляцією |
Передзорове поле, інші ділянки |
Пролактину за допомогою ПІГ і ПРГ |
Рецептори дотику в молочній залозі та інші невідомі рецептори |
Дугоподібне ядро, інші ділянки (гіпоталамус пригнічує секрецію) |
Гормону росту за допомогою соматостатину і СТГ-РГ |
Невідомі рецептори |
Навколошлуночкове ядро, дугоподібне ядро |
Інстиктивна потреба Спрага |
Осморецептори, ймовірно, розміщені в судинному органі кінцевої пластинки; збільшення кількості ангіотензину II в субфорнікальному органі |
Верхньолатеральна ділянка гіпоталамуса |
Голод |
Глюкостатичні клітини, чутливі щодо рівня утилізації глюкози; лептинові рецептори; рецептори інших поліпептидів |
Вентромедіальне, дугоподібне і пришлуночкове ядра; латеральні ділянки гіпоталамуса |
Статевий потяг |
Клітини, чутливі до естрогену й андрогену, що циркулюють у крові та інші |
Передньовентральні ділянки гіпоталамуса, а також в осіб чоловічої статі грушоподібна кора |
Захисні реакції (страх, гнів) |
Органи чуття, нова кора; шляхи невідомі |
Дифузні, у лімбічній системі і гіпоталамусі |
Регулювання ритмів ендокринної секреції та ритмів активності |
Сітківка, через сітківко-гіпоталамічні волокна |
Надперехресні ядра |
Питання щодо надолужування росту в дітей розглянуто в Розділі 22, а зв’язок характеру харчування і довголіття - у Розділі 1.
Витрата енергії теж регульована. Вона зростає після приймання їжі внаслідок специфічної динамічної дії (СДД) поживних речовин (див. Розділ 17) і посилення впливу симпатичної нервової системи. СДД не регульована, проте зростає у випадку симпатичного впливу. Значне зниження рівня обміну речовин під час голодування дає змогу зберігати енергію протягом деякого періоду (див. Розділ 18).
Виявляється, що в регулюванні апетиту бере участь низка чинників і цей процес ще мало вивчений. Гіпоталамус, без сумніву, також бере участь у його регулюванні.

Рис. 14-4. Вплив різного споживання їжі й ушкодження вентромедіальної ділянки гіпоталамуса на добровільне споживання їжі і масу тіла А - щурі спочатку примусово відгодовані упродовж трьох-шести тижнів, а потім їм дозволено їсти досхочу В - щурі піддані частковому голодуванню протягом трьох-шести тижнів, а потім їм дозволено їсти досхочу С - двобічне ушкодження вентромедіальної ділянки гіпоталамуса Упродовж трьох тижнів щурам дозволяли їсти досхочу (відтворено за згодою з Stricker EM Hyperphadia N Engl J Med 1978,298 1010)

Рис. 14-5. Вплив ушкодження гіпоталамуса на апетит

Рис. 14-6. Гіпоталамічне ожиріння. Маса тварини праворуч, у якої чотири місяці тому ушкоджено вентромедіальні ядра - 1080 г Маса контрольної тварини (ліворуч) 520 г (відтворено за згодою з Stevenson JAF in: The Hypothalamus Haymaker W, Aaderson E, Nauta WJH [editors], Thomas, 1969).
Інші поліпептиди, що підвищують рівень споживання їжі, містять орексин-А і орексин-В та кодовані тим самим геном за допомогою почергового сплайсингу. Вони діють на два рецептори. Орексини синтезуються в нейронах латеральної гіпоталамічної ділянки і теж становлять інтерес, оскільки відомо, що мутація в одному з генів орексинових рецепторів зумовлює нарколепсію в собак.
Ще іншим поліпептидом, що підвищує рівень споживання їжі в ссавців, є меланінконцентрувальний гормон - 19-амінокислотний поліпептид, що продукований гіпофізом риб і бере участь у регулюванні кольору їхньої шкіри (див. Розділ 22). У ссавців його мРНК виявлена лише в латеральній гіпоталамічній ділянці і невизначеній зоні.
Похідні гіроопіомеланокортину (ПОМК) (див. Розділ 22) знижують рівень споживання їжі. Є чотири визначені рецептори цих похідних: MC1-R (необхідний для пігментації шкіри), MC2-R (забезпечує синтез глюкокортикоїдів у наднирковій залозі), MC3-R (пов’язаний з регулюванням секреції сальних залоз) і MC4-R (опосередковує вплив на апетит). Іншим нейропептидом, що знижує рівень споживання їжі і міститься в гіпоталамусі, є кокаїн- і амфетамін-регулювальний транскрипт (CART - від англ. cocaine-and amphetanine-regulated transcript). КРГ - гормон головного мозку, що стимулює секрецію АКТГ (див. нижче), теж знижує рівень споживання їжі.
Дослідження цих та інших поліпептидів, що впливають на споживання їжі і витрати енергії, тривають, та наразі отримані дані не можна застосувати для детальної характеристики процесу регулювання апетиту.
Катехоламіни також беруть участь у регулюванні маси тіла. Миші, у яких нокаут гена дофамін-Р-гідроксилази блокує синтез норадреналіну й адреналіну, мають підвищений рівень споживання їжі. Цікаво, що такі тварини не хворіють на ожиріння, оскільки в них одночасно, що не цілком зрозуміло, підвищений рівень метаболізму. Механізм дії амфетаміну й інших подібних лікарських засобів, які застосовують з метою зниження апетиту, полягає, очевидно, у вивільненні в ЦНС норадреналіну. Миші з нокаутом 5НТ2С - рецептора повніють, що свідчить про причетність серотоніну до регулювання споживання їжі.
Механізми аферентного впливу
Запропоновано чотири головні гіпотези для пояснення процесу регулювання приймань їжі, однак вони взаємовилучають одна одну. Згідно з ліпостатичною гіпотезою жирова тканина виділяє гуморальні фактори, кількість яких пропорційна до накопиченої жирової тканини, і таким способом відбувається вплив на гіпоталамус. Унаслідок цього знижується рівень споживання їжі і збільшується витрата енергії. За кишково-пептидною гіпотезою поживні речовини в шлунково-кишковому тракті зумовлюють вивільнення одного або більше поліпептидів, що впливають на гіпоталамус, спричинюючи зниження рівня споживання їжі. Відповідно до глюкостатичної гіпотези виникає відчуття ситності внаслідок того, що структури гіпоталамуса збільшують використання глюкози. За термостатичною гіпотезою зниження температури тіла нижче деякої межі стимулює апетит, а підвищення його пригнічує.
Лептин
Результати клонування гена ob мишей, щурів і людини спонукали зосередити увагу на ліпостатичній гіпотезі. Гомозиготні за дефективним геном ob миші (оb/оb-миші) не насичуються внаслідок приймання їжі, стають товстими і хворіють на діабет. Продукт цього гена, що його виробляють головно ліпоцити, - це циркулювальний білок, який містить 167 амінокислот, його називають лептин (з гр. leptos - тонкий, слабкий).
Інший ген - db - регулює продукування рецептора лептину. Миші лінії db/db, у яких цей ген дефектний, теж повніють, що зумовлено відсутністю в тварин лептинових рецепторів, хоча рівень циркулювального лептину в них високий. Ген лептинового рецептора регулює утворення декількох різних за конфігурацією форм рецептора. Довга форма, що міститься в гіпоталамусі, має один трансмембранний домен, а також внутрішньоклітинний, що нагадує такий самий домен декількох цитокінів, зокрема ІЛ-6 (див. Розділи 1 та 27). Ця форма рецептора, особливо численна в дугоподібному ядрі, опосередковує характер впливу (центральний тип) лептину на апетит і витрати енергії. Ауротіоглюкоза, яка, як давно відомо, спричинює ожиріння в мишей, зумовлює деструкцію дугоподібного ядра.
Лептин, що циркулює, досягнувши центральної точки впливу, повинен проникнути крізь гематоенцефалічний бар’єр. Коротка форма лептинового рецептора в значній кількості міститься у мікросудинах головного мозку й, очевидно, причетна до транспортування лептину в його структури.
Лептинові рецептори є як у головному мозку, так і в різних периферійних тканинах. У гризунів зумовлене голодуванням зниження рівня плазматичного лептину супроводжується затримкою статевого дозрівання, пригніченням функції щитоподібної залози, підвищенням секреції глюкокортикоїдів. Уважають, що ці зміни є пристосувальними реакціями, які виникають у відповідь на зниження рівня лептину і спрямовані на збереження калорій. Інше цікаве спостереження: лептинові рецептори містяться також у бурій жировій тканині, і, що ймовірно, лептин підвищує активність незв’язаних білків (див. Розділ 17), чинячи безпосередній периферійний вплив на збільшення витрат енергії.
У людини інактивувальні мутації гена лептину спричинюють ожиріння вже в ранньому періоді життя. Рівень плазматичного лептину в жінок вищий, ніж у чоловіків, проте це не єдиний чинник наявності більшої кількості жирових відкладень у жіночому організмі. Рівень лептину високий і в повних людей. Його кількість пропорційна до процентного відношення кількості жирової тканини і маси тіла; водночас є позитивна кореляція між концентрацією лептинової мРНК у жировій тканині і кількістю цієї тканини. Тому, як уважають, принаймі в багатьох випадках, причина ожиріння в людини швидше подібна до причини цієї хвороби в db/db мишей, ніж в ob/ob; тобто внаслідок дефекту гена рецептора лептину. Звичайно, є й інші можливості, зокрема порушене транспортування лептину до головного мозку чи порушення процесів, які регулює ген. Необхідні подальші дослідження для з’ясування цього питання.
Отже, є підстави вважати, що лептин діє як частина механізму зворотного зв’язку, за допомогою якого інформація у вигляді цього гуморального фактора, сигналізує про кількість відкладень жирової тканини в організмі людини і бере участь у регулюванні споживання їжі (рис. 14-7).
Кишкові пептиди
Шлунково-кишкові гормони, зокрема ГРП, глюкагон, соматостатин і ХЦК, як уважають, можуть понижувати мотивацію до споживання їжі. Гіпотеза, за якою їжа в шлунково-кишковому тракті ініціює виділення речовин, що впливають на центри в головному мозку, зумовлюючи стан насичення, інтригує. Дія лептину, вочевидь, достатньо тривала. Отже, кишкові пептиди можуть забезпечувати короткочасне контролювання процесу приймання їжі.
Значна частина анорексигенного ефекту циркулювального ХЦК, очевидно, зумовлена збудженням вісцеральних рецепторів, оскільки цей вплив помітно зменшується після субдіафрагмальної ваготомії. Рецептори ХЦК містяться в одному з навколошлуночкових органів у задньому полі, проте роль заднього поля в регулюванні споживання їжі не з’ясована. Ін’єкція ХЦК в ділянку гіпоталамуса теж знижує рівень приймання їжі. Можливо, у процесі регулювання беруть участь як центральні, так і периферійні механізми. Периферійні - це, здебільшого, ХЦК-А-рецептори, тоді як головний мозок містить ХЦК-А- і ХЦК-В-рецептори (див. Розділ 26). Специфічні антагоністи рецепторів обох типів пригнічують насичення. Проте антагоністи ХЦК-В в 100 разів активніші, ніж антагоністи ХЦК-А. Отже, центральні ХЦК-рецептори, очевидно, відіграють важливішу роль.
Поліпептид GLP-1 (7-36), що утворюється в шлунково- кишковому тракті, теж є в гіпоталамусі. Внутрішньошлуночкова ін’єкція GLP-1 (7-36) гальмує мотивацію приймання їжі, а цей ефект усуває антагоніст GLP-1 (7-36). Однак роль цього гормону, як і інших шлунково-кишкових, у регулюванні споживання їжі потрібно ще детально вивчити, перш ніж вважати їх регуляторами апетиту.
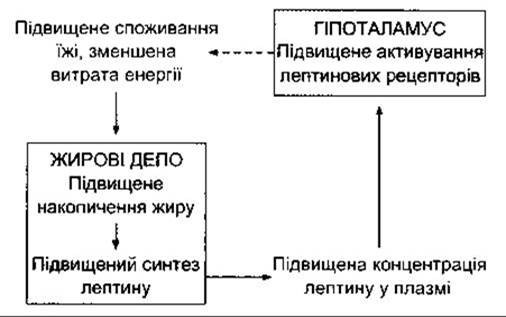
Рис. 14-7. Процес регулювання лептином накопичення жиру за допомогою механізму зворотного зв’язку. Суцільні стрілки позначають стимулювання, штрихова стрілка - гальмування.
Глюкоза
Активність центру насичення, розміщеного в вентромедіальних ядрах, очевидно частково залежить від рівня використання їхніми нейронами глюкози. З’ясовано: якщо використання цими клітинами глюкози невелике, і, відповідно, артеріовенозна різниця кількості глюкози в крові, що тече через ці ядра, низька, то активність у них зростає. За цих умов активність харчового центру невпинна, й особа відчуває голод. У випадку високого рівня використання глюкози активність глюкостатів послаблюється, харчовий центр пригнічується й особа відчуває ситість. Ця глюкостатична гіпотеза регулювання апетиту ґрунтується на численних експериментальних даних. Наприклад, приймання їжі різко зростає після внутрішньошлуночкового введення окремих речовин, таких як 2-діоксиглюкоза, що зменшують використання клітинами глюкози. У разі гіпоглікемії використання глюкози послаблюється внаслідок зменшення її кількості, що надходить до клітин, і апетит зростає. Поліфагія простежується у випадку цукрового діабету, за якого концентрація глюкози в крові хоча й висока, та використання її клітинами незначне з огляду на недостатній синтез інсуліну (див. Розділ 19). Однак наводять аргументи стосовно того, що інсулін швидше гальмує, ніж стимулює апетит.
Інші фактори впливу на приймання їжі
Споживання їжі збільшується в холодну погоду і зменшується в гарячу пору. Однак є незначна вірогідність того, що температура тіла може бути важливим чинником регулювання апетиту.
Розтягнення стінок шлунково-кишкового тракту пригнічує апетит, а скорочення порожнього шлунка (голодове скорочення) посилює його, проте денервація шлунка і кишок не впливає на кількість споживання їжі. Зокрема, в людини на апетит впливають культура харчування, умови споживання їжі, спогади, пов’язані з виглядом їжі, її смаком і запахом.
Бура жирова тканина - це окрема форма жирової тканини, яку інтенсивно іннервує симпатична нервова система і яка, ймовірно, може брати участь у регулюванні маси тіла. Це питання розглянуто вище, а також у Розділі 17.
Тривале регулювання апетиту
Оптимальний ефект механізмів, що регулюють апетит у практично здорових тварин і людини полягає в тому, щоб звести приймання їжі до такого рівня, коли кількість отриманих калорій збалансована з витратами енергії, завдяки чому підтримується стала маса тіла. В дитячому віці споживання їжі неврівноважене. Відомо, що дітям смакує одна їжа і несмакує інша. Проте згодом відбувається збалансування споживаної їжі з витратами енергії на безпосередні потреби і ріст. З віком людина набирає маси, цей процес є повільним і добре відрегульованим. В одному з досліджень зазначено, що маса жіночого організму в середньому збільшується на 11 кг за період від 25 до 65 років. Приймаючи, що загальна кількість спожитої їжі за цей період (40 років) становить понад 18 тонн, можна обчислити, що перевага кількості спожитої їжі над витраченою енергією становить менше ніж 0,03%.
Проблеми ожиріння, а також інші аспекти харчування розглянуто в Розділі 17. Тут, однак, зазначимо, що є значна генетична залежність у визначенні максимальної маси тіла. Дослідження близнюків, яких виховували в різних родинах і різних середовищах, дали змогу виявити, що чинники середовища впливають на масу тіла менше, ніж на 30%.