Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Ендокринні функції підшлункової залози й регулювання метаболізму вуглеводів
Механізм дії
Інсулінові рецептори
Інсулінові рецептори виявлені в багатьох клітинах тіла, навіть у тих, де інсулін не збільшує поглинання глюкози. Зазначимо, що рецептор інсуліну має молекулярну масу близько 340 000 дальтон, це тетрамер, що складається з двох а- і двох ß-глікопротеїнових субодиниць (рис. 19-6). Усі вони синтезуються на одній мРНК, а потім протеолітично розщеплюються й з’єднуються одна з одною дисульфідними зв’язками. Ген інсулінового рецептора має 22 екзони і розташований у 19-й хромосомі. Альфа-субодиниці приєднують інсулін і є позаклітинними, тоді як ß-субодиниці проходять через мембрану. Внутрішньоклітинні частини ß-субодиниць мають тирозинкіназну активність. Обидві а- і ß-субодиниці глікозильовані залишками цукрів, що поширюються у інтерстиційну рідину.
Приєднання інсуліну зумовлює тирозинкіназну активність ß-субодиниць, спричинюючи їхнє автофосфорилювання по залишках тирозину. Автофосфорилювання, яке потрібне для прояву біологічних ефектів інсуліну, приводить до фосфорилювання одних цитоплазматичних білків та дефосфорилювання інших, переважно по залишках серину та треоніну (рис. 19-7). Описано чотири близькі субстрати інсулінового рецептора в клітинах: IRS-1, IRS- 2, IRS-З та IRS-4 (IRS - від англ. insulin receptor substrate). Напевно, що кожний з них відповідає за якусь частину дії інсуліну. Наприклад, у миші з нокаутом гена інсулінового рецептора простежується помітне сповільнення внутрішньоутробного росту, аномалії ЦНС та шкіри, і вона помирає під час народження внаслідок дихальної недостатності. Проте IRS-1 нокаутної миші лише помірно сповільнюється внутрішньоутробний ріст, вона виживає і є інсулінорезистентною, водночас за іншими ознаками практично нормальна. Отже, внутрішньоклітинні шляхи, що не містять IRS-1, повинні брати участь в інсуліновій активності. Зв’язок IRC-2 із нагромадженням В-клітин розглянуто нижче.
Цікаво порівняти інсуліновий рецептор з іншими близькими рецепторами. Він дуже подібний до рецептора ІФР-I, однак відрізняється від рецептора ІФР-ІІ (див. рис. 19-6). Інші рецептори факторів росту та рецептори різних онкогенів також є тирозинкіназами. Незважаючи на це, амінокислотний склад цих рецепторів цілком відмінний.
Коли інсулін зв’язується зі своїми рецепторами, то відбувається їхнє агрегування і поглинання в клітину шляхом рецепторопосередкованого ендоцитозу (див. Розділ 1).
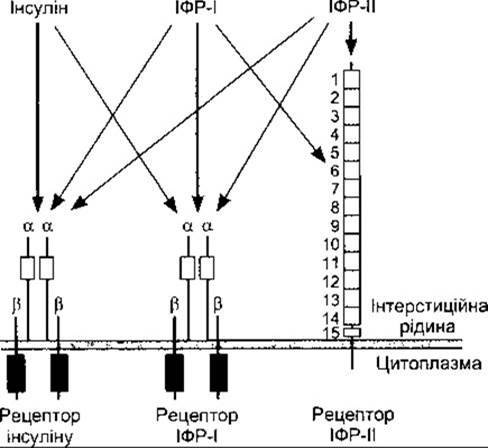
Рис. 19-6. Інсулін, ІФР-І та ІФР-ІІ. Кожний гормон зв’язується, головно, зі своїм рецептором, однак інсулін також зв’язується з рецептором ІФР-І, а ІФР-І - з усіма трьома. Прямокутники темного кольору - це внутрішньоклітинні домени тирозинкіназ Зверніть увагу на подібність між рецептором інсуліну та рецептором ІФР-І, а також на 15 повторних послідовностей зовнішньоклітинної частини рецептора ІФР-ІІ.
Комплекси інсулін-рецептор потрапляють у лізосоми, де рецептори переважно розпадаються або використовуються повторно. Період півжиття інсулінового рецептора становить близько 7 год.
Інсулін та інші гормони, фізичні навантаження, їжа й інші чинники впливають на кількість чи спорідненість інсулінових рецепторів або ж на обидві ознаки. Дія великих кількостей інсуліну зменшує концентрацію рецепторів (низхідне регулювання), а зниження рівня інсуліну збільшує їхню спорідненість. Кількість рецепторів на одну клітину збільшується під час голодування і зменшується в разі ожиріння й акромегалії. Спорідненість рецепторів збільшується у випадку наднирникової недостатності і зменшується за надлишку глюкокортикоїдів (див. нижче).