Фізіологія людини - Вільям Ф. Ґанонґ 2002
Функції травної системи
Травлення та всмоктування
Всмоктування вітамінів і мінералів
Вітаміни
Всмоктування водорозчинних вітамінів відбувається швидко, проте для жиророзчинних вітамінів A, D, Е і К - є недостатнім, якщо абсорбція жирів пригнічена з огляду на нестачу панкреатичних ензимів або жовч не потрапляє до кишки внаслідок обструкції жовчних проток. Більшість вітамінів всмоктується у проксимальній частині тонкої кишки, а вітамін В12 - у клубовій: він зв’язується з внутрішнім фактором - білком, що секретується в шлунку, а утворений комплекс абсорбується через слизову оболонку клубової кишки (див. Розділ 26).
Всмоктування вітаміну В12 і фолатів є Na -залежним процесом, проте всі решта сім водорозчинних вітамінів - тіамін, рибофлавін, ніацин, піридоксин, пантотенат, біотин і аскорбінова кислота - потрапляють в організм за допомогою носіїв, що є Na-котранспортерами.
Кальцій
В організмі людини всмоктується від 30 до 80% спожитого кальцію. Активне транспортування Са2+ з кишкового просвіту відбувається головно у проксимальній частині тонкої кишки і, частково, пасивною дифузією. Його полегшує 1,25-дигідроксихолекальциферол (кальцитріол) - метаболіт вітаміну D, що утворюється у нирках. Цей метаболіт індукує синтезування двох форм Са2+-зв’язаних білків у слизових клітинах і декілька форм Са2+-Н+-АТФ-аз (див. Розділ 21). Однак остаточно механізми стимулювання метаболітом вітаміну D всмоктування Са2+ ще нез’ясовані. Рівень утворення 1,25-дигідроксихолекальциферолу збільшується, коли концентрація Са2+ у плазмі зменшується, і навпаки, зі збільшенням вмісту Са2+ у плазмі рівень кальцитріолу зменшується (див. Розділ 21). Очевидно, всмоктування Са2+ залежить від потреб організму: за нестачі Ca2+ збільшується, аза надлишку-зменшується. Всмоктування Ca2+ теж полегшує білок, інгібуючи фосфати й оксалати, оскільки ці аніони утворюють нерозчинні солі з Са2+ у кишках. Всмоктування магнезії теж полегшене відповідним білком.
Залізо
У дорослих кількість заліза, що виходить з організму, порівняно незначна. Ці втрати головно нерегульовані, а кількість депонованого заліза регульована змінами у рівні всмоктування цього мікроелемента з кишки. Чоловіки втрачають понад 0,6 мг/добу, тоді як жінки - по-різному, однак майже вдвічі більше, оскільки додатково втрачають його під час місячних кровотеч. Щоденна доза заліза для європейської популяції та Сполучених Штатів Америки становить 20 мг. Кількість заліза, що абсорбується, майже така ж, що й втрачається; у разі надлишкового приймання настає перевантаження організму залізом. За нормальних умов кількість абсорбованого заліза коливається від 3 до 6% від кількості спожитого. Засвоєння заліза під час всмоктування стимулюють різноманітні харчові фактори, наприклад, фігова кислота, що міститься у зернових пластівцях, реагує з залізом, утворюючи нерозчинну сполуку у кишці. Так само діють фосфати й оксалати.
Найліпше абсорбується двовалентне залізо (Fe2 ), однак більшість харчового заліза міститься у феритичній формі (Fe3 ). Не більше мінімальної кількості заліза всмоктується у шлунку, проте шлунковий сік розчиняє залізо і дає змогу Fe2+ утворювати розчинні комплекси з аскорбіновою кислотою та іншими речовинами, допомагаючи трансформуватись у Fe2 форму. Важливість цієї функції пояснює факт, що після часткової гастроектомії порівняно часто розвивається виражена залізодефіцитна анемія. В щіточковій облямівці також виявляється активність Fe3+ редуктази.
Більшість заліза всмоктується в проксимальній частині тонкої кишки. Гемне Fe2+ та негемне Fe2+ також абсорбуються. Гем (див. Розділ 27) зв’язується до транспортного білка, форму якого ще остаточно не ідентифіковано, і переходить у цитоплазму, де активність гемоксигенази виводить Fe2+ з порфірину й додає його до вільного пулу Fe2+ в ентероцитах (рис. 25-8). Негемне Fe2+ абсорбоване іншими транспортними білками. Декілька білків-кандидатів було ізольовано та клоновано, у тім числі протонозв’язаний з металом транспортер, що має 12 сполучених з мембраною доменів і зв’язує не тільки Fe2+, а й Zn2+, Mn2+, Ca2+, Cd2+, Cu2+, Ni2+ i Pb2+. Проте досі остаточно не з’ясована кількість і деталі діяльності цих транспортних білків.
Частина цитоплазматичного Fe2+ в ентероцитах окиснюється до Fe3+ і зв’язується з апоферитином, утворюючи феритин (див. нижче). Є труднощі у вивільненні заліза з депонованої форми, та назагал феритин утримується в ентероцитах до моменту, доки він повністю не переміститься на верхівку ворсинки, а згодом вийде з каловими масами (див. Розділ 26).
Більша частина цитоплазматичного Fe2+, що залишилася, активно транспортується через базолатеральні мембрани ентероцитів і потрапляє в кров, де зв’язується з Fe3+ формою апоферитину, утворюючи трансферитин - активний залізотранспортний білок у плазмі. Цей поліпептид має два залізозв’язувальні сайти. За нормальних умов трансферитин насичений залізом на 35%, і рівень заліза у плазмі становить 130 мг/дл (23ммоль/л) у чоловіків та 110 мг/дл (19 ммоль/л) у жінок.
Всмоктування заліза збільшується у випадку виснаження депонованого заліза організму або зростання еритропоезу і зменшується за протилежних станів. Деталі механізмів регулювання все ще остаточно не з’ясовані. Крім того, ці процеси залучають поглинання вздовж щіточкової облямівки, що полегшене в разі дефіциту заліза і виникає, коли трансляція апоферитину мРНК зменшується, утворюючи більше Fe2+ для транспортування у кров. За надлишку заліза утворюється більше феритину в ентероцитах, який злущується з цими клітинами до калових мас.
Феритини наявні не тільки в ентероцитах (головному місці депонації заліза), а й у багатьох інших клітинах. Апоферитин - це глобулярний білок, що складається з 24 субодиниць. Залізо утворює міцели гідроксифосфату заліза (II), і у феритині субодиниці оточують цю міцелу. Феритинова міцела може вміщувати майже 4500 атомів заліза. Феритин добре видно під електронним мікроскопом, тому його застосовують як елемент-індикатор у разі вивчення фагоцитозу та споріднених явищ. Він також є головною формою депонації заліза в організмі; його молекули у лізосомальних мембранах можуть аґреґуватись у відкладеннях, що містять понад 50% заліза. Такі відкладення називають гемосидерином. В організмі людини 70% від усього заліза містяться у гемоглобіні, 3% - у міоглобіні, а решта - у феритині. Нормальне співвідношення між факторами, що підтримують баланс заліза в організмі, необхідне для здоров’я. Дефіцит заліза спричинює анемію. Якщо ж всмоктується більше заліза, ніж виводиться, то простежується надлишок заліза. У випадку, коли такий стан виражений і тривалий, гемосидерин акумулюється в тканинах, і розвивається гемосидероз. Значна кількість гемосидерину пошкоджує тканини, спричинюючи гемохроматоз. Цей синдром супроводжується пігментацією шкіри, ураженням підшлункової залози діабетом («бронзовий діабет»), цирозом печінки, високим рівнем випадків печінкових карцином та атрофією гонад. Гемосидероз може бути первинним або вторинним. Анормальний ген, що досить поширений у кавказької популяції, міститься на короткому плечі 6-ї хромосоми, близько зв’язаної з HLA-A локусом. Особи, гомозиготні за цим геном, мають характерну регуляторну систему в слизовій оболонці, що поводиться так, наче дефіцит заліза є навіть тоді, коли рівень споживання заліза високий. Якщо цю аномалію діагностувати, перш ніж надлишок заліза депонується у тканинах, то тривалість та якість життя можна продовжити повторними кровопусканнями. Вторинний гемохроматоз виникає у випадках, коли залізорегулювальні системи переповнені надлишком заліза через хронічну деструкцію еритроцитів, хвороби печінки або хронічно підвищене приймання заліза. Частою причиною надлишкового споживання заліза у деяких місцевостях Африки є споживання страв з ягід, які готують у сталевих барабанах.
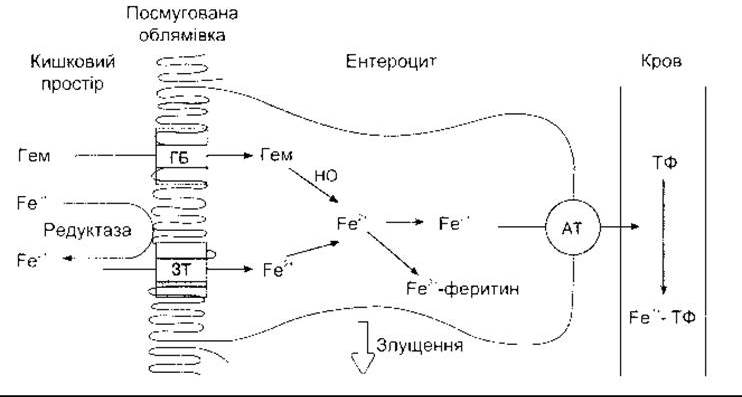
Рис. 25-8. Всмоктування заліза. Гем потрапляє в ентероцити за допомогою гемтранспортувального білка (ГБ) Йони Fe2+ через посмуговану облямівку переносить один або кілька залізотранспортувальних білків (ЗТ). Частина Fe2+ оксигенує і зв’язується з феритином. Інші йони проходять через базолатеральну мембрану завдяки активному транспортуванню (AT). Потім вони потрапляють у кров, де Fe3+ зв’язує їх до трансферитину (ТФ). Ентероцити міґрують з крипт до кінчиків ворсинок і з часом злущуються у кишковий простір разом із залізовмісним феритином (модифіковано та відтворено за дозволом з Debnam ES, Srai SKS- Intensinal iron absorption: Cellular mechanism and regulation. News Physiol Sei 1997; 12:184).