Фізіологія людини - Вільям Ф. Ґанонґ 2002
Функції травної системи
Механізми регулювання шлунково-кишкових функцій
Гастроінтестинальні гормони
Біологічно активні поліпептиди, що їх секретують нейрони та залозисті клітини слизової оболонки, впливають як паракринним способом, так і гуморальним, бо одночасно потрапляють у кровообіг. Експериментальні дослідження ефектів та вимірювання їхньої концентрації в крові за допомогою радіоімунологічного методу ідентифікують роль цих гастроінтестинальних гормонів у регулюванні секреції та моторики шлунково-кишкового тракту. В разі введення великих доз цих гормонів їхні ефекти перекриваються. Крім того, їхні фізіологічні ефекти з’являються досить дискретно (відокремлено). На підставі структурної подібності (табл. 26-2) і залежно від ступеня тотожного функціювання частина гормонів належить до однієї з двох родин гастринів, головними представниками яких є гастрин та холецистокінін (ХЦК), і до секретинів, головними представниками яких є секретин, глюкагон, гліцентин (GLl - від англ. glicentyn), ВІП та шлунковий інгібувальний поліпептид (ШІП). Крім того, є ще інші гомони, які не належать до цих двох родин.
Ентероендокринні клітини
У слизовій оболонці шлунка, тонкої та товстої кишки містяться понад 15 типів гормонопродукувальних ентероендокринних клітин. Багато з них секретують тільки один гормон та ідентифіковані літерами (G-клітини, S-клітини тощо). Клітини, що виробляють серотонін (хоча не всі), відомі як ентерохромафінні КЛІТИНИ. Клітини, що продукують поліпептиди та аміни, інколи називають APUD-клітинами (від анл. amine precursor uptake and decarboxylase накопичення та декарбоксилювання попередників амінів), або нейроендокринними клітинами, які, крім шлунково-кишкового тракту, містяться в легенях та інших органах. Вони також є клітинами, в яких формуються карциноїдиі пухлини.
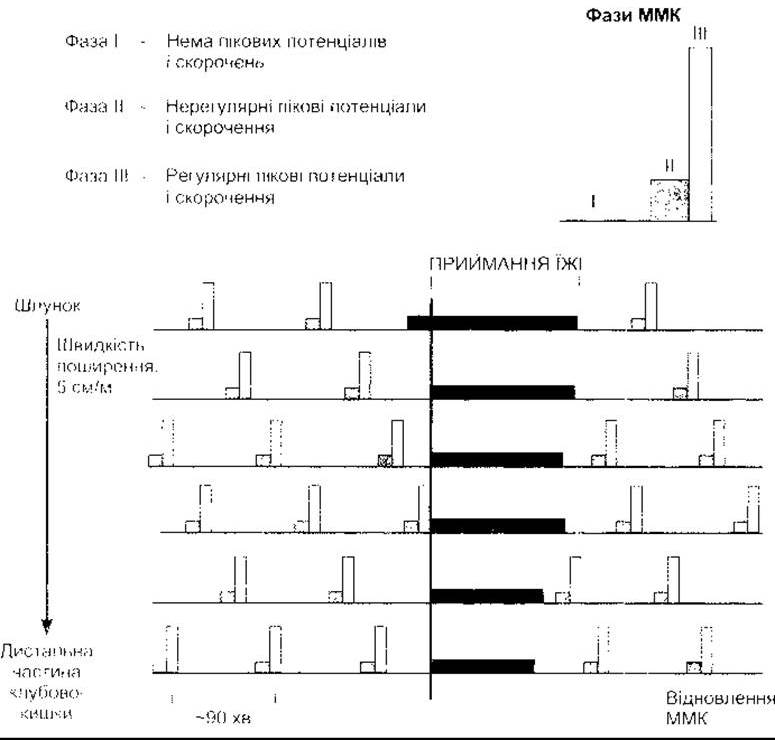
Рис. 26-3. Міграційні моторні комплекси (ММК) Зверніть увагу, що комплекси рухаються у шлунково-кишковому тракті вниз зі звичайною швидкістю у міжтравний період, повністю загальмовані під час приймання їжі та поновлюються через 90-120 хв після приймання їжі (відтворено за дозволом з Chang ЕВ, Sitrin MD, Black DD Gastrointestinal Hepatobiliary and Nutritional Physiology Lippincott-Raven, 1996)
Гастрин
Гастрин утворюють G-клітини в латеральних стінках залоз слизової оболонки в антральній частині шлунка (рис. 26-4). Ці G-клітини мають колбоподібну форму широке дно містить багато астринових гранул, а вузька верхівка відкривається на поверхню слизової оболонки. З апікального кінця у просви відходять мікроворсинки. На них містяться гастринові рецепторти, що реагують на зміну вмісту гастрину. Інші клітини шлунково-кишкового тракту, що секретують гормони, мають подібні морфологічні ознаки. Іншим чином гастринопродукувальних клітин є ТG-клітини, що містяться як у шлунку, так і в тонкій кишці. Вони мають G 34 і карбоксильне закінчення тетрапептиду гастрину, однак втратили G17 (див. нижче).
Під час ембріонального життя гастрин також міститься в острівцях підшлункової залози. Гастриносекретувальні пухлини, які називають гастриноми, трапляються також у підшлунковій залозі, проте досі не з’ясовано, чи за нормальних умов будь-який гастрин наявний у підшлунковій залозі дорослих. Крім того, гастрин також виробляють передня та проміжна частки гіпофіза, гіпоталамус, довгастий мозок, а також блукаючий та сідничий нерви. Гастрин є типовим представником поліпептидних гормонів, які мають як макрогетерогеннісгь, так і мікрогетерогенність. Макрогетерогенність стосується випадків появи у тканинах та тканинних рідинах організму пептидних ланцюгів різної довжини; мікрогетерогенність відмінностей у молекулярній будові залежно від походження окремих амінокислотних залишків. Унаслідок процесингу препрогастрину утворюються фрагменти різноманітних розмірів. Три головні фрагменти містять 34, 17 га 14 амінокислотних залишків Усі вони мають однакову конфігурацію з карбоксильними кінцями (див. табл. 26-2). Ці форми часто називають, відповідно, G34-, G17-, G14-гастрини. Іншою формою є тетрапептид з карбоксильним залишком, який як велика форма збільшений завдяки амі- нозакінченню, що містить понад 45 залишків амінокислот. Ще одна похідна форма - сульфатація тирозину, який є шостим амінокислотним залишком на карбоксильному кінці. У крові й тканинах міститься однакова кількість несульфатованих та сульфатованих форм. Інші похідні утворені амінуванням карбоксильних кінців фенілаланіну.
Таблиця 26-2. Структура деяких гормонально активних поліпептидів, що їх секретують клітини шлунково-кишкового тракту в людини1
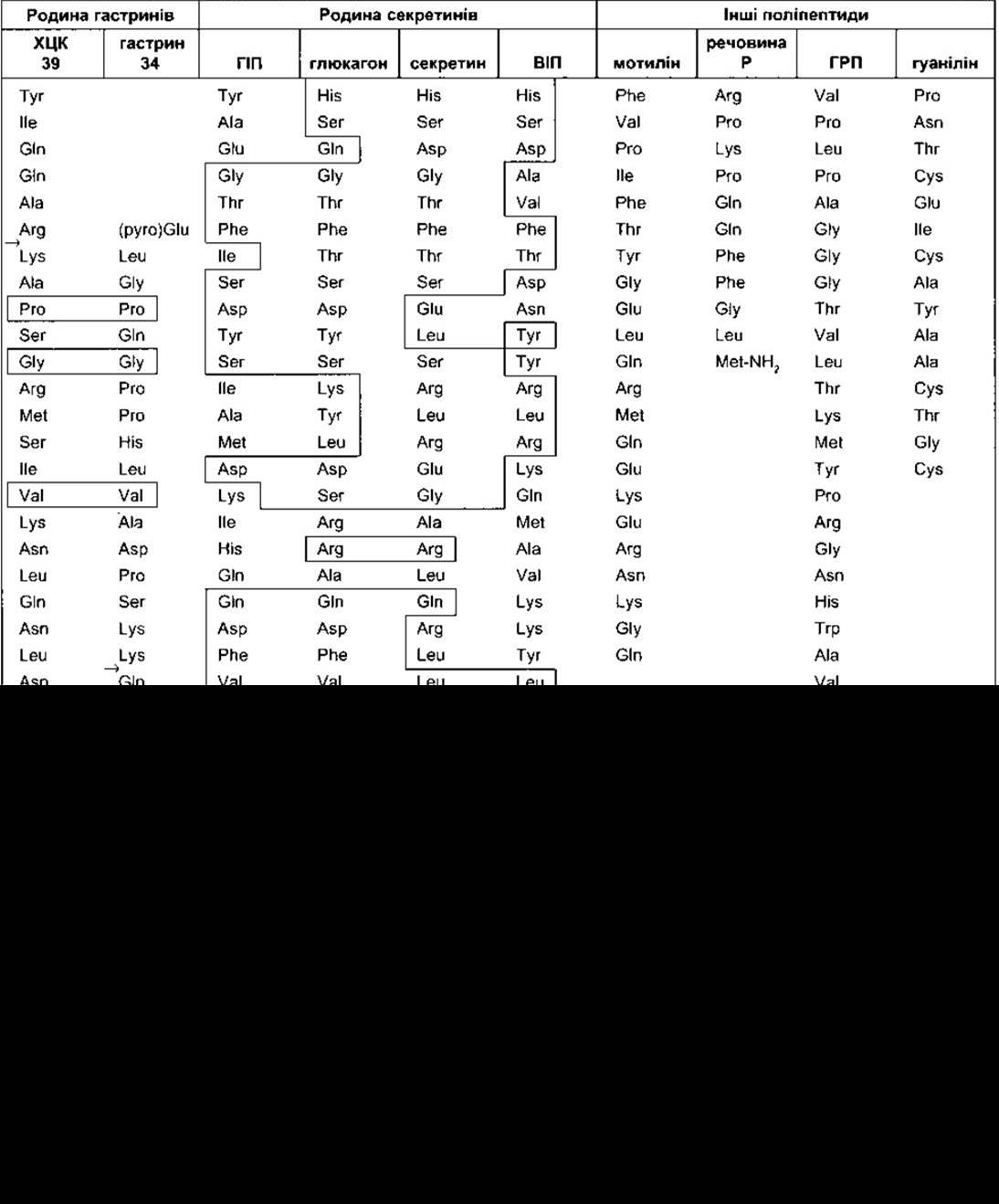
1 Гомологічні амінокислотні залишки оточені лініями, які переходять від одного поліпептиду до іншого. Стрілки позначають на місця розщеплення для утворення менших варіантів;

Рис. 26-4. Поширення гастроінтестинальних пептидів уздовж шлунково-кишкового тракту. Товщина кожної позначки пропорційна до концентрації пептиду у слизовій. Препроглюкагон перетворюється до глюкагону найбільше в A-клітинах у проксимальній частині та до гліцентину; GLP-1, GLP-2 та інші похідні у L-клітинах дистальної частини шлунково-кишкового тракту.
Фізіологічне значення виявленої гетергенності таке. Є незначна відмінність в активності між різними компонентами, а також розбіжна пропорційність компонентів у різних тканинах, де міститься гастрин. Це підтверджене тим, що утворення різних форм гастрину зумовлене модифікованим функційним впливом.
Отже, можна стверджувати, що G17 - головна форма, яка відповідає за секрецію соляної кислоти у шлунку. Тетрапептид з карбоксильним залишком має всі активності гастрину, проте лише 10% від потужності G17. Період півжиття G14 та G17 у крові становить 2-3 хв, тоді як G34 - 15 хв. Інактивація гастринів відбувається головно в нирках і тонкій кишці.
У великих дозах гастрин впливає по-різному, однак головною фізіологічною дією є стимулювання шлункової кислотності та секреції пепсину, а також спонукання росту слизової оболонки в шлунку, тонкій та товстій кишці (трофічна дія). Стимулювання шлункової моторики - ще один наслідок впливу гастрину, який спричинює скорочення шлунково-стравохідних сфінктерів (див. нижче), однак значення цього фізіологічного ефекту не з’ясоване. Гастрин також стимулює секрецію інсуліну, проте тільки після приймання білкової, а не вуглеводної їжі. Зі збільшенням рівня циркулювального ендогенного гастрину збільшується/секреція інсуліну. Функції гастрину гіпофіза, інших частин головного мозку та периферійних нервів остаточно не з’ясовані.
Секреція гастрину залежить від спожитої їжі, рівня імпульсації блукаючого нерва та різних факторів, що містяться в крові (табл. 26-3). Атропін не гальмує виділення гастрину в людей на пробний сніданок, оскільки трансмітером, який секретують постгангліонарні волокна блукаючого нерва, що іннервують G-клітини, є швидше гастрин-рилізинг поліпептид (ГРП; див. нижче)*, ніж ацетилхолін. Секреція гастрину також збільшується за наявності перетравленої білкової їжі у шлунку, передусім амінокислот, які безпосередньо впливають на G-клітини. Особливо ефективні фенілаланін та триптофан.
Наявність кислоти в антральному відділі шлунка гальмує секрецію гастрину частково завдяки безпосередній дії на G-клітини, а частково внаслідок вивільнення соматостатину, порівняно потужного інгібітора секреції гастрину. Вплив кислоти на секрецію гастрину - це основа для механізмів регулювання за принципом зворотного зв’язку. Збільшення секреції гормонів спричинює зростання секреції хлористоводненої кислоти парієтальними клітинами.
Наростання кислотності шлункового середовища спричинює за механізмом зворотного зв’язку гальмування секреції гастрину.
Роль гастрину в патогенетичних механізмах виразкової хвороби дванадцятипалої кишки описана нижче. У випадку перніціозної анемії, коли уражені кислотопродукувальні клітини шлунка, секреція гастрину хронічно підвищена.
* Синонім гастрин-рилізинг поліпептиду - бомбезин.
Таблиця 26-3. Фактори, які впливають на секрецію гастрину

Холецистокінін-панкреозимін
Раніше вважали, що гормон холецистокінін спричинює скорочення жовчного міхура, тоді як зовсім інший гормон - панкреозимін - збільшує секрецію панкреатичного соку, що багатий на ензими. Тепер відомо, що це єдиний гормон, який секретують клітини слизової оболонки проксимальної частини тонкої кишки, який виконує ці дві функції, тому його нова назва - холецистокінін-панкреозимін (ХЦК- ПЗ, тепер поширеніше ХЦК).
Подібно до гастрину ХЦК є сполукою, що відображає молекулярну як макро-, так і мікрогетерогенність. Під час процесинґу пре-ХЦК утворює декілька фрагментів. Великий ХЦК містить 58 амінокислотних залишків (ХЦК 58). Крім того, є декілька форм ХЦК з різною кількістю амінокислотних залишків: ХЦК 39 - 39 амінокислотних залишків, ХЦК 33 - відповідно, 33, а також декілька форм, що містять 12 (ХЦК 12) або трохи менше амінокислотних залишків (ХЦК 8). Усі ці форми мають, як і гастрин, п’ять амінокислот на карбоксильному кінці (див. табл. 26-2). Тетрапептид з карбоксильним кінцем (ХЦК 4) також міститься в тканинах. Карбоксильні кінці амінуються, і тирозин, що є сьомим амінокислотним залишком у карбоксильному закінченні, сульфатується. Відмінна від гастрину несульфатована форма ХЦК, якої нема в тканинах. Крім того, відомо, що утворюються ще інші похідні від решти амінокислотних залишків ХЦК. Період півжиття ХЦК у кровообігу 5 хв, однак мало що відомо про його метаболізм.
Секретують ХЦК ендокриноцити - І-клітини проксимального відділу тонкої кишки, нервові кінці дистальної частини клубової та ободової кишки. ХЦК міститься у нейронах головного мозку, особливо в його корі, нервових волокнах організму людини (див. Розділ 4). У головному мозку цей гормон відповідає за регулювання споживання їжі (див. Розділ 14), його поява пов’язана з почуттям страху, тривоги, знеболення. ХЦК, що секретується в дванадцятипалій та голодній кишці, представлений здебільшого ХЦК 8, ХЦК 12. Крім цих форм, у кишці та крові, що циркулює, у багатьох видах наявний ХЦК 58. Ентеричні та панкреатичні нервові волокна містять передусім ХЦК 4. У головному мозку є ХЦК 58 і ХЦК 8.
Крім описаних вище впливів, ХЦК посилює дію секретину, який стимулює секрецію лужного підшлункового соку, сповільнює випорожнення шлунка, впливає на трофіку підшлункової залози, збільшує секрецію ентерокінази і може підвищувати моторику тонкої та ободової кишки. У деяких випадках секретин посилює скорочення пілоричного сфінктера, попереджуючи рефлюкс дуоденального вмісту до шлунка. Гастрин і ХЦК стимулюють секрецію глюкагону в разі перетравлення білкових страв. Реалізовуючи свій вплив окремо або разом, ці гормони стають такими кишковими факторами, що стимулюють секрецію глюкагону (див. Розділ 19). Як зазначено у Розділах 4 і 14, сьогодні ідентифіковано два ХЦК-рецептори. На периферії головно розташовані ХЦК-А-рецептори, тоді як у головному мозку - ХЦК-А і ХЦК-В. Обоє активовані ФЛС і продукують ІФ3 і ДАГ (див. Розділ 1). Нещодавно клоновано гастриновий рецептор у шлунку, який хоча дуже подібний, проте не однаковий з ХЦК-В-рецептором. Незважаючи на це відмінності між впливом гастрину та ХЦК на периферії та концентрацією ХЦК-В-рецепторів у головному мозку, не зрозумілі.
Збільшення секреції ХЦК відбувається в разі контакту перетравлених продуктів, особливо пептидів та амінокислот з інтестинальною слизовою оболонкою, а також за наявності в дванадцятипалій кишці жирних кислот, що містять понад десять атомів вуглецю. З моменту стимульованого ХЦК надходження жовчі та підшлункового соку у дванадцятипалу кишку, в ній утворюються нові порції продуктів перетравлення білків і жирів, які знову підвищують секрецію ХЦК: це регулювання за механізмом позитивного зворотного зв’язку. Воно завершується з надходженням перетравлених продуктів у дистальні відділи шлунково-кишкового тракту.
Секретин
В історії фізіології секретин посідає унікальне місце. В 1902 р. Бейлісс та Старлінґ перші описали збуджувальний ефект дуоденального стимулювання панкреатичної секреції фактором, що міститься в крові. Виконані дослідження привели до відкриття секретину. Вчені також передбачили, що багато інших хімічних агентів повинні бути секретовані клітинами організму, які згодом потрапляють у кровообіг від органів афектів, що розташовані на значній відстані. Стралінґ увів термін гормон, який означив як хімічний месенджер. Сучасна ендокринологія підтвердила правильність та коректність цієї гіпотези.
Секретин виділяють S-клітини, які розміщені глибоко в залозах слизової оболонки проксимального відділу тонкої кишки. Секреція секретину (див. табл. 26-2) відрізняється від ХЦК і гастрину, та однакова з глюкагоном, GLI, ВІП і ШІП. Виділено тільки одну форму секретину і фрагменти молекули, які вивчено у дослідженнях як неактивні. Тривалість півжиття секретину близько 5 хв, мало що відомо про його метаболізм.
Секретин збільшує секрецію бікарбонатів у клітинах проток підшлункової залози та біліарного тракту, а також спричинює секрецію водянистого лужного підшлункового соку. Його вплив на клітини проток опосередкований через цАМФ. Відомо, що секретин впливає на ХЦК, який відповідає за секрецію травних ензимів підшлунковою залозою.
Водночас він зменшує секрецію соляної кислоти у шлунку, яка приводить до скорочення пілоричного сфінктера.
Секреція секретину збільшується в разі утворення продуктів травлення білків і подразнення кислотним вмістом слизової проксимального відділу тонкої кишки. Вивільнення секретину внаслідок впливу кислоти є ще одним прикладом регулювання за принципом зворотного зв’язку. Секретин спричинює секрецію лужного підшлункового соку і потрапляння його до дванадцятипалої кишки, нейтралізуючи кислотність у шлунку і припиняючи подальшу секрецію гормону.
Шлунковий інгібувальний поліпептид
Шлунковий інгібувальний поліпептид (ШІП) складається з 43 амінокислотних залишків (див. табл. 26-2) і утворюється в К-клітинах слизової оболонки дванадцятипалої та голодної кишки. Секрецію ШІП стимулюють глюкоза і жири, що містяться у дванадцятипалій кишці. У випадку продукування великої кількості пептиду відбувається гальмування секреторної та моторної функцій шлунка. Ця дія і зумовила його назву - шлунковий інгібувальний пептид. Окрім того, сучасні дані свідчать, що ШІП не реалізує свого впливу - гальмування активності шлунка, якщо вивільнюється малими дозами у кровоплин після їди. Водночас відомо, що ШІП стимулює секрецію інсуліну. Гастрин, ХЦК, секретин, глюкагон теж мають такий ефект, та лише один ШІП стимулює секрецію інсуліну, створюючи такий рівень у крові, що можна порівняти з аналогічним як після орального приймання глюкози. З цього огляду ШІП часто називають інсулінотропічним глюкозозалежним поліпептидом. Похідні глюкагону GLP-1 (7-36) (див. Розділ 19) також стимулюють секрецію інсуліну і є в цих випадках потужнішими, ніж ШІП. Отже, він може бути також фізіологічним В-клітинним стимулювальним гормоном шлунково-кишкового тракту.
Інтеграція впливу гастрину, ХЦК, секретину та ШІП полягає в поліпшенні травлення й утилізації абсорбованих харчових продуктів (рис. 26-5).
Вазоактивний інтестинальний поліпептид
Вазоактивний інтестинальний поліпептид (ВІП) містить 28 амінокислотних залишків (див. табл. 26-2). Він міститься у волокнах, що іннервують шлунково-кишковий тракт. Препро-ВІП містить як ВІП, так і близькоспоріднений поліпептид (РНМ-27 у людей, РНІ-27 в інших видів). Період півжиття для ВІП становить 2 хв. У кишці він стимулює інтестинальну секрецію електролітів та води. До інших впливів належить розслаблення гладких м’язів кишки, у тім числі сфінктерів, дилятація периферійних кровоносних судин і гальмування секреції соляної кислоти шлунком. ВІП також міститься в головному мозку та багатьох нервових волокнах автономної нервової системи (див. Розділ 4), де часто простежується в тих нейронах, що й ацетилхолін. Він підсилює дію ацетилхоліну на слинні залози. Проте ВІП і ацетилхолін не можуть співіснувати в нейронах, що іннервують інші частини шлунково-кишкового тракту. ВІП-секретувальні пухлини (ВІПоми) описують у пацієнтів з тяжкими діареями. Зв’язок ШІП і ВІП з ентерогастроном, несправжнім гормоном, який гальмує секрецію кислоти у шлунку і моторику, досі остаточно не з’ясований. Крім того, пептид YY (див. Розділ 19) також можна вважати ентерогастроном. Жири спричинюють його вивільнення в голодну кишку, і цей пептид є ефективним інгібітором гастриностимульованої секреції соляної кислоти.
Мотилін
Мотилін - поліпептид, що вміщує 22 амінокислотні залишки, секретований ентерохромафінними клітинами і Mo-клітинами шлунка, тонкої та ободової кишки. Він впливає на рецептори, що зв’язані з G-білком ентеричної системи дванадцятипалої та ободової кишки. У разі введення мотиліну виникають скорочення гладких м’язів шлунка та кишки. Рівень мотиліну в крові збільшується періодично з інтервалами 100 хв у міжтравному періоді. Мотилін є головним регулятором ММК, який регулює шлунково-кишкову моторику в період між прийманням їжі. Антибіотик еритроміцин зв’язується з рецепторами мотиліну, і похідні цих сполук мають значення для пацієнтів, оскільки на тлі приймання цього лікарського засобу простежується сповільнення шлунково-кишкової моторики.
Інші шлунково-кишкові гормони
Нейротензин- 13-амінокислотний поліпептид, що його утворюють нейрони та клітини, які містяться у слизовій оболонці клубової кишки. Він вивільняється внаслідок подразнення жирними кислотами.
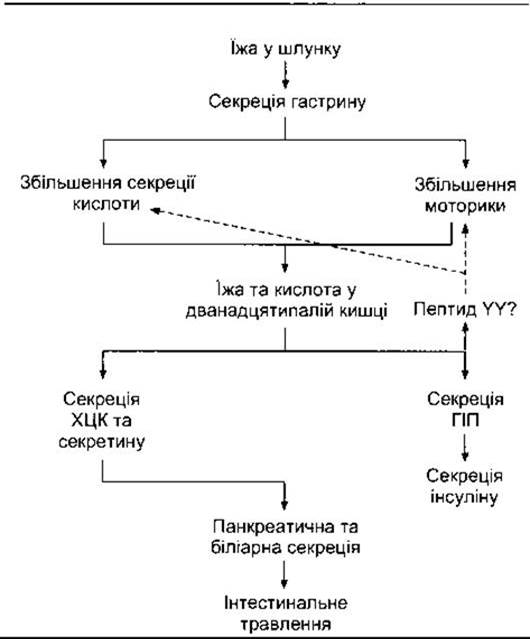
Рис. 26-5. Інтегрувальна дія гастроінтестинальних гормонів у регулюванні травлення та засвоєння абсорбованих поживних речовин. Штрихова стрілка позначає інгібіцію. Точна ідентифікація гормонального або кишкових факторів, що інгібують секрецію шлункової кислоти та моторику, досі не з’ясована, однак ним може бути пептид YY.
Головний вплив нейротензину - гальмування шлунково-кишкової моторики і збільшення кровоплину у клубовій кишці. Речовина Р (див. табл. 26-1) міститься в ендокриноцитах і нейронах шлунково-кишкового тракту й може потрапляти у кровообіг. Вона збільшує моторику тонкої кишки. ГРП (гастрин-рилізинг пептид) вміщує 27 амінокислотних залишків, а 10 амінокислотних залишків на їхніх карбоксильних кінцях також ідентифіковані як двозначний бомбезин. Він наявний у нервових волокнах блукаючого нерва, що закінчуються на G-клітинах. У разі їхнього подразнення вивільнюється бомбезин, що збільшує секрецію гастрину. У випадках значного збільшення секреції деяка частина гастрину потрапляє до кровообігу. Соматостатин, гормон-інгібітор виділення гормону росту, крім синтезу у гіпоталамусі, секретують у кровообіг D-клітини острівців підшлункової залози (див. Розділ 19) і D-подібні клітини слизової оболонки шлунково-кишкового тракту. Як описано у Розділі 14, він наявний в тканинах у двох формах: соматостатин 14 (див. рис. 4-27) і соматостатин 28, які вивільняються одночасно. Соматостатин гальмує секрецію гастрину, ВІП, ШІП, секретину та мотиліну. Подібно до інших гастроінтестинальних гормонів, соматостатин секретується у великих кількостях у просвіт шлунка, а потім - у кров’яне русло. Його секреція збільшується з підвищенням рівня кислотності у шлунку і, вірогідно, паракринна дія через шлунковий сік спонукає до гальмування секреції гастрину, що спричинюване впливом кислоти. Соматостатин також гальмує екзокринну секрецію підшлункової кислоти, секрецію соляної кислоти та моторику шлунка, скорочення жовчного міхура, абсорбцію глюкози, амінокислот і тригліцеридів. Глюкагон зі шлунково-кишкового тракту відповідає (частково) за гіперглікемію після панкреатотомії. Продукти, утворені з препроглюкагону у проксимальній та дистальній частинах кишки, описані у Розділі 19 і показані на рис. 19-16.
Гуанілін - гастроінтестинальний поліпептид, що зв’язується з С-типом гуанілатциклази. Він утворений з 15 амінокислотних залишків (див. табл. 26-2); секретований клітинами слизової оболонки кишки. У людини гуанілін також можуть виробляти клітини Пейнета, ендокриноцити, що містяться біля Люберкюнових крипт тонкої кишки. Стимулювання гуанілатциклази збільшує концентрацію внутрішньоклітинного цГМФ, який, вірогідно, спричинює посилення активності Сl - регульованих каналів у разі кистозного фіброзу (муковісцидозу) і збільшує секрецію Сl у кишковий просвіт. Гуанілін здебільшого діє паракринно й утворюється в клітинах від пілоричного відділу шлунка до прямої кишки. Цікавий приклад клітинної мімікрії: у термостійкого ентеротоксину зі штаму Е.соlі, що спричинює діарею, простежується однакова будова з гуаніліном і активування гуанілінових рецепторів у кишці.
Гуанілінові рецептори також містяться в нирках, печінці, жіночій статевій системі. Гуанілін теж гуморально впливає на регулювання руху рідин у тканинах.
ТРГ і АКТГ містяться у шлунково-кишковому тракті; очевидно, що ці гормони не потрапляють у систему кровообігу внаслідок специфічності місця продукування з моменту ураження гіпоталамуса або гіпофізектомії відбувається вплив на щитоподібну та надниркові залози за умови, що шлунково-кишковий тракт інтактний. Крім того, відомі випадки, коли місцево утворені ТРГ або ТСГ залучені до регулювання секреторного імунітету в кишці (див. Розділ 25). ТРГ також виявляють в острівцях підшлункової залози і, ймовірно, в В-клітинах. Речовина урогастрон (назва зумовлена тим, що її вперше виділили з сечі) належить до трансмітерів захисту і бере участь у загоєнні виразок; тепер відома як епідермальний фактор росту (див. Розділ 22).
Клітини, які виділяють гастроінтестинальні поліпептиди, можуть утворювати пухлини. Гастриноми становлять 50%, глюкагономи - 25% від цих пухлин, у літературі описані також ВІПоми, нейротензиноми та ін.