Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Рідини, що циркулюють в організмі
Кров - Червоні кров'яні клітини
Червоні клітини крові (еритроцити) переносять у крові кисень. Це двоввігнуті диски, які утворюються у кістковому мозку (рис. 27-15). У ссавців перед виходом у системний кровообіг еритроцити втрачають ядро. Тривалість життя еритроцитів у людей становить у середньому 120 днів. У нормі середня кількість еритроцитів у чоловіків - 5,4 млн/мкл, у жінок - 4,8 млн/мкл. Кожний еритроцит людини має діаметр 7,5 мкм, товщину 2 мкм і містить приблизно 29 пг гемоглобіну (табл. 27-6). У крові дорослої людини міститься 3x1013 еритроцитів і близько 900 г гемоглобіну (рис. 27-16). Контроль еритропоезу за принципом зворотного зв’язку описано в Розділі 24. Роль ІЛ-1, ІЛ-3,1Л-6 і КСФ-ҐМ у розвитку еритроїдного ростка показана на рис. 27-2.
Резистентність еритроцитів
Еритроцити, як і інші клітини, зморщуються в розчинах з осмотичним тиском, вищим від нормального тиску плазми. У розчинах з нижчим осмотичним тиском вони набухають, змінюючи форму з дископодібної на сферичну, і втрачають гемоглобін (гемоліз). Гемоглобін гемолізованих еритроцитів розчиняється в плазмі, забарвлюючи її у червоний колір. Розчин натрію хлориду 0,9% концентрації є ізотонічний з плазмою. За нормальної осмотичної резистентності гемоліз еритроцитів починається у 0,5% сольовому розчині; 50% лізис відбувається у 0,40-0,42% сольовому розчині, а повний лізис - у 0,35% розчині. У разі спадкового сфероцитозу (вродженої гемолітичної жовтяниці) клітини сфероцити нормальної плазми і гемолізують швидше, ніж нормальні клітини у гіпотонічному розчині натрію хлориду. Сфероцити також видаляє селезінка (див. нижче). Отже, спадковий сфероцитоз - це одна з головних причин спадкової гемолітичної анемії.
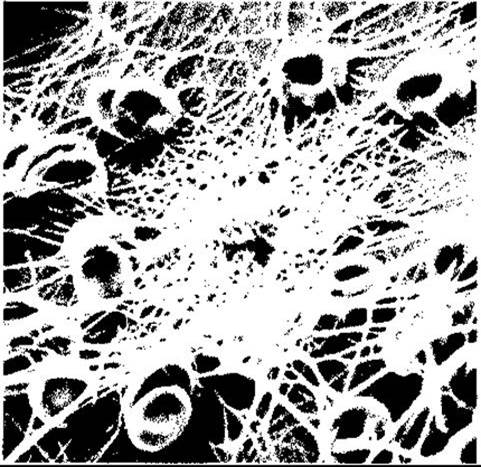
Рис. 27-15. Людські еритроцити і нитки фібрину. Кров нанесена на полівінілхлоридну поверхню, зафіксована і сфотографована за допомогою скануючого електронного мікроскопа X 2590 (з дозволу NF Rodman).
Сфероцитоз виникає внаслідок порушень білкової сітки, яка зумовлює форму і гнучкість мембрани еритроцитів. Мембранний скелет частково утворений спектрином і прикріплений до трансмембранного білка смужки 3 за допомогою білка анкірину (див. рис. 1-11). Білок смужки З, крім того, є важливим аніонним обмінником (див. Розділ 35). Описано дефекти білка смужки 3, спектрину та анкірину. Лізис еритроцитів можливий також під впливом ліків і в разі інфекцій. Схильність еритроцитів до гемолізу під дією цих факторів посилена за наявності дефіциту ензиму глюкозо-6-фосфатдегідрогенази (Г6ФД). Цей ензим каталізує початковий етап окиснення глюкози у гексозомонофосфатному шляху (див. Розділ 17), який забезпечує утворення НАДФ, необхідного для нормальної резистентності еритроцитів. Виражена недостатність Г6ФД зменшує також здатність гранулоцитів спричиняти загибель бактерій і сприяє розвитку важких інфекцій (див. вище).
Таблиця 27-6. Характеристика еритроцитів людини1
Чоловіки |
Жінки |
||
Гематокрит (Hct), % |
47 |
42 |
|
Еритроцити (ЕРЦ), 106/мкл |
5,4 |
4,8 |
|
Гемоглобін (Hb), г/дл |
16 |
14 |
|
Середній корпускулярний об’єм (MCV2), фл |
= Hсt X 10 / ЕРЦ (106/мкл) |
87 |
87 |
Середній корпускулярний гемоглобін (МСН2), пг |
= Hb X 10 / ЕРЦ (106/мкл) |
29 |
29 |
Середня корпускулярна концентрація гемоглобіну (МСНС2), г/дл |
= Hbx 100/Hct |
34 |
34 |
Середній діаметр клітини (MCD2), мкг |
= Середній діаметр 500 клітин у мазку |
7,5 |
7,5 |
1 Клітини із СКО > 95 фл називають макроцитами; клітини із СКО < 80 фл - мікроцитами; клітини із СКГ < 25 г/дл - гіпохромними.
2 MCV - від англ. mean corpuscular volume; MCH - від англ. mean corpuscular hemoglobin; MCHC - від англ. mean corpuscular hemoglobin concentration, MCD - від англ. mean cell diameter.
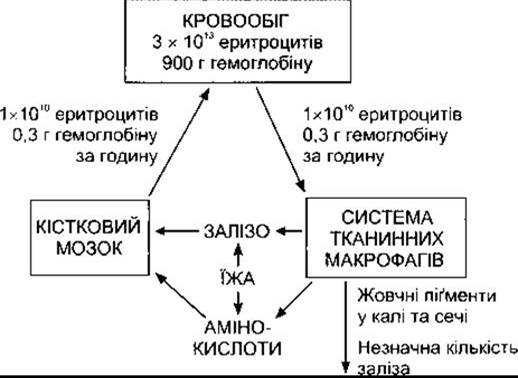
Рис. 27-16. Утворення і деструкція еритроцитів.
Роль селезінки
Селезінка виконує важливу функцію фільтра, який видаляє сфероцити та інші змінені еритроцити. Вона також містить велику кількість тромбоцитів і відіграє важливу роль в імунній системі. Кровообігу в селезінці притаманні два компоненти: швидкий компонент за функцією забезпечує переважно живлення, у цьому разі кров перебуває в просвіті кровоносних судин; повільний компонент, за якого кров покидає артеріоли і, перш ніж потрапити у синуси селезінки і повернутися у загальний кровообіг, фільтрується через велику кількість фагоцитів і лімфоцитів. Фагоцити видаляють бактерії і розпочинають імунну відповідь. Змінені еритроцити видаляються, якщо вони є не настільки гнучкими, як нормальні, а отже, не можуть проникнути через щілини між ендотеліальними клітинами, які вистеляють синуси селезінки. Якщо нема селезінки, то бактеріальні інфекції виникають частіше і бувають у важчій формі. Підвищується також смертність від малярії, оскільки деформовані еритроцити, які містять збудник малярії, не видаляються.
Гемоглобін
Червоний пігмент, який переносить кисень і міститься в еритроцитах хребетних, - це гемоглобін, білок з молекулярною масою 64 450. Гемоглобін має глобулярну молекулу, утворену чотирма субодиницями (рис. 27-17). Кожна субодиниця містить гем, зв’язаний з поліпептидом. Гем - це залізовмісна сполука, похідна порфірину (рис. 27-18). Комплекс поліпептидів називають глобіновою частиною (глобіном) молекули гемоглобіну. В кожній молекулі гемоглобіну є дві пари поліпептидів. У гемоглобіні нормальної дорослої людини (гемоглобіні А (від англ. adult - дорослий)) два типи поліпептидів називають а-ланцюгами, кожний з яких містить 141 амінокислотний залишок, і ß-ланцюгами, кожний з яких містить 146 амінокислотних залишків. Отже, гемоглобін А позначають а2ß2. У нормі в дорослих не весь гемоглобін крові є гемоглобіном А. Близько 2,5% гемоглобіну становить гемоглобін А2, у якому ß-ланцюги заміщені δ-ланцюгами (а2δ2); δ-ланцюги також містять 146 амінокислотних залишків, однак 10 з них відрізняються від залишків ß-ланцюгів.
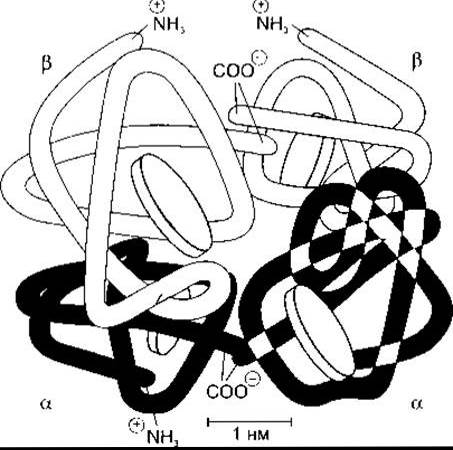
Рис. 27-17. Схематичне зображення молекули гемоглобіну А, яка складається з чотирьох субодиниць Молекула містить два а- і два ß поліпептидні ланцюги, кожний з яких має гем Гем зображено у вигляді дисків (відтворено за дозволом з Harper НА et al Physiologische Chemie. Springer, 1975)
Невелика кількість похідних гемоглобіну А представлена глікозильованими гемоглобінами. Один з них - гемоглобін А1С (НbА1C) - містить глюкозу, прикрі плену до термінального валіну в кожному ß-ланцюзі. Це особливо важливо, оскільки його концентрація в крові збільшується у хворих з недостатньо компенсованим цукровим діабетом (див. Розділ 19).
Реакції гемоглобіну
Гемоглобін зв’язує O2 з утворенням оксигемоглобіну; O2 приєднується до Fе2+-гему. Спорідненість гемоглобіну до O2 залежить від pH, температури і концентрації в еритроцитах 2,3-дифосфогліцерату (2,3-ДФГ). 2,3-ДФГ і Н+ конкурують з O2 за зв’язування з деоксигенованим гемоглобіном, змінюючи положення чотирьох пептидних ланцюгів (четвертинна структура). Детально реакції оксигенації і деоксигенації гемоглобіну та їхня фізіологічна роль описані в Розділі 35.
Під час дії на кров різноманітних ліків та інших окисників за умов in vivo та in vitro двовалентне залізо (Fe2+), яке в нормі міститься в молекулі, перетворюється на тривалентне (Fe3+), приводячи до утворення метгемоглобіну. Метгемоглобін має темне забарвлення і за наявності у великій кількості в системному кровообігу зумовлює відповідне забарвлення шкіри, яке нагадує ціаноз (див. Розділ 37). Незначне окиснення гемоглобіну до метгемоглобіну незначно відбувається і в нормі, однак за допомогою системи ензимів у еритроцитах, системи НАДН-метгемоглобінредуктази, метгемоглобін знову перетворюється на гемоглобін. Вроджена відсутність цієї системи є однією з причин спадкової метгемоглобінемії.
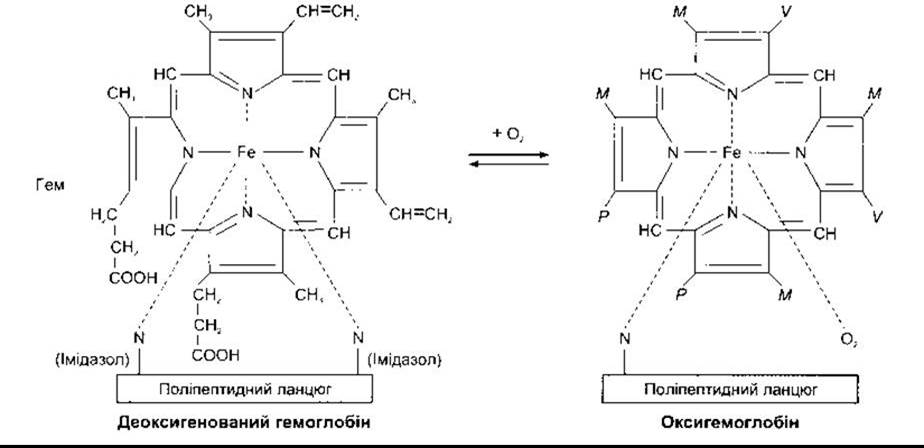
Рис. 27-18. Реакція взаємодії гему з O2. Абревіатура М, V та Р відповідає хімічним групам на рисунку ліворуч.
Монооксид вуглецю взаємодіє з гемоглобіном з утворенням карбоксигемоглобіну. Спорідненість гемоглобіну до O2 значно нижча, ніж до монооксиду вуглецю, тому монооксид вуглецю витісняє O2 з гемоглобіну, зменшуючи кисеньзв’язувальну здатність крові (див. Розділ 37).
Гем також є в складі міоглобіну, кисеньзв’язувального пігменту, що міститься у червоних (повільних) м’язах (див. Розділ 35) і в складі ензиму дихального ланцюга, цитохрому с (див. Розділ 17). Порфірини, відмінні від тих, що містяться в складі гему, відіграють роль у патогенезі деяких метаболічних захворювань (вроджена і набута порфірія тощо).
Гемоглобін плоду
У нормі в крові плоду людини міститься фетальний гемоглобін (гемоглобін F (від англ. fetus - плід)). За будовою він подібний до гемоглобіну А, однак замість ß-ланцюгів має у-ланцюги; гемоглобін F позначають а2у2. Гамма-ланцюги також містять 146 амінокислотних залишків, однак 37 з них відмінні від тих, що є в складі ß-ланцюгів. У нормі після народження фетальний гемоглобін заміщується гемоглобіном дорослих (рис. 27-19). У деяких людей фетальний гемоглобін не зникає і є в крові протягом усього життя. В організмі за заданого РO2 вміст O2 у фетальному гемоглобіні вищий, ніж у гемоглобіні дорослих, тому що він менше зв’язується з 2,3-ДФГ. Це полегшує транспортування О2 з материнського кровообігу у кровообіг плоду (див. Розділ 32). На ранніх етапах ембріонального розвитку, крім цього, виявляють і ε-ланцюги, які утворюють гемоглобін Gower-1 (ζ2ε2) та гемоглобін Gower-2 (а2ε2). На людській 16-й хромосомі є дві копії гена а-глобіну. Крім того, на 11-й хромосомі міститься тандем п’яти генів глобіну, які кодують ß-, у- та δ-ланцюги глобіну і два ланцюги, що в нормі виявляються лише протягом фетального періоду. Вважають, що перехід від однієї форми гемо
глобіну до іншої в період розвитку регульований ділянкою локусного контролю (LCR - від англ. locus control region) ДНК людського гена для ε-гемоглобіну. Однак детально цей процес переходу ще не вивчений.
Порушення продукування гемоглобіну
Амінокислотна послідовність поліпептидних ланцюгів гемоглобіну визначена генами глобіну.
Є два головні типи спадкових порушень продукування гемоглобіну у людей: гемоглобінопатії, за яких утворюються змінені поліпептидні ланцюги, і таласемії та споріднені порушення, за яких нормальні ланцюги утворюються в недостатній кількості або взагалі не утворюються внаслідок дефекту регуляторної ділянки генів глобіну. Таласеміям a- і ß-типу властива зменшена кількість або відсутність a- і ß-поліпептидів, відповідно.
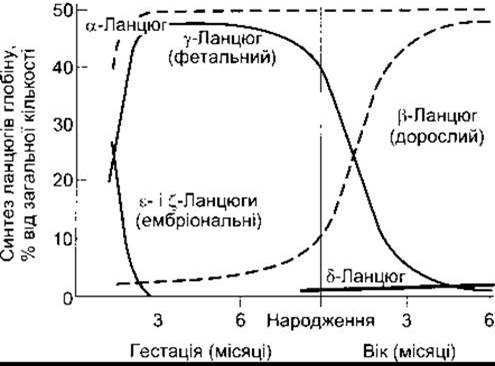
Рис. 27-19. Розвиток ланцюгів гемоглобіну в людини
Мутантні гени, які продукують аномальні гемоглобіни, досить поширені. У людей описано багато форм аномальних гемоглобінів. Зазвичай, ці форми позначають літерою: гемоглобін С, Е, I, J, S і т.д. У більшості випадків гемоглобіни відрізняються від нормального гемоглобіну А за будовою поліпептидних ланцюгів. Наприклад, у гемоглобіні S а-ланцюги нормальні, однак ß-ланцюги змінені, оскільки із 146 амінокислотних залишків у кожному ß-пол і пептидному ланцюзі один залишок глутамінової кислоти заміщений залишком валіну (табл. 27-7).
Якщо аномальний ген, успадкований від одного з батьків, спричинює утворення аномального гемоглобіну, тобто коли людина є гетерозиготною, то половина гемоглобіну, що циркулює, аномальна, інша - нормальна. Якщо ідентичні аномальні гени успадковані від обох батьків, тобто людина є гомозиготною, то весь гемоглобін аномальний. Теоретично людина може успадкувати два різні аномальні гемоглобіни, один від батька, інший від матері. Вивчення особливостей успадкування і географічного розподілу аномальних гемоглобінів дає змогу в деяких випадках з’ясувати, де виник мутантний ген і приблизно наскільки давно відбулася мутація. Загалом особи з мутаціями, що небезпечні для життя, вмирають, однак мутантні гени, за яких людина виживає, зберігаються і поширюються в популяції.
Багато аномальних гемоглобінів незагрозливі. Проте деякі порушують процес з’єднання О2, інші спричинюють анемію. Наприклад, гемоглобін S полімеризується в разі низької напруженості О2. Це призводить до того, що еритроцити набувають форми серпа, гемолізуються, утворюють агрегати, що закупорюють кровоносні судини. Унаслідок цього розвивається важка гемолітична анемія, відома як серпоподібноклітинна анемія. У гетерезиготних осіб прояви цієї анемії ледь помітні, у гомозиготних хвороба виявляється повністю.
Ген серпоподібних клітин - це приклад гена, який зберігається і поширюється в популяції. Він виник серед чорного населення Африки і зумовлює резистентність до однієї з форм малярії. Це важлива позитивна особливість в Африці, у деяких регіонах Африки гетерозиготну форму серпоподібноклітинної анемії має 40% населення. Серед чорного населення Сполучених Штатів Америки захворюваність становить 10%.
Гемоглобін F здатний зменшувати полімеризацію деоксигенованого гемоглобіну S. Гідроксисечовина зумовлює продукування гемоглобіну F і в дітей, і в дорослих. Доведено, що ця речовина ефективна для лікування серпоподібноклітинної анемії. У хворих з важкою формою серпоподібноклітинної анемії позитивні результати простежуються після трансплантації кісткового мозку, однак цей метод лікування потребує подальшого вивчення.
Синтез гемоглобіну
У нормі вміст гемоглобіну в крові становить у середньому 16 г/дл у чоловіків і 14 г/дл у жінок (весь міститься в еритроцитах). В організмі чоловіка масою 70 кг міститься близько 900 г гемоглобіну; 0,3 г гемоглобіну руйнується і 0,3 г синтезується протягом кожної години (див. рис. 27- 19). Гемічна частина гемоглобіну синтезується з гліцину і сукциніл-КоА.
Катаболізм гемоглобіну
Коли відбувається руйнування старих еритроцитів системою тканинних макрофагів, глобін відщеплюється, а гем перетворюється на білівердин. У цьому процесі бере участь ензим гемоксигеназа (див. рис. 4-29), і утворюється СО, який може відігравати роль внутрішньоклітинного месенджера подібно до NО (див. Розділ 4).
У людей основна частина білівердину перетворюється на білірубін (рис. 27-20) і виділяється у жовч (див. Розділ 26). Залізо гему повторно використовується для синтезування гемоглобіну.
Унаслідок дії на шкіру білого світла відбувається перетворення білірубіну на люмірубін, який має коротший період півжиття порівняно з білірубіном. Фототерапія (дія світла) дає позитивний результат у лікуванні жовтяниці новонароджених з гемолізом. Обов’язковим фактором у процесі синтезування гемоглобіну є залізо. Якщо організм втрачає залізо і його дефіцит не компенсований, то розвивається залізодефіцитна анемія. Обмін заліза описано в Розділі 25.
Таблиця 27-7. Частковий склад нормальних ß-ланцюгів людини і ß-ланцюгів деяких аномальних гемоглобінів1

1 Інші гемоглобіни містять змінені а-ланцюги. Аномальні гемоглобіни, які ведуть себе подібно до нормальних у разі елекрофорезу, однак дещо відрізняються за складом, позначають тією ж літерою; а за допомогою індекса зазначають місцевість, де вони вперше виявлені, звідси MSaskatoon та MUllwaukee,
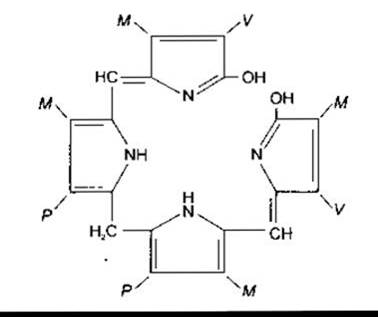
Рис. 27-20. Білірубін. Абревіатура М, V та Р відповідає хімічним групам, позначеним на рис. 27-18 ліворуч.