Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Природа серцевого скорочення й електричної активності серця
Зміни ЕКГ у разі інших серцевих і системних захворювань
Інфаркт міокарда
Унаслідок порушення кровопостачання ділянок міокарда в ньому розвиваються глибокі зміни, які ведуть до незворотних уражень і загибелі м’язових клітин (інфаркт міокарда; див. Розділ 32). ЕКГ використовують для діагностування і визначення локалізації інфаркту. Зміни ЕКГ та їхні механізми є складними, тому ми описуємо їх лише коротко.
Три головні види порушень, які спричинюють електрокардіографічні зміни в разі гострого інфаркту міокарда, наведено в табл. 28-3. Спочатку це надзвичайно швидка реполяризація м’язових волокон у зоні інфаркту внаслідок прискореного відкривання К+-каналів; в експериментах розвивається протягом секунд після оклюзії коронарної артерії у лабораторних тварин. Ці зміни тривають лише декілька хвилин, і до їхнього зникнення потенціал спокою волокон у зоні інфаркту зменшується внаслідок втрати внутрішньоклітинних йонів К+. Приблизно через 30 хв у волокнах в зоні інфаркту деполяризація починає відбуватися повільніше, ніж у навколишніх нормальних волокнах.
Усі три види порушень зумовлюють струми, які спричинюють підіймання сегмента ST на ЕКГ у відведеннях, за яких електроди розміщені над зоною ураження (рис. 28- 19). Унаслідок швидкої реполяризації в зоні інфаркту мембранний потенціал у ній є більшим, ніж у нормальних ділянках протягом останнього періоду реполяризації. Тому нормальні ділянки стають негативно зарядженими щодо зони інфаркту. Отже, позаклітинний струм спрямований із зони інфаркту до нормальної ділянки (оскільки відомо, що струм спрямований від позитивного заряду до негативного). Цей струм тече до електродів над зоною ураження, спричинюючи позитивне зміщення на ЕКГ між зубцями S і Т. Сповільнення деполяризації в уражених клітинах теж призводить до того, що зона інфаркту стає позитивно зарядженою щодо нормальної тканини (див. табл. 28-3) протягом першого етапу реполяризації. Внаслідок цього простежується підвищення сегмента ST. Зменшення потенціалу спокою під час діастоли спричинює струм, спрямований у зону інфаркту протягом діастоли шлуночків. Наслідком цього є зниження сегмента QT на ЕКГ. Однак завдяки особливостям записування ЕКГ зниження сегмента QT відображається у вигляді підіймання інтервалу ST. Отже, головна ознака гострого інфаркту міокарда - підіймання сегмента ST у відведеннях над зоною інфаркту (див. рис. 29-19). У відведеннях з протилежного боку серця виявляють зниження сегмента ST.
Таблиця 28-3. Три головні види порушень поляризації мембрани у разі гострого інфаркту міокарда
Дефект ушкодженої клітини |
Струм |
Зміни ЕКГ у відведеннях надзоною інфаркту |
Прискорена реполяризація |
Із зони інфаркту |
Підвищення сегмента ST |
Зменшення мембранного потенціалу спокою |
До зони інфаркту |
Депресія сегмента QT (виявляється підвищенням сегмента ST) |
Сповільнена реполяризація |
Із зони інфаркту |
Підвищення сегмента ST |
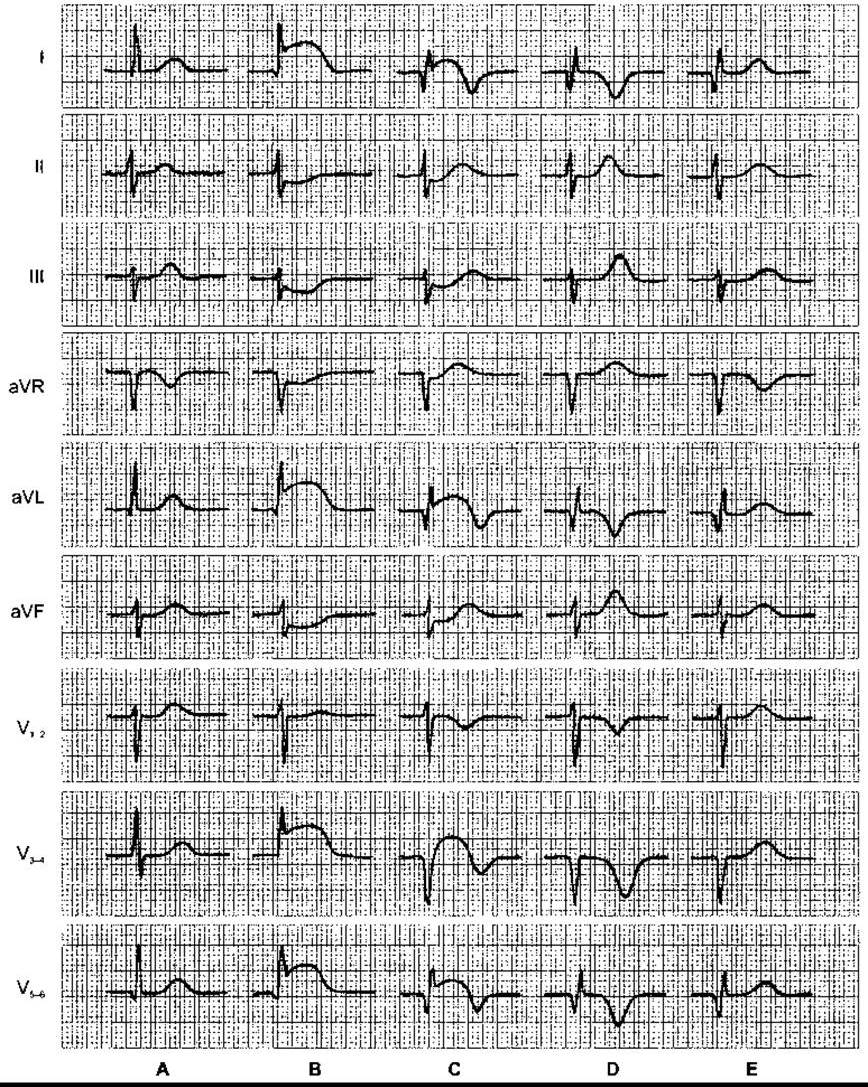
Рис. 28-19. Серія ЕКГ у випадку інфаркту передньої стінки. А: нормальна ЕКГ. В: ЕКГ у перші години після інфаркту: підвищення сегмента ST у I, aVL та V3-6; реципрокна депресія ST у ІІ, III та aVF. С: ЕКГ через багато годин або декілька днів: зубець Q з’являється в I, aVL та V5-6, комплекси QS - у V3-4. Це означає, що трансмуральний інфаркт локалізований у ділянці, яка відповідає V3-4. Зміни сегмента ST є, однак менше виражені. Починається інверсія зубця Т у відведеннях, де є підвищення сегмента ST. D: ЕКГ через багато днів або декілька тижнів: наявні зубці Q та комплекси QS, сегмент ST на ізоелектричній лінії. Виявляється симетричність і глибока інверсія зубця Т у відведеннях, у яких було підвищення ST; зубець Т високий у відведеннях, у яких була депресія ST. Ці зміни можуть простежуватися до кінця життя хворого. Е: ЕКГ через місяці або роки після інфаркту. Наявні патологічний зубець Q і комплекс QS. Зубець Т поступово нормалізується (відтворено за дозволом з Goldschlager N, Goldman MJ: Principles of Clinical Electrocardiography, 13th ed. McGraw-Hill, 1989).
Через декілька днів або тижнів зміни сегмента ST зменшуються. Некротизований м’яз та рубцева тканина стають електрично неактивними. Отже, зона інфаркту стає негативно зарядженою щодо нормального міокарда протягом систоли і тому не спричинює позитивного зміщення комплексів ЕКГ. Прояви цієї негативності є численними і складними. Головні зміни - поява зубця Q у відведеннях, у яких він раніше не виявлявся, і збільшення розмірів зубця Q у відведеннях, у яких він був у нормі. Однак трапляються інфаркти і без змін зубця Q. Цим інфарктам властивий легший перебіг, а, проте, в цьому разі вищий ризик повторного інфаркту. У випадку інфаркту передньої стінки лівого шлуночка нема наростання амплітуди зубця R. У нормі в кожному наступному грудному відведенні з правого боку до лівого зубець R повинен бути більшим, ніж у попередньому. Унаслідок інфаркту перегородки провідна система може бути ушкоджена і, як наслідок, виникає блокада ніжки пучка Гіса або інші блокади серця. Інфаркт міокарда часто ускладнений важкими шлуночковими аритміями із загрозою фібриляції шлуночків і смерті. У лабораторних тварин і, можливо, у людей шлуночкові аритмії виникають протягом трьох періодів. Упродовж перших 30 хв інфаркту найчастіше розвиваються аритмії за механізмом повторного входження. Потім настає порівняно спокійний щодо розвитку аритмій період. Однак через 12 год після інфаркту аритмії виникають унаслідок підвищення автоматизму серця. Аритмії, що розвиваються через три дні або декілька тижнів після інфаркту, здебільшого зумовлені механізмом повторного входження. Зазначимо, що в разі інфаркту з ураженням епікардіальних ділянок міокарда ушкоджені симпатичні нервові волокна. Денервація ділянок за межами інфаркту спричиняє їхню підвищену чутливість до катехоламінів (див. Розділ 4). Навпаки, у випадку ураження ендокарда ушкоджені волокна блукаючого нерва (див. вище), внаслідок чого ефекти симпатичних нервів не можуть бути блоковані парасимпатичним впливом. Таке локальне посилення симпатичної активності може спричиняти аритмії. Є дані про те, що пригнічення проходження імпульсів до серця із лівого зірчастого вузла, який іннервує АВ-вузол, ефективне в лікуванні шлуночкових аритмій і профілактиці раптової смерті після інфаркту міокарда.

Рис. 28-20. Співвідношення між концентрацією К+ у плазмі та ЕКГ (за умови, що рівень Са+ у плазмі нормальний). Наведені записи зроблено у лівих шлуночкових епікардіальних відведеннях (відтворено за дозволом з Goldman MJ: Principles of Clinical Electrocardiography, 12th ed. McGraw-Hill, 1986).
Наслідки змін йонного складу крові
Очевидно, що зміни концентрації йонів Na+ і К+ у ПКР впливають на мембранний потенціал м’язових волокон, оскільки електрична активність серця залежить від розподілу цих йонів щодо мембран. Клінічно зниження рівня Na+ у плазмі може зумовлювати низький вольтаж електрокардіографічних комплексів. Однак зміни концентрації К+ у плазмі можуть спричинити важкі розлади серцевої діяльності. Гіперкаліємія - це загрозливий для життя стан, який призводить до летальних наслідків унаслідок впливу на серце. Збільшення концентрації К+ у плазмі на ЕКГ виявляється передусім високим загостреним зубцем Т, який свідчить про порушення реполяризації (рис. 28-20). За ще більшого рівня К+ розвиваються параліч передсердь і збільшення тривалості комплексу QRS. Інколи можуть виникати шлуночкові аритмії. Зі збільшенням позаклітинної концентрації К+ знижується мембранний потенціал спокою м’язових волокон. Волокна стають незбудливими, і серце зупиняється у діастолі. Навпаки, зниження рівня К+ у плазмі спричиняє збільшення тривалості інтервалу PR, виражений зубець U, деколи пізню інверсію зубця Т у грудних відведеннях. Якщо зубці Т і U зливаються, то тривалість інтервалу QT часто збільшується. Якщо ж зубці Т і U відокремлені, то інтервал QT на ЕКГ має нормальну тривалість. Гіпокаліємію треба розцінювати як небезпечний стан, однак не настільки загрозливий, як гіперкаліємія.
Збільшення позаклітинної концентрації Са2+ зумовлює посилення скоротливості міокарда. У разі введення великої кількості Са2+ лабораторним тваринам їхнє серце менше розслабляється протягом діастоли і зупиняється під час систоли (кальцієвий рігор). Однак у випадках клінічних станів, пов’язаних з гіперкальціємією, концентрація кальцію у плазмі практично не буває настільки високою, щоб це призвело до ураження серця. Гіпокальціємія спричинює збільшення тривалості сегмента ST і внаслідок цього - інтервалу QT. Ці ж зміни виникають під впливом фенотіазинів і трициклічних антидепресантів, а також у разі різноманітних захворювань ЦНС.
Зміни концентрації Са2+ і К+ у плазмі виражено впливають на чутливість серця до наперстянки. Гіперкальціємія посилює токсичність наперстянки, гіперкаліємія її послаблює; Mg2+, який пригнічує міокард, також знижує токсичність наперстянки.