Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Кровообіг в окремих ділянках організму
Кровообіг у вінцевих судинах
Анатомічні особливості
Обидві вінцеві артерії, що постачають кров у міокард, відходять від синусів позаду двох стулок аортального клапана в корені аорти (рис. 32-11). Вихрові потоки тримають клапани на відстані від ділянок відходження артерій, і вони є доступними протягом усього серцевого циклу. У 50% осіб кровоплин є більшим у правій вінцевій артерії, у 20% - у лівій, а в 30% він однаковий в обох судинах. Більша частина венозної крові відтікає до серця через вінцевий синус та передні серцеві вени (рис. 32-12), які дренують у праве передсердя. Крім того, є інші судини, що випорожнюються прямо у камери серця. До цієї групи належать артеріосинусоїдні судини, синусоїдні капіляроподібні судини, що з’єднують артеріоли з камерами, тебезієві вени, що з’єднують капіляри і камери, та декілька артеріолюмінальних судин, які є дрібними артеріями, дренованими прямо у камери. Між вінцевими та позасерцевими артеріолами є декілька анастомозів, особливо біля входу великих артерій. Анастомози між вінцевими артеріями у людини пропускають часточки, діаметр яких до 40 мкм, однак є дані про те, що у хворих з коронарною хворобою ці канали розширюються.
Градієнт тиску та плин крові у вінцевих судинах
У серцевому м’язі, як і в скелетному, під час скорочення відбувається перетискання судин. Тиск у лівому шлуночку є дещо вищим, ніж в аорті під час систоли (табл. 32-4). Отже, плин крові відбувається в артеріях, що постачають субендокардіальні ділянки лівого шлуночка, тільки під час діастоли, хоча у поверхневих ділянках міокарда лівого шлуночка сила досить розсіяна для того, щоб забезпечити проходження крові через цю зону протягом серцевого циклу. Оскільки діастола стає коротшою за вищої частоти серцевих скорочень, то вінцевий кровоплин через ліву вінцеву артерію послаблюється в разі тахікардії. З іншого боку, різниця тиску між аортою та правим шлуночком, а також різниця між аортою та передсердям є дещо більшими під час систоли, ніж під час діастоли. Отже, вінцевий кровоплин у цих частинах серця не буде значно послаблюватись під час систоли. Кровоплин у правій та лівій вінцевих артеріях показаний на рис. 32-13. Відсутність кровоплину у субендокардіальних відділах лівого шлуночка під час систоли спричинює чутливість до ішемічного ушкодження. Ця ділянка найчастіше є місцем розвитку інфаркту міокарда. Приплив крові до лівого шлуночка послаблений у хворих зі стенозом отвору аортального клапана, оскільки в разі цього захворювання тиск у лівому шлуночку для виштовхування крові повинен бути набагато вищим, ніж тиск у аорті. Отже, вінцеві судини є значно стиснутими під час систоли. Хворі на таке захворювання дуже чутливі до розвитку симптомів ішемії міокарда, частково внаслідок цієї компресії, а частково тому, що міокард потребує більше енергії для проштовхування крові через звужений аортальний клапан. Вінцевий кровоплин також послаблений, коли аортальний діастолічний тиск знижується. Підвищення венозного тиску за таких станів, як застійна серцева недостатність, послаблює вінцевий кровоплин, оскільки він зменшує ефективний тиск вінцевої перфузії.
Таблиця 32-4. Тиск в аорті, лівому та правому шлуночках під час ситоли та діастоли
Тиск, мм рт. ст. |
Різниця тиску, мм рт. ст., між аортою і |
||||
Аорта |
ЛШ1 |
ПШ1 |
ЛШ |
ПШ |
|
Систола |
120 |
121 |
25 |
-1 |
95 |
Діастола |
80 |
0 |
0 |
80 |
80 |
1 ЛШ - лівий шлуночок, ПШ - правий шлуночок.
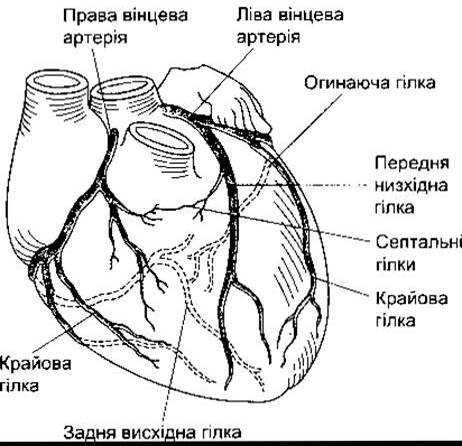
Рис. 32-11. Вінцеві артерії та їхні головні гілки у людини (відтворено за дозволом з Ross G: The cardiovascular system. In: Essentials of Human Physiology. Ross G [editor]. Year Book Medical Publishers, 1978).
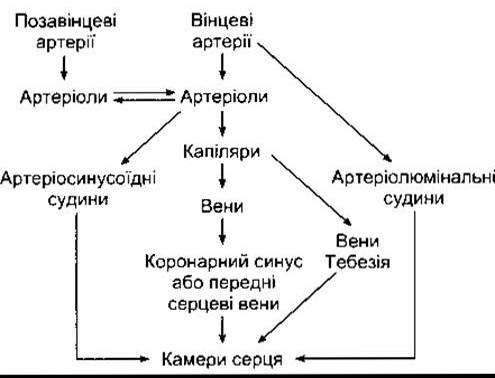
Рис. 32-12. Схема вінцевого кровообігу.
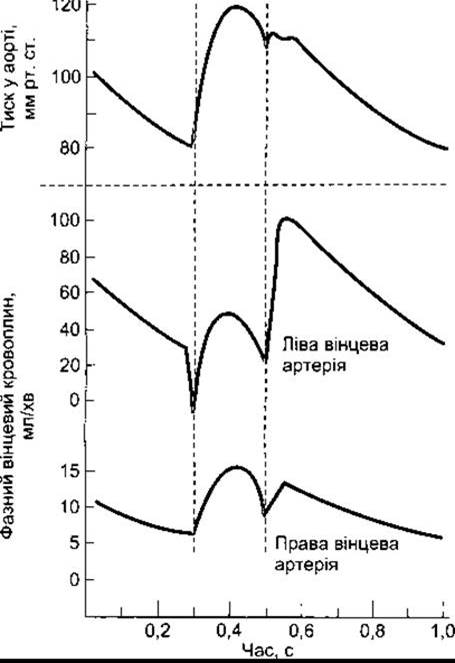
Рис. 32-13. Плин крові у лівій та правій вінцевих артеріях під час різних фаз серцевого циклу. Систола показана між двома штриховими лініями (відтворено за дозволом з Berne RM, Levy MN: Physiology. Mosby, 1983).
Вінцевий кровоплин вимірюють шляхом уведення катетера у вінцевий синус та застосування методу Кеті до серця з урахуванням того, що вміст N2О у вінцевій венозній крові є типовим для всієї крові, що проходить через міокард. У людини в стані спокою він становить 250 мл/хв (5% від серцевого викиду). Різні методи із застосуванням радіонуклідів, радіоактивних міток, які можна виявити детекторами радіації поверх грудної клітки, використовують для вивчення регіонарного кровоплину у серці та для виявлення ділянок ішемії й інфаркту, а також для оцінки функції шлуночків. Такі радіонукліди, як талій 201 (201Тl), потрапляють у серцевий м’яз завдяки Na+-К+-АТФ-азі та врівноважуються з внутрішньоклітинним пулом К+. Протягом перших 10-15 хв внутрішньовенного введення розподіл 201Тl прямо пропорційний до кровоплину в міокарді, і ділянки ішемії можна виявити завдяки їхньому низькому поглинанню. Поглинання ізотопу часто визначають одразу після навантаження і через декілька годин після нього для того, щоб виявити ділянки, де напруження спричинило найвираженіші зміни кровоплину. На відміну від цього, радіофармацевтичні сполуки, такі як олов’яний пірофосфат технеціуму 99m (99mТс-РУР), селективно поглинаються у зоні інфаркту завдяки незрозумілим механізмам і дають змогу виявляти інфаркт як «гарячі плями» на сцинтіосканограмах грудної клітки. Вінцеву ангіографію можна комбінувати з вимірюванням вимивання 133Хе (див. вище) для детального аналізу вінцевого кровоплину. Радіонепроникний контраст спочатку вводять у вінцеві артерії, після чого застосовують рентгенівське опромінення для виявлення його розподілу. Ангіографічну камеру можна заміняти багатокристалічною сцинтиляційною камерою для подальшого вимірювання вимивання 133Хе. Приклад нормального розподілу крові після введення сполуки у ліву вінцеву артерію показано на рис. 32-14.
Варіанти вінцевого кровоплину
У стані спокою серце споживає 70-80% кисню з кожної одиниці крові, що надходить (див. табл. 32-1). Значно підвищити споживання кисню можна тільки у разі збільшення кровоплину. Тому не дивно, що плин крові посилюється з підвищенням рівня метаболізму в міокарді. Розмір просвіту вінцевих судин та залежний від нього вінцевий кровоплин пов’язані не тільки зі змінами тиску в аорті, а й з хімічними та нервовими факторами. Крім того, вінцевий плин крові значно зумовлений авторегулюванням.
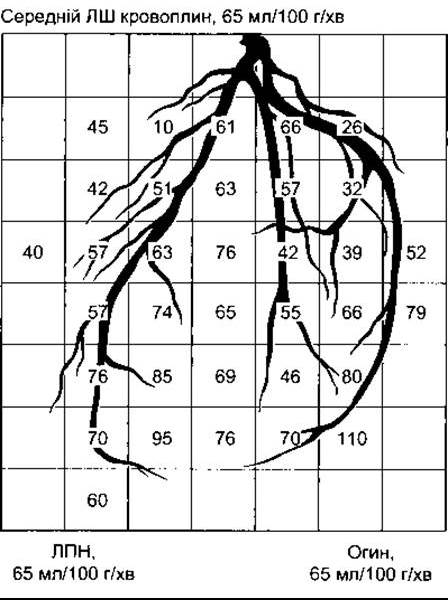
Рис. 32-14. Схема нормальної перфузії міокарда людини після ін’єкції 133Хе у ліву головну вінцеву артерію. Гілки артерії показані кольором, а їхня кількість та площа відповідають показникам кровоплину (мл/100 г/хв) у ділянках під кожним сцинтиляційним детектором; Огин - гілка, що огинає; ЛПН - ліва передня низхідна артерія; ЛШ - лівий шлуночок (відтворено за дозволом з Cannon PJ, et al: Evaluation of myocardial circulation with radionuclides. Cardiovasc Med 1978;2:371).
Хімічні фактори
Тісний взаємозв’язок між вінцевим плином крові та споживанням O2 у міокарді свідчить про те, що один або декілька продуктів метаболізму спричинює вінцеву вазодилатацію. Факторами, які, ймовірно, причетні до цього, є недостатність O2, підвищена локальна концентрація СO2, H+, К+, лактату, простагландинів, аденінових нуклеотидів та аденозину Можуть бути задіяні декілька вазодилататорних метаболітів. Асфіксія, гіпоксія та внутрішньовінцеві введення ціанідів посилюють вінцевий кровоплин на 200-300% як у денервованому, так і в інтактному серці. Для всіх трьох станів спільним є наявність гіпоксії волокон серцевого м’яза. Подібне посилення плину крові простежується у ділянці міокарда, де просвіт відповідної вінцевої артерії був спочатку обтурований, а потім вивільнений. Ця реактивна гіперемія нагадує процес у шкірі (див. далі). Вважають, що у серці це пов’язано із вивільненням аденозину. Аденозин додатково з’являється для поліпшення у разі ушкодження, зумовленого відновленням кровоплину (див. Розділ 33).
Нервові фактори
Вінцеві артеріоли містять а-адренергічні рецептори, які зумовлюють вазоконстрикцію, та ß-адренергічні рецептори, які забезпечують вазодилатацію. Активування норадренергічних нервів серця та введення норадреналіну спричинює вінцеву вазодилатацію. Однак норадреналін підвищує частоту та силу серцевих скорочень, а вазодилатація розвивається вторинно завдяки утворенню вазодилататорних метаболітів у міокарді у відповідь на посилення їхньої активності. Після того, як іно- та хронотропний ефекти внаслідок імпульсації у норадренергічних нервах блоковані ß-адренергічними блокаторами, стимулювання норадренергічних нервів або введення норадреналіну у неанестезованих тварин зумовлює вінцеву вазоконстрикцію. Отже, прямим ефектом норадренергічного стимулювання є швидше спазм, ніж розширення вінцевих судин. Подразнення волокон блукаючого нерва призводить до розширення вінцевих судин.
Зі зниженням системного тиску крові загальним ефектом від рефлекторного посилення імпульсації у норадренергічних синапсах буде посилення вінцевого кровоплину внаслідок метаболічних змін у міокарді тоді, коли судини шкіри, нирок та внутрішніх органів скорочуються. Отже, кровообіг у серці, подібно до мозку, підтримується, тоді як в інших органах він послаблюється.
Захворювання вінцевих артерій
З послабленням плину крові через вінцеві артерії до рівня, коли в міокарді розвивається гіпоксія, нагромаджується P-фактор та розвивається стенокардія (див. Розділ 7). Якщо ішемія міокарда виражена і тривала, то у серцевому м’язі настають незворотні зміни і внаслідок цього - інфаркт міокарда. Інфаркт міокарда є частою причиною смерті, особливо у розвинених країнах, з огляду на атеросклероз та гіперхолестеролемію. Ці взаємозв’язки описано у Розділі 17. Причиною стенокардії звичайно є закупорення щонайменше 75% просвіту вінцевої артерії. Кровоплин у стані спокою нормальний, однак рівень, до якого він може посилитись під час навантаження, обмежений. Якщо ж стеноз досягає 85%, то простежується також зниження тиску крові у стані спокою і схильність до тромбоутворення в ділянці звуження. У разі тромбозу виникають такі процеси: - спазм вінцевих артерій, транзиторна агрегація тромбоцитів у ділянці склерозу судини, а також розрив або геморагія в атеросклеротичну бляшку. Важливо зазначити, що введення ацетилхоліну спричинює швидше констрикцію, ніж дилатацію у ділянках стенозу вінцевих артерій, оскільки ушкодження ендотелію у стенозованих ділянках запобігає утворенню NO, і простежується прямий констрикторний ефект ацетилхоліну на гладкі м’язи судин.
Крім високого рівня холестеролу у крові, фіксують позитивну кореляцію між атеросклерозом вінцевих артерій та рівнем циркулювального ліпопротеїну (a) (Lp(a)). Ліпопротеїн Lp(a) впливає на фібриноліз, пригнічуючи утворення плазміну (див. Розділ 27). Виявлено також чіткі корелятивні зв’язки з рівнем гомоцистеїну, що циркулює у крові. Ця сполука ушкоджує ендотеліальні клітини. Вона перетворюється у нетоксичний метіонін за наявності фолату та вітаміну В12. Сьогодні тривають клінічні дослідження з виявлення впливу забезпеченості фолатами та вітаміном В12 на частоту коронарної хвороби.
Останнім часом значну увагу приділяють можливій ролі запального компонента у розвитку атеросклерозу. У ділянках атеросклеротичних змін міститься запальний інфільтрат і простежується цікава кореляція між антитілами, що циркулюють у крові, до Chlamidia pneumonia та атеросклеротичних бляшок. Названий мікроорганізм містить у складі плазматичної мембрани амінокислоти, послідовність яких нагадує послідовність в а-міозинових тяжких ланцюгах серця. Введення цих послідовностей спричинює автоімунне запалення та фіброз вінцевих артерій у мишей, приклад молекулярної мімікрії (див. Розділ 27).
Електричні зміни, що виникають у разі ішемії чи інфаркту міокарда, та відповідні ознаки, які фіксують під час ЕКГ, розглянуто у Розділі 28. Ішемізовані клітини, перш ніж загинути, припиняють скорочення, і це припинення має» гомеостатичний ефект - незворотні зміни виникають пізніше. Причина втрати скоротливої активності не зрозуміла. У собак, у яких кровоплин до ділянки міокарда був припинений, через 20 хв починався некроз, однак він був незавершеним через 3-6 год.
З ушкоджених клітин у кровообіг виділяються ензими. Визначення підвищеної кількості ензимів та ізоензимів, що їх виводять клітини в разі інфаркту міокарда, відіграють важливу роль у діагностиці цього захворювання. До ензимів, які найчастіше визначають сьогодні, належать MB ізомер креатинкінази (CK-МВ), тропонін Т та тропонін І.
Нітрати, наприклад нітрогліцерин, часто допомагають припинити біль у випадку стенокардії. Ці сполуки приводять до утворення NO та розширюють нормальні артеріальні судини. Як зазначено вище, виділення NO порушується внаслідок атеросклеротичних змін судин. Однак головним ефектом нітратів є розширення периферійних ємнісних судин і, як наслідок, зменшене повернення венозної крові до серця. Це зменшує об’єм серцевого викиду, внаслідок чого зменшується споживання O2 міокардом.
Окремі ділянки звуження вінцевих артерій виявляють у разі артеріографії, їхню роль у порушеннях плину крові можна послабити завдяки імплантації трансплантата (аортокоронарне шунтування). Ця процедура часто приводить до стійкого припинення стабільної стенокардії. Останні дослідження свідчать, що така реваскуляризація поліпшує виживання клітин, частково шляхом відновлення скорочень у нефункційному міокарді. Такий термін використовують для опису ділянок міокарда з хронічними ішемічними змінами, які не є мертвими, проте не скорочуються нормально, доки кровоплин не відновлений. Ці зміни треба відрізняти від міокардіального приголомшення - короткочасної транзиторної постішемічної міокардіальної дисфункції за нормального плину крові.
Під час лікування інфаркту міокарда головний акцент сьогодні роблять на припиненні обструкції та/або лізисі тромбу якомога швидше після початку болю для того, щоб забезпечити реперфузію та запобігти незворотним змінам. За однією із методик уводять катетер в уражену артерію, де його використовують для розширення в ділянці констрикції та формування тромбу (вінцева ангіопластика). Однак цей метод має високу частоту повторних оклюзій у віддалені терміни (понад 30% протягом року), що пов’язано зі схильністю до утворення тромбу та гіперплазією гладких м’язів у ділянці ушкодження ендотелію.
Іншим шляхом є лізис внутрішньовінцевого тромбу внаслідок внутрішньовенного або внутрішньовінцевого введення сполук, що продукують плазмін (див. Розділ 27). Один із препаратів, який часто застосовують, - стрептокіназа, білок із гемолітичного стрептокока, що перетворює плазміноген у плазмін (див. Розділ 27). Інший літичний фактор, що перетворює плазміноген у плазмін у тромбі, - активатор плазміногена тканинного типу (t-PA), природна протеаза, яку виробляють для використання у медицині методами рекомбінантної ДНК. Перевага t-PA в тому, що він переважно активує плазміноген, зв’язаний із фібрином і, отже, спричинює фібринолізис у тромбі й обмежує активування плазміногена в інших ділянках тіла. Однак все ще нез’ясовано чи t-PA є ефективнішим, ніж стрептокіназа, крім того, стрептокіназа значно дешевша. В будь-якому випадку, якщо в разі розвитку інфаркту міокарда літичний препарат уведено протягом перших декількох годин після початку больового приступу, то вінцева перфузія може бути поліпшена у більшості хворих. У решти стан підтримують уведенням антитромботичних та інших препаратів.