Фізіологія людини - Вільям Ф. Ґанонґ 2002
Кровообіг
Серцево-судинний гомеостаз у нормі та в разі патології
Шок
Загальні положення
Шок - це синдром, щодо якого завжди було багато суперечностей. Частково труднощі пов’язані з неадекватним використанням терміна фізіологами та в клініках, а особливо неспеціалістами. Наприклад, електричний та спінальний шок маг мало спільного зі станом, що виникає під час кровотечі та пов’язаних з нею серцево-судинних розладів. У вузькому розумінні гемодинамічний шок тлумачать як сукупність різних станів, що мають певні спільні риси. Найтиповішою ознакою для всіх станів є неадекватна тканинна перфузія з порівняно або абсолютно недостатнім хвилинним об’ємом. Хвилинний об’єм крові може бути неадекватним, якщо кількість рідини у судинній системі недостатня для заповнення цієї системи (гіповолемічний шок). Крім того, можлива відносна недостатність хвилинного об’єму, зумовлена збільшенням об’єму судинної системи внаслідок вазодилатації, навіть за нормального об’єму крові (шок перерозподілу, вазогенний, або шок низького опору). Причиною шоку може бути неадекватна нагнітальна функція серця, пов’язана з ураженням міокарда (кардіогенний шок), а також з недостатнім хвилинним об’ємом крові внаслідок обструкції кровотоку у легенях та серці (обструктивний шок). Ці форми шоку та приклади захворювань, що можуть їх спричинити, наведені у табл. 33-3.
Гіповолемічний шок
Гіповолемічний шок називають також «холодним шоком». Його ознаки: гіпотензія, швидкий ниткоподібний пульс, холодна, бліда, липка шкіра, виражена спрага, прискорене дихання, втомлюваність або, навпаки, заціпеніння. Проте жодна з наведених ознак не є обов’язковою. Гіпотензія може бути відносною. Наприклад, у хворого з гіпертензією і звичайними показниками артеріального тиску 240/140 виражений шок може бути при тиску 120/90.
Гіповолемічний шок часто поділяють на декілька видів відповідно до причини. Наприклад, використання термінів геморагічний, травматичний, хірургічний, опіковий шок доцільне, оскільки, незважаючи на подібність загальної картини, є важливі риси, специфічні для окремих видів.
Геморагічний шок
Детальніше розглянемо процеси в разі геморагії, оскільки вони відображають ознаки, спільні для всіх видів гіповолемічного шоку, та множинні компенсаторні реакції, що розвиваються для підтримання об’єму ПКР. Головні реакції наведені у табл. 33-4.
Зменшення об’єму крові, спричинене кровотечею, послаблює венозне повернення крові та зумовлює зменшення хвилинного об’єму крові. У випадку помірної кровотечі (5-15 мл/кг маси тіла) знижується пульсовий тиск, а середній артеріальний тиск може бути нормальним. Зміни тиску дуже індивідуальні навіть за однакової крововтрати. Шкіра холодна та бліда, може мати сірий відтінок з огляду на капілярний стаз та незначний ціаноз. Дихання стає швидким, а у хворих, що не втратили свідомості, буває виражена спрага.
У випадку гіповолемічного та інших форм шоку недостатня перфузія тканин призводить до підвищеного анаеробного гліколізу з утворенням значної кількості молочної кислоти. У виражених випадках рівень лактату крові збільшується до 9 ммоль/л (нормальний - 1 ммоль/л). Унаслідок молочнокислий ацидоз пригнічує міокард, зменшує чутливість периферійних судин до катехоламінів і може бути причиною коми.
Таблиця 33-3. Види шоку і приклади станів та захворювань, що можуть їх спричинити

Таблиця 33-4. Компенсаторні реакції, активовані у разі геморагії

Негайні компенсаторні реакції
Зі зменшенням об’єму крові та венозного повернення артеріальні барорецептори розтягуються менше і посилюється вплив симпатичної іннервації. Навіть якщо середній артеріальний тиск не знижується, то зниження пульсового тиску призводить до зменшення частоти генерації потенціалу дії у барорецепторах артерій, внаслідок чого розвивається рефлекторна тахікардія та вазоконстрикція. Цікаво, що зі збільшенням крововтрати тахікардія переходить у брадикардію. Це простежується, доки шок є ще оборотним (див. внизу). З продовженням кровотечі частота серцевих скорочень збільшується. Брадикардія переважно пов’язана з демаскуванням депресорного рефлексу, зумовленого впливом блукаючого нерва. Цю реакцію можна використати як механізм припинення наступної крововтрати.
Вазоконстрикція є генералізованою, у ній не задіяні лише судини мозку та серця. Вазоконстрикторна іннервація мозкових артеріол, ймовірно, незначна з функційного погляду, а вінцеві судини є розширеними внаслідок підвищеного рівня метаболізму у міокарді, відповідно, зумовленого збільшеною частотою серцевих скорочень (див. Розділ 32). Вазоконстрикція найбільше виражена у шкірі, де вона зумовлює відчуття прохолоди та блідість, у нирках та внутрішніх органах.
Кровотеча також спричинює поширену веноконстрикцію - венозний ефект, що допомагає підтримувати тиск наповнення серця кров’ю, хоча рецептори, що зумовлюють веноконстрикцію, ще не виявлені. Виражений спазм судин у внутрішніх органах призводить до перерозподілу крові з вісцеральних резервуарів у системний кровоплин. Переміщення крові відбувається також з підшкірних ділянок та легеневих вен. Скорочення селезінки дає змогу виділити у кровообіг «депоновану» кров, хоча об’єм крові, мобілізованої цим шляхом у людини, незначний.
У нирках простежується спазм як аферентних, так і еферентних артеріол, однак еферентні судини скорочуються більше. Рівень клубочкової фільтрації знижений, проте плин плазми зменшений ще більше, тому фільтрувальна фракція (рівень клубочкової фільтрації, поділений на нирковий плин плазми) збільшується; можливе шунтування крові через мозковий шар нирки в обхід кіркових клубочків; утворюється дуже мало сечі; вираженою є затримка Na+, а також затримка азотовмісних продуктів метаболізму у крові (азотемія або уремія). У випадках, коли гіпотензія тривала, можливе значне ушкодження канальців (гостра ниркова недостатність).
Крововтрата є потенційним подразником для секреторної активності кори надниркових залоз (див. Розділ 20). Циркулювання адреналіну теж посилюється, завдяки частішій імпульсації у симпатичних норадренергічних нейронах. Збільшений вміст катехоламінів у крові порівняно мало впливає на генералізовану вазоконстрикцію, однак він може призвести до стимулювання ретикулярної формації (див. Розділ 11). Можливо, тому частина хворих з геморагічним шоком є неспокійними та стурбованими. Інші тихі та апатичні, а їхня свідомість затьмарена, ймовірно, внаслідок церебральної ішемії та ацидозу. За неспокою посилена моторна активність, а посилені дихальні рухи збільшують м’язове та грудне нагнітання венозної крові.
Втрата еритроцитів зменшує можливості постачання кров’ю О2, кровоплин у каротидних та аортальних тільцях також зменшується. Анемія та застійна гіпоксія (див. Розділ 37), як і ацидоз, призводять до стимулювання хеморецепторів. Посилена активність хеморецепторів є, ймовірно, головною причиною стимулювання дихання в разі шоку. Активування хеморецепторів призводить до збудження вазомоторних центрів у стовбурі мозку, посилюючи вазоконстрикторний ефект. Справді, в собак, у яких після кровотечі артеріальний тиск становив до 70 мм рт. ст., перерізання нервів від каротидних баро- та хеморецепторів частіше спричинює подальше зниження тиску, ніж його підвищення. Ця парадоксальна реакція пов’язана з тим, що за тиску до 70 мм рт. ст. у барорецепторах не відбувається імпульсації, а активність у волокнах, що проходять від каротидних хеморецепторів, передається до вазомоторних центрів дуже слабко на фоні посилюваного пригнічення барорецепторів.
Підвищений рівень ангіотензину II, що циркулює в крові, внаслідок збільшення реніну плазми під час кровотечі, зумовлює спрагу, впливаючи на субфорнікальний орган (див. Розділ 32); споживання рідини допомагає відновити об’єм ПКР. Збільшення кількості ангіотензину II допомагає також підтримувати артеріальний тиск. Зниження тиску крові, зумовлене втратою частини об’єму крові, більше виражене у тварин, яким уведено препарати, що блокують рецептори ангіотензину II, порівняно з контролем. Вазопресин теж спричинює підвищення тиску крові в разі введення великих доз нормальним тваринам, однак уведення доз, що зумовлюють такий же рівень вазопресину у плазмі, що й у випадку геморагії, призводить лише до незначного підвищення тиску крові, оскільки простежується компенсаторне зменшення хвилинного об’єму крові (див. Розділ 31). Водночас у разі уведення після геморагії пептидів з ефектом, протилежним до вазопресину, тиск крові знижується. Отже, виявляється, що вазопресин теж відіграє важливу роль у підтриманні артеріального тиску. Підвищення рівня ангіотензину II та АКТГ у крові, що циркулює, посилює секрецію альдостерону, а збільшення кількості альдостерону та вазопресину зумовлює затримку Na+ та води, що допомагає відновити об’єм крові. Проте ефект альдостерону настає через 30 хв, і первинне зменшення об’єму сечі та виділення Na+ пов’язане переважно з гемодинамічними змінами у нирках.
У разі спазму артеріол та зниження венозного тиску внаслідок зменшення об’єму крові простежується зниження тиску у капілярах. Рідина проникає у капіляри для підтримання об’єму крові, що циркулює. Це призводить до зменшення кількості інтерстиційної рідини, що, відповідно, зумовлює вихід рідини з клітин.
Довготривалі компенсаторні реакції
Після помірної кровотечі об’єм плазми, що циркулює, поновлюється через 12-72 год (рис. 33-7). Фіксують також швидке надходження раніше синтезованих альбумінів із позасудинних запасів, однак більша частина мобілізованої тканинної рідини бідна на білки. Рідина розводить білки плазми та клітини крові, проте у разі втрати цільної крові гематокрит може не зменшуватись протягом декількох годин після початку кротечі. Після першого надходження попередньо синтезованих альбумінів решта втрачених білків плазми відновлюється завдяки синтезу в печінці протягом трьох-чотирьох днів. У крові з’являється еритропоетин, а також збільшується кількість ретикулоцитів, досягаючи максимального рівня на десятий день. Кількість еритроцитів відновлюється до норми протягом чотирьох-восьми тижнів. Низький гематокрит добре зрівноважуваний впливом різноманітних компенсаторних механізмів. Одним з них є збільшення концентрації 2,3-ДФГ в еритроцитах, що поліпшує перехід кисню в тканини з гемоглобіну (див. Розділ 27). У випадку тривалої анемії в попередньо здорових осіб задишка під час напруження не виявляється за концентрації гемоглобіну близько 7,5 г/дл. Слабість стає вираженою за рівня 6 г/дл; задишка в спокої з’являється на рівні 3 г/дл; а серцева слабість розвивається, коли рівень гемоглобіну зменшується до 2 г/дл.
Рефрактерний шок
Відповідно до об’єму крововтрати одні хворі помирають одразу після кровотечі, а інші одужують завдяки компенсаторним механізмам, посиленим за допомогою відповідного лікування, що приводить до поступового відновлення нормального кровообігу. У проміжній групі хворих шок триває протягом годин, поступово прогресуючи у стан, коли організм не реагує на введення вазопресорних препаратів, і за якого навіть у разі відновлення об’єму крові, що циркулює в кровообігу, хвилинний об’єм крові зменшений. Цей стан відомий як рефрактерний шок. Він трапляється не тільки у випадку геморагічного, а й інших видів шоку. Ще його називають необоротним шоком, унаслідок якого хворі вмирають, незважаючи на інтенсивну терапію. Однак щораз більше хворих вдається врятувати, оскільки розуміння патофізіологічних механізмів сприяє поліпшенню лікування. Тому рефрактерний шок, напевно, - відповідніший термін.
Спазм прекапілярних сфінктерів та венул, особливо у внутрішніх органах, є характерною ознакою на цій стадії. Послаблена капілярна перфузія внаслідок констрикції прекапілярних сфінктерів призводить до гіпоксичного ушкодження тканини. Через 3-5 год прекапілярні сфінктери розширюються, тоді як венули є спазмованими. Кров на цьому етапі надходить у капіляри і застоюється у цих судинах, тому тканинна гіпоксія триває. Гідростатичний тиск у капілярах підвищується, і рідина виходить з судинної системи у великій кількості. Гранулоцити адгезують до ушкодженої судинної стінки і виділяють вільні радикали, особливо О2, що спричинює наступне ушкодження тканини. Є дані про те, що антитіла до білкових комплексів, які зв’язують нейтрофіли з тканиною, значно поліпшують виживання в разі тяжкого шоку. Ушкодження слизової шлунково-кишкового тракту зумовлює вихід бактерій у судинне русло.
Різноманітні позитивні механізми зворотного зв’язку відіграють важливу роль у розвитку рефрактерного шоку. Наприклад, значна мозкова ішемія призводить у кінцевому підсумку до пригнічення вазомоторних та серцевих центрів мозку, спричинюючи вазодилатацію та зменшення частоти серцевих скорочень. Обидва процеси сприяють зниженню тиску крові з подальшим зменшенням мозкового кровообігу та депресією вазомоторних і серцевих центрів.
Іншим важливим прикладом цього типу позитивного зворотного зв’язку є депресія міокарда. В разі вираженого шоку вінцевий кровоплин послаблюється внаслідок гіпотензії та тахікардії (див. Розділ 32), навіть незважаючи на розширення вінцевих судин. Недостатність міокарда погіршує перебіг шоку та посилює ацидоз, а це, відповідно, інгібує функції міокарда. Якщо послаблення функцій є значним і тривалим, то ушкодження міокарда може досягти рівня, за якого хвилинний об’єм крові уже не відновити до нормального рівня, незважаючи на заміщення втраченого об’єму крові.
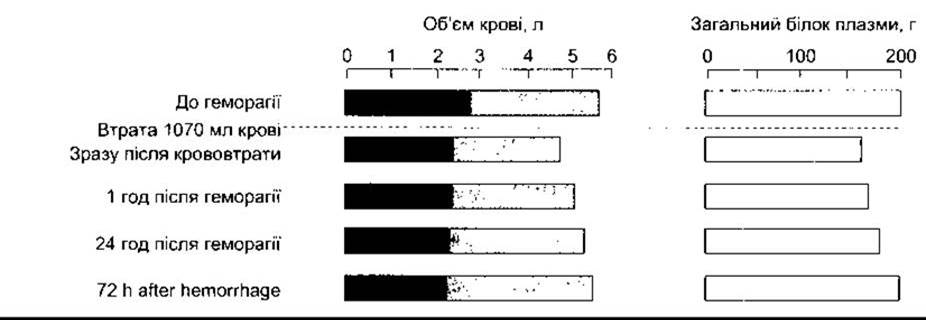
Рис. 33-7. Зміни об’єму еритроцитів (темний колір), плазми (світлий колір) та загального білка плазми після геморагії у нормальної особи.
Пізнім ускладненням шоку, яке може бути смертельним, є ураження легень з розвитком гострого респіраторного дистрес-синдрому (РДС, респіраторний дистрес-синдром дорослих; див. Розділ 37). Цей синдром супроводжується гострою дихальною недостатністю та високою смертністю, і може бути спричинений не тільки шоком, а й сепсисом, ушкодженням легень, іншими травмами й тяжкими станами. Загальною ознакою цього ураження буде ушкодження ендотеліальних клітин капілярів та альвеолярних епітеліальних клітин з виділенням цитокінів.
Інші форми гіповолемічного шоку
Травматичний шок виникає за значного ушкодження м’язів та кістки. Цей тип шоку простежується у жертв бійок та автомобільних катастроф. Значна кровотеча у ділянку ушкодження є головною причиною шоку, хоча деяка кількість плазми теж проникає у тканину. Кількість крові, яка може бути втраченою за порівняно невеликого ушкодження, викликає подив: у м’язах стегна може нагромадитись 1 л екстравазованої крові, наприклад, у разі збільшення діаметра стегна тільки на 1 см.
Руйнування скелетного м’яза (рабдоміоліз) є додатковою проблемою у випадках, коли шок супроводжується вираженим розчавлюванням м’яза (синдром розчавлений). Після того, як тиск на тканини знижується і перфузія відновлюється, генеруються вільні радикали, що призводить до подальшого ушкодження тканини (ушкодження внаслідок реперфузії). Під час ішемії утворюється значна кількість вільних радикалів, оскільки тканинна ксантин- дегідрогеназа перетворюється у ксантиноксидазу і після відновлення плину крові ензим сприяє утворенню О2. Простежується адгезія лейкоцитів до тканинних елементів, а це також сприяє утворенню вільних радикалів. Інгібітор ксантиноксидази алопуринол та антитіла, що запобігають адгезії нейтрофілів, зменшують ушкодження в разі реперфузії. Ще однією причиною ушкодження тканини в ділянках реперфузії є надлишкове внутрішньоклітинне нагромадження Са2+, яке переважно пов’язане з обміном надлишкового внутрішньоклітинного Na+ нa позаклітинний Са2+. За синдрому розчавлення нерідко уражені нирки. Це пов’язано з нагромадженням міоглобіну та інших продуктів метаболізму з ділянок реперфузії у нирках, де гломерулярне фільтрування вже послаблене внаслідок шоку. Продукти метаболізму ушкоджують та закупорюють канальці, спричинюючи анурію, яка може бути фатальною.
Хірургічний шок, як звичайно, є наслідком комбінації зовнішньої кровотечі, крововиливів у внутрішні органи та дегідратації. За опікового шоку найочевиднішими змінами є втрата плазми у вигляді ексудату з ділянок опіку. Оскільки в таких ситуаціях переважно відбувається втрата плазми, а не цілісної крові, то гематокрит збільшується, і просте
жується згущення крові. Опіки зумовлюють також не зовсім зрозумілі метаболічні зміни, що розвиваються додатково до втрати рідини. Наприклад, у 50% зафіксовано підвищення рівня метаболізму, не пов’язане з тиреоїдними змінами, у деяких хворих розвивається гемолітична анемія. З огляду на ці ускладнення, важкість шоку, проблеми сепсису та ушкодження нирок рівень смертності внаслідок опіків третього ступеня (понад 75% тіла) наближається до 100%.
Гіповолемічний шок є ускладненням різних метаболічних та інфекційних захворювань. Наприклад, хоча механізми відрізняються в кожному випадку, недостатність надниркових залоз, діабетичний кетоацидоз та виражена діарея супроводжуються втратою Na+ із крові. Зменшення об’єму плазми крові, що виникає внаслідок цього, може бути визначальним для спричинення серцево-судинного колапсу.
Шок розподілу
Як зазначено вище, шок розподілу виникає, коли об’єм крові нормальний, а ємність судинної системи збільшується внаслідок вираженої дилатації. Його називають також теплим шоком, оскільки шкіра не є холодною та липкою, як у разі гіповолемічного шоку. Прикладом є анафілактичний шок - виражена алергічна реакція, що дуже швидко розвивається й іноді виникає у випадках повторного введення антигену особам, що були попередньо сенсибілізовані до нього. Реакція антиген-антитіло, що виникає внаслідок цього, супроводжується виділенням значної кількості гістаміну, зумовлюючи збільшення проникності капілярів та поширення дилатації артеріол і капілярів.
Іншою частою формою шоку розподілу є септичний шок. У цьому випадку бактерійні токсини спричинюють вазодилатацію. Крім того, простежується депресія міокарда і збільшується проникність капілярів, унаслідок чого плазма проникає у тканини, і об’єм крові зменшується. З огляду на це септичний шок є одночасно кардіогенним, гіповолемічним та шоком розподілу.
У хворих з підвищеною температурою перебіг шоку важчий, оскільки кровоносні судини шкіри часто розширені (див Розділ 32), що збільшує невідповідність між ємністю судинної системи та об’ємом крові, що циркулює.
Грам-негативні бактерії, що часто спричинюють септичний шок, виділяють ендотоксин, ліпополісахарид клітинної стінки мікроорганізму. Ця сполука зумовлює активування макрофагів та виділення збільшеної кількості цитокінів. Антитіла проти цитокінів або частин молекули ендотоксину можна використовувати для лікування шоку, однак клінічні спостереження не є оптимістичними. Глюкокортикоїди - ефективні лікувальні засоби для тварин, проте не для людини.
Ще одним типом шоку розподілу є нейрогенний шок, за якого раптова автономна активність призводить до вазодилатації та скупчення крові у венах. Прикладом може бути втрата свідомості в разі сильних емоцій, таких як страх або горе.
Стан непритомності
Стан непритомності, або синкопе, є раптовою транзиторною втратою свідомості. Він може бути пов’язаний з метаболічними чи неврологічними порушеннями, однак частіше виникає в разі розладів периферійного кровообігу або серцевих порушень, що спричинюють неадекватний плин крові у головному мозку. Перебіг, звичайно, сприятливий і пов’язаний з раптовою вазодилатацією, яка веде до гіпотензії, що переважно супроводжується брадикардією. Для позначення цього стану використовують термін вазовагальне синкопе.
Постуральним синкопе називають стан непритомності, зумовлений нагромадженням крові у залежних від стоячого стану частинах тіла. Синкопе з мимовільним сечовиділенням - непритомність, що настає під час сечовипускання, трапляється у хворих з ортостатичною гіпотензією. Вона пов’язана з ортостатичною та рефлекторною брадикардією, спричиненою випорожненням. Тиск на каротидний синус, зумовлений, наприклад, тісним комірцем, може спричинити виражену брадикардію та вазодилатацію, що призводить до непритомності (синкопе каротидного синуса). Зрідка вазодилатація та брадикардія можуть бути пов’язані з ковтанням (синкопе ковтання). Синкопе кашлю виникає в разі підвищення внутрішньогрудного тиску під час напруження чи кашлю до рівня, достатнього для блокади венозного надходження крові до серця. Синкопе зусилля означає стан непритомності у випадку напруження внаслідок неспроможності збільшити хвилинний об’єм крові відповідно до підвищених потреб тканин, і зазвичай характерне для хворих зі стенозом аорти або легеневої артерії.
Синкопе може бути пов’язане з серйознішими ураженнями. Близько 25% епізодів синкопе серцевого походження зумовлені або тимчасовою обструкцією течії крові через серце, або раптовим зменшенням хвилинного об’єму крові внаслідок різноманітних видів серцевих аритмій. Непритомність, пов’язану з брадикардією, блокадою серця або синусового вузла, називають нейрокардіогенниим синкопе. Крім того, стан непритомності є початковим симптомом у 7% хворих з інфарктом міокарда. Тому у всіх випадках синкопе потрібне обстеження для виявлення його причини.
Кардіогенний та обструктивний шок
Якщо нагнітальна функція серця порушена настільки, що плин крові до тканин не є адекватним для звичайних метаболічних потреб, то виникає стан, який називають кардіогенним шоком. Зазвичай, він трапляється у разі обширного інфаркту лівого шлуночка, однак може бути зумовлений іншими захворюваннями, що супроводжуються послабленням функції шлуночків. Виникають симптоми, характерні для шоку, а також застій у легенях та внутрішніх органах, оскільки серце не спроможне виштовхувати всю кров, що надходить до нього. З огляду на це описаний стан іноді називають застійним шоком. Частота такого шоку у хворих з інфарктом міокарда становить близько 10%, а смертність від нього - 60-90%.
Картина застійного шоку простежується також у разі обструктивного шоку. Якщо обструкція пов’язана з напруженим пневмотораксом та перетисканням великих вен (див. Розділ 37) або кровотечею у перикард зі стисканням серця ззовні (тампонада серця), зо негайне хірургічне втручання необхідне для того, щоб уникнути смерті.
Лікування шоку
Лікування шоку спрямоване на усунення причини і стимулювання фізіологічних компенсаторних механізмів для відновлення адекватного рівня тканинної перфузії. У разі геморагічного, травматичного та хірургічного шоку, наприклад, головною причиною шоку є крововтрата, і лікування передбачає раннє та швидке переливання адекватної кількості сумісної цільної крові. Фізіологічний розчин можна використовувати обмежено - лише як тимчасовий засіб. Найважливішим завданням є відновлення адекватного об’єму крові, що циркулює, а оскільки фізіологічний розчин розподіляється у ПКР, то тільки 25% кількості призначеної рідини залишається у судинній системі. У випадку опікового шоку та інших станів, що супроводжуються зсіданням крові, плазма є препаратом для усунення головного дефекту - втрати плазми. Препарати білкових фракцій плазми крові, розчини вуглеводів високої молекулярної маси і споріднені речовини, які не проникають через стінку капілярів, можуть забезпечувати деякий терапевтичний ефект. Концентрований людський альбумін плазми й інші гіпертонічні розчини збільшують об’єм крові, що циркулює, завдяки здатності забезпечувати надходження інгерстиційної рідини у судини. Їх можна застосовувати з метою швидкої допомоги, однак їхній недолік полягає у здатності посилювати дегідратацію тканин.
У випадку анафілактичного шоку високоефективним і дещо специфічним засобом є адреналін, дія якого складніша, ніж просто звуження розширених судин. За всіх видів шоку забезпечення адекватного рівня артеріального тиску відіграє важливу роль у підтриманні вінцевого кровообігу. З цією метою можна застосувати такий судинозвужувальний препарат, як норадреналін, однак його введення треба припинити якомога швидше, оскільки він забезпечує розширення судин нирок і позитивний інотропний ефект, одночасно спричинюючи звуження інших судин (див. Розділ 20). У разі травматичного і кардіогенного шоку лікувальну дію має дофамін.
Деякі заходи з тих, що застосовують під час шоку, пригнічують розвиток фізіологічних компенсаторних механізмів. Седативні засоби та інші речовини, що зумовлюють депресію центральної нервової системи, потрібно застосовувати з обережністю, оскільки вони пригнічують активність вазомоторної зони. Особливо небезпечним є алкоголь, оскільки він пригнічує центральну нервову систему і розширює судини шкіри (завдяки центральній дії). Треба уникати перегрівання, унаслідок якого відбувається розширення судин шкіри. Небезпечні наслідки для кровообігу може мати зміна положення хворого, якщо він встане або сяде. Сили гравітації потрібно спрямувати на допомогу, а не на пригнічення компенсаторних механізмів. Надання хворому положення з дещо піднятими ногами за допомогою підіймання відповідного кінця ліжка на 15-30 см є простим і важливим терапевтичним заходом, спрямованим на збільшення венозного надходження крові з нижньої частини тіла до серця і на поліпшення мозкового кровообігу. Однак положення головою вниз сприяє тому, що органи черевної порожнини тиснуть на діафрагму, утруднюючи дихання і зумовлюючи розвиток ускладнень з боку легень. Тому цей метод не можна застосовувати протягом тривалою періоду.