Фізіологія людини - Вільям Ф. Ґанонґ 2002
Функції нервової системи
Шкірна, глибока та вісцеральна чутливість
Больова чутливість
Рецептори і провідні шляхи
Больові рецептори є вільними нервовими закінченнями, які містяться майже у всіх тканинах тіла. Больові імпульси передаються до ЦНС двома системами волокон. Одна ноцицепторна система складається з тонких мієлінових волокон Аδ, що мають діаметр 2-5 мкм і передають імпульси зі швидкістю 12-30 м/с. Інша система складається із безмієлінових волокон С діаметром 0,4-1,2 мкм. Ці волокна містяться у латеральних ділянках задніх корінців, їх часто називають волокнами С задніх корінців; вони проводять імпульси з низькою швидкістю 0,5-2 м/с. Обидві групи волокон закінчуються у задніх рогах: волокна Аδ - переважно на нейронах пластинок І та V, тоді як волокна С задніх корінців - на нейронах пластинок І та II. Є докази такого: синаптичним трансмітером, що його виділяють первинні аферентні волокна, які забезпечують відчуття швидкого болю середньої сили (див. нижче), є глутамат, а трансмітером, який передає повільний сильний біль, - речовина Р.
Синапси між периферійними ноцицепторними волокнами і клітинами заднього рогу у спинному мозку є місцями значної пластичності. З огляду на це задній ріг називають воротами, де больові імпульси можуть бути модифіковані. Наприклад, стимулювання аферентних волокон великого діаметра, які йдуть від ділянки, де був спричинений біль, зменшує його. Колатеральні гілки дотикових волокон дорсальних стовпів проходять у драглисту речовину; було зроблено припущення, що імпульси з цих колатералей, або інтернейронів, на яких вони закінчуються, гальмують передавання від больових волокон задніх корінців до спіноталамічних нейронів: Механізм цього процесу може охоплювати пресинаптичне гальмування (див. Розділ 4) на закінченнях первинних аферентних нейронів, що передають больові імпульси.
Деякі аксони нейронів задніх рогів закінчуються у спинному мозку і мозковому стовбурі. Інші проходять у передньолатеральну систему, у тім числі в бічний спіноталамічний шлях. Деякі піднімаються у задньолатеральній частині спинного мозку. Частина висхідних волокон проектована на задні вентральні ядра, які є специфічними чутливими перемикальними ядрами таламуса, і звідти надходить у кору мозку. Дослідження нормальних людей з використанням зображень ПЕТ та функційного ЯМР дали змогу виявити, що біль активує кортикальні зони SI, SII, а також поясну закрутку протилежного до подразнення боку. Окрім того, активними стають присередня лобова закрутка, острівцева частка кори, а також мозочок.
Шеррінґгон назвав біль «фізичним додатком до імперативного захисного рефлексу». Реакцією на больове подразнення звичайно є швидке відсмикування з наступним униканням. Крім того, біль унікальний серед відчуттів, оскільки він зумовлює неприємне навантаження. В експериментах, розроблених з метою відокремити передчуття болю від болю як такого, передчуття болю активувало присередню лобову закрутку, острівцеву частку кори та мозочок, зумовлюючи активування ділянок лобової кори швидше, ніж тих ділянок, що були активовані власне болем.
Багато волокон, що їх активує біль, закінчуються у ретикулярній системі, яка проектується на ядра середньої лінії та неспецифічні проекційні внутрішньопластинчасті ядра таламуса, а звідти - до різноманітних ділянок кори мозку. Інші волокна проектуються на гіпоталамус, а деякі закінчуються у навколоводопровідній сірій речовині, яка відома як больова ділянка (див. нижче).
Швидкий та повільний біль
Наявністю двох провідних шляхів для болю - одного повільного, а іншого швидкого - пояснюють фізіологічні спостереження двох типів болю. Больовий подразник зумовлює чітке, різке локальне відчуття, яке змінюється тупим, інтенсивним, дифузним і неприємним. Ці два типи відчуттів мають різні назви - швидкий і повільний, або перший і другий біль. Чим далі від мозку завдано больове подразнення, тим більша різниця часу між цими двома компонентами. Це та інші спостереження доводять, що швидкий біль забезпечений активністю волокон болю Аδ, тоді як повільний - активністю волокон С.
Адекватний подразник
Больові рецептори є специфічними, біль не виникає у разі надмірного стимулювання інших рецепторів. З іншого боку, адекватні подразники для рецепторів болю не такі специфічні, як для інших видів чуття, тому їх можна стимулювати різними сильними подразниками. Наприклад, больові рецептори реагують на високу температуру, проте підраховано, що поріг теплового подразнення для них у 100 разів вищий, ніж для температурних рецепторів. Больові рецептори реагують також на електричну, механічну і, особливо, хімічну енергію.
Учені припустили, що опосередковування болю відбувається хімічно і що незалежно від енергії, подразники, які його спричинюють, здатні вивільняти хімічний чинник, що подразнює нервові закінчення. Таким хімічним чинником може бути АТФ, який за посередництва рецепторів Р2Х відкриває керовані лігандами канали на сенсорних нейронах (див. Розділ 4). Крім того, АТФ наявний у цитоплазматичних екстрактах, які спричинюють біль, а також зумовлює біль у разі внутрішньошкірного введення. Інший можливий чинник - поки що не ідентифікований ендогенний ліганд капсаїцинового рецептора. Капсаїцин - це речовина, яка зумовлює пекучий біль у випадку вживання в їжу червоного гіркого перцю (гострого чілі). Капсаїциновий рецептор, який є неселективним йонним каналом, забезпечує проникнення Na+ та Ca2+ всередину активованих ноцирецепторних нейронів, що спричинює їхню деполяризацію. Цей рецептор, інша назва якого завдяки близькій спорідненості капсаїцину і ванілі - ванілоїдний, також активований теплом (див. вище) і може відігравати роль температурного рецептора. Окрім того, його активують протони. У мишей з блокованими капсаїциновими рецепторами послаблена реакція на теплове стимулювання та дію хімічних подразників, однак збережена нормальна відповідь на механічні подразнення.
Підкіркове сприйняття та афект
Є переконливі докази того, що сприйняття чутливих подразнень відбувається навіть тоді, коли нема кори головного мозку, особливо це стосується больових подразнень. Кіркові сприймальні ділянки, очевидно, пов’язані із розрізненням, уточненням та інтерпретацією болю і деяких його емоційних компонентів, однак саме сприйняття болю не потребує наявності кори.
Посттравматичний та нейропатичний біль
Загоювання рани супроводжується посттравматичним болем. У цьому випадку подразнення травмованої ділянки, які у нормальних умовах спричинили б лише незначний біль, зумовлюють патологічну больову реакцію (гіпералгезія), біль спричинюють також звичайні небольові подразники, наприклад, дотик (алодинія). Якщо нерви, що забезпечують іннервацію травмованої ділянки, пошкоджені, то біль може бути постійним і перетворитися на нестерпний навіть після загоювання рани (нейропатичний біль). Нейропатичний біль можна змоделювати в експерименті шляхом ушкодження нервів. Клінічно для нього характерна нечутливість до анальгетиків і він може бути надзвичайно стійким до лікування.
Посттравматичний та нейропатичний біль супроводжується посиленням чутливості периферійних больових рецепторів унаслідок місцевого виділення речовин сенсибілізації. Підвищується також інтенсивність синаптичного передавання сигналів між нейронами першого та другого порядку у задніх рогах спинного мозку. До появи цього болю може спричинитися багато різних механізмів. Один із них полягає у посиленні активності пресинаптичних рецепторів NMDA первинних аферентних закінчень з одночасним збільшенням продукування речовини Р. Інший механізм пов’язаний із перемиканням генів, унаслідок чого субпопуляція волокон Aß, що надходять від механорецепторів, починає продукувати речовину Р. Окрім того, з’ясовано, що нейропатичний біль зменшується або цілком зникає у мишей, які не мають 5-форми протеїнази С, у мишей без простациклінових рецепторів, а також у щурів зі зменшеною кількістю рецепторів речовини Р на нейронах пластини І. Конкретну роль кожного з означених механізмів уточнюють, однак спільними для усіх означених спостережень є посилене виділення речовини Р первинними аферентами та продукування речовини Р конвергентними нервовими волокнами, які у нормі сприймають лише дотик і тиск.
Глибокий біль
Головна відмінність між поверхневою та глибокою чутливістю зумовлена різною природою болю, спричиненого небезпечними подразниками. На відміну від поверхневого болю, глибокий біль погано локалізований, спричинює нудоту, часто його супроводжують пітливість та зміни артеріального тиску. Його можна змоделювати в експерименті шляхом ін’єкції гіпертонічного сольового розчину в окістя або зв’язки. Такий змодельований біль спричинює рефлекторне скорочення прилеглих скелетних м’язів, яке подібне до спазму м’язів, що супроводжує ушкодження кісток, сухожиль та суглобів. Постійно скорочені м’язи ішемізуються, що стимулює їхні больові рецептори (див. нижче). Біль, відповідно, спричинює ще більше спазмування, й утворюється замкнуте коло.
М’язовий біль
Під час ритмічного скорочення м’язів за умов відповідного кровопостачання біль, як звичайно, не виникає. У разі порушення кровообігу м’язові скорочення швидко спричинюють біль, який не зникає і після завершення скорочення аж до повного відновлення нормального кровообігу.
Ці спостереження важко тлумачити без використання концепції, яка пояснює біль місцевим нагромадженням у м’язах певного хімічного чинника (P-фактор за Левісом). У разі відновлення кровообігу цю речовину вимиває кров, або ж вона метаболізує. Ідентичність означеного чинника та речовини Р не доведена, ним можуть бути також йони К+.
Клінічний розвиток загрудинного болю в разі ішемізації серцевого м’яза внаслідок фізичного навантаження (так звана грудна жаба) є класичним прикладом нагромадження у м’язі P-фактора. Симптоми загрудинного болю зменшуються після відпочинку, бо тоді зменшується потреба міокарда у кисні, і кров видаляє P-фактор. Переміжна кульгавість пов’язана з виникненням болю у нижніх кінцівках в осіб з хворобами закупорення судин. Її характерною рисою є біль під час ходьби і припинення болю після відпочинку.
Вісцеральний біль
Біль з внутрішніх органів погано локалізований, неприємний, зумовлює нудоту і вегетативну симптоматику. Часто він іррадіює або пов’язаний з іншими частинами тіла.
Автономна нервова система, подібно до соматичної, складається з аферентних компонентів, інтегративних центрів та ефекторних шляхів. Рецептори болю та інших форм чуття з внутрішніх органів подібні до відповідних рецепторів шкіри, проте характер їхнього розподілу суттєво відрізняється. У внутрішніх органах нема пропріорецепторів, міститься незначна кількість рецепторів температурної та дотикової чутливості. Больові рецептори наявні, однак розкидані вони рідше, ніж у соматичних структурах.
Аферентні волокна від вісцеральних структур досягають ЦНС по симпатичних або парасимпатичних провідних шляхах. Тіла цих нейронів містяться у спинномозкових та гомологічних гангліях черепних нервів. Зокрема, вісцеральні аференти є у складі лицевого, язикоглоткового та блукаючого нервів; у складі задніх корінців грудних та верхніх поперекових, а також крижових нервів (рис. 7-7). Вісцеральні аференти від очних яблук належать до трійчастого нерва. Принаймні деякі аферентні волокна, що містять речовину Р, через колатералі утворюють зв’язки з постгангліонарними симпатичними нейронами у колатеральних симпатичних вузлах, таких як нижній брижовий ганглій. Ці зв’язки можуть відігравати відповідну роль у рефлекторному, незалежному від ЦНС, контролі за роботою внутрішніх органів.
У ЦНС вісцеральна чутливість проходить по тих самих шляхах, що й соматична, а саме: по спіноталамічних трактах і таламічних проекціях; кіркові сприймальні ділянки вісцеральної чутливості чергуються з соматичними.
Подразнення больових волокон
З огляду на порівняно малу кількість больових рецепторів у внутрішніх органах вісцеральний біль погано локалізований. Очевидно, кожен з власного досвіду знає, що вісцеральний біль може бути дуже сильним. Рецептори в стінках порожнистих внутрішніх органів особливо чутливі до розтягу. Такий розтяг можна змоделювати в експерименті шляхом надування заковтнутого балончика, сполученого трубкою із зовнішнім середовищем. Надування балончика супроводжується приступами болю, що періодично послаблюється (так званими кишковими кольками), відповідно до скорочення та розслаблення кишки навколо балончика. Подібні кольки виникають у разі кишкової непрохідності внаслідок скорочень розширеної кишки над місцем закупорення. Якщо внутрішні органи у стані запалення або гіперемії, то навіть порівняно слабкий подразник може спричинити сильний біль. Це, ймовірно, є однією з форм первинної гіпералгезії (див. вище). Натяг брижі також спричинює біль, проте його значення у виникненні вісцерального болю не з’ясоване. Вісцеральний біль особливо неприємний тому, що багато аферентів від внутрішніх органів, збуджених тим самим процесом, що й біль, утворюють рефлекторні зв’язки, які спричинюють нудоту, блювання та інші вегетативні рефлекси.
Спазм та заціпеніння м’язів
Вісцеральний біль, подібно до глибокого соматичного, зумовлює рефлекторне скорочення прилеглих скелетних м’язів. Цей спазм звичайно захоплює черевну стінку, від чого вона ціпеніє. Особливо характерне це заціпеніння в разі охоплення запальним процесом очеревини, хоча може простежуватися і без цього. Анатомічні деталі рефлекторних шляхів, які є в основі спазмогенного впливу уражених внутрішніх органів на скелетні м’язи, не з’ясовані. Рефлекторний спазм м’язів черевної стінки захищає запалені структури черевної порожнини від випадкової травми, тому його називають захисним.
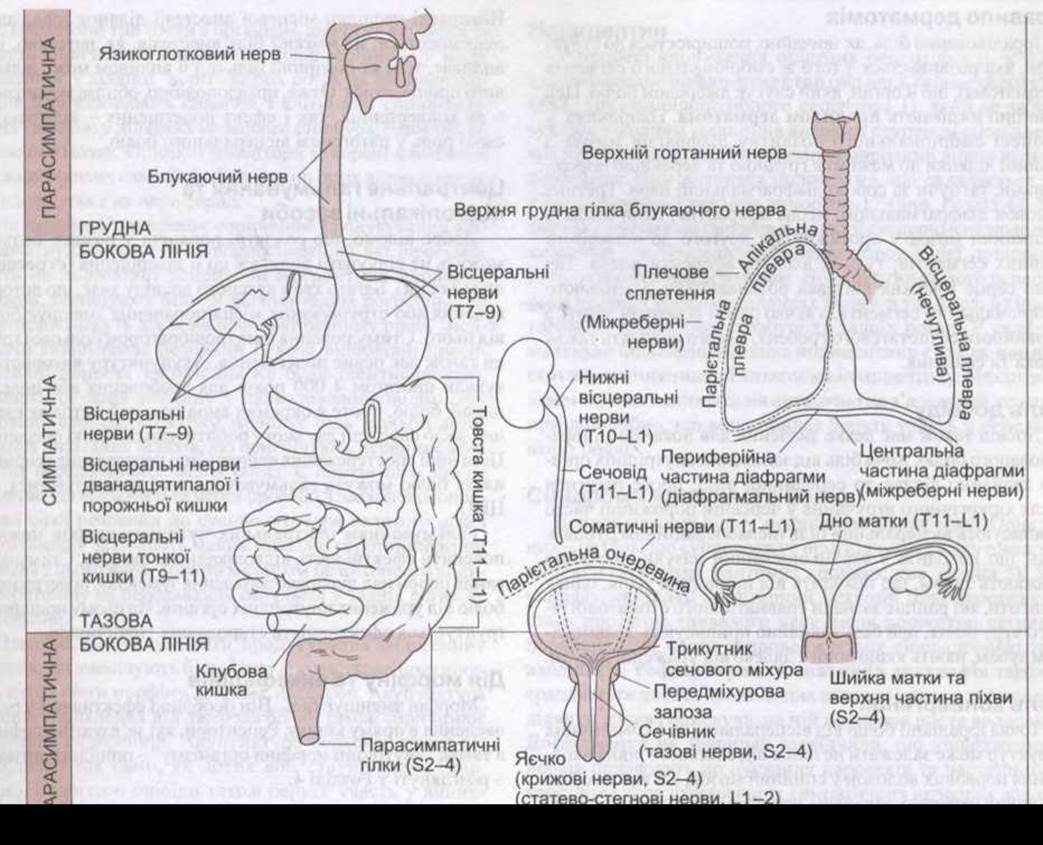
Рис. 7-7. Больова іннервація внутрішніх органів. Висхідні імпульси від структур, що розміщені над лінією грудного болю та під лінією тазового болю, перетинають парасимпатичні шляхи (за White JC. Відтворено за дозволом з Ruch ТС: Phisiology and Biophysics, 19th ed. Ruch TC, Patton HD [editors]. Saunders, 1965).
Класичними ознаками запалення органів черевної порожнини є біль, підвищена уразливість, вегетативні зміни, такі як гіпотензія та пітливість, а також спазм черевної стінки. Походження усіх цих симптомів зрозуміле. Уразливість зумовлена посиленням чутливості больових рецепторів внутрішніх органів, вегетативні зміни спричинені активуванням вісцеральних рефлексів, спазм виникає внаслідок рефлекторного скорочення м’язів черевної стінки.
Іррадійований біль
Подразнення внутрішніх органів часто спричинює больові відчуття не з вісцеральних органів, а з соматичних структур, які можуть бути на значній відстані. Такий біль називають іррадійованим до соматичної структури. Глибокий соматичний біль також може бути іррадійованим, але не поверхневим. Якщо вісцеральний біль є одночасно локальним та іррадійованим, то він дає відчуття розлитого болю (іррадіація), що охоплює як місце ураження, так і віддалені ділянки.
Очевидно, знання феномена іррадійованого болю, як і ділянок, які найчастіше дають больову симптоматику в разі ураження тих або інших внутрішніх органів, дуже важливе для лікаря. Мабуть, найліпше відома іррадіація серцевого болю по внутрішній поверхні верхньої лівої кінцівки. Іншим прикладом може бути біль верхньої частини плеча в разі подразнення центральної частини діафрагми та біль у яєчку, зумовлений розтягненням сечівника. Подібні випадки широко трапляються в практиці терапевта, хірурга та стоматолога. Як звичайно, локалізація іррадійованого болю не є стереотипною, і незвичайні точки іррадіації бувають доволі часто. Наприклад, серцевий біль може іррадіювати до черевної порожнини, правої руки і навіть шиї. Іррадійований біль можна змоделювати в експерименті шляхом подразнення відсіченого кінця вісцерального нерва.
Правило дерматомів
Іррадійований біль, як звичайно, поширюється до структури, яка розвивається з того ж ембріонального сегмента (дерматома), що й орган, який слугує джерелом болю. Цей принцип називають правилом дерматома. Наприклад, у процесі ембріонального розвитку діафрагма мігрує з шийної ділянки до межі між грудною та черевною порожнинами, тягнучи за собою діафрагмальний нерв. Третина волокон діафрагмального нерва аферентна, вони входять у спинний мозок у проміжку від другого до четвертого шийних сегментів; туди ж входять аференти плеча. Так само серце і верхня кінцівка розвиваються зі спільного ембріонального сегмента, а яєчко разом із нервом мігрує з первинного сечостатевого гребеня, з якого походять також нирка та сечівник.
Роль досвіду
Досвід також має деяке значення для локалізації іррадійованого болю. Хоча біль від запалених внутрішніх органів звичайно віддає до серединної лінії, проте пацієнти після хірургічного втручання у черевній порожнині часто приписують вісцеральний біль післяопераційним рубцям. Біль, що походить з верхньощелепної пазухи, звичайно вважають таким, що походить від прилеглих зубів, однак пацієнти, які раніше зазнали травматичного стоматологічного втручання, цей біль звичайно приписують травмованим зубам, навіть якщо вони є далеко від ураженої пазухи.
Роль конверґенції
Точка іррадіації болю від вісцеральних або соматичних структур може залежати не лише від спільного рівня входження нервових волокон у спинний мозок, а й від того, що чутливих нервових закінчень периферійних нервів більше, аніж волокон у спіноталамічних трактах. Тому, очевидно, є значна конвергенція периферійних чутливих нервових волокон на рівні спіноталамічних нейронів. На цій концепції ґрунтується одна з теорій походження іррадійованого болю. Згідно з цією теорією, соматичні та вісцеральні аференти сходяться до тих самих спіноталамічних нейронів (рис. 7-8). Оскільки соматичний біль виникає частіше, аніж вісцеральний, то мозок «навчений», що активність того або іншого больового шляху зумовлена подразенням конкретної соматичної ділянки. Якщо цим же шляхом до мозку надходять сигнали від вісцеральних аферентів, то біль проектується на відповідну соматичну ділянку.
Ефекти полегшення
Полегшення також може відігравати деяку роль у походженні іррадійованого болю. Колатеральні зв’язки вісцеральних аферентів з нейронами заднього рогу спинного мозку, які сприймають больові імпульси від соматичних структур, можуть забезпечувати шляхи, по яких посилена активність вісцеральних аферентів продукуватиме ЗПСП і, таким способом, підвищуватиме збудливість нейронів. Тоді мінімальна активність соматичних аферентів може спричиняти постійний біль.
Якщо б конвергенція була єдиним поясненням іррадійованого болю, то місцева анестезія соматичних ділянок іррадіації на біль не впливала б, тоді як у разі ефекту полегшення під дією анестезії біль повинен би припинитися.
Насправді наслідки місцевої анестезії ділянок іррадіації відрізняються: на важкий біль анестезія, як звичайно, не впливає, тоді як помірний біль під її впливом може цілковито припинитися. Отже, правдоподібно, обидва механізми - як конвергенція, так і ефект полегшення - відіграють свою роль у патогенезі вісцерального болю.
Центральне гальмування та відволікальні засоби
Добре відомо, що солдати, поранені у розпалі битви, можуть не відчувати болю аж до її завершення (стресова анальгезія). Багато хто з власного досвіду знає, що доторкування або струшування місця поранення зменшує біль від нього. Стимулювання електровібратором больової точки також дає певне полегшення. Акупунктуру використовували протягом 4 000 років для знеболення або полегшення болю, проте в окремих випадках цей метод як єдиний засіб анестезії дає змогу робити навіть великі операції. Ці та інші спостереження свідчать, що передавання і сприйняття болю можуть гальмуватися, як і полегшуватися, у ЦНС.
Гальмуванням центральних чутливих шляхів можна пояснити ефективність відволікальних засобів. Стимулювання шкіри над ділянкою запалення зумовлює полегшення болю від уражених внутрішніх органів. На цьому принципі ґрунтується ефективність стародавніх гірчичників.
Дія морфіну та енкефалінів
Морфін зменшує біль. Він особливо ефективний у разі введення в пряму кишку. Рецептори, які зв’язують морфін, а також «внутрішні морфіни організму» - опіоїдні пептиди - розглянуті у Розділі 4.
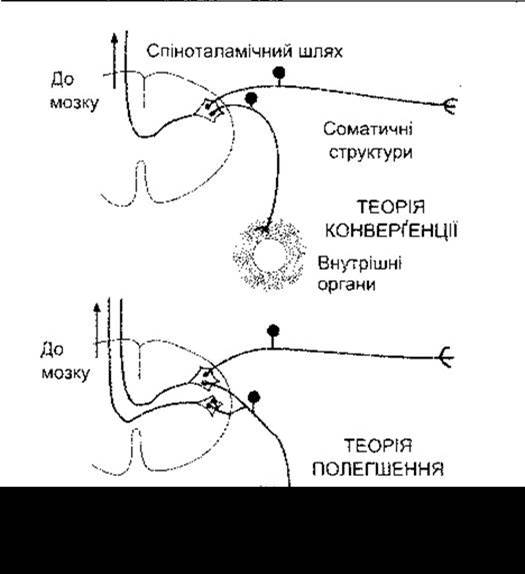
Рис. 7-8. Ілюстрації до теорій конверґенції та полегшення у механізмі виникнення іррадійованого болю.
Є принаймні три точки в організмі, діючи на які, опіоїди можуть спричинити анальгезію: периферійно - у місці поранення; у ділянці «воріт» задніх рогів, де ноцицепторні волокна утворюють синапси з клітинами спинномозкових гангліїв; у ділянках мозкового стовбура, ближчих до головного мозку. Опіоїдні рецептори утворені клітинами спинномозкових гангліїв і мігрують по їхніх відростках як до центра, так і на периферію.
На периферії запалення спричинює продукування клітинами імунної системи опіоїдних пептидів, які, вірогідно, діють на відповідні рецептори аферентних нервових волокон, зменшуючи біль. У ділянці задніх рогів опіоїдні рецептори можуть діяти на пресинаптичному рівні, зменшуючи вивільнення речовини Р, хоча відповідні пресинаптичні нервові закінчення не були ідентифіковані. Нарешті, ін’єкція морфіну у навколоводопровідну сіру речовину середнього мозку зменшує біль шляхом активування низхідних шляхів, які пригнічують первинне аферентне передавання у задніх рогах. Є докази того, що це активування відбувається через проекції з навколоводопро- відної сірої речовини до сусіднього ядра великого шва і що гальмівну активність мають низхідні серотонінергічні волокна з цього ядра. Тонкий механізм інгібіторного впливу серотоніну на передавання імпульсів у задніх рогах не з’ясований.
Плацебо здатне зумовити продукування ендогенних опіоїдів, які зменшують біль. Їхню дію частково пригнічують антагоністи морфіну, зокрема, налоксон. Акупунктура ділянок, віддалених від джерела болю, також спричинює виділення ендорфінів. Акупунктура больової точки діє приблизно так само, як дотик або струшування (див. вище). Ендогенні опіоїди також беруть участь у виникненні стресової аналгезії, оскільки в експерименті на тваринах доведено, що налоксон здатний блокувати деякі її форми. На виникнення інших форм стресової аналгезії налоксон не впливає, що свідчить про залучення інших компонентів.
Ацетилхолін
Епібатидин, холінергічний агоніст, уперше ізольований зі шкіри жаби, є сильним неопіоїдним анальгетичним засобом, синтетичні похідні якого мають ще вищу болезаспокійливу активність. їхню дію блокують холінергічні блокатори; досі не отримано доказів того, що вони спричинюють звикання. Анальгетична дія нікотину, навпаки, менш виражена у мишей з дефіцитом а4- та ß2-cyбoдиниць холінергічних рецепторів нікотину. Ці спостереження доводять, що нікотин-холінергічний механізм бере дієву участь у регулюванні больових відчуттів, хоча тонкий механізм цього регулювання ще потребує дослідження.
Канабіноїди
Як зазначено у Розділі 4, анандамід канабіноїдів та ПЕА продуковані ендогенно і пов’язані, відповідно, з рецепторами CB1 та СВ2. Для анандаміду характерна виражена анальгетична активність, а у складі навколоводопровідної сірої речовини та інших ділянок мозку, пов’язаних з відчуттям болю, виявлені анандамісткі нейрони. ПЕА у разі використання впливає на периферії, посилюючи аналь- гетичну дію анандаміду.
Ноцицептин
У процесі клонування опіатних рецепторів μ, к і δ ідентифіковано орфан-рецептор (від англ. orfan - сирота), ORL1 (для опіоїдоподібного рецептора 1), який не зв’язувався з жодним із опіоїдів високим ступенем спорідненості. Нещодавно ідентифіковано природний ліганд цього рецептора. Ним виявився поліпептид, що складається з 17 амінокислот і нагадує динорфін-17 (див. Розділ 4). У випадку внутрішньомозкової ін’єкції експериментальним тваринам він зумовлював гіпералгезію. З цієї причини його названо ноцицептином. Ноцицептин та його рецептори наявні у багатьох ділянках мозку, в тім числі в гіпоталамусі, мозковому стовбурі та задніх рогах. У складі молекули білка-попередника ноцицептину є також ноцистатин, поліпептидний антагоніст ноцицептину. Механізм взаємодії цих поліпептидів остаточно не з’ясований, однак правдоподібно, що вони обидва беруть участь у передаванні болю.
Синдроми хронічного болю
Нейропатичний біль у людини має різні форми. Одна з них - це біль, що супроводжує інші відчуття з ампутованої кінцівки (так звана фантомна кінцівка; див. Розділ 5). У випадку каузалгії спонтанний пекучий біль простежується протягом тривалого часу після порівняно легких поранень. Він часто супроводжується гіпералгезією та алодинією. Рефлекторна симпатична дистрофія також трапляється досить часто. У цих випадках шкіра ураженої ділянки тонка і блискуча, на ній посилено росте волосся. Дослідження на тваринах засвідчили, що ушкодження нервів призводять до пускання паростків та наступного вростання норадренергічних симпатичних нервових волокон у спинномозкові вузли, що забезпечують іннервацію уражених ділянок. У цьому разі симпатичні імпульси забезпечують відчуття болю. Отже, периферія закорочувана, і відповідні пошкоджені волокна стимулюються нор- адреналіном на рівні спинномозкового ганглія. Альфа-адренергічна блокада забезпечує зменшення болю каузалгічного типу у людини, хоча з невідомих причин а1,- адренергічні блокатори ефективніші, ніж а2-засоби.
Відчуття спонтанного болю може генеруватися на рівні таламуса. У разі таламічного синдрому характерним є ушкодження задніх таламічних ядер, що найчастіше зумовлене закупоренням таламоколінчастої гілки задньої мозкової артерії. Пацієнти з цим синдромом мають приступи тривалого, важкого і надзвичайно неприємного болю, які виникають спонтанно або у відповідь на звичайні подразнення.
Біль часто, проте не завжди, можна усунути використанням відповідних доз анальгетиків. Для зменшення некурабельного болю запропоновано хронічне стимулювання задніх рогів спинного мозку за допомогою імплантованих електродів. Електроди можна приєднати до портативного стимулятора, і пацієнти отримають змогу самостійно контролювати свій біль. Самостимулювання навколоводопровідної сірої речовини також допомагає зменшити некурабельний біль, імовірно, завдяки підвищеному виділенню ß-ендорфінів.
У деяких випадках неприємних симптомів важкого болю можна позбутися шляхом розтину глибоких зв’язків лобових часток з рештою мозку (префронтальна лоботомія). Після такої операції пацієнти відчувають біль, та він їх більше не турбує. Така операція, однак, зумовлює значні зміни особистості (див. Розділ 16). Зменшення болю можна також досягти шляхом видалення поясної закрутки. Названі операції, а також інші можливості оперативного розтину больових шляхів показані на рис. 7-9. Одне із таких оперативних втручань називають передньолатеральною кордотомією. Ця операція передбачає вставляння скальпеля у бічну частину спинного мозку з наступним охопленням передньолатеральних ділянок. За належного виконання таке втручання забезпечує розтин латеральних спіноталамічних та передньолатеральних систем волокон больової провідності, залишаючи інтактними більшість вентральних спіноталамічних волокон дотикової чутливості. Іноді біль може відновлюватися через місяці і навіть роки, відображаючи можливості короткого перемикання його провідних шляхів.