Фізіологія людини - Вільям Ф. Ґанонґ 2002
Вступ
Загальні засади та клітинні основи фізіології людини
Міжклітинний зв'язок
Клітини контактують між собою за допомогою хімічних месенджерів. У межах конкретної тканини деякі месенджери рухаються від клітини до клітини через щілинні контакти (див. вище), не потрапляючи до ПКР. Окрім того, на клітини впливають хімічні месенджери, секретовані до ПКР. Такі месенджери зв’язуються з білковими рецепторами на поверхні клітини чи, в окремих випадках, у цитоплазмі ядра, стимулюючи послідовність внутрішньоклітинних змін, що мають фізіологічну дію. Месенджери в ПКР є посередниками трьох головних типів міжклітинних зв’язків, а саме: нервового зв’язку, за якого нервові клітини вивільняють у синаптичних з’єднаннях нейротрансмітери, що впливають через вузьку синаптичну щілину на постсинаптичну клітину (див. Розділ 4); ендокринного зв’язку, у разі якого гормони та фактори росту досягають клітин завдяки кровообігу (див. Розділи 18-24); паракринною зв’язку, за якого продукти клітин дифундують у ПКР, впливаючи на сусідні клітини, що можуть перебувати на деякій відстані (рис. 1-34). Клітини також секретують хімічні месенджери, що в окремих ситуаціях зв’язуються з рецепторами цієї ж клітини, яка секретувала месенджери (автокринний зв’язок). До хімічних месенджерів належать аміни, амінокислоти, стероїди, поліпептиди та інколи інші речовини Зазначимо, що в різних частинах тіла цей же хімічний месенджер може діяти як нейротрансмітер, паракринний посередник, гормон, секретований нейронами в кров (нейрогормон), та гормон, виділений клітинами залози в кров.
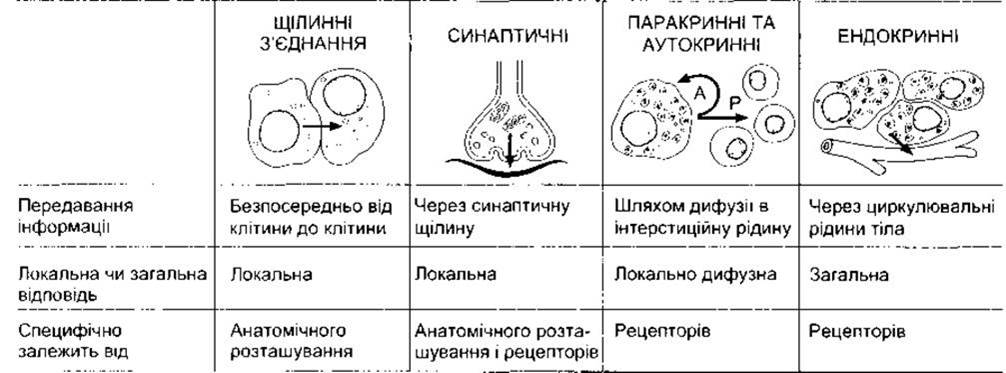
Рис. 1-34. Міжклітинний зв’язок за допомогою хімічних медіаторів
Додатковою формою міжклітинною зв’язку є юкстакринний зв’язок. Деякі клітини позаклітинно експресують численні повторення факторів росту, зокрема трансформувального фактора росту альфа (ТФРа) на трансмембранних білках, що забезпечують прикріплення до клітини. Інші клітини мають ТФРа-рецептори. Отже, ТФРа, прикріплені до клітини, можуть зв’язуватися з ТФРа-рецепторами на іншій клітині, з’єднуючи дві клітини. Це може бути важливим у разі створення локальних осередків росту в тканинах
Радіоімуноаналіз
Сьогодні вже створені антитіла до поліпептидів та білків, а спеціальні технології дають змогу також створити антитіла до інших хімічних месенджерів. Антитіла можна використовувати для вимірювання месенджерів у рідинах організму та в екстрактах тканин методом радіоімуноаналізу. Ця технологія полягає в тому, що позначений ліганд і доданий радіоактивний ліганд конкурують за зв’язування з антитілом до ліганду. Чим більшу кількість переліченого ліганду в зразку аналізують, тим більше він конкурує, і тим менша кількість радіоактивного ліанду, що зв’язується з антитілом. Meтод раіоімуноаналізу широко застосовують у наукових дослідженнях та клінічній медицині.
Рецептори для гормонів, нейротрансмітерів та інші ліґанди
Багато рецепторів для хімічних месенджерів уже виділено та схарактеризовано. Ці білки не є постійними компонентами клітини, їхня кількість збільшується та зменшується внаслідок різноманітних подразників, а їхні властивості змінюються відповідно до змін фізіологічних умов. Коли гормон чи нейротрансмітер є в надлишку, то кількість активних рецепторів, як звичайно, зменшується (регулювання рецеп горів пригніченням), у разі нестачі хімічних месенджерів кількість активних рецепторів збільшується (регулювання рецепторів посиленням). Анпотензин II у дії на кіркову речовину наднирника є винятком: він збільшує, а не зменшує кількість рецепторів у наднирнику. Щодо рецепторів у мембрані, то рецепторно опосередкований ендоцитоз відповідає за негативне регулювання; ліґанди зв’язуються зі своїми рецепторами і комплекси ліганд-рецептор рухаються латерально в мембрані до заглибин, покритих оболонкою, де вони втягуються в клітину під час ендоцитозу (інтерналізація). Це зменшує кількість рецепторів у мембрані. Деякі рецептори будуть використані після інтерналізації, тоді як інших заміняє de novo синтез у клітині. Ще одним типом негативного регулювання є десенсибілізація, за якої рецептори хімічно модифікуються, що робить ix менш чутливими (див. Розділ 4).
Механізм дії хімічних месенджерів
Головні механізми внутрішньоклітинної дії хімічних месенджерів наведено в табл. 1-8. Такі ліганди, як ацетилхолін, зв’язуються безпосередньо з йонними каналами в клітинній мембрані, змінюючи їхню провідність. Тиреоїдні та стероїдні гормони 1,25-дигідроксихолекальціферол та ретиноїди потрапляють у клітини і діють на того чи іншого представника родини подібних за структурою цитоплазматичних чи ядерних рецепторів. Активований рецептор зв’язується з ДНК і підсилює транскрипцію вибраних мРНК. Майже всі інші ліганди в ПКР зв’язуються з рецепторами на поверхні клітин і багато з них стимулює виділення внутрішньоклітинних посередників, зокрема цАМФ, ІФ3 та ДАГ (див. нижче), що ініціюють зміни в діяльності клітини. З огляду на це позаклітинні ліґанди називають первинними месенджерами, а внутрішньоклітинні посередники - вторинними месенджерами.
Вторинні месенджери призводять до багатьох короткотривалих змін у діяльності клітини, змінюючи ензимну активність, стимулюючи екзоцитоз тощо, однак, окрім того, вони перебудовують транскрипцію різних генів і роблять це частково завдяки вже наявним у автивованій клітині активації транскрипційним факторам. Ці фактори спричиняють транскрипцію генів негайного типу (див. рис. 1-20). Фактори транскрипції, що є продуктами таких генів, активують інші гени, що мають довготриваліші наслідки.
Таблиця 1-8. Головні механізми, за допомогою яких хімічні месенджери у ПКР спричинюють зміни клітинної функції
Механізм |
Приклади |
Відкривають чи закривають йонні канали в клітинній мембрані |
Ацетилхолін на нікотиновому холінергічному рецепторі, норадреналін на К+-каналі в серці |
Діють через цитоплазматичні чи ядерні рецептори, посилюючи транскрипцію вибраних м-РНК |
Тиреоїдні гормони, ретинова кислота, стероїдні гормони |
Активують фосфоліпазу С поряд з внутрішньоклітинним виробленням ДАГ, ІФ3 та інших інозитфосфатів |
Ангіотензин II, норадреналін через a1-адренорецептор, вазопресин через V1-рецептор |
Активують чи інгібують аденілатциклазу, спричиняючи підвищення або зниження вироблення цАМФ |
Норадреналін через ß-адренорецептор (збільшення цАМФ); норадреналін через а2-адренорецептор (зменшення цАМФ) |
Збільшують цГМФ у клітині |
АНП, NO (ФРЕ) |
Підвищують тирозинкіназну активність цитоплазматичних ділянок трансмембранних рецепторів |
Інсулін, EGF, PDGF, M-CSF |
Після активування багато з мембранних рецепторів зумовлюють виділення вторинних месенджерів, або ж інші внутрішньоклііинні зміни через ГТФ-зв’язувальні білки (G-білки, див. нижче). Вторинні месенджери переважно активують протеїнкінази - ензими, що каталізують фосфорилювання тирозину або серину та треонінових залишків у білках. Описано понад 300 протеїнкіназ. Деякі з них, що мають важливе значення для ссавців, наведені в табл. 1-9. Додавання фосфатних груп змінює конфігурацію білків, змінюючи їхні функції та, як наслідок, функції клітини. У деяких випадках, наприклад у випадку з рецептором інсуліну, внутрішньоклітинні ділянки рецепторів і є протеїн-кіназами, інколи ж вони самі себе фосфорилюють (автофосфорилювання). Інші рецептори, зокрема рецептори цигокіну, не є прогеїнкіназами, однак спричиняють фосфорилювання багатьох внутрішньоклітинних білків. Очевидно, важливими є також фосфатази, оскільки усунення фосфатних груп дезактивує чи активує низку транспортних білків чи ензимів.
Таблиця 1-9. Головні протеїнкінази

Стимулювання транскрипції
Коли тиреоїдні та стероїдні гормони, 1,25-дигідроксихолекальциферол та ретиноїди зв’язуються зі своїми рецепторами всередині клітини, то змінюється конформація рецепторного білка, а ДНК-зв’язувальний домен експонується (рис. 1-35). Комплекс рецептор-гормон рухається до ДНК, де він зв’язується з підсилювальними елементами в нетрансльованих 5"-ділянках певних генів. Естроген та трийодотиронін (Т3) зв’язуються з рецепторами в ядрі; Т3 - рецептори також зв’язуються з тироксином (Т4), однак менш інтенсивно. Глюкокортикоїдний рецептор розташований переважно в цитоплазмі, однак, як тільки він зв’язується зі своїм лігандом, то мігрує прямо до ядра. Початкове розташування інших рецепторів, що діють подібно, не з’ясоване. В будь-якому випадку зв’язування комплексу рецептор-гормон з ДНК підсилює транскрипцію мРНК, кодованих геном, з яким він зв’язується. В рибосомах транслюються мРНК, продукуючи підвищену кількість білків, що змінюють клітинну функцію.
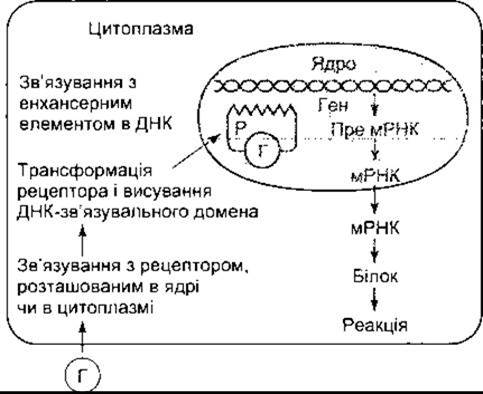
Рис. 1-35. Механізм дії стероїдних та тиреоїдних гормонів Г - гормон, Р - рецептор
У випадку, якщо нема стероїда, рецептор зв’язується з білком теплового шоку Hsp90 та іншими білками, які покривають домен, що зв’язує ДНК. Під час взаємодії стероїда з рецептором розривається його конформація, відривається білок теплового шоку, який буде міститися на ДНК-зв’язувальному домені.
Білки теплового шоку є групою внутрішньоклітинних білків, кількість яких збільшується у разі теплового впливу на клітину та інших стресів. Вони допомагають клітинам виживати у випадках різноманітних стресів. Тому правильніше було б називати їх стресорними білками.
Структура рецепторів
Структура глюко- та мінералокортикоїдних рецепторів людини зображена на рис. 1-36. Було ідентифіковано два естроген-рецептори (а та ß) та два Т3-рецептори (а та ß); а-естроген-рецептор та ß-T3-рецептор зображено на рис. 1-36. Усі ці рецептори є частиною великої родини рецепторів, що мають спільний висококонсервативний, багатий на цистеїн ДНК-зв’язувальний домен; ліганд-зв’язувальний домен на або біля кінцевої карбоксильної групи рецептора та порівняно змінну, низькоконсервативну ділянку кінцевої аміногрупи. Зв’язування з ДНК відбувається через цинквмісні пальці (див. вище). До інших рецепторів цієї родини належать рецептори прогестерону, андрогена та 1,25-дигідроксихолекальциферолу. Багато інших факторів, що регулюють гени, діють через рецептори цього типу в різноманітних біологічних видах від фруктової мушки до людини. Сьогодні описано понад 70 представників суперродини рецепторів. Тепер відомо ліганди близько половини цих рецепторів, а решту становлять орфанові рецептори, ліганди яких не ідентифіковані. Ретинова кислота - похідна від ретинолу (вітаміну А) - відіграє екстенсивну роль у розвитку плоду. Є три рецептори ретинової кислоти - а, ß і у, кодовані двома родинами рецепторів ретинової кислоти - RAR та RXR, кожна з яких має a-, ß- і у-форми. Рецептори Т3 утворюють гомодимери перед тим, як зв’язуватися з ДНК; гетеродимери з ретиновими рецепторами також формують і зв’язують їхню діяльність, отже, ця діяльність є досить складною (див. Розділ 18).
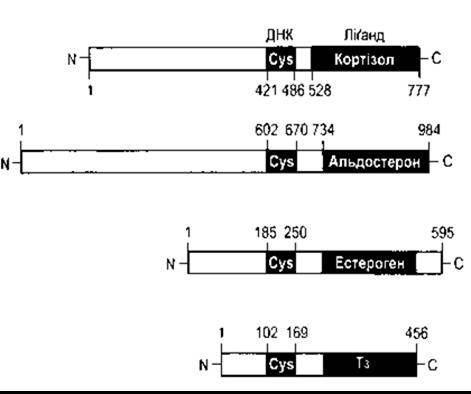
Рис. 1-36. Будова людського глюкокортикоїдного, мінерало- кортикоїдного, а-естрогенного та р-Т3-рецепторів Зверніть увагу на те, що кожен рецептор має багатий на цистеїн ДНК- та ліґандозв’язувальний домен на/або біля кінцевої карбоксильної групи та надзвичайно змінну кінцеву аміногрупу білка. Цифрами позначено амінокислотні залишки.
Швидка дія стероїдів
Деякі дії стероїдів набагато швидші, ніж ті, що опосередковані шляхом зв’язування з ДНК. Як приклад, можна навести швидке збільшення концентрації Са2+ в головках сперматозоїдів, зумовлене прогестероном, та швидку стероїдно-зумовлену зміну у функціях багатьох нейронів. Це привело до гіпотези, що стероїди можуть також зв’язуватися з рецепторами мембрани і діяти через негеномні механізми. Є певні докази існування таких рецепторів. Стероїди також зв’язуються з ГАМКА-рецепторами, активізуючи їхню діяльність (див. Розділ 4).
Внутрішньоклітинний Са2+
Катіон Са2+ регулює надзвичайно велику кількість різноманітних фізіологічних процесів, зокрема проліферацію, нейрональне передавання сигналів, запам’ятовування, скорочення, секрецію та запліднення. Отже, Са2+ відіграє надзвичайно важливу роль. Концентрація вільного Са2+ підтримується на рівні приблизно 100 нмоль/л; у міжклітинній рідині вона приблизно у 12 000 разів вища від концентрації в цитоплазмі, тобто становить 1 200 000 нмоль/л, тому концентраційний та електричний градієнти мають чітке внутрішнє спрямування. Значна частина внутрішньоклітинного Са2+ зв’язана ендоплазматичною сіткою та іншими органелами (рис. 1-37), що забезпечують пул, з якого Са2+ може вивільнюватися, збільшуючи концентрацію вільного Са2+ у цитоплазмі. Завдяки підвищенню вмісту цитоплазматичний Ca2+ зв’язується з кальційзв’язувальними білками, активуючи їх, а ті, відповідно, активують низку протеїн-кіназ.
У клітину Са2+ потрапляє через різноманітні канали. Серед них - канали з потенціалозалежними воротами та лігандні ворота. Потенціалозалежні ворота Са2+-каналів, яких налічується щонайменше чотири види, активуються деполяризацією, натомість лігандні ворота Са2+ каналів активовані багатьма різними нейротрансмітерами та гормонами. Окрім того, є Са2+-канали, активовані розтягуванням.
Потенціалозалежні ворота Са2+-каналів часто поділяють на Т- (від англ. transient - короткотривалі) або L- (від англ. long-lasing - довготривалі) типи, які залежать від тривалості активації під час деполяризації. Підтипи таких каналів теж описані, однак їхню появу пояснюють альтернативним сплайсингом мРНК і комбінацією субодиниць.
Нон Са2+ випомповується з клітини в обмін на два Н+ за допомогою Са2+-Н+-АТФ-ази, його транспортує з клітин антипорт, якого приводить у рух Na+ -градієнт, що виконує обмін трьох Na+ на кожен Са2+.
Багато вторинних месенджерів підвищують цитоплазматичну концентрацію Са2+ шляхом вивільнення Са2+ з внутрішньоклітинних пулів, передусім з ендоплазматичної сітки, або шляхом підвищення рівня Са2+, що потрапляє в клітину, або ж шляхом дії обох механізмів. ІФ3 є основним вторинним месенджером, що спричиняє вивільнення Са2+ з ендоплазматичної сітки. Окрім того, може бути задіяна циклічна аденозиндифосфатрибоза (цАДФР) - метаболіт НАД+, що діє на ріанодин-рецептори (див. Розділ 3). У багатьох тканинах швидкий витік Са2+ з внутрішніх пулів у цитоплазму спричиняє відкривання Са2+-каналів та приплив Са2 (пул-керований приплив Са2+). Це робить можливим триваліші реакції та допомагає відновити внутрішньоклітинні пули.
Зазначимо, що реакції на незначне збільшення цитоплазматичного Са2+ можуть відрізнятися від реакцій на значне його збільшення. Це важливо, оскільки в багатьох випадках вивільнення з пулу в одній частині клітини спричиняє високу локальну концентрацію Са2+ з подальшим поширенням в інші частини, зумовлюючи дифузну, однак нижчу концентрацію. Крім того, цитоплазматична концентрація Са2+, часто коливається в межах норми, а гормони та інші позаклітинні месенджери переважно можуть змінювати частоту, а не амплітуду цих коливань.
Кальційзв’язувальні білки
Описано багато різних Са2+ -зв’язувальних білків, у тому числі тропонін, кальмодулін та кальбіндін. Тропонін задіяний у скороченні скелетного м’яза (див. Розділ 3). Кальмодулін містить 148 амінокислотних залишків (рис.1-38) і має чотири Са2+ -зв’язувальні домени. Він унікальний, оскільки 115-й залишок є триметильований і надзвичайно консервативний; наявний він як у рослинних, так і в тваринних білках. Коли кальмодулін зв’язується з Са2+, він здатний активувати п’ять різних кальмодулінозалежних кіназ (див. табл. 1 -9). Одна з них - міозин лег коланцюгова кіназа, що фосфорилює міозин; а це спричиняє скорочення гладкого м’яза. Інша - кіназа фосфорилази, що активує фосфорилазу (див. Розділ 17). Крім того, Са2+/кальмодулін кінази І та II задіяні в синаптичній функції, а Са2+/кальмодулін кіназа III - у синтезі білка. Ще одним кальмодулін-активованим білком є кальциневрин - фосфатаза, що дезактивує Са2+-канали шляхом їхнього фосфорилювання. Вона також бере участь у активації Т-клітин та інгібується деякими імуносугіресорами (див. Розділ 27).
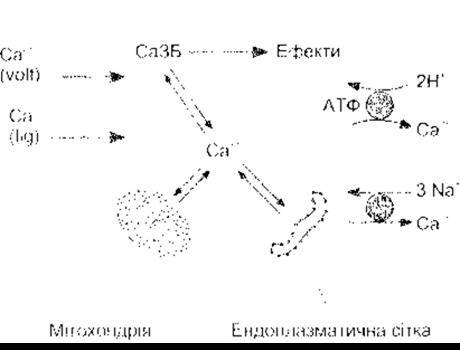
Рис. 1-37. Метаболізм Са2+ у клітинах ссавців Цитоплазматичний Са перебуває в стані рівноваги з Са2+, що зв’язаний з мітохондрією та ендоплазматичною сіткою Кальційзв’язувальні білки (СаЗБ) зв’язують Са2+ і, активовані у такий спосіб, спричиняють різноманітні фізіологічні ефекти Са2+ потрапляє до клітини через потенціалозалежні (volt) «ворота» та пов’язані з ліїандом (lig) Са2+-канали 3 клітини Са2+ виводить Са2+-H+-АТФ-аза та Na+-Са2+-антипорт.
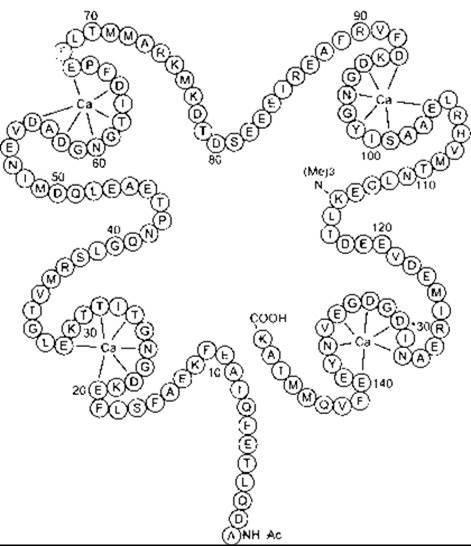
Рис. 1-38. Будова кальмодуліна в мозку бика Одною літерою позначено амінокислотні залишки (табл. 17-2) Зверніть увагу на чотири домени кальцію (забарвлені залишки), оточені з кожного боку ділянками а-спіралі (відтворено за дозволом з Cheung WY: Calmodulin. An overview. Fed Proc 1982,41:2253)
G-білки
Як звичайно, трансляція сигналу на біологічну реакцію всередині клітини відбувається за допомогою нуклеотидо-регуляторних білків (G-білків), що зв’язуються з ГТФ. ГТФ є гуанозиновим аналогом АТФ (див. Розділ 17). Коли сигнал досягає G-білка, то білок обмінює ГДФ на ГТФ. Комплекс ГТФ-білок зумовлює реакцію. Спадкова ГТФ-азна активність білка конвертує ГТФ на ГДФ, відновлюючи стан спокою. ГТФ-азну активність посилюють Г ТФ-аз-активовані білки (ГАБ) (регулятори передавання сигналів G-білків).
Малі G-білки задіяні в багатьох клітинних функціях. Представники Rab родини цих білків регулюють інтенсивність транспортування пухирців між ендоплазматичною сіткою, апаратом Ґольджі, лізосомами, ендосомами та клітинною мембраною (див. вище). Інша родина малих ГТФ- зв’язувальних білків - Rho/Rac - опосередковує взаємодії між цитоскелетом та клітинною мембраною, а ще інша - Ras - регулює ріст, переносячи сигнали з клітинної мембрани до ядра. Представники цих трьох родин пов’язані з продуктом ras протоонкогена.
Ще одна родина G-білків - великі гетеротримерні G-білки - зшивають рецептори поверхні клітини в каталітичні одиниці, що каталізують внутрішньоклітинне утворення вторинних месенджерів або ж скріплюють рецептори безпосередньо в йонні канали. Ці G-білки складаються з трьох субодиниць - а, ß і у (рис. 1-39). Субодиниця а зв’язана з ГДФ. Коли ліганд зв’язується з G-зшитим рецептором, то цей ГДФ обмінюється на ГТФ, а а-субодиниця відділяється від з’єднаних ß- і у-субодиниць. Відділена а-субодиниця чинить багато біологічних впливів. Субодиниці ß і у не роз’єднуються одна від одної і ßy активує багато різноманітних ефекторів. Внутрішня ГТФ активність a-субодиниці конвертує ГТФ на ГДФ, що призводить до з’єднання a- з ßy-субодиницею та завершення активування ефекторів.
Гетеротримерні G-білки затримують сигнали з понад 1 000 рецепторів, а їхніми ефекторами в клітині є йонні канали й ензими. Приклади наведені в табл. 1-10. Щонайменше 16 різних а-субодиниць, 6 різних ß-субодиниць та 12 різних у-субодиниць можуть з’єднуватися, утворюючи численні комбінації. Відповідно до дії на ефектор та споріднених характеристик, їх поділяють на п’ять родин: Gs, G1, Gt, Gq та G13.
Багато G-білків унаслідок прикріплення до них специфічних ліпідів модифікуються, тобто стають ліпідованими (див. рис. 1-6). Тримерні G-білки можуть бути міристольовані, пальмітильовані чи пренильовані, а малі G-білки - лише пренильовані.
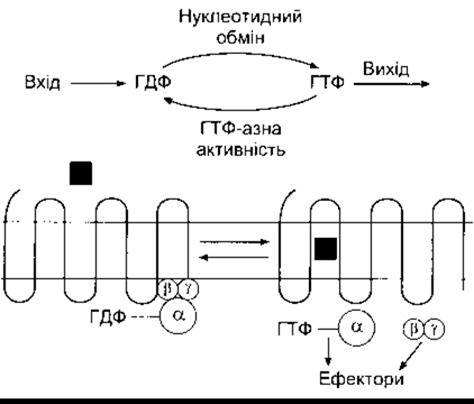
Рис. 1-39. Гетеродимерні G-білки. Вгорі: сумарний огляд повної реакції Внизу: коли ліґанд (квадрат) зв’язується зі серпентиновим рецептором у клітинній мембрані. ГТФ заміняє ГДФ на а-субодиниці. ГТФ-а від’єднується від ßy-субодиниці, і ГТФ-а та ßy активують різноманітні ефектори, чинячи фізіологічні впливи Далі внутрішня ГТФ-азна активність ГТФ- а конвертує ГТФ у ГДФ, a а-, ß- і у-субодиниці з’єднуються.
Таблиця 1-10. Головні ліґанди для рецепторів, з’єднаних з G-білками
Клас |
Ліґанд |
Нейротрансмітери |
Адреналін Норадреналін Дофамін 5-Гідрокситриптамін Гістамін Ацетилхолін Аденозин Опіоїди |
Тахікініни |
Речовина Р Нейрокінін А Нейропептид К |
Інші пептиди |
Ангіотензин II Аргінін вазопресин Окситоцин ВІП, СТР-РГ, ТРГ, ПТГ |
Глікопротеїнові гормони |
ТСГ, ФСГ, ЛГ, ХГл |
Похідні арахідонічної кислоти |
Тромбоксан А2 |
Інші |
Одоранти Тастанти Ендотеліни Фактор активування тромбоцитів Канабіноіди Світло |
Серпентинові рецептори
Усі гетеродимерні зшиті G-білком рецептори є білками, що оточують клітинну мембрану сім разів (серпентинові рецептори). Ці рецептори можуть бути пальмітильовані. Надзвичайно велику кількість їх було клоновано, а їхні функції є численними та різноманітними. Структуру двох з них зображено на рис. 1 -40. Переважно малі ліґанди зв’язуються з амінокислотними залишками в мембрані, тоді як великі поліпептидні та білкові ліґанди зв’язуються з позаклітинними доменами, що є більшими і ліпше розвиненими в рецепторах для поліпептидів та білків. Це, як звичайно, амінокислотні залишки в третій цитоплазматичній петлі, що є найближчою до кінцевої карбоксильної групи і взаємодіє з G-білками.
Інозитолтрифосфат та діацилгліцерол як вторинні месенджери
Контакт між мембранним з’єднанням ліганду, що діє через Са2+, та швидким збільшенням цитоплазматичної концентрації Са2+ часто забезпечує інозитолтрифосфат (інозитол 1,4,5-трифосфат, ІФ3). Коли один з цих лігандів зв’язується зі своїм рецептором, то активування рецептора спричиняє активування фосфоліпази С на внутрішній поверхні мембрани через Gq-білок. Сьогодні визначено вісім ізоформ фосфоліпази С (ФЛС), а ФЛСß1- та ФЛCß2- форми активовані G-білками. Вони каталізують гідроліз фосфатидилінозиту 4,5-дифосфату (ФІФ2), утворюючи ІФ3 та діацилгліцерол (ДАГ) (рис. 1-41). З’єднані з тирозинкіназою рецептори (див. нижче) можуть також продукувати ІФ3 та ДАГ шляхом активування ФЛCß1. ІФ3 дифундує в ендоплазматичну сітку, де спричиняє вивільнення Са2+ в цитоплазму (рис. 1-42). ІФ3-рецептор подібний до ріанодин-рецептора, що є Са2+-каналом у саркоплазматичній сітці скелетного м’яза (див. Розділ 3), лише з тією різницею, що ІФ3-рецептор удвічі більший. ДАГ також є вторинним месенджером; він залишається в клітинній мембрані, де активує один з семи підвидів протеїнкінази С (див. табл. 1-9). Приклади лігандів, що діють через ці вторинні месенджери, наведено в табл. 1-8.
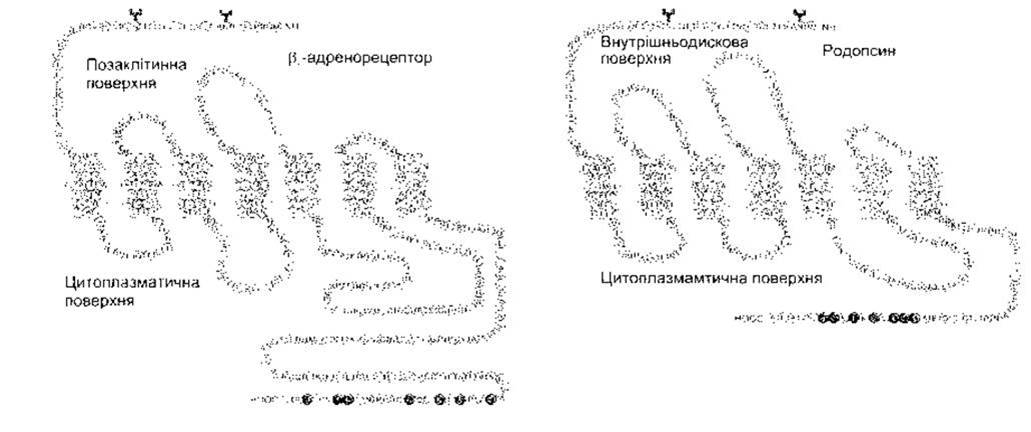
Рис. 1-40. Структура β2-адренорецептора та родопсину. Окремі амінокислотні залишки позначені однолітерними кодами, а забарвлені в темний колір є сайтами фосфорилювання. Y-подібними символами на N залишках позначено сайти глікозилювання. Зверніть увагу на позаклітинну кінцеву аміногрупу, позаклітинну карбоксильну групу та забарвлені ясним кольором сім ділянок кожного білка, що охоплюють мембрану (відтворено за дозволом з Nature 1986;321:869. Macmillan Magazines, 1986).
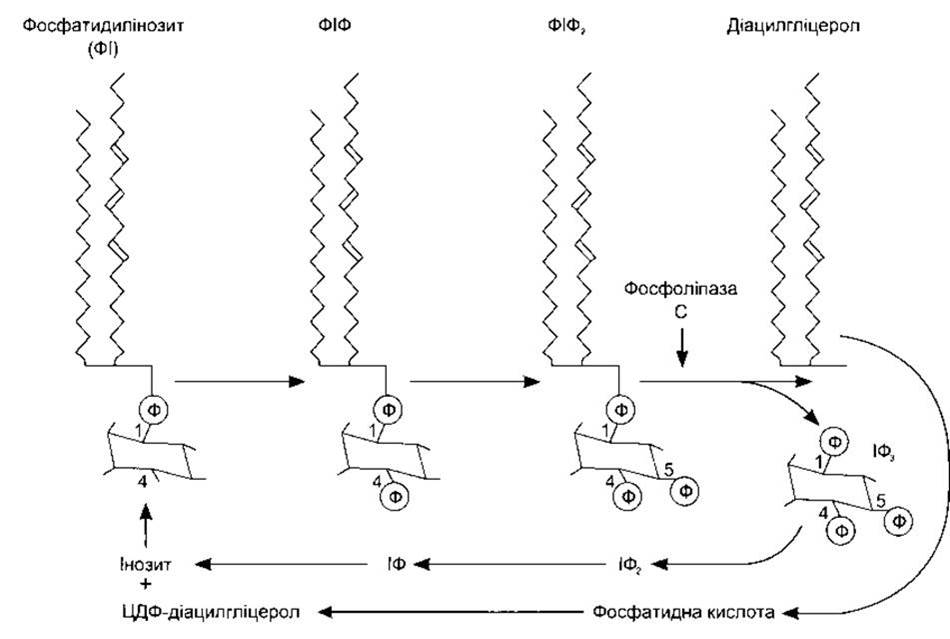
Рис. 1-41. Метаболізм фосфатидилінозиту в клітинних мембранах. Фосфатидилінозит фосфорилює, утворюючи фосфатидилінозит 4-фосфат (ФІФ), а далі - фосфатидилінозит 4,5-дифосфат (ФІФ2). Фосфоліпаза Cß1 та ß2 каталізує розпад ФІФ2 на інозит 1,4,5-трифосфат (ІФ3) та діацилгліцерол. Також можуть утворюватися інші інозитфосфати та фосфатидилінозитпохідні. ІФ3 дефосфорилює до інозиту, а діацилгліцерол метаболізує до цитозиндифосфат (ЦДФ) діацилгліцеролу. Далі ЦДФ-діацилгліцерол та інозит з’єднуються, утворюючи фосфатидилінозит, і цикл завершується (модифіковано з Berrdge MJ: Inositol triphosphate and diacylglycerol as second messengers. Biochem J 1984;220:345).
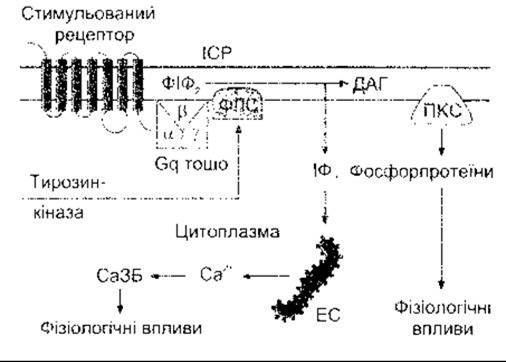
Рис. 1-42. Схематичне зображення виділення інозитолтрифосфату (ІФ3) та діацилгліцеролу (ДАГ) як вторинних месенджерів. Зв’язування ліґанду зі з’єднаним з G-білком рецептором активує фосфоліпазу С (ФЛС) ß1 чи ß2. Активування рецепторів внутрішньоклітинними доменами тирозинкінази може активувати ФЛС у1 Унаслідок цього гідроліз ФІФ2 продукує ІФ3, що вивільнює Са2+ з ендоплазматичної сітки (ЕС) та ДАГ, що активує протеїнкіназу С (ПКС). Са3Б - Са2+- зв’язувальні білки, ІСР - інтерстиційна рідина.
Попередником ФІФ2 є фосфатидилінозитол (див. рис. 1-41). Цей фосфоліпід міститься в порівняно невеликих кількостях у внутрішній пластинці клітинної мембрани. Спочатку він конвертується у фосфатидил-4-фосфат (ФІФ), а пізніше у ФІФ2-похідний, що гідролізується, утворюючи ІФ3 та ДАГ. Інші інозитолфосфати також формуються в клітинах, однак їхні функції точно нез’ясовані. ІФ3 метаболізується шляхом послідовних кроків дефосфорилювання до інозитолу. ДАГ конвертується у фосфатидну кислоту, а далі - у цитозиндифосфат (ЦДФ) діацилгліцерол, який з’єднується з інозитолом, утворюючи фосфатидил інозитол і завершує цикл.
Циклічний АМФ
Вторинним месенджером є також циклічний АМФ (цАМФ) (рис. 1-43). Деякі з багатьох лігандів, що діють через це з’єднання, наведені в табл. 1-8. Циклічний АМФ є циклічним аденозин-3',5'-монофосфатом. Він утворюється від АТФ унаслідок дії ензиму аденілатциклази і конвертується в неактивний 5АМФ унаслідок дії ензиму фосфодіестерази. Циклічний АМФ активує циклічну нуклеотидозалежну протеїнкіназу (протеїнкіназу А), що, як і протеїнкіназа С, каталізує фосфорилювання білків, змінюючи їхню конформацію та активність. Типовим прикладом є активування кінази фосфорилази в печінці адреналіном через цАМФ та протеїнкіназу А (див. рис. 17-13). Окрім цього, активна каталічна субодиниця РКА рухається до ядра і фосфорилює цАМФ-чутливий елементозв’язувальний білок (CREB - від англ. cAMP-responsive element-binding protein). Цей фактор транскрипції надалі зв’язується з ДНК і змінює транскрипцію низки генів.
Циклічний АМФ метаболізує фосфодіестераза. Цю фосфодіестеразу інгібують метилксантини, зокрема кофеїн та теофілін, унаслідок чого такі з’єднання посилюють впливи гормонів та трансмітерів, опосередковані через цАМФ.
Активування аденілатциклази
У механізмі, за допомогою якого ліганди спричиняють зміни у внутрішньоклітинній концентрації цАМФ, задіяно п’ять компонентів: каталітичну одиницю - аденілатциклазу, що каталізує конверсію АТФ у цАМФ; стимулювальні та інгібувальні рецептори; а також стимулювальні та інгібувальні G-білки, що з’єднують рецептор з каталітичною одиницею (рис. 1-44). Як і рецептори, аденілатциклаза є трансмембранним білком, що перетинає мембрану 12 разів. Описано вісім ізоформ цього ензиму, а їхнє поєднання з багатьма різними формами G-білків дає змогу пристосовувати цАМФ шляхи до специфічних потреб тканини. Коли відповідний ліганд зв’язується зі стимулювальним рецептором, Gs-a-субодиниця активує одну з аденілатциклаз. І навпаки, коли відповідний ліганд зв’язується з інгібувальним рецептором, то G1-a-субодиниця інгібує аденілатциклазу. Рецептори є специфічними і відповідають лише одному або групі споріднених лігандів. Незважаючи на це, гетеродимерні G-білки опосередковують стимулятивні та інгібувальні ефекти, створювані багатьма різними лігандами. Окрім цього, є взаємозв’язок між системою фосфоліпази С та системою аденілатциклази, а кілька ізоформ аденілатциклази стимульовані кальмодуліном. Нарешті, впливи протеїнкінази А та протеїнкінази С значно поширені. Як же, враховуючи таку складність, досягаються специфічні реакції на специфічні стимули? Відповідь полягає в прив’язуванні G-білків, аденілатциклази та протеїнкінази до цитоскелета таким способом, що утворюються локальні мікродомени. Деякі з цих прив’язувань виконують ліпідні продукти (див. рис. 1 -6).
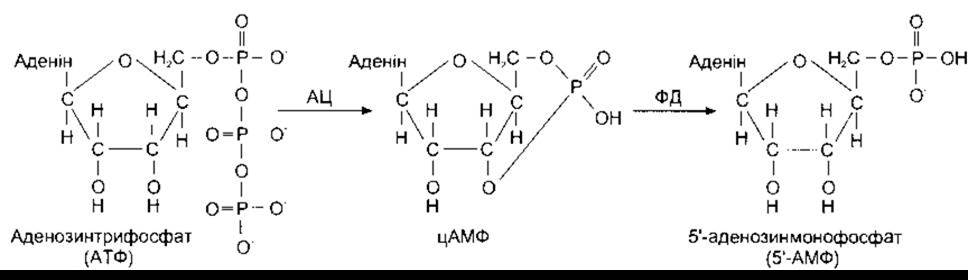
Рис. 1-43. Утворення та метаболізм цАМФ. АЦ - аденілатциклаза; ФД - фосфодіестераза.
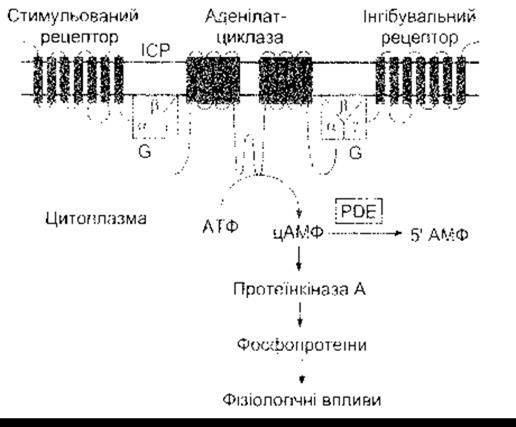
Рис. 1-44. Система цАМФ. Активування аденілатциклази каталізує конверсію АТФ у цАМФ. Циклічний АМФ активує протеїнкіназу А, що фосфорилює білки, спричиняючи фізіологічні ефекти. Стимульовані ліґанди зв’язуються зі стимульованими рецепторами й активують аденілатциклазу через Gs. Інгібувальні ліґанди інгібують аденілатциклазу через інгібувальні рецептори, ІСР - інтерстиційна рідина.
Частина циклічного АМФ покидає клітину внаслідок стимулювання певних гормонів, однак ці кількості малі порівняно з внутрішньоклітинною концентрацією, і лише незначні кількості позаклітинного цАМФ потрапляють у клітини.
Важливий вплив на аденілатциклазу мають два бактеріальні токсини, опосередковані G-білками. Субодиниця А токсину холери каталізує обмін АДФ-рибози на аргініновий залишок у середині a-субодиниці Gs. Це інгібує її ГТФ-азну активність, спричиняючи продовжене стимулювання аденілатциклази (див. Розділ 25). Токсин коклюшу каталізує АДФ-рибозилювання цистеїнового залишку біля кінцевої карбоксильної групи a-субодиниці G1. Це інгібує функцію G1.
Крім того, що ці зміни призводять до захворювання, обидва токсини використовують у фундаментальних дослідженнях функції G-білка. Лікарський засіб форсколін стимулює активність аденілатциклази шляхом прямої дії на ензим.
Гуанілатциклаза
Іншим циклічним фізіологічно важливим нуклеотидом є циклічний гуанозинмонофосфат (циклічний ГМФ, цГМФ). Циклічний ГМФ є важливим для зору. Світло діє на родопсин, що міститься в паличках, фоторецепторних клітинах сітківки. Родопсин зв’язаний з фосфодіестеразою за допомогою Gtl, і активування фосфодіестерази пришвидшує конверсію цГМФ у 5"-ГМФ (див. Розділ 8). Подібний процес відбувається в колбочках. Окрім цього, є цГМФ-регульовані йонні канали, і цГМФ активує цГМФ-залежну кіназу (див. табл. 1-9), спричиняючи низку фізіологічних впливів.
Гуанілатциклази є родиною ензимів, що каталізують утворення цГМФ. Вони бувають у двох формах (рис. 1- 45). Одна форма має позаклітинний кінцевий амінодомен, що є рецептором, простий трансмембранний домен та цитоплазматичну кінцеву карбоксильну групу, у якій міститься тирозинкіназоподібний та циклічний домени гуанілатциклази. Схарактеризовано три такі гаунілатциклази. Дві є рецептором для АНП (АНП-А та АНП-В; див. Розділ 24), а третя зв’язує ентеротоксин кишкової палички та шлунково-кишковий поліпептид гуанілін (див. Розділ 26). Інша форма гуанілатциклази розчинна, містить гем і є повністю внутрішньоклітинною. Є кілька ізоформ внутрішньоклітинного ензиму. Їх активує оксид азоту (NO) та сполуки, що містять NO. Оксид азоту є фактором релаксації ендотелію (ФРЕ) та міжклітинним месенджером. Він утворений він від аргініну, що відіграє важливу роль у регулюванні діаметра кровоносних судин (див. Розділ 31). Також NO задіяний у багатьох інших функціях, у тому числі ерекції статевого члена (див. Розділ 23) та синаптичному передаванні в мозку (див. Розділ 4). Нещодавно отримані дані свідчать про те, що, крім ефектів, опосередкованих цГМФ, NO також може, діяти прямо на них, активуючи Са2+-залежні К+-канали.
Фосфатази
У клітині містяться численні фосфатази, що виводять фосфатні групи з білків. Часто вони близько споріднені з/або спаровані з тирозинкіназами і серинтреоніновими кіназами. Два представники цієї групи показані на рис. 1-45.
Фактори росту
Фактори росту стають щораз важливішими в багатьох різних аспектах фізіології. Вони є поліпептидами та білками, що розділені на гри групи. До першої групи належать агенти, що сприяють збільшенню чи розвитку різних типів клітин: фактор росту нервів (див. Розділ 2), інсуліноподібний фактор росту І (ІФР-І; див. Розділ 22), активіни та інгібіни (див. Розділ 23), фактор росту епідермісу (EGF - від англ. epidermal growth factor). Усього описано понад 20 представників цієї групи. Другу групу утворюють цитокіни. Ці фактори створені макрофагами та лімфоцитами, вони важливі в регулюванні імунної системи (див. Розділ 27). Їх також описано понад 20. Третя група складається з колонієстимулювальних факторів, що регулюють проліферацію та дозрівання червоних і білих кров’яних тілець. Ця група також описана в Розділі 27.
Рецептори для EGF, фактори росту тромбоциту (PDGF - від англ. platelet-derived growth factor) та багатьох інших факторів, що сприяють росту та збільшенню клітин, мають єдиний домен, що охоплює мембрану з внутрішньоклітинним доменом тирозинкінази (див. рис. 1-45). Коли ліганд зв’язується з рецептором, то домен тирозинкінази автофосфорилюється. Деякі з рецепторів у разі зв’язування з лігандами димеризуються, а домени внутрішньоклітинної тирозинкінази перехресно фосфорилюють один одного. Один зі шляхів, активований фосфорилюванням, веде через продукт ras протоонкогена та кілька MAP-кіназ, прямо до утворення в ядрі факторів транскрипції, що змінюють експресію гена. Цей важливий прямий шлях від поверхні клітини до ядра схематично зображено на рис. 1- 46. Зверніть увагу нате, що Ras є одним з малих G-білків, який для активування потребує зв’язування з ГТФ. Рецептори для цитокінів та колонієстимулювальних факторів відрізняються від інших факторів росту тим, що більшість з них не мають доменів тирозинкінази у своїх цитоплазматичних ділянках, а інші мають маленький або зовсім не мають кінцевого цитоплазматичного сегмента. Однак вони ініціюють активність тирозинкінази в цитоплазмі. У деяких випадках це спричиняє зв’язування з асоційованим мембранним білком gp 130 (див. Розділ 27). Рецептори для цитокінів, зокрема, активують так звані Янус-тирозинкінази (JAK - від англ. Janus tyrosine kinases) в цитоплазмі (див. рис. 1-47), які, відповідно, фосфорилюють сигнальний трансдуктор та активатор білків транскрипції (STAT - від англ. signal transducer and activator of transcription). Фосфорильовані STAT утворюють гемо- та гетеродимери і рухаються до ядра, де діють як фактори транскрипції. Сьогодні у ссавців відомо чотири JAK та сім STAT. Шлях JAK-STAT - ще один важливий прямий шлях з клітинної поверхні до ядра. Однак зазначимо, що Ras та JAK-STAT шляхи дуже складні, між ними та шляхами фосфоліпази С і цАМФ є взаємозв’язок.
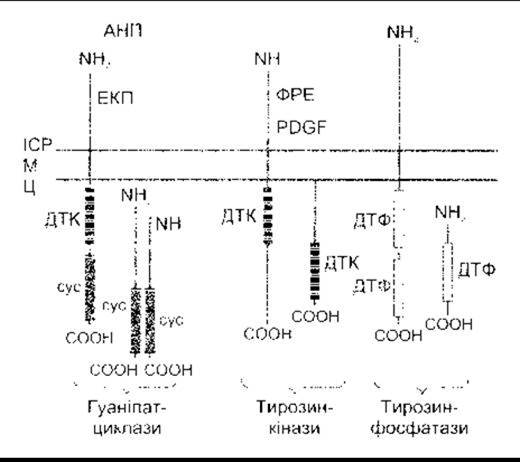
Рис. 1-45. Схематичне зображення гуанілатциклаз, тирозин- кіназ та тирозинфосфатаз. АНП - атріальний натрійуретичний пептид; Ц - цитоплазма; сус - домен циклази; ФРЕ - фактор росту епідермісу; ІСР - інтерстиційна рідина; М - клітинна мембрана; PDGF - фактор росту тромбоциту; ДТК - домен тирозинкінази; ДТФ - домен тирозинфосфатази; ЕКП - ентеротоксин кишкової палички (модифіковано та відтворено за дозволом з Koesling D, Bohme Е, Schultz G: Guanylyn Cyclases, a growing family of signal transducing enzymes. FASEB J 1991:5-2785).
Рецептори іншої родини зв’язують трансформувальний фактор росту ß (ТФРβ) та споріднені поліпептиди. Ці рецептори мають активність серинтреонінкінази, а їхні впливи опосередковані SMAD - внутрішньоклітинними білками, які після фосфорилювання рухаються до ядра, зв’язуються з ДНК і разом з іншими білками ініціюють транскрипцію різних генів.
І нарешті, як зазначено вище, інтегрини також ініціюють фосфорилювання білків, що потрапляють до ядра і змінюють генну транскрипцію.
Захворювання, пов’язані з рецепторами та G-білком
Щораз більшу кількість хвороб спричиняють мутації генів, які відповідають за рецептори. Наприклад, рецепторні мутації «втрати функції рецептора», що спричиняють хворобу, було виявлено в 1,25-дигідроксихолекальциферол-рецептора (див. Розділ 21), інсулін-рецептора (див. Розділ 19). Певні захворювання спричинює продукування антитіл проти рецепторів. Зокрема, антитіла проти ТСГ-рецепторів зумовлюють хворобу Ґрейва (див. Розділ 18), тоді як антитіла проти нікотинових ацетилхолінових рецепторів - важку міастенію (див. Розділ 44).
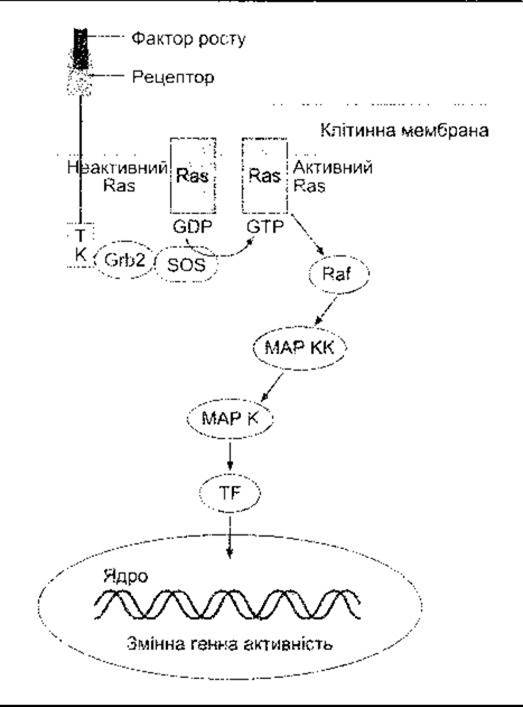
Рис. 1-46. Один з прямих шляхів, через який фактори росту змінюють генну активність. ТК - домен тирозинкінази; Grb2 - активатор контролер Ras; Sos-активатор Ras; Ras-продукт ras гена; МАРК - мітогенактивована протеїнкіназа; МАРКК - МАР кіназа; TF - фактор транскрипції. Є взаємовплив між цим шляхом та шляхом цАМФ, а також взаємозв’язок з ІФ3- ДАГ шляхом.
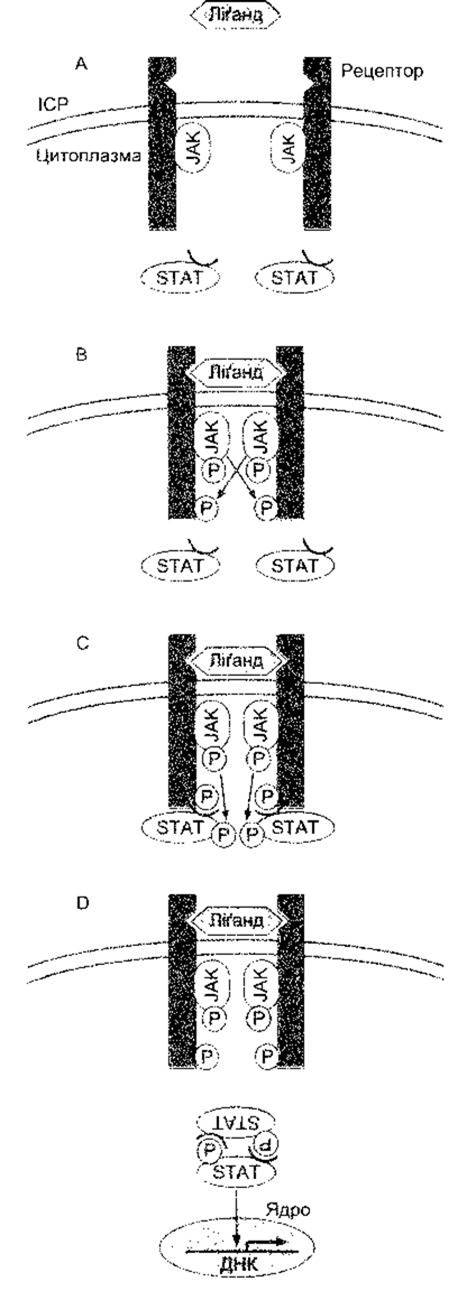
Рис. 1-47. Проходження сигналу через JAK-STAT шлях. А: зв’язування ліґанду призводить до димеризації рецептора. В: активування та тирозинфосфорилювання JAK. С: JAK фосфорилюють STAT. D: STAT димеризуються з відповідним елементом ДНК, що реагує (модифіковано з Takeda К, Kishimoto Т, Akira S: STAT6: Its role in interleukin 4-mediatwd biological functions. J Mol Med 1997;75:17).
Мутовані рецептори можуть як набувати, так і втрачати функцію. Це відображено в табл. 1-11, де перелічено хвороби, спричинені змінами у зшитих з G-білками рецепторах, та хвороби, зумовлені змінами у субодиницях G-білків. Прикладом втрати функції рецептора є нефрогенний нецукровий діабет, що виникає внаслідок втрати здатності V2-вазопресинового рецептора опосередковувати концентрацію сечі (див. Розділи 14 та 38). 1 навпаки, мутація набуття функції в Са2+-рецептора (див. Розділ 21) призводить до надмірного пригнічення паратиреоїдного гормону і зумовлює родинну гіперкальційуричну гіпокальціємію.
Мутаціям втрати чи набуття функції, що спричиняють хворобу, також можуть піддаватися G-білки. У випадку одної з форм псевдогіпопаратиреоїдизму мутована Gs а втрачає здатність реагувати на паратиреоїдний гормон, зумовлюючи симптоми гіпопаратиреоїдизму без будь-яких відхилень у циркуляції паратиреоїдного гормону. Цікавим захворюванням є тестоксикоз, що поєднує набуття і втрату функції. У цьому стані активована мутація Gs а зумовлює надмірну секрецію тестостерону та препубертатне статеве дозрівання. Однак вона чутлива до температури й активна лише в разі порівняно низької температури яєчок (33°С, див. Розділ 23). При температурі 37°С - нормальній температурі решти тіла - відбувається заміна набуття функції втратою, що спричинює гіпопаратиреоїдизм та послаблену реактивність до ТСГ. Інша мутація в Ga пов’язана з наявністю ділянок пігментації шкіри з шорсткими краями та гіперкортицизмом у разі синдрому Мак-Кюна-Олбрайта. Ця мутація виникає протягом фетального розвитку, утворюючи мозаїку з нормальних та аномальних клітин. Ще одна мутація в Gs a послаблює її внутрішню ГТФ-азну активність. Унаслідок чого вона набагато активніша в соматотропних клітинах переднього відділу гіпофізу, що призводить до постійного зростання рівнів цАМФ. Далі це призводить до того, що клітини стають неопластичними, утворюючи аденоми гіпофізу, які спричиняють акромегалію (у 40% від усіх випадків акромегалій) (див. Розділ 22).