БИОТЕХНОЛОГИЯ РАСТЕНИЙ И БИОБЕЗОПАСНОСТЬ - А. П. Ермишин - 2015
ГЛАВА 8. ИСПОЛЬЗОВАНИЕ МЕТОДОВ КУЛЬТУРЫ КЛЕТОК И ТКАНЕЙ РАСТЕНИЙ IN VITRO ДЛЯ ПРЕОДОЛЕНИЯ МЕЖВИДОВЫХ РЕПРОДУКТИВНЫХ БАРЬЕРОВ
Селекция любой культуры может быть эффективной лишь в случае достаточно высокой генетической изменчивости исходного селекционного материала. Для многих сельскохозяйственных растений характерна весьма узкая генетическая основа, что существенно затрудняет выведение новых сортов. Наиболее эффективным методом расширения генетической базы селекционного материала является гибридизация его с дикими и примитивными культурными родственными видами (отдаленная гибридизация). В селекции нашли отражение два основных направления использования отдаленной гибридизации: для расширения генетической базы соответствующего культурного вида (расширения аллельного разнообразия) и для интрогрессии в селекционный материал отдельных ценных генов.
Для реализации первого из названных направлений наибольший интерес представляют виды, выращиваемые местным населением в центрах происхождения культуры (примитивные культурные виды). Как правило, они относительно легко скрещиваются с культурным видом. Полученные гибриды скрещивают между собой или беккроссируют культурным видом, получая селекционный материал с расширенным аллельным разнообразием, использование которого позволяет повысить эффективность селекции культуры на продуктивность и экологическую стабильность.
Для интрогрессии в селекционный материал отдельных генов от диких видов получают межвидовые гибриды с участием культурного вида, затем проводят ряд беккроссов культурным видом с тем, чтобы в селекционном материале осталась лишь незначительная часть привнесенного генетического материала от дикого сородича, связанная с экспрессией каких-либо ценных генов, отсутствующих у культурного вида, например генов устойчивости к абиотическим и биотическим факторам окружающей среды, признаков качества продукции.
Многие культурные виды имеют большое количество диких сородичей, представляющих интерес для селекции. Некоторые из них можно непосредственно скрестить с культурными формами. Однако во многих случаях такие скрещивания связаны со значительными проблемами, вызванными естественными межвидовыми барьерами. Выделяют следующие основные факторы, обеспечивающие обособление видов: 1) внешние экологические барьеры: физическое разделение популяций видов в пространстве и времени (несовпадение периода цветения), обусловленное их адаптацией к специфическим экологическим нишам; 2) геномные различия между видами; 3) различия в плоидности; 4) внутренние барьеры, препятствующие гибридизации (преи постзиготные репродуктивные барьеры).
Первые из названных барьеров преодолеть относительно легко, добившись одновременного цветения скрещиваемых видов в одном месте. Значительные геномные различия между видами делают практически невозможной интрогрессию ценных генов от одного вида к другому из-за нарушений рекомбинации генов в мейозе межвидовых гибридов. Относительно просто можно совместить в одном генотипе ценные признаки от двух видов со значительными геномными различиями, получив амфидиплоидные межвидовые гибриды (Г. Д. Карпеченко, 1935). У таких гибридов геномы родительских видов представлены в диплоидной форме, благодаря чему возможна нормальная конъюгация в мейозе гомологичных хромосом. Однако этот метод применим преимущественно к гибридам между культурными видами (например, тритикале - гибрид между пшеницей и рожью).
Различия в плоидности между скрещиваемыми видами могут быть причиной нескрещиваемости между ними (см. ниже постзиготные репродуктивные барьеры) или стерильности межвидовых гибридов даже в случае наличия у родительских видов сходных геномов. Во многих случаях эту проблему нетрудно решить, увеличив или уменьшив плоидность одного из видов (например, получение гибридов между автотетраплоидным культурным картофелем и диплоидными дикими или примитивными культурными видами картофеля, см. раздел 7.12).
Особую проблему представляют репродуктивные межвидовые барьеры, связанные с пре- или постзиготной (постгамной) несовместимостью. Для их преодоления разработаны специальные приемы, основанные, в том числе, на применении методов культуры клеток и протопластов in vitro.
8.1. Пре- и постзиготная (постгамная) межвидовая несовместимость
Презиготные барьеры могут проявляться в виде непрорастания пыльцы на рыльце пестика, прорастания, но не сопровождающегося проникновением пыльцевой трубки в ткани пестика, проникновения трубки в ткани пестика, но при котором происходит ингибирование роста пыльцевой трубки в разной степени и в разных частях столбика или в завязи. Они имеют место при внутривидовых и межвидовых скрещиваниях.
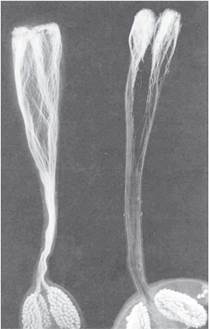
При внутривидовых скрещиваниях презиготная несовместимость проявляется в виде самонесовместимости. Так, большинство диплоидных видов картофеля самонесовместимы, т. е. при самоопылении у них не происходит завязывание семян из-за стойкого ингибирования и остановки роста пыльцевых трубок в верхней трети столбика пестика (рис. 8.1).
Рис. 8.1. Презиготная несовместимость при межвидовой гибридизации картофеля: мониторинг роста пыльцевых трубок в пестиках с помощью флюоресцентной микроскопии с использованием окраски препаратов анилиновым синим: слева - совместимая комбинация (большое количество пыльцевых трубок проникло в завязь); справа - несовместимая комбинация (ингибирование роста пыльцевых трубок в верхней трети пестика)
(по R. Eijlander, 1998)
Для многих культур (прежде всего пасленовых) характерна система однолокусной гаметофитной самонесовместимости. Суть ее заключается в наличии в геноме вида так называемого S-локуса, который может быть представлен у конкретного генотипа разными аллелями. При совпадении S-аллеля пыльцы с одним или обоими S-аллелями диплоидного пестика, что происходит, например, при самоопылении, рост пыльцевой трубки ингибируется и останавливается, т. е. несовместимость в этом случае зависит от генотипа гаметофита опылителя и спорофита материнской формы (несет или не несет гаметофит аллель S-гена из числа тех, что представлены в пестике материнской формы).
У растений может иметь место и спорофитная самонесовместимость, которая зависит от спорофитов материнской формы и опылителя. В этом случае информацию о спорофите опылителя несет оболочка пыльцы. Спорофитная самонесовместимость характерна для крестоцветных.
С точки зрения эволюции возникновение механизма самонесовместимости имело большое значение, так как благодаря ему удается предотвратить появление заведомо неконкурентоспособных в окружающей среде организмов (из-за перехода в гомозиготное состояние полулетальных рецессивных генов).
Согласно современным представлениям о природе гаметофитной самонесовместимости, S-локус содержит два основных компонента: пестичный и пыльцевой. Входящие в них гены кодируют продукты, которые экспрессируются в пестиках и в пыльцевых трубках соответственно. Результат гибридизации определяется взаимодействием продуктов пестичного и пыльцевого компонентов S-локуса. Продуктами пестичного компонента S-локуса являются гликопротеины, имеющие рибонуклеазную активность (S-РНКазы). S-РНКазы содержатся в пестиках вне зависимости от факта опыления, их рибонуклеазная активность неспецифична. S-РНКазы могут свободно проникать в цитоплазму пыльцевых трубок и, действуя как ингибитор процесса трансляции, останавливать их рост (A. Clarke, E. Newbigin, 1993). Этот своеобразный барьер могут преодолеть лишь те пыльцевые трубки, которые содержат определенные продукты, способные дезактивировать соответствующие РНКазы. В качестве кандидатов в продукты пыльцевого компонента S-локуса рассматривают так называемые SLF-протеины (F-box proteins of S locus), которые, как полагают, могут узнавать соответствующие S-РНКазы и запускать систему их деградации (N. Eckardt, 2004).
Корреляция в поведении видов при межвидовых скрещиваниях и при самоопылении позволила прийти к заключению, что гаметофитная самонесовместимость и межвидовая несовместимость имеют общий механизм, или, по крайней мере, общие элементы в своем механизме. В частности, описанная выше модель гаметофитной самонесовместимости может быть использована для объяснения механизмов межвидовой несовместимости у картофеля, если допустить, что процесс взаимодействия пыльцевого и пестичного компонентов S-локуса имеет видовую специфику: дезактивация соответствующих пестичных РНКаз может произойти только с помощью SLF-протеинов того же или близкородственного вида. Так, известно, что дигаплоиды S. tuberosum способны скрещиваться со многими диплоидными видами картофеля из Южной Америки, которые для них эволюционно близки. Следовательно, возможные различия пыльцевого компонента S-локуса у этих видов не отражаются на способности его продуктов дезактивировать пестичные РНКазы других южноамериканских видов при осуществлении межвидовой гибридизации. Диплоидные виды картофеля из Мексики - группа наиболее древних с точки зрения эволюции видов клубненосных Solanum. Очевидно, в силу дивергенции между этими видами и видами картофеля из Южной Америки различия в S-локусе у них настолько существенны, что может быть нарушено взаимодействие пыльцевого и пестичного компонентов при гибридизации между этими группами видов, результатом чего является презиготная несовместимость (см. А. Ермишин, 2001).
Постзиготными (постгамными) считаются барьеры, возникающие после проникновения пыльцевых трубок в завязь и после оплодотворения. Чаще всего постгамная несовместимость выражается в нарушении развития эндосперма гибридного семени и, в результате, ранней гибели зародыша. У семенных растений эндосперм - один из важнейших элементов семени, который выполняет функцию питания зародыша в ходе его развития с момента образования зиготы. Эндосперм - продукт двойного оплодотворения, формирующийся в результате оплодотворения диплоидной центральной клетки женского гаметофита одним из спермиев.
Постгамная несовместимость характерна, прежде всего, для интерплоидных скрещиваний (т. е. между родительскими формами, имеющими разную плоидность). Однако во многих случаях межвидовой гибридизации удачными могут оказаться скрещивания между видами разной плоидности и неудачными - одинаковой плоидности. Так, аллотетраплоидные виды картофеля из серий Acaulia и Longipedicillata не скрещиваются с тетраплоидными сортами культурного картофеля S. tuberosum, однако легко скрещиваются с дигаплоидами S. tuberosum, а также с большинством диплоидных диких видов из Южной Америки, формируя триплоидные гибриды.
Для объяснения этих отклонений от общего правила была предложена гипотеза балансового числа эндосперма (EBN - endosperm balance number) (S. Johnston и др., 1980). Согласно этой гипотезе, разным видам в зависимости от их поведения в межвидовых скрещиваниях присваивается определенное EBN, которое характеризует их «эффективную плоидность». Соотношение EBN женского и мужского партнера по скрещиваниям должно быть в эндосперме 2: 1, чтобы гибридный эндосперм, а, следовательно, и семя развивались нормально, т. е. для успешной гибридизации EBN родительских форм должны совпадать.
В большинстве случаев EBN вида соответствует его реальной плоидности, но может и отличаться. Так, аллотетраплоидные виды картофеля имеют эффективную плоидность 2 ББЫ, тетраплоидные сорта культурного картофеля и гексаплоидный S. demissum имеют 4 EBN, большинство южноамериканских диплоидных видов картофеля имеют 2 EBN, в то время как некоторые диплоидные южноамериканские виды, а также большинство диплоидных видов из Мексики, неклубненосные диплоидные виды картофеля имеют 1 EBN (см. таблицу). Аналогичные системы описаны также для люцерны, хлопчатника, овса, пшеницы, томатов.
Группировка видов Solanum в соответствии с их плоидностью и EBN (по J. Hermsen, 1994)
Плоидность |
EBN |
Виды Solanum* |
2х |
1 |
blb, brd, cap, chn, clr, cph, cmm, crc, etb, frn, jam, lgl, mrf, pld, pnt, trf, амфимоноплоиды аллотетраплоидных видов |
2х |
2 |
chc, chm, ifd, tar, sect. Megistacroloba и Tuberosa, за исключением chn, дигаплоиды естественных и искусственных автотетраплоидов |
4х |
2 |
Все аллотетраплоиды: acl, agf,col, fen, hjt, opl, plt, pta, scr, sto, tuq; все удвоенные 2х, 1 EBN виды |
4х |
4 |
tbr subsp. tbr и adg; все удвоенные 2х, 2 EBN виды (автотетраплоиды) |
6х |
4 |
Sect. Demissa; acl subsp. albicans |
* Для обозначения названий видов использованы международные аббревиатуры, например: blb - S. bulbocastanum, acl - S. acaule, tbr - S. tuberosum (см. www.ars-grin.gov/nr6).
Увеличение плоидности с помощью митотического или мейотического удвоения хромосом одного из родителей в целях соблюдения правила EBN позволяет получить жизнеспособные семена с нормально развитым эндоспермом между видами с разной эффективной плоидностью.
8.2. Опыление in vitro для преодоления межвидовой несовместимости
Опыление in vitro используют прежде всего для преодоления презиготной несовместимости при межвидовых и внутривидовых скрещиваниях. Впервые этот метод был успешно применен индийскими учеными (K. Kanta и др., 1962) для получения самоопыленного потомства у самонесовместимого мака Papaver somniferum. Позднее с его помощью были получены самоопыленные линии различных самонесовместимых видов, а также гибриды между разными видами капусты, табака, петунии и другими представителями разных систематических групп (см. M. Zenkteler, 1992; S. Bho- jwani, M. Razdan, 1996).
Метод включает в себя обнажение семяпочки или семяпочек путем удаления тканей пестика и завязи, нанесение на них пыльцы и культивирование оплодотворенных семяпочек на питательной среде до образования зрелых семян или получения из семяпочек растений-регенерантов (рис. 8.2). Культивирование завязей или семяпочек, как правило, производят на сравнительно простой питательной среде Нича (J. Nitsch, 1951) с 5 % сахарозы. Во многих случаях благоприятное влияние на развитие семян оказывало добавление в среду различных регуляторов роста (ауксинов, цитокининов), а также кокосового молока, дрожжевого экстракта, различных аминокислот.
Рис. 8.2. Прорастание семяпочки подсолнечника Helianthus annuus L. через 21 день культивирования после опыления in vitro: Е - эндосперм; L - лист; R - корешок (по M. Popielarska,2005)

Было предложено несколько вариантов метода: опыление и культивирование изолированных завязей, семяпочек, прикрепленных к плаценте, семяпочек без плаценты. Подобно оплодотворению в пробирке у животных, удалось добиться выделения и слияния in vitro единичных женских и мужских гамет и регенерации из продуктов слияния растений (E. Kranz, H. Lorz, 1993). Был разработан метод химического слияния гамет (с помощью CaCl2), который обеспечивал высокую частоту (около 80 %) слияния преимущественно женских гамет с мужскими (J. Faure и др., 1994). При этом отсутствовала полиспермия (оплодотворение яйцеклеток несколькими спермиями), что делает излишним применение обязательных при соматической гибридизации селективных систем для отбора продуктов слияния (см. ниже).
Культура оплодотворенных завязей оказалась весьма эффективным приемом также для получения межвидовых и даже межродовых гибридов в комбинациях, которые ранее не удавались из-за постгамной несовместимости (гибели зародыша на ранних стадиях развития из-за несовместимости с эндоспермом, раннего опадания плодов). С помощью этого метода были получены ценные для селекции межвидовые гибриды хлопчатника, клевера, подсолнечника.
Используя в межвидовой гибридизации методы опыления in vitro или культуры оплодотворенных завязей, не всегда удается получить зрелые выполненные семена, содержащие жизнеспособные зародыши. Однако эти технологии дают возможность предотвратить преждевременную гибель гибридных зародышей и «дорастить» их до размеров и стадии, когда их можно извлечь из культивируемых семяпочек и поместить на питательную среду для получения растений-регенерантов. Метод эмбриокультуры имеет и самостоятельное значение для устранения последствий постгамной межвидовой несовместимости.
8.3. Применение эмбриокультуры для устранения последствий постгамной межвидовой несовместимости
Первым продемонстрировал возможности использования культуры изолированных зародышей для преодоления межвидовых репродуктивных барьеров F. Laibach (1925, 1929). С помощью этого метода ему удалось получить межвидовые гибриды льна Linum perenne х L. austriacum из щуплых невсхожих семян. В настоящее время этот метод широко используется в селекции для целей межвидовой гибридизации риса, фасоли, томатов, картофеля, лилий, донника и других культур. Этот метод используют также при получении гаплоидов путем опыления пыльцой гаплопродюсеров, облученной пыльцой (см. раздел 7.8), для прерывания периода покоя семян и других целей.
Методика культуры in vitro зиготических зародышей (ее в англоязычной литературе называют «embryo rescue» - спасение зародышей) относительно простая. Зародыши вычленяют в стерильных условиях из гибридных семян, помещают их на питательную среду и при культивировании на свету добиваются регенерации из них растений. В качестве питательных сред используют обычные для культуры клеток среды Мурасиге и Скуга, В-5 Гамборга и др. Концентрация сахарозы для относительно зрелых зародышей 2-3 %, для незрелых она может быть выше (до 10 %). Как правило, используют среды без добавления регуляторов роста. Однако в отдельных случаях их добавление является необходимым. Повысить эффективность эмбриокультуры можно также с помощью добавления в среду различных биологических жидкостей: дрожжевого экстракта, гидролизата казеина, кокосового молока, растительных экстрактов, а также аминокислот и витаминов.
Эффективность регенерации растений в культуре зародышей в значительной степени зависит от размера эксплантата и стадии развития зародыша: чем больше эксплантат и чем более зрелый зародыш, тем выше вероятность регенерировать из него растение. Однако при межвидовых скрещиваниях гибридные зародыши нередко погибают на самых ранних стадиях развития из-за несовместимости с эндоспермом или из-за недоразвитого эндосперма, преждевременного опадания ягод. Для того чтобы предотвратить или отсрочить эти неблагоприятные явления, применяют такие методические приемы, как обработку завязавшихся ягод регуляторами роста (ауксинами), культуру оплодотворенных завязей (см. раздел 8.2). Для культуры мелких зародышей на ранних стадиях развития используют обогащенные питательные среды, а также получают из них каллюс, из которого затем регенерируют растения (B. Thomas, D. Pratt, 1981). Следует заметить, что регенерационная способность у каллюсных культур злаковых, полученных из незрелых зиготических зародышей, значительно выше, чем у культур, полученных из зрелых зародышей.
8.4. Получение межвидовых гибридов путем слияния протопластов для интрогрессии ценных генов в селекционный материал
Описанные ранее в этой главе методы культуры клеток и тканей позволяют повысить эффективность получения гибридов между филогенетически отдаленными видами растений путем половых скрещиваний. Однако во многих случаях их применение не обеспечивает преодоление существующих межвидовых репродуктивных барьеров. Использование методов соматической гибридизации путем слияния протопластов открывает новые возможности в этой области.
Первая методика слияния протопластов, основанная на применении нитрата натрия, была разработана в лаборатории Э. Кокинга в Ноттингемском университете (J. Power и др., 1970; P. Evans, E. Cocking, 1975). С помощью этой методики в США в 1972 г. были получены растения соматических гибридов между разными видами табака (Nicotiana glauca + N. langsdorffii) (P. Carlson и др., 1972). В настоящее время технология соматической гибридизации отработана для многих хозяйственно важных видов растений. Получено большое количество ценных соматических гибридов, на основе которых выведены новые сорта.
Технология соматической гибридизации включает в себя следующие этапы: получение суспензий протопластов двух видов растений, гибриды между которыми предполагается выделить; получение смешанной суспензии протопластов двух видов и использование экспериментальных воздействий (химических или электрических), обеспечивающих слияние протопластов; отбор продуктов слияния, получение из них каллюсной культуры и регенерация растений соматических гибридов, подтверждение их гибридности (рис. 8.3).
Рис. 8.3. Получение межвидовых гибридов пастбищных трав путем слияния протопластов: а - слияние протопластов; б - деление слившихся клеток через 4 дня культивирования; в - многоклеточная структура, сформировавшаяся через 4 недели культивирования; 2 - колонии каллюсных клеток (четыре недели культивирования после слияния протопластов); д, е -регенерация из каллюса соответственно через 8-10 и 12 недель с начала культивирования слившихся клеток; ж- растение-регенерант, сформировавшееся через 16 недель после слияния протопластов (www.phytowelt.com)

8.4.1. Методы слияния протопластов
Изолированные протопласты, как правило, являются одноименно (отрицательно) заряженными частицами. Поэтому для того чтобы они сблизились и произошло слияние протопластов разных видов, в питательную среду к суспензии протопластов добавляют определенные вещества (фьюзогены от англ. fusion - слияние) или суспензию подвергают воздействию электрического тока.
Как отмечалось выше, в качестве первого фьюзогена использовали NaNO3 (J. Power и др., 1970). Позднее были предложены менее токсичные и более эффективные воздействия. Наибольшее распространение получили следующие системы слияния протопластов: высокая концентрация в среде ионов Ca2+ (около 50 мМ) и высокая рН (9-11) при температуре 37 °С (W. Keller, G. Melchers, 1973); добавка в среду полиэтиленгликоля (ПЭГ) (K. Kao, M. Michayluk, 1974; A. Wallin и др., 1974); сочетание ПЭГ + высокая концентрация ионов Ca2+ и высокая рН. Для слияния протопластов используют полиэтиленгликоль молекулярной массой 1500-6000 в концентрации 15-45 %, продолжительность воздействия 15-20 мин. Его применение обеспечивает высокую частоту слияния протопластов (выше 30 %) большого числа видов растений.
Предполагается, что длинная молекула ПЭГ может создавать молекулярный мостик между поверхностями соседних протопластов, вызывая их адгезию (слипание), которая усиливается в присутствии ионов Ca2+ благодаря нейтрализации отрицательного заряда мембран протопластов. Слияние протопластов происходит во время последующей отмывки суспензии от фьюзогенов, вызывающей осмотический шок и перераспределение электрических зарядов на большой поверхности тесно контактирующих мембран протопластов. Первоначально между контактирующими протопластами в местах разрыва мембран формируются небольшие цитоплазматические мостики. Постепенно они расширяются и, наконец, образуются гибридные протопласты (гетерокариоциты) сферической формы. Перемешивание цитоплазм в них завершается в течение 3-10 ч. В процессе деления гетерокариоцитов (в профазе-метафазе митоза) происходит объединение генетического материала ядер, в результате первого митоза образуется два гибридных ядра.
Метод электрослияния протопластов растений впервые был предложен U. Zimmermann, P. Scheurich (1981). На основе этой разработки в США было начато производство автоматической установки «Zimmermann Electrofusion System», которая, как и аналогичные приборы, показала высокую эффективность для получения разнообразных соматических гибридов. Электрослияние осуществляют в специальной кювете прибора с двумя электродами, расстояние между ними 0,2-0,5 мм (рис. 8.4). Через питательную среду, в которую помещают суспензию протопластов двух видов, пропускают высоковольтные импульсы (синусоидальная волна; расстояние между пиками 5-10 В; частота 500 кгц; напряжение от 200 В до 350 В, длительность импульса ~50 мс). Параметры электрического поля и продолжительность его действия в каждом случае подбирают экспериментально. Под действием тока на электродах образуются агрегаты из 2-3 протопластов либо цепочки из 5-6 протопластов между электродами. В это время на электроды подают единичные импульсы постоянного тока, которые приводят к образованию пор в сильно сжатых мембранах протопластов. В результате происходит перемешивание цитоплазмы контактирующих протопластов и образуются гибридные протопласты. В основе слияния лежит различное действие постоянного и переменного электрического тока на плазмалемму: постоянное эклектическое поле сжимает мембраны, ведя к их локальному разрушению, а переменное - вызывает латеральную диффузию белков мембраны, образуя свободные от гликопротеидов липидные области, где противоположные мембраны могут установить контакт.
Рис. 8.4. Оборудование для электрослияния протопластов фирмы «Eppendorf» (мультипоратор, ячейка для электрослияния протопластов, инвертированный микроскоп), в нижнем углу - внешний вид ячейки для электрослияния протопластов (www.eshopeppendorfna.com)

Считается, что метод электрослияния протопластов более эффективный, чем химический. Он обеспечивает высокую частоту слияния - 10-50 % (при химическом - 10-30 %). Продолжительность процедуры составляет всего около 15 мин, протопласты не подвергаются воздействию токсических веществ, что положительно сказывается на жизнеспособности гетерокариоцитов. Однако следует иметь в виду, что приборы для электрослияния протопластов весьма дорогостоящи. Практика показывает, что, как правило, по эффективности оба метода равноценны.
8.4.2. Отбор продуктов слияния протопластов
После проведения слияния протопластов двух видов растений в смешанной суспензии можно обнаружить гетерокариоциты (продукты слияния протопластов разных видов), гомокариоциты (продукты слияния протопластов одного вида) и неслившиеся протопласты. Все они, в принципе, могут регенерировать клеточные стенки и перейти к делениям. Возникает задача - выделить из общей массы гибридные клетки, чтобы можно было из них регенерировать соматические гибриды.
Поскольку существующие методы обеспечивают высокую частоту слияния протопластов, можно получить большое количество растений-регенерантов и проводить отбор гибридов на организменном уровне. Это можно делать по внешним признакам растений, особенно в тех случаях, когда родительские виды значительно различаются по морфологии либо один или оба родителя имеют доминантные маркерные признаки. Можно для отбора использовать белковые (изоферменты) или ДНК-маркеры. Однако во многих случаях гибриды сложно отличить от родительских форм, особенно на ранних стадиях развития растений, частота регенерации гибридов может быть очень низкой. Поэтому их отбор рекомендуется проводить на уровне клеток, применяя следующие подходы (Ю. Глеба, К. Сытник, 1984).
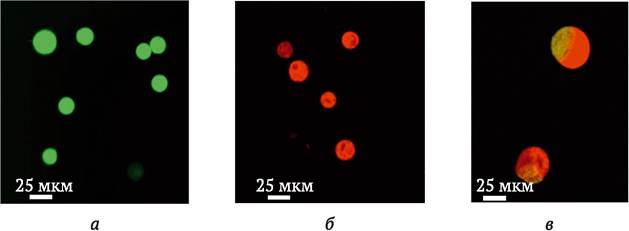
Механическая изоляция. Сущность метода заключается в том, что используют морфологически различные типы родительских протопластов, например, протопласты из каллюсных клеток и мезофилла листа. После слияния гибридные протопласты выявляют визуально под микроскопом, изолируют микропипеткой и с помощью микроманипулятора переносят в отдельную каплю обогащенной питательной среды. Несмотря на требование специального оборудования и навыков работы с микротехникой, метод отличается довольно высокой эффективностью применительно к тем видам растений, для которых отработаны методы культивирования единичных клеток (см. раздел 3.7). Одним из вариантов метода механической изоляции гетерокарионов является использование прижизненной окраски родительских протопластов разными флюоресцентными красителями (рис. 8.5).
Рис. 8.5. Прижизненная окраска протопластов флюоресцентными красителями в целях упрощения визуального отбора продуктов слияния: а - протопласты имбиря, окрашенные диацетатом флюоресцеина (FDA), флюоресцирующие желто-зеленым при свете 490 нм; б - протопласты имбиря, окрашенные Родамином В, флюоресцирующие красным при свете 595 нм; в - гетеро- карионы, имеющие комбинированную флюоресценцию желто-зеленым/красным при 490 нм и 595 нм свете (по Q. Guan и др., 2010)
Генетическая комплементация. Для соматической гибридизации растений чаще всего используют генетическую комплементацию с участием хлорофилл дефектных мутантов, которые нередко специально для этого получают. Впервые предложили использовать хлорофилльные мутанты для отбора соматических гибридов, полученных путем слияния протопластов, G. Melchers, G. Labib (1974).
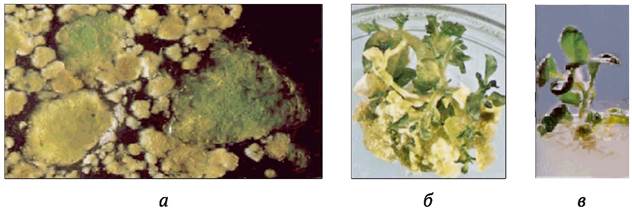
Хлорофилльные мутации относятся к наиболее распространенным у высших растений. Их индуцировать относительно просто, например, с помощью таких мутагенов, как НММ и ЭМС (В. Сидоров, 1990). Полученные пестролистные формы расхимеривают с помощью культуры клеток (наиболее эффективным считается получение растений-регенерантов в культуре протопластов из мезофилла листа). Хлорофиллдефектные мутанты нежизнеспособны в окружающей среде, однако их несложно поддерживать в условиях in vitro. Если слить протопласты мутантов, гомозиготных по разным рецессивным генам, полученные соматические гибриды в силу гетерозиготности по этим генам будут иметь фенотип дикого типа (нормальный). Продукты слияния могут приобретать зеленую окраску уже при культивировании каллюса на свету. Из такого каллюса регенерируют зеленые растения (рис. 8.6).
Рис. 8.6. Использование генетической комплементации по генам хлорофилльной недостаточности в целях отбора соматических гибридов табака: а - образование хлорофилла в клеточных колониях, сформировавшихся после слияния протопластов мутантов N. rustica и N. tabacum с хлорофилльной недостаточностью; б - регенерация зеленых (гибридных) и хлорофилл-дефектных (негибридных) проростков из каллюса; в - растение-регенерант соматического гибрида с хорошо развитыми зелеными листьями, стеблем и корнями (по G. Douglas и др., 1981)
Помимо мутантов, дефектность хлорофилла которых обусловлена рецессивными ядерными генами, нашли применение и мутации, контролируемые пластомом (внеядерными генами), а также ядерные мутации с промежуточным доминированием. Недостаток метода заключается в том, что стадия отбора гибридов отодвигается до уровня растений-регенерантов. Использование ауксотрофных мутантов позволяет проводить отбор соматических гибридов на клеточном уровне (В. Сидоров, 1990).
Физиологическая комплементация. Метод основан на способности гибридных клеток делиться и переходить к морфогенезу в условиях культуры, при которых родительские клетки этого делать не в состоянии. При этом неспособность родительских культур клеток к росту и морфогенезу не связана с какой-нибудь определенной мутацией, а является их нормальной физиологической реакцией на условия культивирования. Один из вариантов физиологической комплементации был использован P. Carlson и другими (1972) при получении первых соматических межвидовых гибридов табака. Было известно, что половые гибриды между N. glauca и N. langsdorfii имеют склонность к опухолеобразованию, а клетки гибридов в условиях in vitro способны расти на питательной среде без гормонов. Гормононезависимость клеток гибрида и была положена в основу метода селекции. После индуцированного слияния протопластов из мезофилла листьев обоих видов табака клетки через некоторое время пересаживали на питательную среду, не содержащую фитогормонов, и отбирали колонии, способные расти в этих условиях.
Основанный на физиологической комплектации подход, применимый не только к вышеназванной комбинации видов, предложил Э. Кокинг (1974). Сущность метода заключается в том, что для соматической гибридизации используют родительские формы, существенно различающиеся по требованиям к условиям культивирования (условия, пригодные для одного из родителей, неприемлемы для другого). После слияния протопластов смешанную суспензию клеток помещают сначала в питательную среду, в которой из-за неспособности к росту элиминируют клетки одного из родителей, а затем переносят в условия, вызывающие аналогичную элиминации клеток другого родителя.
Инактивация протопластов одного из родителей до слияния протопластов ионизирующим излучением (X-, γ-лучами в дозах 50-300 Дж/кг) или биохимическими ядами (монойодацетатом, N-этилмалеимидом, диэтилпирокарбонатом, флюоридин-трихлорбензеном) необратимо подавляет метаболизм клетки (L. Menczel и др., 1981, 1982, 1983). В гибридных клетках способность к делению и морфогенезу в культуре in vitro восстанавливается.
Физическое обогащение заключается в разделении протопластов после слияния с помощью центрифугирования в градиенте плотности. Продукты слияния протопластов двух родительских форм имеют промежуточное значение плотности по сравнению с родительскими формами. Благодаря этому их можно выделить в виде отдельной фракции. Физическое обогащение позволяет также повысить эффективность других методов селекции, например, генетической комплементации.
8.4.3. Симметричные и асимметричные соматические гибриды, цибриды. Подтверждение гибридности растений-регенерантов, полученных после слияния протопластов
В результате слияния протопластов двух видов растений могут быть получены соматические гибриды, у которых полностью представлены геномы обоих родительских видов. Такие гибриды называют симметричными. При получении соматических гибридов путем слияния протопластов отдаленных в систематическом отношении видов нередкой является ситуация, при которой в процессе деления клеток происходит избирательная элиминация хромосом одного из родителей. В результате у растений-регенерантов полностью сохраняется геном только одного из видов, а также отдельные хросомосомы второго вида. Такие гибриды называют асимметричными. Возможна ситуация, при которой у полученных растений-регенерантов ядерный генетический материал одного из родителей отсутствует полностью. В то же время у них может присутствовать ДНК пластид и митохондрий обоих родителей либо родителя, хромосомы которого утрачены. Такие гибриды называют цибридами (цитоплазматическими гибридами).
Асимметричные гибриды могут образоваться и при соматической гибридизации относительно близкородственных видов, например, в случае, если произошло слияние двух протопластов одного из родительских видов и одного протопласта - второго родительского вида. Имеется технология преднамеренного получения ассиметричных гибридов путем слияния интактных протопластов одного вида (реципиентного, чаще всего это культурный вид) и протопластов другого вида (донорного, обычно дикого вида), чей геном сильно фрагментирован с помощью специальных воздействий. Цель создания таких гибридов - полностью сохранить геном культурного родителя, а от дикого вида перенести лишь отдельные ценные для селекции ядерные гены, элиминировав многочисленные нежелательные гены. Эта технология также позволяет получать цибриды, несущие ценные цитоплазматические гены донорного вида, например, связанные с перенесенными митохондриями гены цитоплазматической мужской стерильности.
Для фрагментации генома донорного вида протопласты подвергают сильному ионизирующему облучению (X-, γ-лучами в дозах 50-300 Дж/кг) или облучению ультрафиолетовым светом. Также используют методику опосредованного микроядрами или микропротопластами переноса хромосом (англ.: micronuclei and microprotoplasts mediated chromosome transfer- MMCT), первоначально разработанную для частичного переноса геномов при гибридизации соматических клеток млекопитающих. Микроядра и микропротопласты получают с помощью антимитотических гербицидов (например, оризалина, хлорпрофама) или колхицина, которые оказывают ингибирующее воздействие на микротрубочки веретена деления клеток. Обработанные токсинами клетки блокируются в стадии метафазы, хромосомы остаются разбросанными в цитоплазме, затем деконденсируются в микроядра. Микропротопласты получают из клеток, содержащих микроядра. Их разделяют на фракции с помощью ультрацентрифугирования и пропускания через фильтры с различным размером пор. Для получения асимметричных гибридов также нашли применение метаболические ингибиторы типа йодацетата, йодоацетамида, родамина 6G, которые ингибируют деления протопластов, необратимо инактивируя цитоплазму. Слияние обработанных метаболическими ингибиторами реципиентных протопластов и облученных донорных протопластов позволяет восстановить деления полученных гетерокарионов или цибридов.
Технология создания асимметричных соматических гибридов не получила широкого распространения в связи с появлением более предсказуемых методов генетической инженерии. Однако интерес к ней возродился в связи со сложностью регуляторных барьеров, связанных с внедрением в практику генетически модифицированных организмов, а также из-за негативного отношения населения к ГМО (L. Shankar и др., 2013).
Полученные соматические гибриды подлежат обязательному изучению. Прежде всего необходимо подтвердить их гибридность. Для этого используют такие подходы, как исследование морфологических признаков (особенно актуально, если родительские виды существенно различаются по морфологии), оценка селекционной ценности гибридов (удалось ли перенести гибридам селекционно ценные гены от диких видов), анализ изоферментов (необходимо показать присутствие видоспецифических изоформ отдельных ферментов обоих родительских видов). В последнее время для подтверждения гибридности растений-регенерантов используют различные ДНК- маркеры, в том числе видоспецифичные маркеры отдельных хромосом, генов родительских видов.
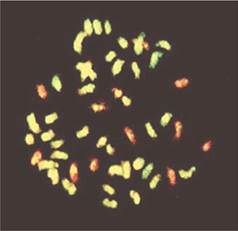
Весьма информативными могут быть современные цитогенетические методики. В частности, метод геномной in situ гибридизации (англ.: genomic in situ hybridization - GISH) позволяет получать различную флюоресцентную окраску хромосом, принадлежащих геномам родительских видов. Благодаря этому появляется возможность не только оценить представленность геномов родительских видов у соматических гибридов, но и проследить судьбу определенных хромосом, например, дикого родителя, при получении, размножении гибридов, беккроссировании их культурным родителем (рис. 8.7). Особенно эффективно использование цитогенетических методов в сочетании с ДНК-маркерами хромосом, генов.
Рис. 8.7. Использование метода GISH для дифференциальной окраски хромосом родительских видов у межвидового соматического гибрида картофеля (клон BC2 соматического гибрида S. tuberosum + S. etubernsum; 2n = 51; 39 хромосом культурного картофеля и 12 хромосом S. etuberosum) (по T. Gavrilenko и др., 2003)
8.4.4. Проблемы беккроссирования соматических гибридов культурным родителем и способы их решения
Несмотря на то что в литературе обсуждаются широкие возможности соматической гибридизации путем слияния протопластов для решения различных фундаментальных и прикладных задач, практический интерес представляет прежде всего применение этой технологии для вовлечения в селекцию ценного генофонда диких сородичей культурных растений, половая гибридизация с которыми сильно затруднена. Наибольшие успехи достигнуты при использовании соматической гибридизации в селекции такой важной сельскохозяйственной культуры, как картофель. С помощью этой технологии получены гибриды между культурным картофелем и такими отдаленными в систематическом отношении видами, как неклубненосные S. brevidens (palustre), S. etuberosum, 1 EBN диплоидные дикие виды S. bulbo- castanum, S. pinnatisectum, S. tarnii, S. cardiofilum, S. polyadenium, S. circaeifolium, S. commersonii, которые несут ценные гены устойчивости к вирусам, нематодам, фитофторозу, бактериальным болезням, заморозкам (Г. Яковлева, 2012).
Однако получение соматических гибридов является лишь первым шагом на пути интрогрессии генофонда диких видов в селекционный материал, так как первичные гибриды требуют последующей селекционной доработки путем беккроссирования культурным видом. Во многих случаях беккроссирование соматических гибридов сортами в целях дальнейшего вовлечения их в селекционный процесс сильно затруднено. Рассмотрим на примере картофеля основные трудности, связанные с беккроссированием соматических гибридов, и способы их преодоления.
Соматические гибриды между культурным картофелем и неклубненосными видами S. brevidens (palustre), S. etuberosum фактически представляют собой аллополиплоиды, у которых из-за значительных геномных различий родительских видов происходит конъюгация преимущественно между гомологичными хромосомами. В связи с этим сильно затруднена интрогрессия в селекционный материал ценных генов диких видов путем рекомбинации в мейозе. У беккроссов таких гибридов с культурным картофелем хромосомы дикого родителя оказываются в унивалентном состоянии, из-за чего передаются потомству случайным образом. В результате уже после двух-трех беккроссов в селекционном материале сохраняются в лучшем случае лишь единичные хромосомы дикого родителя. В связи с этим предполагается, что интрогрессия ценных генов от неклубненосных видов культурному картофелю в основном возможна путем получения трисомных (имеющих геном культурного картофеля и отдельные дополнительные хромосомы дикого вида), тетрасомных (имеющих дополнительную пару хромосом дикого вида) или замещенных по отдельным хромосомам линий (одна из пары гомологичных хромосом культурного картофеля замещена парой гомологичных хромосом дикого вида). Поддерживать такие линии путем вегетативного размножения несложно. Однако при вовлечении их в гибридизацию для использования в селекции необходимо постоянно контролировать передачу потомству хромосом дикого вида.
Соматические гибриды между культурным картофелем и дикими видами с гомологичными геномами в большинстве случаев несут факторы преи постзиготной межвидовой несовместимости, характерные для родительских видов. Так, тетраплоидные соматические гибриды между дигаплоидами S. tuberosum и S. pinnatisectum, S. bulbocastanum не скрещивались с сортами культурного картофеля. Это обусловлено прежде всего тем, что рост пыльцы S. tuberosum ингибируется в пестиках соматических гибридов (презиготная несовместимость). Исходя из гипотезы, описывающей механизм действия презиготной межвидовой несовместимости (А. Ермишин и др., 2006), при использовании соматических гибридов в качестве материнской формы бек- кроссирование не может быть успешным, так как в пестиках таких гибридов присутствуют S-РНКазы, которые являются продуктами S-генов обоих родительских видов. S-РНКазы дикого вида не могут быть дезактивированы факторами ингибирования S-РНКаз, присутствующими в пыльцевых трубках S. tuberosum,что приводит к развертыванию реакции несовместимости.
Проблемы при использовании таких соматических гибридов в селекции могут быть связаны также с постзиготными барьерами, поскольку они, по- видимому, имеют балансовое число эндосперма (EBN), отличное от 4 (EBN культурного картофеля), что может быть одной из причин неудач их беккроссирования сортами картофеля. Пентаплоидные и гексаплоидные гибриды, имеющие в своем составе увеличенное по сравнению с диким видом количество геномов S. tuberosum, беккроссируются S. tuberosum легче. Это объясняют прежде всего тем, что EBN таких соматических гибридов ближе к EBN культурного картофеля, чем в случае тетраплоидных соматических гибридов. Увеличение дозы геномов культурного картофеля у таких соматических гибридов должно также ослабить презиготные барьеры, обусловленные наличием пестичных РНКаз - продуктов S-генов дикого родителя.
Однако эффективность интрогрессии ценного генофонда диких видов в селекционный материал картофеля при использовании высоко полиплоидных соматических гибридов имеет ряд недостатков. Требуется достаточно длительное время для снижения уровня плоидности селекционного материала до тетраплоидного уровня. Отбор по селекционно-ценным признакам проводится среди полиплоидного и анеуплоидного селекционного материала, для которого характерно сложное расщепление. В связи с этим использование в селекции тетраплоидных соматических гибридов, перевод материала на диплоидный уровень представляется более перспективным.
Для того чтобы обойти или преодолеть презиготные факторы межвидовой несовместимости, сохраняющиеся у соматических гибридов, в лаборатории генетики картофеля Института генетики и цитологии НАН Беларуси предложен ряд подходов (А. Ермишин и др., 2006, 2008) (рис. 8.8).
Рис. 8.8. Расщепление по S-локусу в мейозе тетраплоидных соматических гибридов S. pinnatisectum + S. tuberosum (pnt + tbr). Гаметы (пыльцевые зерна), содержащие в гомозиготном состоянии S-гены культурного родителя (StbrStbr), способны опылять материнские растения S. tuberosum. Соответственно дигаплоиды соматических гибридов, являющиеся гомозиготами StbrStbr, могут скрещиваться с дигаплоидами S. tuberosum
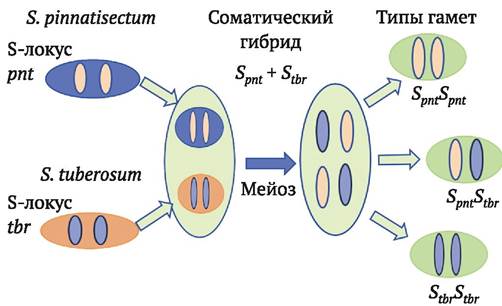
Подход 1. Использование первичных соматических гибридов в качестве опылителей в скрещиваниях с сортами картофеля. В популяции пыльцы обязательно будут генотипы без S-генов дикого вида и благодаря этому способные расти в пестиках S. tuberosum.
Подход 2. Снижение плоидности соматических гибридов (получение дигаплоидов с использованием гаплопродюсеров S. phureja). Предполагается, что среди дигаплоидов будут выщепляться гомозиготы по S-генам S. tuberosum, которые будут совместимы в качестве материнской формы в скрещиваниях с дигаплоидами культурного картофеля.
Подход 3. Получение дигаплоидов или удвоенных дигаплоидов в культуре пыльников соматических гибридов. Этот подход предлагается использовать для соматических гибридов S. tuberosum + S. bulbocastanum, которые непосредственно не скрещиваются с S. phureja из-за жесткой презиготной несовместимости.
Скрещивания с использованием соматических гибридов в качестве опылителей (первый подход), как правило, оказываются результативными. Этот подход, в частности, реализован A. Carrasco и другими (2002) с гибридами S. tuberosum + S. pinnatisectum (4х). Однако его возможности ограничены обычной для соматических гибридов мужской стерильностью, возникающей в результате нарушений мейоза при формировании микроспор.
Второй подход был успешно реализован в лаборатории генетики картофеля Института генетики и цитологии НАН Беларуси при работе с гибридами S. tuberosum + S. pinnatisectum (4х) (А. Ермишин и др., 2006). С помощью опыления этих гибридов пыльцой гаплопродюсера S. phureja IvP35 были получены 10 дигаплоидов. Все они успешно завязывали ягоды при опылении их смесью пыльцы фертильных дигаплоидов S. tuberosum, ягоды содержали зрелые жизнеспособные семена. Таким образом, полученные формы легко скрещивались с дигаплоидами S. tuberosum, т. е. между ними отсутствовали как пре-, так и постзиготные межвидовые барьеры, характерные для исходных видов.
Для соматических гибридов S. tuberosum + S. bulbocastanum (4х), которые несовместимы с S. phureja, был использован третий из названных подходов
(А. Ермишин и др., 2008). Для получения гомозигот по S-генам культурного родителя были получены растения-регенеранты (андроклоны) в культуре пыльников соматических гибридов S. tuberosum + S. bulbocastanum. Анализ их плоидности показал, что все они являются тетраплоидами (удвоенными дигаплоидами), т. е. использованная методика культуры пыльников не дает возможности получать дигаплоиды гибридов. Для снижения плоидности андроклонов использовали опыление гаплопродюсером S. phureja IvP35. Результаты гибридизации андроклонов соматических гибридов с S. phureja, а также данные по анализу роста пыльцевых трубок при опылении андроклонов смесью пыльцы сортов картофеля, свидетельствуют о том, что часть из них хорошо совместимы с пыльцой использованных опылителей и, следовательно, имеется возможность преодоления презиготных репродуктивных барьеров.
Тем не менее андроклоны, в пестиках которых наблюдался нормальный рост пыльцевых трубок культурного картофеля, не завязывали жизнеспособных семян при опылении их смесью пыльцы сортов картофеля. Это очевидно связано с тем, что эффективная плоидность (EBN) андроклонов, как и исходных соматических гибридов, отличается от 4, из-за чего происходит нарушение развития эндосперма гибридных семян. И только снижение уровня плоидности андроклонов позволило преодолеть постзиготные барьеры. Среди отобранных диплоидных сеянцев от опыления андроклонов гаплопродюсером IvP35 один оказался достаточно жизнеспособным и имел удовлетворительную интенсивность цветения. Он хорошо скрещивался с дигаплоидами S. tuberosum, образуя выполненные семена, имеющие высокую всхожесть. Это говорит о том, что полученный дигаплоид соматического гибрида является гомозиготой по S-генам культурного картофеля и его эффективная плоидность (EBN) равняется 2.
Как видим, снижение плоидности соматических гибридов такого типа (предположительно имеющих 3 EBN) позволяет получать формы, которые нормально скрещиваются с дигаплоидами картофеля (2 EBN). По-видимому, в результате мейоза соматических гибридов или их андроклонов происходит образование гамет с разным EBN (расщепление по EBN). Гибридизация с гаплопродюсером обеспечивает отбор гамет с 2 EBN, что позволяет получить выполненные семена дигаплоидов соматических гибридов.
Интересный подход к вовлечению в селекцию соматических гибридов картофеля предложил V.-M. Rokka (1998). У соматических межвидовых гибридов, которые сложно беккроссировать культурным картофелем, получают с помощью культуры пыльников гаплоиды (соматогаплоиды), которые затем используют в качестве одного из родителей при соматической гибридизации с дигаплоидами культурного картофеля. В результате получают вторичные соматические гибриды, в геноме которых преобладают хромосомы культурного родителя. Этот подход был реализован при получении соматических гибридов с участием таких диких видов картофеля, как неклубненосный S. brevidens и аллотетраплоидный S. acaule. В принципе, процедуру «насыщения» генома гибридов генетическим материалом S. tuberosum с помощью данной технологии можно проводить в несколько циклов. Однако она, как видим, технически весьма сложная. В случае гибридов с такими видами, как S. brevidens, неизвестно, какие из хромосом дикого вида сохранятся у соматических гибридов (см. начало этого раздела).
Заключение
Наиболее эффективным методом расширения генетической основы селекционного материала является гибридизация его с дикими и примитивными культурными родственными видами (отдаленная гибридизация). Однако во многих случаях скрещивания между культурными и дикими видами связаны со значительными проблемами, вызванными естественными межвидовыми барьерами. Наиболее существенные барьеры - это геномные различия между видами, различия в плоидности, барьеры, препятствующие гибридизации (пре- и постзиготные репродуктивные барьеры). Для их преодоления разработаны специальные приемы, основанные, в том числе, на применении методов культуры клеток и протопластов in vitro.
Опыление in vitro используют прежде всего для преодоления презигот - ной несовместимости при межвидовых и внутривидовых скрещиваниях. Метод включает: обнажение семяпочки или семяпочек путем удаления тканей пестика и завязи, нанесение на них пыльцы и культивирование оплодотворенных семяпочек на питательной среде до образования зрелых семян. Было предложено несколько вариантов метода: опыление и культивирование изолированных завязей, семяпочек, прикрепленных к плаценте, семяпочек без плаценты. Подобно оплодотворению в пробирке у животных, удалось добиться выделения и слияния in vitro единичных женских и мужских гамет и регенерации из продуктов слияния растений (E. Kranz, H. Lorz, 1993). Был разработан метод химического слияния гамет (с помощью CaCl2), который обеспечивал высокую частоту (около 80 %) слияния преимущественно женских гамет с мужскими (J. Faure и др., 1994). Культура оплодотворенных завязей оказалась весьма эффективным приемом для получения межвидовых и даже межродовых гибридов в комбинациях, которые ранее не удавались из-за постгамной несовместимости (гибели зародыша на ранних стадиях развития из-за несовместимости с эндоспермом, раннего опадания плодов). С помощью этого метода были получены ценные для селекции межвидовые гибриды хлопчатника, клевера, подсолнечника.
Культура in vitro зиготических зародышей («embryo rescue» - спасение зародышей) позволяет предотвратить их гибель из-за нарушения питания, например, из-за недоразвитого эндосперма гибридного семени. Метод широко используется в селекции для межвидовой гибридизации риса, фасоли, томатов, картофеля, лилий, донника и других культур. Этот метод используют также при получении гаплоидов путем опыления пыльцой гаплопродюсеров, облученной пыльцой (см. раздел 7.8), для прерывания периода покоя семян и других целей.
Зародыши вычленяют в стерильных условиях из гибридных семян, помещают на питательную среду и при культивировании на свету добиваются регенерации из них растений. Эффективность регенерации растений в значительной степени зависит от размера эксплантата и стадии развития зародыша: чем больше эксплантат и чем более зрелый зародыш, тем выше вероятность регенерировать из него растение. Для культуры мелких зародышей на ранних стадиях развития используют обогащенные питательные среды, а также получают из них каллюс, из которого затем регенерируют растения.
Использование методов соматической гибридизации путем слияния протопластов открывает новые возможности в области отдаленной гибридизации. Технология соматической гибридизации включает в себя следующие этапы: получение суспензий протопластов двух видов растений, гибриды между которыми предполагается выделить; получение смешанной суспензии протопластов двух видов и использование экспериментальных воздействий (химических или электрических), обеспечивающих слияние протопластов; отбор продуктов слияния, получение из них каллюсной культуры и регенерация растений соматических гибридов, подтверждение их гибридности.
Изолированные протопласты, как правило, являются одноименно (отрицательно) заряженными частицами. Поэтому для того чтобы они сблизились и произошло слияние протопластов разных видов, в питательную среду к суспензии протопластов добавляют определенные вещества (фьюзогены) или суспензию подвергают воздействию электрического тока. Наибольшее распространение получили следующие системы слияния протопластов: высокая концентрация в среде ионов Са2+ (около 50 мМ) и высокая рН (9-11) при температуре 37 °С; добавка в среду полиэтиленгликоля (ПЭГ); сочетание ПЭГ + высокая концентрация ионов Са2+ и высокая рН.
Электрослияние протопластов осуществляют в специальной кювете прибора с двумя электродами. Через питательную среду, в которую помещают суспензию протопластов двух видов, пропускают высоковольтные импульсы. Параметры электрического поля и продолжительность его действия в каждом случае подбирают экспериментально. Под действием тока на электродах образуются агрегаты из 2-3 протопластов либо цепочки из 5-6 протопластов между электродами. В это время на электроды подают единичные импульсы постоянного тока, которые приводят к образованию пор в сильно сжатых мембранах протопластов. В результате происходит перемешивание цитоплазмы контактирующих протопластов и образуются гибридные протопласты.
Поскольку существующие методы обеспечивают высокую частоту слияния протопластов, можно получить большое количество растений-регенерантов и проводить отбор гибридов на организменном уровне. Однако во многих случаях гибриды сложно отличить от родительских форм, поэтому их отбор рекомендуется проводить на уровне клеток, применяя следующие подходы.
Механическая изоляция: используют морфологически различные типы родительских протопластов, например, протопласты из каллюсных клеток и мезофилла листа. После слияния гибридные протопласты выявляют визуально под микроскопом, изолируют микропипеткой и с помощью микроманипулятора переносят в отдельную каплю обогащенной питательной среды.
Генетическая комплементация: если слить протопласты мутантов, гомозиготных по разным рецессивным генам, полученные соматические гибриды в силу гетерозиготности по этим генам будут иметь фенотип дикого типа (нормальный). Отбор гибридов проводят на клеточном уровне или среди растений-регенерантов. Для соматической гибридизации растений чаще всего используют генетическую комплементацию с участием хлорофилл дефектных мутантов, которые нередко специально для этого получают, а также ауксотрофных мутантов.
Физиологическая комплементация основана на способности гибридных клеток делиться и переходить к морфогенезу в условиях культуры, при которых родительские клетки или клетки одного из родительских видов этого делать не в состоянии. При этом неспособность родительских культур клеток к росту и морфогенезу не связана с какой-нибудь определенной мутацией, а является их нормальной физиологической реакцией на условия культивирования.
Инактивация протопластов одного из родителей до слияния протопластов ионизирующим излучением или биохимическими ядами, необратимо подавляющими метаболизм клетки. В гибридных клетках способность к делению и морфогенезу в культуре in vitro восстанавливается.
Физическое обогащение заключается в разделении протопластов после слияния с помощью центрифугирования в градиенте плотности. Физическое обогащение позволяет повысить эффективность других методов селекции, например, генетической комплементации.
В результате слияния протопластов двух видов растений могут быть получены соматические гибриды, у которых полностью представлены геномы обоих родительских видов (симметричные гибриды), полностью сохраняется геном только одного из видов и отдельные хросомосомы второго вида (асимметричные гибриды), геном одного из родителей, а также ДНК пластид и митохондрий обоих родителей либо родителя, хромосомы которого утрачены (цибриды или цитоплазматические гибриды). Полученные соматические гибриды подлежат обязательному изучению: проводят исследование морфологических признаков, оценку селекционной ценности гибридов, анализ изоферментов, различных ДНК-маркеров, применяют цитогенетические методики, например, метод геномной in situ гибридизации (GISH).
Получение соматических гибридов является лишь первым шагом в интрогрессии генофонда диких видов в селекционный материал, так как первичные гибриды требуют последующей селекционной доработки путем бек- кроссирования культурным видом. Во многих случаях беккроссирование соматических гибридов сильно затруднено. Соматические гибриды могут представлять собой аллополиплоиды, у которых из-за значительных геномных различий родительских видов происходит конъюгация преимущественно между гомологичными хромосомами. Интрогрессия ценных генов от дикого вида культурному при использовании таких гибридов в основном возможна путем получения трисомных, тетрасомных или замещенных по отдельным хромосомам линий.
Соматические гибриды в большинстве случаев несут факторы пре- и постзиготной межвидовой несовместимости (пре- и постзиготные межвидовые барьеры), характерные для родительских видов. Увеличение дозы геномов культурного родителя у таких соматических гибридов позволяет их ослабить и получить в результате беккроссное потомство в скрещиваниях с культурным видом. Однако интрогрессия ценного генофонда диких видов в селекционный материал при использовании высоко полиплоидных соматических гибридов требует достаточно длительного времени для снижения уровня плоидности селекционного материала до уровня плоидности культурного вида. Отбор по селекционно-ценным признакам проводится среди полиплоидного и анеуплоидного селекционного материала, для которого характерно сложное расщепление. Для того чтобы обойти или преодолеть факторы межвидовой несовместимости, сохраняющиеся у соматических гибридов, предлагается ряд подходов, позволяющих добиться расщепления по этим факторам: использование, если это возможно, соматических гибридов в качестве опылителей в скрещиваниях с культурным видом, снижение их плоидности с помощью гаплопродюсеров или культуры пыльников.
Контрольные вопросы
1. Назовите основные факторы, обеспечивающие обособление видов, которые препятствуют межвидовой гибридизации.
2. Какие механизмы лежат в основе презиготной самонесовместимости и межвидовой несовместимости?
3. Что такое эффективная плоидность (балансовое число эндосперма), какова его роль в межвидовой гибридизации растений?
4. В чем состоит методика опыления in vitro и для каких целей ее используют в селекции растений?
5. Опишите методику культуры незрелых зародышей. Приведите примеры ее применения в селекционно-генетических исследованиях.
6. Назовите основные методы слияния протопластов, которые используют для получения соматических гибридов.
7. Какие методы отбора продуктов слияния протопластов применяют в соматической гибридизации?
8. Что из себя представляют асимметричные соматические межвидовые гибриды, цибриды? Каким образом они могут быть получены?
9. Какие факторы могут затруднять вовлечение в селекцию соматических межвидовых гибридов?
10. Назовите подходы, применяемые для повышения эффективности беккроссирования соматических гибридов культурным родительским видом.