ОСНОВЫ БИОТЕХНОЛОГИИ - Е.П. СУЧКОВА - 2016
ЛАБОРАТОРНАЯ РАБОТА № 8
ИЗУЧЕНИЕ ДЕЙСТВИЯ ФЕРМЕНТОВ ЖИВОТНОГО, РАСТИТЕЛЬНОГО И МИКРОБНОГО ПРОИСХОЖДЕНИЯ
Цель работы - изучить действие ферментов животного, растительного и микробного происхождения на изменение пищевых систем в процессе переработки.
Ход работы. Выполняются задания:
Задание 1. Изучить характеристики ферментных препаратов и их использование в пищевой промышленности.
Задание 2. Изучить особенности процессов получения ферментов различного происхождения.
Задание 3. Исследовать процессы действия ферментов на пищевые системы и их активность.
Теоретическое обоснование
Биохимические процессы, протекающие при хранении сырья и при производстве пищевых продуктов, связаны с действием собственных ферментов пищевого сырья, а также ферментов, вносимых в ходе технологического процесса в виде ферментных препаратов. Последние могут быть животного, растительного или микробного происхождения.
Наиболее древние ферментативные процессы, освоенные человеком, - спиртовое и молочнокислое брожение, применение сычуга при приготовлении сыров, использование солода и плесневых грибов для осахаривания крахмалистого сырья, применение заквасок при изготовлении хлеба.
В настоящее время многие отрасли пищевой промышленности, в медицине и сельском хозяйстве основаны на использовании различных ферментативных процессов.
Ферменты - биологические катализаторы белковой природы. Ферменты ускоряют химические реакции в 100-1000 раз благодаря тому, что при взаимодействии с субстратом образуют фермент-субстратный комплекс, для этого требуется значительно более низкая энергия активации (по сравнению с протеканием реакции без фермента); на второй стадии этот комплекс распадается на продукты реакции и свободный фермент, который может взаимодействовать с новой молекулой субстрата.
Многие ферменты являются двухкомпонентными, т.е. состоят из белковой части - апофермента и связанного с ним небелкового компонента - кофермента, участвующего в действии фермента в качестве обязательного кофактора. В качестве коферментов могут выступать витамины и их производные, нуклеотиды и нуклеозиды.
Для характеристики активности ферментов используются различные единицы:
Стандартная единица фермента - это такое количество фермента, которое катализирует превращение одного микромоля данного субстрата за одну минуту при заданных условиях. Стандартная единица фермента обозначается буквой Е (единица) или буквой U (unit).
Катал - каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 моль в секунду, в заданной системе измерения активности. Каталитическая активность в 1 катал (кат) при практическом применении оказывается слишком большой величиной, поэтому в большинстве случаев каталитические активности выражают в микрокаталах (мккат), нанокаталах (нкат) или пико- каталах (пкат). Стандартная единица фермента находится с каталом в следующем соотношении: 1 Е (U) = 16,67 нкат.
В большинстве случаев ферменты обладают строгой специфичностью, а также лабильны, т. е. могут изменять свою активность под действием рН, температуры, в присутствии активаторов и ингибиторов и др.
Активаторами называют вещества, которые повышают активность ферментов. В роли активаторов могут выступать некоторые металлы, аминокислоты и другие вещества. Ингибиторами называют вещества, снижающие активность ферментов.
При определении названия ферментного препарата учитывают только основной фермент, активность которого преобладает. Наименование ферментного препарата начинается с сокращенного названия основного фермента. Если основным ферментом является амилаза, то наименование препарата начинается с «амил», глюкоамилаза - «глюк», у протеолитических ферментов - «прот», у пектолитических - «пект», у цитолитических - «цит» и т. д. Затем следует измененное видовое название продуцента. Наименование препаратаоканчивается на «ин». Если продуцентом является Aspergillus oryzae, то вторая часть названия фермента звучит «оризин», если Bacillus subtilis, то «субтилин», если Aspergillusawamori, то «аваморин», если Aspergillus foetidus, то «фоетидин», если Trichoderma viride, то «виридин» и т. д. В наименовании препарата отражается также и способ культивирования микроорганизма-продуцента. При глубинном культивировании после названия ставится буква «Г», при поверхностном - «П».
Выпускаемые ферментные препараты представляют собой либо жидкости с содержанием сухих веществ не менее 50 %, либо порошки белого, серого или желтоватого цвета с определенной стандартной ферментативной активностью.
Производство ферментных препаратов осуществляется поверхностным или глубинным способом (рис. 27). В основе поверхностного способа лежит выращивание микроорганизмов на рыхлых питательных средах. Этот способ используется для культивирования микроскопических грибов. При глубинном способе культивирования микроорганизмы выращиваются в толще жидких питательных сред. В этих условиях культивируют как аэробные, так и анаэробные микроорганизмы. Из поверхностных культур труднее получить высокоочищенные препараты, так как они содержат много балластных веществ. Питательные среды подбирают в зависимости от физиолого-биохимических особенностей микроорганизма-продуцента и того фермента, который необходимо получить.
Рис. 27. Принципиальная схема получения ферментных препаратов
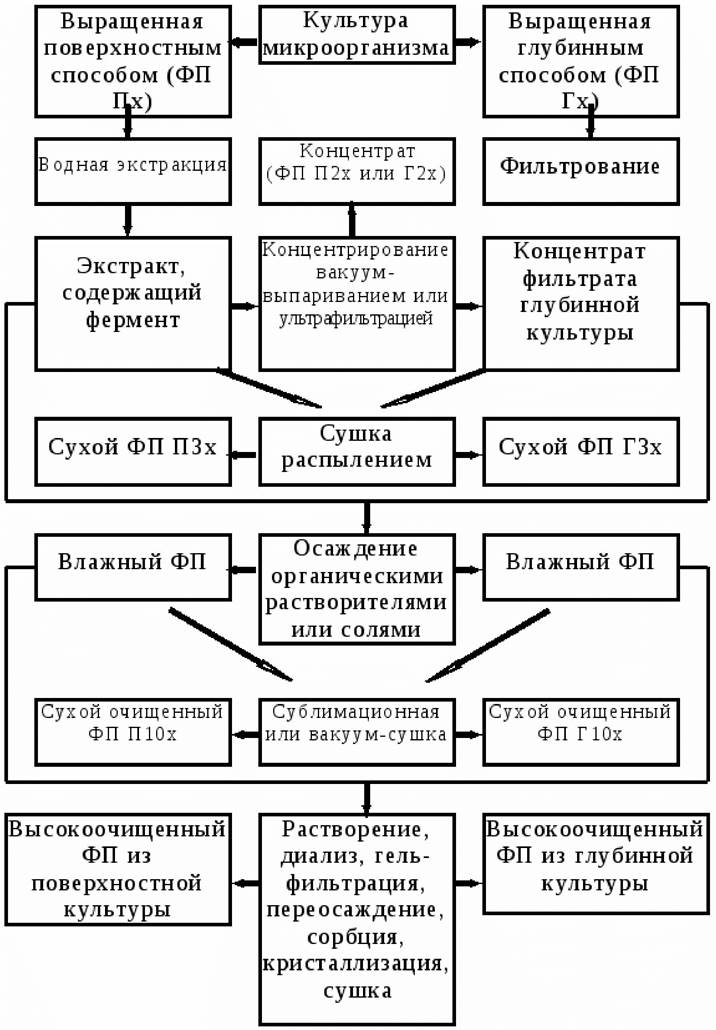
Ферментные препараты широко используются в различных отраслях промышленности. Отличаются они от чистых ферментов тем, что содержат один либо несколько ферментов с преобладанием какого-либо одного, а также балластные вещества среды, на которой были выращены микроорганизмы-продуценты ферментов. Для промышленного производства ферментных препаратов используют микроорганизмы, выделенные из природных источников, и мутагенные штаммы.
Основную часть ферментов, получаемых промышленным способом, составляют гидролазы. К ним относятся в первую очередь амилолитические ферменты: α-амилаза, β-амилаза, глюкоамилаза. Их основная функция - гидролиз крахмала и гликогена. Крахмал при гидролизе расщепляется на декстрины, а затем до глюкозы. Эти ферменты применяются в спиртовой промышленности, хлебопечении.
Продуцентами амилолитических ферментов являются микроскопические грибы родов Aspergillus, Rhisopus (видов oryzae, niger, awamori, batatae, foetidus, flavus и др). Большое количество амилолитических ферментов синтезируют также спороносные бактерии рода Bacillus (видов subtilis, mesentericus, brevis и др.).
Протеолитические ферменты образуют класс пептидгидролаз. Их действие заключается в ускорении гидролиза пептидных связей в белках и пептидах. Важная их особенность - селективный характер действия на пептидные связи в белковой молекуле. Например, пепсин действует только на связь с ароматическими аминокислотами, трипсин - на связь между аргинином и лизином. Среди продуцентов протеолитических ферментов практический интерес представляют грибы рода Aspergillus, Penicillium, Rhisopus. Спороносные бактерии рода Bacillus способны образовывать протеолитические ферменты. Протеазы находят широкое применение в разных отраслях промышленности: молочной - производство сыров, творога; мясной - для смягчения мяса; кожевенной - смягчение шкур; парфюмерной - добавки в зубную пасту, кремы, лосьоны; производство моющих средств - добавки для удаления загрязнений белковой природы; медицина - при лечении воспалительных процессов, тромбозов и т. д.
Пектолитические ферменты уменьшают молекулярную массу и снижают вязкость пектиновых веществ. Пектиназы делятся на две группы - гидролазы и трансэлиминазы. Гидралазы отщепляют метильные остатки или разрывают гликозидные связи. Трансэлиминазы ускоряют негидролитическое расщепление пектиновых веществ с образованием двойных связей. Применяются в текстильной промышленности (вымачивание льна перед переработкой); в виноделии - осветление вин; при консервировании фруктовых соков.
Продуцентами пектолитических ферментов являются бактерии, микроскопические грибы, дрожжи. Наибольшая продуцирующая способность обнаружена у грибов рода Aspergillus, Penicillium. Продуцентами пектиназы могут быть также анаэробы - спороносные бактерии рода Clostridium. Активными продуцентами цитолитических ферментов являются грибы Aspergillus, Penicillium, Fusarium, Trichoderma (вид viride).
Целлюлолитические ферменты очень специфичны, их действие проявляется в деполимеризации молекул целлюлозы. Обычно используются в виде комплекса, доводящего гидролиз целлюлозы до глюкозы (в гидролизной промышленности). В медицинской промышленности их используют для выделения стероидов из растений; в пищевой - для улучшения качества растительных масел; в сельском хозяйстве - в качестве добавки в комбикорма для жвачных животных. Целлюлолитические ферменты синтезируются в основном грибами, относящимися к различным видам: Aspergillus amstelodamy, Aspergillus fumigatus, Aspergillus oryzae, Aspergillus terreus, Fusarium culmorum, Fusarium oxysporum, Fusarium solani, Penicillium notatum, Rhizopus oryzae, Trichoderma lignorum, Trichoderma virida, Trichoderma koningii и многие другие. Они широко распространены в природе (в почве, в организмах животных, в растительных остатках).
Молокосвертывающие ферменты. В основе технологии производства сыров лежит способность казеина молока коагулировать под воздействием протеолитических ферментов, получивших название молокосвертывающих. Общее свойство молокосвертывающих ферментов, применяемых в сыроделии, - способность гидролизовать![]() казеин по связи Фен105-Мет106 называют молокосвертывающей активностью, в отличие от общей протеолитической активности - способности расщеплять другие связи в белках. Общая протеолитическая активность ферментов, применяемых в сыроделии, должна быть как можно более низкой по отношению к молокосвертывающей.
казеин по связи Фен105-Мет106 называют молокосвертывающей активностью, в отличие от общей протеолитической активности - способности расщеплять другие связи в белках. Общая протеолитическая активность ферментов, применяемых в сыроделии, должна быть как можно более низкой по отношению к молокосвертывающей.
Реннин (химозин) - фермент из класса гидролаз, который вырабатывается в желудочных железах млекопитающих. У жвачных животных вырабатывается железами сычуга (4-го отдела желудка), отсюда одно из его названий - сычужный фермент. Вторым главным составляющими сычужного фермента являются пепсин.
Сычуг, полученный из желудка теленка молочного возраста (до 3 месяцев), содержит 88-94 % химозина и 6-12 % пепсина. Сычуг из желудка более взрослого животного, получающего обычный корм, содержит 90-94 % пепсина и всего 10 % химозина. Химозин, полученный из желудка молочного теленка, наиболее активен при рН 6,2-6,4, а активность пепсина располагается в области повышенной кислотности при рН 1,7-2,3, поэтому эти ферменты дополняют друг друга, и их смеси нашли широкое применение в сыроделии.
В настоящее время в связи с дефицитом сычужного фермента из-за нецелесообразности забоя молодняка в молочный период жизни и снижения поголовья скота при резком возрастании его продуктивности широко используются другие ферменты, близкие по действию к сычужному: пепсины свиной, говяжий, птичий, а также энзимы, продуцируемые некоторыми микроорганизмами.
Разработаны методы генной инженерии, позволяющие включать гены, осуществляющие синтез сычужного фермента, в геномы микроорганизмов и тем самым осуществлять синтез сычужного энзима микроорганизмами. Сычужный фермент, полученный методами генной инженерии, уже вырабатывается и применяется в промышленных масштабах (табл. 4).
Таблица 4. Номенклатура, продуценты и производители микробиальных молокосвертывающих ферментов
Название фермента/ КФ* |
Продуцент |
Торговое название |
Производитель |
Аспергиллопепсин I (aspergillopepsin I) КФ 3.4.23.18 |
Aspergillus niger var. awamori |
CHY-MAX М Liquid |
Chr. Hansen, Дания |
Эндофиапепсин (еndothiapepsin) КФ 3.4.23.22 |
Endolhia parasitica |
Суперен |
Pfizer, США |
Мукорпепсин (mucorpepsin) КФ 3.4.23.23 |
Mucor miehei |
Реннилаза |
Novo Rennet, Дания |
Фромаза |
Wallerslein, США |
||
Микробиальн ый ренин |
Meito Sangyo, Япония |
||
Marzyme |
Danisko, Франция |
||
Milase |
CSK food enrichment, Нидерланды |
*КФ - код фермента по Международной классификации ферментов (энзимов).
Наряду с ферментными препаратами животного и микробного происхождения для сквашивания молока используются также препараты растительного происхождения. Экстракты растений, которые традиционно считались ферментными коагулянтами молока, такими не являются, так как они имеют другой механизм действия или, возможно, они содержат микробы, обладающие способностью к свертыванию молока. Примером использования растительного экстракта может служить выработка португальского сыра Sena da Estrela из овечьего молока с помощью водной вытяжки цветков кардона (артишока).
Известно, что использование ферментов, как сычужного, так и микробиального происхождения, производится однократно, в связи с этим являются актуальными использование и разработка приемов, позволяющих многократно использовать ферменты. Одним из таких приемов является иммобилизация, т. е. включение молекул фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться с находящимися в ней молекулами субстрата, эффектора или ингибитора.
Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами. Прежде всего, такие ферменты, представляя собой гетерогенные катализаторы, легко отделяются от реакционной среды, могут использоваться многократно и обеспечивают непрерывность каталитического процесса. Кроме того, иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечны и в десятки тысяч раз стабильнее свободных энзимов.
Методические указания
Оборудование и материалы: весы лабораторные аналитические, водяная баня, термостат, секундомер, ФЭК, рН-метр, пипетки на 5 и 10 см3, мерный цилиндр на 100 см3, колбы на 50-100 см3, бюретки на 25 см3, стаканы на 100 см3, чашка фарфоровая, пестик, шпатель, термометр со шкалой 0-100 С, 1 %-й раствор фенолфталеина, 0,1 н. раствор гидроксида натрия, 3 %-й раствор сычужного фермента, препарат амилазы, 1 %-й раствор крахмала, ацетатный буферный раствор с рН 4,7, 0,1 М раствор соляной кислоты, основной раствор йода.
Подготовить образцы к исследованию.
Приготовить рабочие растворы ферментных препаратов.
Исследовать влияние температуры и дозы протеолитического фермента на процесс свертывания молока.
Исследовать амилолитическую активность ферментов.
Сравнить полученные результаты и сделать выводы.
Техника определения
Изучение влияния температуры и дозы протеолитического фермента на процесс свертывания молока
Для свертывания молока в сыроделии применяют препараты сычужного фермента и пепсин, который содержит два компонента - химозин (реннин) и пепсин (А и В), оба свертывают молоко, но химозин более активен. Молокосвертывающая активность сычужного фермента зависит от соотношения компонентов и от свойств молока: кислотности, температуры и содержания в нем ионов кальция. Фермент стабилен при pH 5,3-6,3, имеет оптимальную активность при pH 6,2 и температуре 40 °С. Увеличение дозы фермента ускоряет процесс сычужного свертывания молока - сокращается общая продолжительность гелеобразования и его отдельных стадий.
Приготовление рабочего раствора фермента. Рабочий 0,03 %-й раствор сычужного фермента (пепсина) готовят
непосредственно перед проведение исследования из 3 %-го. Для приготовления рабочего раствора отмеряют 1 см3 3 %-го раствора фермента, вносят в мерную колбу на 100 см3 и доводят дистиллированной водой до метки.
Подготовить образцы сырого молока для исследований. Определить титруемую и активную кислотность молока.
В стаканы отмерить по 50 см3 молока и подготовить по схеме, представленной в табл. 5. Ставятся 2 серии параллельных опытов с применением сычужного фермента и пепсина.
Молоко подогреть до требуемой температуры и в каждый образец внести раствор фермента. Тщательно перемешать стеклянной палочкой. Палочку после каждого образца сполоснуть водой, протереть сухим бумажным фильтром или салфеткой.
Таблица 5. Схема исследования и результаты
Образец молока |
Температура свертывания, °С |
Количество 0,03 %-го раствора фермента, см3 |
Продолжительность свертывания молока с применением, мин |
|
препарата сычужного фермента |
препарата пепсина |
|||
8. |
40 |
10 |
||
9. |
5 |
|||
10. |
30 |
10 |
||
11. |
5 |
|||
12. |
20 |
10 |
||
13. |
5 |
|||
После внесения фермента молоко тщательно перемешать и оставить в покое до готовности сгустка. Готовность определяют визуально. Через каждые 2-3 мин стакан с образцом слегка наклоняют, чтобы определить начало свертывания молока. Затем оставляют в покое. Окончание процесса свертывания молока определяют: через каждые 2-3 мин аккуратно надавливают на поверхность шпателем или стеклянной палочкой у стенки сосуда. Если при незначительном разрушении сгустка начинает отделяться прозрачная сыворотка, процесс закончен.
Продолжительность свертывания отмечают по секундомеру и записывают в таблицу. Рассчитать дозу фермента, вносимую в каждый образец молока. Построить графики зависимостей продолжительности свертывания молока от дозы ферментных препаратов при разных температурах свертывания.
Сделать выводы.
Определение амилолитической активности ферментов (АС)
Метод основан на гидролизе крахмала ферментами амилолитического комплекса до декстринов различной молекулярной массы.
Амилолитическая активность характеризует способность ферментов катализировать гидролиз крахмала до декстринов различной молекулярной массы и выражается числом единиц указанных ферментов в 1 г препарата (или на 1 мг белка).
За единицу активности амилолитического фермента (АС) принято такое количество фермента, которое в строго определенных условиях температуры, рН и времени действия катализирует до декстринов различной молекулярной массы 1 г растворимого крахмала, что составляет 30 % от введенного в реакцию.
За единицу амилолитической активности (АС) принято такое количество фермента, которое при определенных значениях рН (6,0 - для бактериальных и 4,7 - для грибных амилаз) и температуре 30 °С за 1 ч катализирует гидролиз 1 г крахмала до декстринов различной молекулярной массы, что составляет 30 % крахмала, введенного в реакцию. Активность выражается в ед. АС/г (для порошкообразного) или в ед. АС/см3 (для жидкого) анализируемого ферментного препарата.
Техника определения
В 2 пробирки наливают по 5 мл 1 %-го раствора крахмала, ставят в термостат с температурой 30 С и выдерживают 5-10 мин. Не вынимая пробирки из термостата, наливают в первую пробирку 2,5 см3 дистиллированной воды (контрольная), а во вторую - 2,5 см3 ферментного раствора (опытная). Смеси быстро перемешивают и выдерживают в термостате 10 мин. Через 10 мин из контрольного и опытного растворов отбирают по 0,25 см3 и переносят в одну из колб с предварительно налитыми 25 см3 рабочего раствора йода. Содержимое колб перемешивают. Полученные растворы приобретают следующую окраску: контрольный - синюю, опытный - фиолетовую различной интенсивности в зависимости от количества непрогидролизованного крахмала. Непосредственно после смешивания растворов определяют их оптическую плотность на ФЭК с максимумом светопоглощения 656 нм, пользуясь кюветами с толщиной поглощающего слоя 10 см3. Контрольным раствором при колориметрировании является дистиллированная вода. Оптическая плотность контрольного раствора (Д1) соответствует количеству исходного субстрата - крахмала. Оптическая плотность опытного раствора (Д2) соответствует количеству крахмала, оставшегося после действия фермента. Разница между значениями оптической плотности соответствует прогидролизованному количеству крахмала.
Расчет активности фермента
Количество прогидролизованного крахмала С в граммах определяют по формуле
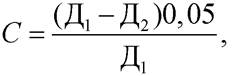
где Д1 - оптическая плотность контрольного раствора; Д2 - оптическая плотность опытного раствора; 0,05 - количество крахмала, взятое для испытания в качестве субстрата, г.
Если количество прогидролизованного крахмала меньше 0,02 или больше 0,04 г, испытание повторяют. При приготовлении рабочего раствора фермента берут большее или меньшее количество исходного раствора для разбавления.
Амилолитическую активность (ед/г) препарата бактериального происхождения (АС) определяют по формуле
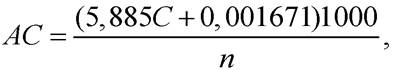
где С - количество прогидролизованного крахмала, г; n - количество ферментного препарата, взятое для испытания, мг; 1000 - коэффициент пересчета мг в г; 5,885 и 0,001671 - коэффициенты расчетного уравнения.
Коэффициенты расчетного уравнения получены при математической обработке экспериментальных данных зависимости количества прогидролизованного крахмала от количества фермента, взятого для испытания. В коэффициенты введен множитель для пересчета на 1 ч действия фермента.
Выполнить расчеты и сделать выводы.
Контрольные вопросы
1. Какими способами осуществляется производство ферментных препаратов?
2. Какие единицы используются для характеристики активности ферментов?
3. Назовите основные продуценты амилолитических ферментов.
4. Назовите основные продуценты протеолитических ферментов.
5. Назовите основные продуценты пектолитических и целюлолитических ферментов.
6. Дайте характеристику молокосвертывающих ферментов и назовите особенности их применения.
7. Назовите области применения ферментов.
8. В чем заключается преимущество применения иммобилизованных ферментов?
Оформление отчета
Отчет должен содержать:
1. Цель работы.
2. Описание основных групп ферментов и их продуцентов.
3. Описание факторов, влияющих на молокосвертывающую способность ферментов и их активность.
4. Расчеты амилолитической активности фермента.
5. Выводы.
Приготовление реактивов для определения амилолитической активности ферментов
1. Приготовление 1 %-ного раствора крахмала (субстрат).
1 г крахмала помещают в мерную колбу вместимостью 100 см3, добавляют 25 см3 воды и перемешивают. Затем добавляют в колбу еще 25 см3 воды, помещают колбу в кипящую водяную баню, непрерывно перемешивая до полного растворения крахмала. После этого содержимое колбы охлаждают, добавляют 10 см3 ацетатного буферного раствора рН 4,7 и доводят объём жидкости до метки дистиллированной водой. Раствор крахмала готовят в день проведения анализа.
2. Приготовление ацетатного буферного раствора с рН 4,7.
Раствор А - 1 М раствор уксусной кислоты. 58 см3 ледяной уксусной кислоты наливают в мерную колбу вместимостью 1000 см3 и доводят объем до метки дистиллированной водой.
Раствор Б - 1 М раствор уксуснокислого натрия. 82 г уксуснокислого натрия помещают в мерную колбу вместимостью 1000 см3 и доводят объем до метки дистиллированной водой.
Ацетатный буферный раствор с рН 4,7 готовят смешиванием равных объемов растворов А и Б. Проверяют значение рН на рН-метре.
3. Приготовление 0,1 М раствора соляной кислоты. 8,2 см3 соляной кислоты наливают в мерную колбу вместимостью 1000 см3 и доводят объем до метки дистиллированной водой.
4. Приготовление основного раствора йода.
0,5 г йода и 5 г йодистого калия растворяют в бюксе с притертой крышкой в малом количестве воды. Содержимое осторожно перемешивают при плотно закрытой крышке бюкса. После полного растворения йода раствор переносят в мерную колбу с притертой пробкой вместимостью 200 см3 и доводят объем до метки дистиллированной водой. Раствор хранят в темноте и используют в течение 1 месяца.
5. Приготовление рабочего раствора йода.
2 см3 основного раствора йода разводят 0,1 М раствором соляной кислоты в мерной колбе вместимостью 100 см3. Перед применением рабочего раствора проверяют на фотоэлектроколориметре его оптическую плотность, пользуясь светофильтром с максимумом пропускания при длине волны 453 нм и толщине пропускающего слоя 1 см3. Оптическая плотность раствора йода должна составлять 0,21-0,23. В случае отклонения оптической плотности раствора от этой величины ее приводят к необходимой, добавляя несколько капель кислоты или основного раствора йода.
6. Приготовление основного раствора ферментного препарата.
0,1 г исследуемого препарата взвешивают в стаканчике вместимостью 25 - 30 см3. Навеску тщательно растирают стеклянной палочкой с небольшим количеством воды, количественно переносят в мерную колбу вместимостью 100 см3, доводят дистиллированной водой до метки, перемешивают и при необходимости фильтруют. Раствор ферментного препарата может храниться в течение 1 суток при температуре от 0 до минус 4 °С.
7. Приготовление рабочего раствора ферментного препарата.
Рабочий раствор фермента готовят из основного раствора, разбавляя его так, чтобы в 5 см3 рабочего раствора содержалось такое количество фермента, которое обеспечивает в принятых условиях гидролиз крахмала от 20 до 70 %. Для этого берут различные количества основного раствора в зависимости от активности исследуемого препарата и разбавляют водой до 50 см3 (при испытании препарата с активностью от 20 до 700 ед/г) и до 200 см3 (при активности от 700 ед/г и выше). Количество основного раствора препарата, которое необходимо взять для приготовления рабочего раствора фермента, находят по таблице:
Амилолитическая активность (АС) препарата, ед/г (предполагаемая) |
Количество препарата в 5 см3 рабочего раствора, мг |
Количество основного раствора, необходимое для вторичного разбавления, см3 |
Общий объем разбавленного раствора, см3 |
От 20 до 80 |
5,0 |
50 |
50 |
От 80 до 150 |
2,0 |
20 |
50 |
От 150 до 300 |
1,0 |
10 |
50 |
От 300 до 700 |
0,5 |
5 |
50 |
От 700 до 1200 |
0,25 |
10 |
50 |
От 1200 до 2500 |
0,125 |
5 |
200 |
От 2500 до 5000 |
0,05 |
2 |
200 |
Свыше 5000 |
0,025 |
1 |
200 |