БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 19.БІОТЕХНОЛОГІЇ ОДЕРЖАННЯ L-АМІНОКИСЛОТ
19.1. МЕТОДИ ОДЕРЖАННЯ L-АМІНОКИСЛОТ
Враховуючи потребу народного господарства в амінокислотах, налагоджено крупнотоннажне промислове їх виробництво. Промислове виробництво амінокислот базується в основному на трьох процесах: гідроліз природної білоквмісної сировини (рослинного і тваринного походження), хімічний та мікробіологічний синтез. Одержання амінокислот гідролізом білкових речовин - найдавніший і найменш ефективний метод. Основними його недоліками є: висока вартість одержаних амінокислот, обмеженість сировинних ресурсів тощо.
Серед методів одержання амінокислот у промисловому масштабі найбільше значення мають мікробіологічні і хімічні. У сучасній світовій практиці за допомогою мікробного синтезу одержують близько 60 % усього об’єму вироблених амінокислот.
Хімічний синтез амінокислот досить ефективний. Він дає можливість одержувати сполуки будь-якої структури й організувати виробництво з високим рівнем автоматизації. Тепер розроблено і реалізовано у промисловому масштабі виробництво багатьох амінокислот методом органічного синтезу — метіоніну, лізину, глутамінової кислоти, триптофану, гліцину тощо. За сучасними технологіями здійснюється також синтез індивідуальних амінокислот з високим виходом і високим ступенем очищення. Однак цей метод має низку суттєвих недоліків.
Так, сучасними методами тонкого органічного синтезу можна одержати D- і L-форми амінокислот у будь-яких кількостях, однак вони знаходяться у вигляді рацематів, тобто рівних за масою сумішей L- і D-амінокислот, молекули яких в L- і D-формі являють собою дзеркальне відображення одна одної. У хімічних реакціях ці ізомери не відрізняються один від одного. Але, як відомо, в організмі тварин (людей) використовується тільки L-амінокислота. Другий ізомер (D-амінокислота) не має біологічної активності і тому не може брати участі в біосинтезі білка. Білки ссавців побудовані виключно з одного типу амінокислот — L-форми. Присутність D-амінокислоти в готовому продукті завжди небажано не тільки через те, що вона є баластом, але й тому, що деякі амінокислоти мають токсичні властивості. Винятком є гліцин і метіонін. Для першого не існують оптично активні ізомери, а у другого D- та L-форми засвоюються організмом людини і тварини однаково.
Крім цього, виробництво амінокислот методом органічного синтезу передбачає здійснення великої кількості технологічних операцій. Реалізація практично кожної з них вимагає певного обладнання. Технологія такого виробництва у більшості випадків направлена на використання достатньо токсичних речовин, високоочищених реагентів і здійснення стадії розділення рацематів, що утворюються. Методи ж розділення рацемічної суміші, у свою чергу, досить складні і потребують значних витрат, а в окремих випадках для деяких амінокислот їх взагалі не розроблено.
Розділення рацемічної суміші на L- і -D-амінокислоти. З існуючих методів розділення рацемічної суміші на складові ізомери найбільш придатним є ферментативний метод, що ґрунтується на використанні пліснявої аміноацилази. Як вихідну сировину використовують ацильовані Д-, L-ізомери амінокислоти, одержані за допомогою хімічного синтезу, і впливають на них аміноацилазою. Фермент вибірково гідролізує тільки ацил-L-ізомер, відщеплюючи від нього об’ємну ацильну групу. В результаті утворюється відповідна L-амінокислота, яка має вищу розчинність, ніж ацил-D-ізомер, що залишився нерозщепленим у розчині.
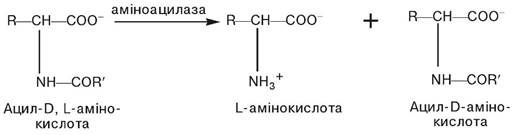
В результаті ферментативного гідролізу утворюється суміш, яка складається із L-амінокислоти і ацил-D-ізомера амінокислоти. Вона легко розділяється, оскільки її компоненти мають різну розчинність, і виділяється L-амінокислота. Ацил- D-амінокислота, яка залишається, при підігріванні рацемізується, тобто знову переходить у суміш ацильованих L, D-амінокислот і процес повторюється спочатку. Таким чином, єдиним продуктом є L-амінокислота.
Оскільки аміноацилаза має чітку специфічність лише до будови ацильної частини і слабку специфічність щодо будови бічного ланцюга амінокислоти, вона може бути використана для розділення багатьох амінокислот.
Вперше на промисловому рівні розділення рацемічної суміші на її складові ізомери було здійснено в Японії компанією «Танабе Сейяку» в 1969 р. Спочатку використовувався нативний фермент, а потім іммобілізований, завдяки якому економічна ефективність процесу виросла у півтора раза. Тепер компанія здійснює на промисловому рівні виробництво п’яти L-амінокислот, з яких чотири є незамінними (метіонін, валін, фенілаланін, триптофан).
Комерційні препарати аміноацилази іммобілізовані методом адсорбції на ДЕАЕ - сефадексі за рахунок іонних взаємодій (японська фірма «Танабе Сейяку») і шляхом включення ферменту у порожнисті нитки триацетату целюлози (італійська фірма «Снам Проджетті»).
Мікробний синтез - найбільш перспективний і економічно вигідний спосіб виробництва амінокислот. Він є альтернативою хімічному синтезу. За допомогою цього методу можна одержати майже всі протеїногенні амінокислоти. Принцип мікробного методу полягає в аеробному вирощуванні мікроорганізмів у поживних розчинах, які містять різні джерела вуглецю, азоту і мінеральних солей та ростових речовин. Мікробний метод має низку переваг перед хімічним. Перш за все, ферментна система мікробної клітини утворює тільки біологічно активний L-ізомер, що забезпечує його виділення і очищення та випуск технічних препаратів з низькою вартістю і в достатній кількості.
Основою створення крупнотоннажного виробництва L-амінокислот мікробіологічним методом було відкриття японськими вченими феномена надсинтезу екстрацелюлярних амінокислот ауксотрофними бактеріальними мутантами із родів Brevibacterium, Micrococcus, Corynebacterium тощо.
Ауксотрофні мутанти — це клітини мікрорганізмів, які, з одного боку, втратили здатність самостійно синтезувати необхідні для росту і розвитку різні амінокислоти, а з іншого — набули здатності до надсинтезу цільової амінокислоти. Такі мутанти можна одержати шляхом впливу різних мутагенів фізичної і хімічної природи на вихідну культуру мікроорганізмів з подальшою селекцією штаму за наперед заданими ознаками, або методом генетичної інженерії.
Отже, спеціально підібрані, відселекціоновані, а інколи і сконструйовані методами генетичної інженерії штами-проду- центи в процесі життєдіяльності, за звичай на різних стадіях розвитку, здійснюють так званий надсинтез L-амінокислот, тобто виробляють їх у кількостях, що набагато перевищують потребу самих клітин. Надлишок L-амінокислот екскретується в культуральну рідину, звідки їх і добувають.
Промислове виробництво L-амінокислот за допомогою мікроорганізмів можна здійснювати за двома технологічними схемами. В основному вони відрізняються стадією одержання культуральної рідини. У першій передбачається виробництво культуральної рідини за два етапи (двоступінчастий спосіб), а у другій — за один етап (одноступінчастий спосіб).
Двоступінчастий спосіб грунтується на використанні як сировини одного із попередника біосинтезу необхідної амінокислоти, який може одержуватись хімічним або біологічним методом. Одержання попередника — це перший ступінь виробництва. До
нього належить і біосинтез ферментного препарату (як правило, мікробного походження), за участю якого відбуватиметься трансформація попередника в цільову амінокислоту.
Друга стадія — це власне процес трансформації попередника в амінокислоту за допомогою ферментних систем мікроорганізма, вирощеного на першій стадії.
Одноступінчастий спосіб синтезу амінокислот найбільш розповсюджений і грунтується на культивуванні чітко визначеного штаму-продуцента цільової амінокислоти на середовищі певного складу при відповідних параметрах процесу ферментації. З цією метою, як правило, вибирають поліауксотрофні мутанти.
При виробництві амінокислот у вигляді високоочищених кристалічних препаратів після завершення ферментації проводять виділення клітин продуцента з культуральної рідини. Цільову амінокислоту виділяють із культуральної рідини за допомогою іонного обміну або методом осадження. Елюати або маточні розчини концентрують вакуум-випарюванням, а технічні кристали, які утворились, очищають шляхом перекристалізації із насиченого розчину. Завершується процес одержання кристалічного препарату, як правило, вакуум-сушкою очищених кристалів і їх упаковкою.
Побічними продуктами такого виробництва можуть бути різні кормові препарати, які виробляються на основі різних відходів виробництва — маточні розчини амінокислоти, біомаса продуцента, промивні води тощо, які висушуються до залишкової вологості близько 10 %.
При випуску кормових препаратів з невисоким вмістом основної амінокислоти (не більше 10 %) технологія їх виробництва передбачає тільки стабілізацію розчину культуральної рідини перед вакуум-упарюванням, концентрування сухих речовин культуральної рідини, стандартизацію розчину шляхом додавання наповнювача, сушку готового продукту і його упаковку.
При одержанні технічних або кормових препаратів з підвищеним вмістом основної речовини (амінокислоти) додатково відділяють клітини продуцента і частково концентрують амінокислоти в нативному розчині методом іонного обміну або осадження.
Недоліки мікробіологічного способу одержання амінокислот також полягають у специфіці застосування мікробіологічних методів. Крім цього, ми не завжди володіємо необхідними знаннями про метаболізм клітини і шляхи його регуляції.
У разі, коли шлях прямої ферментації не достатньо розроблений або економічно малоефективний, амінокислоти отримують хіміко-мікробіологічним (комбінованим) шляхом, при якому вихідна сполука утворюється в результаті хімічних реакцій, а кінцева стадія здійснюється мікроорганізмами.
Одержання амінокислот з білкових гідролізатів. Цей спосіб полягає у гідролізі (кислотному, лужному, ферментативному) деяких найбільш доступних природних білків. До них належать відходи м’ясної промисловості, казеїн молока, клейковина пшениці та інші. Недоліками цього способу є: обмеженість і нестандартність джерел сировини, багатоступенева хімічна обробка, пов’язана з виділенням амінокислот і їх очищенням. Крім того, гідроліз під дією мінеральних агентів призводить до часткового руйнування таких цінних амінокислот, як триптофан, треонін, цистеїн, серин.