БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина І. Загальна біотехнологія
РОЗДІЛ 5. ОСНОВИ ГЕНЕТИЧНОЇ ІНЖЕНЕРІЇ
5.1.БІОТЕХНОЛОГІЯ КОНСТРУЮВАННЯ РЕКОМБІНАНТНИХ ДНК
5.1.3.Конструювання рекомбінантної ДНК
Розробка технології конструювання рекомбінантних ДНК є одним з найважливіших досягнень молекулярної біології. Молекули ДНК, у тому числі і гігантські молекули ДНК еука- ріот, що містять цікаві для дослідника гени, за допомогою рестрикційних ендонуклеаз (рестриктаз) розщеплюють на окремі фрагменти. Заслуговує на увагу та обставина, що за допомогою одного і того самого ферменту рестрикції здійснюють розщеплення як молекули ДНК, з якої планується одержання необхідного гена, так і ДНК вектора (плазміди чи помірного фага). У цьому випадку рестрикційна ендонуклеаза, наприклад EcoRI, що є бактеріальним ферментом, розщеплює короткі палиндромні (ті, що мають вісь симетрії другого порядку) послідовності в специфічних місцях усередині цих послідовностей навскіс в обох ланцюгах хромосомної ДНК і ДНК вектора з утворенням комплементарних одноланцюгових виступів, що мають назву липких кінців. Дуже важливо, що за допомогою ферментів удається хромосомну ДНК, з якої утвориться безліч фрагментів, і ДНК плазміди перевести в лінійну форму, а потім одноланцюгові комплементарні кінці фрагмента великої молекули ДНК і плазміди піддати відпалу, що веде до з’єднання
липких кінців у результаті спарювання азотистих основ, а наявний у структурі відпаленої ДНК розрив усунути за допомогою легкодоступного бактеріального ферменту ДНК-лігази (рис. 5.1).
Відомі й інші методи, що застосовуються у генетичній інженерії (конекторний, лінкерний), за допомогою яких досягається з’єднання неспоріднених молекул ДНК. З’єднання двох неспо- ріднених молекул ДНК конекторним методом досягається за рахунок ферментативного приєднання за допомогою кінцевої трансферази (дезоксинуклеотидилтрансферази) полі(dА)-фрагментів до обох 3'-кінців однієї з двох неспоріднених молекул ДНК; до обох 3'-кінців другої неспорідненої молекули ДНК приєднують фрагменти полі(dТ). Для з’єднання 3'-кінців дволанцюгової структури ДНК можна використовувати гомополімерні нуклеотидні послідовності, що складаються з гуанінового і цитидилового нуклеотидів. Особливістю термінальної дезоксинуклеотидилтрансферази є незалежність її дії від присутності полінуклеотидної матриці, у зв’язку з чим подовження 3-кінців молекул ДНК, що з’єднуються, можливе за рахунок гомополімерних нуклеотидних послідовностей довжиною близько 100 залишків. У зв’язку з тим, що приєднані до 3'-кінців однотипні полінуклеотидні послідовності можуть мати різну довжину, дефекти, що виникли в зв’язку з цим у двоспіральній структурі ДНК, добудовуються за рахунок ДНК-полімерази I.
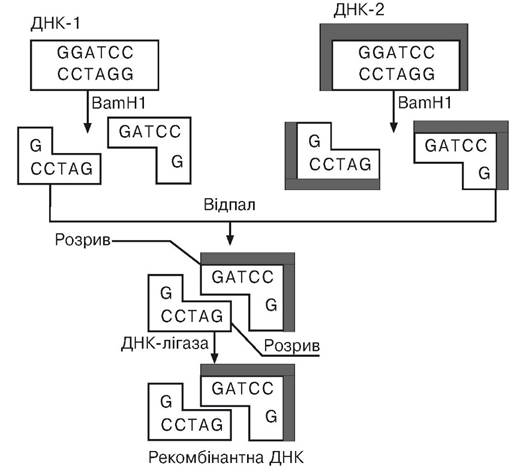
Рис. 5.1. Схема конструювання рекомбінантної ДНК
(за Хопвудом Д., 1984)
З’єднання фрагментів ДНК і вектора, утворених у результаті дії відповідних ферментів рестрикції, здійснюють за допомогою методу, що включає в себе елементи методів конекторного та липких кінців. Для цього попередньо хімічним шляхом синтезують олігонуклеотидний фрагмент, що складається з 6-10 пар нуклеотидних залишків. Цей фрагмент виконує з’єднуючу функцію, і тому називається лінкером. За його допомогою з’єднуються кінці клонованого фрагмента ДНК і вектора, у який цей фрагмент уводиться для утворення рекомбінантних молекул ДНК. Попередньою умовою при створенні лінкера є можливість наступного його розщеплення відповідною рестрикційною ендонуклеазою. Потім до 3'-кінців плазмідного чи іншого походження вектора і фрагментів ДНК приєднують з утворенням ковалентних зв’язків заздалегідь синтезований лінкер (сполучний ланцюг), а 5'-кінці лінкера клонованої ділянки ДНК і ДНК вектора фосфорилюють за участю поліну- клеотидкінази і за допомогою лігази (фага Т4), що утворює ковалентний зв’язок між тупими кінцями ДНК. Тупі кінці, утворені приєднанням лінкера до клонованого фрагмента ДНК чи вектора після ферментативної обробки відповідною рестриктазою, наприклад EcoRI, перетворюють на липкі кінці (рис. 5.2), в основі з’єднання яких лежить механізм, описаний вище.
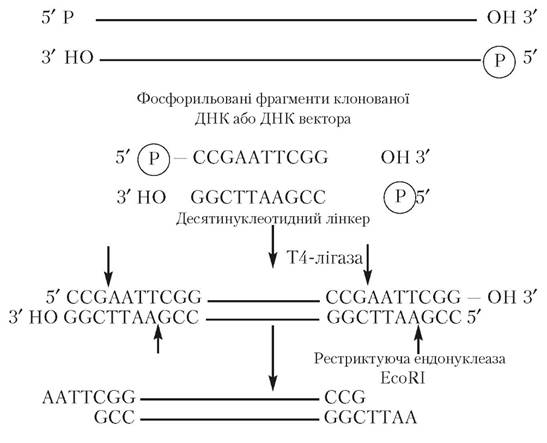
Рис. 5.2. Схема з’єднання фрагментів ДНК комбінованим (лінкерним) методом. Стрілками позначені місця дії рестриктази,
що призводить до утворення липких кінців
(за Страйєром Л., 1985)
На стадії виділення клонованих генів сумарну ДНК клітини-донора (наприклад, ссавця) за допомогою ферментів рестриктаз, що виконують роль своєрідного захисника, який охороняє клітину від вторгнення чужорідної ДНК, розщеплюють на фрагменти розміром від 1 до 30 тис. нуклеотидів. Складний геном удається розділити на кілька сотень тисяч полінуклеотидних фрагментів, кожний з яких можна вмонтувати в молекулу ДНК вектора. Важливо, щоб полінуклеотидний фрагмент ДНК клітини-реципієнта, що вбудовується, не перевищував поліну- клеотидної ємності вектора, що використовується.
З фрагментів, що утворяться при розщепленні ендонуклеазами сумарної геномної ДНК і ДНК вектора (плазміди чи бактеріофага) за допомогою методу липких кінців, конекторного чи комбінованого (лінкерного) методів у присутності ДНК-лігази одержують молекулу рекомбінантної (гібридної) ДНК. У присутності всіх необхідних компонентів процес утворення рекомбінантної ДНК завершується протягом декількох хвилин.
Наступна стадія на шляху клонування рекомбінантної ДНК — введення цих гібридних молекул, що складаються з убудованих у ДНК вектора клонованих фрагментів ДНК, у тому числі еукаріотичних організмів, у бактеріальну клітину-хазяїна. Процес проникнення так званих голих молекул ДНК у бактеріальну клітину і здатність їх надавати цим клітинам нових спадкових ознак описані американськими дослідниками з лабораторії Ейвери О.Т. (1944). Явище поглинання ДНК із середовища бактеріальними та еукаріотичними клітинами одержало назву трансформації. Ефективність трансформації дуже низька: тільки одна з мільйона молекул ДНК проникає у клітину. Створюючи особливі умови, кількість трансформованих клітин можна значно збільшити.
Важливою умовою одержання рекомбінантних молекул ДНК є вибір таких плазмід, у яких була б тільки одна ділянка специфічної взаємодії з певною рестрикційною ендонуклеазою. За дотримання цієї умови кільцева плазмідна ДНК при ферментативному розщепленні перетворюється тільки на одну лінійну молекулу. Якщо в плазміді є декілька палідромних послідовностей, з якими специфічно взаємодіє фермент рестрикції, то в результаті його гідролітичної дії плазмідна ДНК розпадається на кілька фрагментів. Для одержання рекомбінантних молекул ДНК необхідно створити дрібні плазміди з високою швидкістю їхнього розмноження.
Нині при створенні нових векторів уже на стадії планування ставиться завдання одержання таких рекомбінантних молекул, які, маючи інші необхідні властивості, порівняно легко могли б проникати в клітину-хазяїна. Такі вимоги задовольняє вектор, сконструйований на основі мутантної форми фага λ, що одержав назву λ g t-λ. Під впливом рестриктази EcoRI цей мутант розщеплюється у двох місцях (кількість місць розщеплення під впливом рестриктази в дикого типу досягає п’яти). Важливим моментом, що дозволяє використовувати цей фаговий мутант як вектор, є й те, що значні ділянки його ДНК можна видалити, не змінивши при цьому інфекційних властивостей бактеріофага. На частку ДНК, що залишилася після розщеплення EcoR1 припадає 72 % довжини вірусного геному. Дефект, що утворився після елімінації ділянки вірусної ДНК, можна заповнити фрагментом ДНК розміром 10 kb, який призначений для клонування. У такому випадку гібридна молекула ДНК, створена на базі фага λ і має 93 % первісної довжини (до обробки рестриктазою), може бути інкапсидована (упакована) у голівці вірусу. Однією з основних переваг створених на основі фага λ векторів є їх здатність проникати в бактерії з ефективністю, що значно перевершує таку ж у гібридних молекул, сконструйованих на плазмідній основі.