БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 7. БІОТЕХНОЛОГІЯ ВИРОБНИЦТВА І ЗАСТОСУВАННЯ ІММОБІЛІЗОВАНИХ ПРЕПАРАТІВ
7.5. МЕТОДИ ІММОБІЛІЗАЦІЇ ФЕРМЕНТІВ
Існуючі способи іммобілізації ферментів діляться на 2 групи: фізичні і хімічні методи.
7.5.1.Фізичні методи іммобілізації
7.5.1.2. Методи механічного включення молекул ферменту в структуру носія
Іммобілізація ферментів шляхом включення в гелі. Суть цього методу іммобілізації полягає в тому, що фермент включається у тривимірну сітку із тісно переплетених полімерних ланцюгів, які утворюють гель (рис. 7.2, б). Утримання молекул ферменту відбувається за рахунок того, що середня відстань між сусідніми ланцюгами в гелі менша за молекули включеного ферменту, тому він не може полишити полімерну матрицю і вийти в розчин. Певну роль в утриманні ферменту в сітці гелю відіграють іонні і водневі зв’язки, які виникають між ферментом і носієм. Простір між полімерними ланцюгами в гелі заповнений водою, на частку якої зазвичай припадає значна частина загального об’єму гелю.
Гелі можуть бути як органічної, так і неорганічної природи. Неорганічні — це силікагель, гель фосфату кальцію. З органічних використовуються гелі природних поліцукрів (крохмалю, агар-агару, агарози карагінана тощо), природних білків — колагену, а також синтетичних полімерів.
Ефективність включення ферменту в гелі досягається при оптимальному поєднанні розмірів пор гелю і молекули ферменту та оптимізації мікрооточення ферменту.
Для підвищення механічної міцності носіїв і більш міцного утримування включеного в них ферменту використовується обробка матриць біфункціональними зшиваючими реагентами, які здатні взаємодіяти з функціональними групами ферменту.
Перевагою методу є його простота, можливість одержання іммобілізованих препаратів у будь-якій формі (сферичні частинки, плівки та ін.), універсальність, тобто можливість використання для іммобілізації будь-яких біологічно активних речовин, поліферментних систем і навіть клітин. Одержані препарати стабільні, оскільки захищені гелем від несприятливих зовнішніх впливів, у тому числі і від бактеріального забруднення, оскільки крупні бактеріальні клітини не можуть проникнути у дрібнопористу матрицю.
Недоліком одержаних таким методом препаратів є певні дифузні труднощі при взаємодії ферменту з субстратом. А коли субстратом є високомолекулярна сполука, то цей спосіб іммобілізації взагалі не може бути використаний.
Іммобілізація ферментів з використанням напівпроникних оболонок (мембран). Загальний принцип, який лежить в основі цього способу, полягає в тому, що водний розчин ферменту відділяється від водного розчину субстрату напівпроникною мембраною, яка є непроникною для ферменту й інших високомолекулярних сполук, але дає можливість вільно дифундувати через неї низькомолекулярним речовинам — субстратам і продуктам реакції (рис. 7.5). Фермент бере участь у каталітичній реакції, перебуваючи у нативному стані в розчині і, утримуючись мембраною, легко може бути відокремлений від продуктів реакції.
Існуючі модифікації цього методу відрізняються лише способами одержання напівпроникної мембрани: методи міжфазової поліконденсації, міжфазової коацервації і метод подвійної емульгації.
Мікрокапсулювання. Цей спосіб іммобілізації ферментів розроблений Т. Чангом (1964). Суть його полягає в тому, що водний розчин ферменту включають всередину мікрокапсул — замкнених сферичних пухирців з тонкою полімерною стінкою — мембраною (рис. 7.5, а). Залежно від способу одержання розміри мікрокапсул складають десятки або сотні мікрометрів, а товщина мембрани — соті-десяті долі мікрометра при діаметрі пор близько декількох нанометрів.
Метод мікрокапсулювання особливо зручний для іммобілізації поліферментних систем і може бути придатним для іммобілізації інших БАР, клітинних органел та інших субодиниць клітини, гомогенатів тканин тощо.
Включення ферменту у волокна. Це аналогічний мікро- капсулюванню метод, який відрізняється від мікрокапсулювання головним чином формою одержаних препаратів. У першому випадку утворюються сферичні мікрокапсули, а в другому — нитки.
Основа методу полягає у розчиненні волокноутворюючого полімеру (похідні целюлози, полівінілхлорид, полі-N-метилглутамат) в органічному розчиннику, емульгації одержаного розчину з розчином або суспензією ферменту і протисненні емульсії через фільєри в рідину, яка викликає коагуляцію (наприклад, толуол).
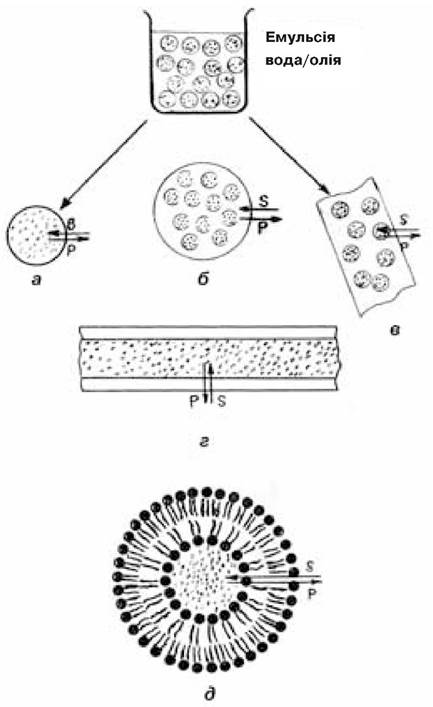
Рис. 7.5. Іммобілізація ферментів з використанням напівпроникних оболонок (мембран)
(за Березіним І.В. та ін., 1987):
а — мікрокапсулювання; б, в — включення у волокна; г — включення у порожнисті нитки з напівпроникними стінками; д — включення в ліпосоми; крапками позначені молекули ферменту; символами S і Р субстрат та продукт ферментативної реакції відповідно
Одержані волокна — це пористі полімерні гелі, які містять гомогенну дисперсію невеликих крапель водного розчину ферменту розміром близько 1 мкм (рис. 7.5, в). Змінюючи умови процесу коагуляції, можна змінювати розмір пор у волокнах та кількість включеного ферменту. Однак не всі ферменти можуть бути інкапсульовані у волокнах. Перешкодою є жорсткі умови обробки (контакт з органічними розчинниками).
Для іммобілізації можуть використовуватись і одержані промисловістю готові полімерні порожнисті волокна, які застосовуються для очищення білків методом діалізу (рис. 7.5, г). їх виготовляють з природних і синтетичних полімерів (целюлоза, полівінілхлорид, поліакриламід).
Для проведення ферментативної реакції волокна, заповнені розчином ферменту, занурюють у розчин субстрату, який дифундує через мембрану всередину волокна.
Недоліком методу є можливість використання тільки низькомолекулярних субстратів. Волокна, як і мікрокапсули, придатні для іммобілізації поліферментних систем, клітин, клітинних фрагментів.
Перевагою методу є його простота. Ферментомісткі волокна мають високу механічну міцність.
Включення ферменту в ліпосоми. Цей метод може використовуватись для іммобілізації практично всіх біологічно активних речовин, а одержані препарати широко застосовуються в медицині, а також для проведення фундаментальних досліджень, оскільки такі системи близькі до природних мембран і їх вивчення може дати цінну інформацію про ферментативні процеси в клітині.
Ліпосоми — це концентричні бішарові замкнуті ліпідні мембрани. Існують декілька способів їх одержання (рис. 7.5, д). У простішому випадку розчин ліпіду (зазвичай лецитину) розчиняють в органічному розчиннику, який упарюють у вакуумі, а на стінках посудини залишається тонка плівка ліпіду. Вона диспергується у водному середовищі, в якому міститься фермент (БАР), з утворенням сферичних капсул — ліпосом. Спосіб інкапсулювання (іммобілізації) ферментів (або інших БАР) в ліпосомах зводиться таким чином до диспергування ліпідної плівки у присутності розчину ферменту.
У другому варіанті методу розчин ліпіду в органічному розчиннику нашаровують на поверхню водного розчину ферменту, після чого органічний розчинник видаляють шляхом випарювання в струмі інертного газу, а ліпідну плівку, що утворилась, диспергують у водному розчині.
Розмір ліпосом залежно від методу їх одержання і фосфоліпідного складу може становить від 250 оА до 1мк і більше. Ліпо- соми можуть бути полі- і моноламелярними, тобто складатись з декількох або одного ліпідного шару. Центральне водне ядро поліламелярних ліпосом має діаметр 0,15 мк, а відстань між сусідніми бішарами дорівнює ~ 75 мк.
Спосіб інкапсулювання ферментів (або інших БАР) в ліпо- сомах зводиться таким чином до диспергування ліпідної плівки у присутності розчину ферменту.
Характер взаємодії включеного білка-ферменту з ліпідними шарами різноманітний. Частина молекул взаємодіє із внутрішніми ліпідними шарами, частково проникаючи в них, а інші молекули ферменту можуть адсорбуватись на зовнішній поверхні ліпосоми.
Відмінність у властивостях структурних частин ліпосом розширюють можливості іммобілізації. Так, речовини, розчинні у воді, можуть включатись у внутрішню фазу ліпосом і/або водний простір між концентричними бішарами, а жиророзчинні можуть включатись у саму мембрану ліпосом. Включення в ліпосоми захищає інкапсульовану речовину від інактивуючого впливу оточуючого середовища.
Сучасні методи одержання ліпосом дають можливість включати в них майже 50 % ферменту, який знаходиться в розчині, причому практично без втрати каталітичної активності.
Іммобілізація ферментів з використанням систем двофазового типу. Відмінною рисою цього способу іммобілізації є те, що обмеження вільного переміщення ферменту в об’ємі системи досягається не за рахунок його взаємодії із жорстким носієм (сорбентом, гелем або мембраною), а внаслідок його здатності розчинятись тільки в одній із фаз двофазової системи, наприклад типу «вода — органічний розчинник, що не змішується з водою» (рис. 7.2, г). В таких системах фермент присутній тільки в одній фазі, а продукт ферментативної реакції зосереджується у другій. Метод простий, однак використання його обмежується низькою швидкістю процесу, можливістю інактивації ферменту на межі розділення фаз, а також переходом ферменту в протилежну фазу, що призводить до забруднення продукту і втрати дорогого каталізатора. Перевагою систем такого типу є можливість перетворення макромолекулярних субстратів.
Отже, перевагою методів механічного включення є те, що іммобілізована біологічно активна речовина захищена від несприятливих зовнішніх впливів шаром носія, що дає можливість одержати стабільні іммобілізовані препарати.
Недоліком є неспецифічні взаємодії між включеним ферментом і носієм, а також можливі міжмолекулярні взаємодії білків, що спричинює їх автоліз.