БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
Розділ 7. БІОТЕХНОЛОГІЯ ВИРОБНИЦТВА І ЗАСТОСУВАННЯ ІММОБІЛІЗОВАНИХ ПРЕПАРАТІВ
7.5. МЕТОДИ ІММОБІЛІЗАЦІЇ ФЕРМЕНТІВ
7.5.2. Хімічні методи іммобілізації
7.5.2.2.Характеристика реагентів
Носій. Для хімічної іммобілізації можуть використовуватись носії як органічної, так і неорганічної природи, природні або синтетичні. У кожному конкретному випадку використовується носій, який має реакційноздатні групи або в нього ці групи введені шляхом активації чи обробки модифікуючими агентами.
Активацію носіїв проводять з метою введення на поверхню електрофільних груп, які реакційноздатні стосовно до нуклеофільних груп білка (аміно- і SH-груп). Для цього, наприклад, вводять діазогрупи, альдегідні, імідоефірні, азидні групи.
Як активатори носіїв використовуються діальдегіди, бром- ціан, ароматичні хінони, карбодиіміди, хлортриазини, епоксиди, реактив Вудворда тощо.
Зшиваючі реагенти. Можуть бути як простими біфункціональними (тобто з двома однаковими або різними за хімічною природою реакційноздатними групами) і складними, поліфункціональними, в тому числі і побудованих із різних за хімічною природою ланок з неоднаковими за міцністю зв’язками між ними.
Найбільш широко як багатофункціональні зшиваючі реагенти використовуються: глутаровий альдегід, 2,4-динітро-3,5-дифторбензол, низькомолекулярні карбодиіміди, ціанурхлорид, епоксиполііміни.
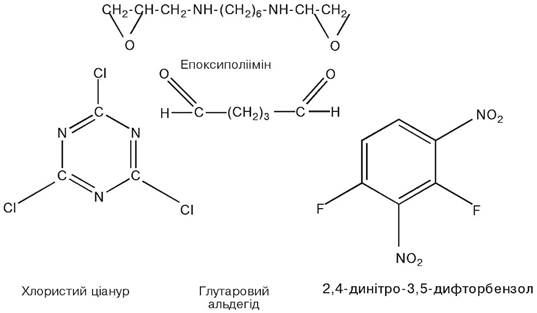
Епоксиполііміни здійснюють поперечне зшивання біокаталізаторів за рахунок епокси- та іміногруп.
Хлористий ціанур містить три активних атоми хлору. Він взаємодіє з целюлозою (носій) і ферментом, а третій реакційноздатний зв’язок![]() може бути використаний для взаємодії з іншим компонентом.
може бути використаний для взаємодії з іншим компонентом.
Глутаровий альдегід, який є біфункціональним реагентом, своїми альдегідними![]() групами при нейтральній реакції середовища утворює ковалентний зв’язок з вільними аміногрупами носія і ферменту. Недоліком його є те, що він може взаємодіяти з функціональними групами, які входять до складу активного центру, в результаті чого фермент інактивується. Щоб запобігти цьому, активний центр захищають глутатіоном, цистеїном або іншим низькомолекулярним тіолом тощо.
групами при нейтральній реакції середовища утворює ковалентний зв’язок з вільними аміногрупами носія і ферменту. Недоліком його є те, що він може взаємодіяти з функціональними групами, які входять до складу активного центру, в результаті чого фермент інактивується. Щоб запобігти цьому, активний центр захищають глутатіоном, цистеїном або іншим низькомолекулярним тіолом тощо.
Зшиваючі реагенти використовуються для віддалення молекули іммобілізованого ферменту від носія на певну відстань. Це обумовлено тим, що у деяких випадках тісний контакт ферменту з носієм є небажаним, наприклад, через несприятливі зміни мікрооточення ферменту, стеричних і дифузійних обмежень. З цією метою використовуються зшиваючі реагенти різної довжини.
Мікрооточення іммобілізованого ферменту — це молекули та іони, що знаходяться дуже близько біля нього і впливають на його активність. Іммобілізація супроводжується зміною багатьох параметрів ферментативної реакції (оптимумів температури і рН, константи Михаєліса, максимальної швидкості реакції та ін.).
Носій впливає на мікрооточення іммобілізованого ферменту. Він може сприяти концентруванню на своїй поверхні або відштовхувати від неї молекули субстрату, продукту реакції, інгібітора, іонів водню та інших молекул і іонів, змінюючи при цьому їхній вміст у безпосередній близькості від ферменту.
Участь носія у створенні мікрооточення іммобілізованого ферменту відрізняється від розчинника. У зв’язку з цим вводиться поняття вільний розчин і мікрооточення ферменту. Якщо фермент, іммобілізованний на поліаніоновому носії і діє
на субстрат, який має позитивний заряд, то у зв’язку з електростатичною взаємодією концентрація субстрату у фазі вільного розчину і в мікрооточенні буде різною. Жоден з іонів, що є у розчині (субстрат, Н+), не розподіляється рівномірно в системі.
Носій впливає також на мікрооточення ферменту в результаті обмежень, створюваних носієм для вільної дифузії молекул (субстрату, продукту, кофактора тощо) як у напрямі до ферменту, так і від нього. Дифузійні обмеження спричинюються внутрішньою або зовнішньою перешкодою.
Зовнішня дифузійна перешкода пов’язана з наявністю навколо носія шару, що не перемішується (шару Нернста), товщина якого залежить від швидкості, з якою розчинник перемішується навколо носія. Зі збільшенням швидкості зменшується величина протидії, створюваної зовнішньою дифузійною перешкодою. Речовини розчинника дифундують у шар Нернста завдяки пасивній молекулярній дифузії і конвекції.
Внутрішні дифузійні перешкоди виникають через обмеження, створювані самим носієм. Визначальною щодо швидкості дифузії є одна з дифузійних перешкод — внутрішня або зовнішня.
Підбираючи довжину зшиваючого агента (або оптимальну суміш зшиваючих агентів різної довжини), можна, по-перше, змінювати каталітичні характеристики іммобілізованого ферменту. По-друге, можна спеціально конструювати зшивку так, щоб вона містила зв’язок, лабільний в певних умовах, або такий, що специфічно розщеплюється певними реагентами (ферментами). Це дає ключ до контрольованого відділення іммобілізованого ферменту від носія, наприклад, при вирішенні проблем направленого транспорту ферментів у живому організмі.
Фермент. Враховуючи, що основою будь-якого ферменту є білок, однією з головних умов успішного проведення іммобілізації хімічним методом є врахування специфічних особливостей будови білкової молекули. Білкові частини ферментів — це компактна конструкція з однієї або декількох поліпептидних ланцюгів, які ковалентно зв’язані (зшиті) між собою дисульфід- ними містками. Вони побудовані з ~ 20 амінокислот, з’єднаних між собою пептидним зв’язком. Кількість амінокислотних залишків у поліпептидних ланцюгах білків складає від декількох десятків до тисяч. Однак якісний склад білків (вміст тих чи інших амінокислотних залишків) виявляється дуже схожим. Майже половину усіх амінокислотних залишків білка складають амінокислоти з неполярними або слабополярними бічними групами. В результаті цього за рахунок гідрофобних взаємодій поліпептидні ланцюги скручуються у глобулярні структури таким чином, що ядро складають неполярні фрагменти полі- пептидних ланцюгів, а зовнішній шар утворюють ланки з полярними та іоногенними групами, такими як —SH, —OH, —COOH, —NH2.
Звичайно, деяка кількість гідрофобних угруповань також може опинитись на поверхні. З них на глобулі формуються контактні ділянки для зв’язування субстратів і (або) для міжсубодиничних взаємодій.
Таким чином, білкові глобули несуть на своїй зовнішній поверхні реакційноздатні функціональні групи — мішені. Реакційна здатність білка — ферменту визначається набором і кількістю розміщених ззовні білкової молекули функціональних груп: тіольних (цистеїну), гідроксильних (серину, треоніну, тирозину), карбоксильних (глутамінової і аспарагінової кислот), гуанідинових (аргініну), імідазольних (гістидину) та аміногруп (лізину).
Найбільш реакційноздатними є SH-групи цистеїну. Вони здатні брати участь у різноманітних хімічних реакціях: окислення, ацилювання, алкілування і т.д. Однак SH-групи не зовсім підходять на роль груп-мішеней для ковалентної іммобілізації через низку причин. По-перше, вміст цистеїну в білках невеликий. По-друге — дуже часто в білках немає вільних SH-груп, тому що вони беруть участь в утворенні дисульфідних містків, які стабілізують структуру ферментів. По-третє: у разі, коли такі групи у білка є, вони, як правило, входять до складу активного центру ферменту і необхідні для каталітичної активності. Тоді при іммобілізації їх спеціально захищають обробкою ферменту різними речовинами. Але попри на це, SH-групи є дуже привабливими як групи-мішені. Тому розроблені методи введення в молекулу ферменту екзогенних SH-груп, наприклад, модифікацією аміногруп білка потрібними реагентами, зокрема, ацилюванням тіолактоном гомоцистеїна.
Для різних хімічних модифікацій і для ковалентної іммобілізації найчастіше використовуються аміногрупи білка. Це обумовлено низкою причин: їх у білку забагато; вони високореакційноздатні і поступаються лише SH-групам за кількістю та різноманітніостю реакцій, у яких вони можуть брати участь; здебільшого аміногрупи відіграють другорядну роль у підтримці структури і функції ферментів.
Крім того, така важлива властивість аміногруп, як здатність бути донором протонів, забезпечує у фізіологічних умовах наявність на поверхні білка позитивних зарядів, які взаємодіють з негативно зарядженими карбоксильними групами білка з утворенням сольових містків. Для ковалентної іммобілізації через аміногрупи розроблена велика кількість носіїв і зшиваючих реагентів.
Таким чином, найбільш зручною групою-мішенню для хімічної іммобілізації є аміногрупа. Однак, крім аміногруп, у реакціях модифікації та іммобілізації можуть брати участь й інші групи білка: тіольні, імідазольні, гуанідинові, гідроксильні, а також небілкові компоненти ферменту, або ж реакційна система, зокрема, вода.
Головним завданням іммобілізації ферментів хімічним методом є максимальне збереження каталітичної функції ферменту шляхом використання функціональних груп, які не входять до активного центру ферменту і несуттєві для виявлення каталітичної активності, а також створення умов іммобілізації, які не викликають денатурації білкової молекули. Отже, при хімічній іммобілізації бажано захищати активний центр ферменту. Для цього можна використати різні захисні реагенти, субстрати, зворотні інгібітори тощо.
Загальною перевагою іммобілізованих хімічним методом препаратів є чітко визначені і контрольовані властивості, що дуже важливо при використанні їх у медицині і в аналітичній роботі.
Недоліком хімічних методів іммобілізації і одержаних таким методом препаратів є їх висока вартість, складність одержання і в зв’язку з цим недоцільність їх використання у великомасштабних промислових процесах. З цією метою більш придатними препаратами є ти, що одержані фізичними методами іммобілізації і особливо шляхом адсорбції.
Таким чином, при іммобілізації ферменти із розряду гомогенних каталізаторів (які знаходяться у тій же фазі, що й субстрати реакції) переходять у розряд гетерогенних (які утворюють особливу фазу, що відділена від реагентів).