БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
РОЗДІЛ 8. ВИКОРИСТАННЯ ІММОБІЛІЗОВАНИХ ПРЕПАРАТІВ З ЛІКУВАЛЬНОЮ МЕТОЮ
8.2.МЕТОДИ ІММОБІЛІЗАЦІЇ І ЗАСТОСУВАННЯ ПРЕПАРАТІВ
Іммобілізація терапевтичних ферментів та інших білкових препаратів може проводитися різноманітними методами ковалентної і нековалентної фіксації ферментів на нерозчинних і розчинних носіях різної природи. Вибір методу залежить від призначення препарату та способу його введення.
Існують два принципово різних підходи до одержання і застосування іммобілізованих терапевтичних ферментів: 1) введення в організм; 2) використання у реакторах за допомогою позаорганізмового шунта (штучної нирки) чи імплантації реактора з іммобілізованим ферментом як протеза кровоносної судини.
Перший підхід обумовлюється різновидами, що залежать від патологічних уражень організму. При різних системних ураженнях, коли необхідна присутність терапевтичного ферменту в різних органах і тканинах, доцільно використовувати тим чи іншим методом іммобілізований водорозчинний препарат, який має підвищену стабільність та уповільнене виведення з організму. До нього належать різні ферментовмісні «штучні клітини» типу мікрокапсул, ліпосом, «тіней» еритроцитів.
З іншого боку, для терапії локальних уражень, коли присутність ферменту потрібна лише у місці ураження, доцільно створювати біосумісні ферментовмісні полімерні частини (які біо- деградуються чи просто тимчасово імплантуються), що можуть бути локалізовані в певному місці і залишатися там деякий час, виділяючи безперервно в оточуюче середовище терапевтичний фермент.
Препарати іммобілізованих ферментів для локального застосування можуть бути одержані як на основі нерозчинних полімерів, так і носіїв, які біодеградуються. У першому випадку носій після закінчення дії ферменту механічно видаляється з вогнища ураження, а в другому — самостійно руйнується у тканинах.
З використанням мікрогранул зшитого декстрану-сефадексу були одержані препарати тромболітичних ферментів з заданою швидкістю біодеградації — фібролізин, стрептокіназа і урокіназа. Вони можуть створювати локальне депо при терапії тромбозів.
Другий підхід в одержанні і застосуванні іммобілізованих ферментів — це використання їх у різних екстракорпоральних апаратах для перфузійного очищення різних біологічних рідин.
Екстракорпоральна перфузія з використанням ферментів широко застосовується для виведення токсинів з організму. Носіями є сферичні частинки з полімерів, скла, кераміки, силікатів. Вимоги до цих носіїв такі: вони мають бути з мінімальною неспецифічною сорбцією, не повинні викликати деформацію формених елементів крові і не мають бути дорогими, тому що колонки для гемодіалізу і детоксикації одноразового використання.
Окремим випадком цього підходу є створення ферментних реакторів, які використовуються як тромбобезпечні протези кровоносних судин. Сюди належить також перев’язувальний матеріал, який містить зазвичай протеолітичні ферменти, що використовуються для очищення гнійних ран.
При лікуванні системних уражень розчинні препарати іммобілізованих ферментів можуть використовуватися для традиційного внутрішньовенного введення. Але краще їх вводити у черевну порожнину, де каталітична активність зберігається протягом 8 місяців. Так, модифіковані декстраном карбоксипептидаза G і аргіназа при внутрішньочеревному введенні мишам з прищепленою мастоцитомою мають здатність створювати більш високу і тривало діючу концентрацію активності у кровотоці, ніж нативні ферменти. Іммобілізація на розчинних полімерних носіях дає можливість одержати більш стабільні, активні і безпечні терапевтичні препарати. Таким методом можна з успіхом іммобілізувати інші препарати білкової природи — різні фізіологічно активні поліпептиди типу панкреатичного інгібітора трипсину і, що надто важливо, гормону інсуліну.
Перспективним методом іммобілізації і застосування модифікованих форм ферментів для лікування є створення різного типу «штучних клітин».
Лікарські препарати, в яких співвідношення білок : полімер за масою дуже високе і досягає сотень тисяч і вище, можуть бути виготовлені за допомогою методу так званої «штучної клітини», а також ліпосом. Ці препарати є свого роду мікросферами з більш-менш твердою і проникною оболонкою. їхнє призначення різне.
Першим типом «штучних клітин» є мікрокапсули, які були одержані Чангом Т.М. в 1965 році. Мікрокапсульовані препарати ферментів - це крихітні реактори діаметром від 103 до 5104 нм, тонка полімерна оболонка яких (200-400 нм) проникна для низькомолекулярних сполук, тобто для низькомолекулярних субстратів і продуктів їх перетворення. Фермент, який знаходиться всередині оболонки, надійно утримується, не контактує з біологічними рідинами і тканинами організму, не руйнується протеїназами, не інгібується та не викликає імунної реакції. В мікрокапсулу можуть бути включені відносно високі концентрації ферменту, досягти яких у кровотоці при використанні нативного ферменту неможливо, а також різні ферменти одночасно.
Основною перевагою мікрокапсул є можливість імплантувати їх у потрібне місце, наприклад у безпосередній близькості до пухлини. Фермент, включений у капсулу, може бути попередньо стабілізованим, або поряд з ним можуть бути включені сполуки, також високомолекулярні, які сприяють його стабілізації.
Капсули можуть містити мікроскопічні ділянки тканин. Наприклад, є експериментальні дані зі створення депо інсуліну в організмі шляхом імплантації мікрокапсул, що містять острівки Лангерганса, які синтезують у підшлунковій залозі інсулін (Березін І.В. та ін., 1987).
Всередину мікрокапсул можуть бути включені поліферментні системи і їх кофактори, модифіковані з метою збільшення молекулярної маси та утримання всередині мікросфери.
Полімерна стінка мікрокапсул зазвичай виготовляється із міцних синтетичних полімерів (поліамідів, поліуретанів та ін.), або з природних (полімолочної кислоти). Полімолочна кислота біодеградується з достатньою швидкістю і тому зникає проблема утилізації матеріалу оболонок мікрокапсул в організмі, а такі ферментні препарати є дуже перспективними. Однак застосування мікрокапсул із синтетичних полімерів дуже ефективне при позаорганізмовому їх використанні: у вигляді колонок для діалізу в апараті «штучна нирка». Це дає можливість зменшити об’єм препарату і відповідно кількість необхідних дорогих розчинів. Наприклад, для мікрокапсульованої «штучної нирки» потрібна колонка об’ємом усього 30 мл, яка працює майже у 100 разів швидше за звичайний апарат.
Уреазу з носієм (іонообмінною смолою чи активованим вугіллям) помішують в одну мікрокапсулу. Аміак, який утворюється в процесі розкладу сечовини, адсорбується всередині мікрокапсули:
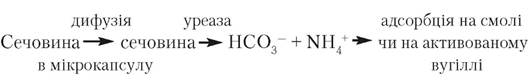
Вірогідно, ферментні реактори на мікрокапсулах будуть використовуватися для деградації недіалізованих матеріалів.
У деяких випадках для виготовлення мікрокапсул використовуються високомолекулярні сполуки, розчинні за одних умов і зберігають високу міцність оболонок — за інших. Таким чином поводить себе ацетилфталілцелюлоза, мікрокапсули з якої інтактні у шлунковому соці і розчиняються у кишечнику, звільнюючи вміст.
Всередину мікрокапсул можуть включатися магнітні частинки. У цьому випадку ззовні підводять магнітне поле і препарат утримують поблизу органу-мішені (хворого органу).
Перші успішні експерименти із застосування мікрокапсульованих ферментів на тваринах були проведені з використанням уреази для зниження сечовини в крові, каталази для лікування тварин з каталазною недостатністю і аспарагінази для пригнічення росту аспарагінозалежних пухлин (Ларіонова Н.І., Торчілін В.П., 1982).
Наступним після мікрокапсулювання методом створення штучних клітин є включення ферментів у ліпосоми — штучні фосфоліпідні мікробульбашки, які ще називають контейнерами-переносниками.
Ліпосоми — це бішарові сферичні утворення діаметром від 20 до 103 нм, які одержують найчастіше при механічних впливах на дисперсії фосфоліпідів (Ларіонова Н.І., Торчілін В.П., 1982). Ліпосоми цілком біосумісні, не викликають імунологічних реакцій, а фосфоліпіди ліпосом при їхній деградації можуть бути використані для синтезу клітинних мембран. На відміну від мікрокапсул ліпосоми мають здатність доставляти включений у них препарат безпосередньо до клітин, з якими ліпосоми взаємодіють, та сприяти надходженню відсутнього ферменту в лізосоми. Однак уже через 15-30 хвилин після введення 50-80 % ліпосом поглинаються клітинами ретикулоендотеліальної системи, насамперед печінки і селезінки. Отже, є проблема специфічного поглинання ферменту, укладеного в ліпосомах, певними тканинами. Є ідеї, реалізація яких дозволить ліпосомам доставляти фермент за адресою, тобто до хворого органу. Для цього передбачається на поверхню ліпосом включати антитіла до антигенних структур, що знаходиться на поверхні тих клітин, для яких призначений фермент.
З великої кількості ферментів, уже включених у ліпосоми, викликає інтерес аспарагіназа, що використовується для лікування деяких форм лейкозу. Установлено, що деякі лейкозні клітини не можуть синтезувати амідаспарагін, а отже, не можуть рости без використання екзогенного аспарагіну. Введення в кров’яне русло іммобілізованої за допомогою включення в ліпосоми чи капсули з полімолочної кислоти аспарагінази призводить до зниження концентрації цього аміду в крові до мінімального рівня. Загибель лейкозних клітин настає від аспарагінового голодування.
Враховуючи те, що клітини ретикулоендотеліальної системи, зокрема печінки, являють собою природну мішень для ліпосом, то включені у ліпосоми ферменти можуть виявитися дуже ефективними для лікування різних ферментних нестач печінки.
Як контейнери для включення ферментів можуть використовуватися і оболонки клітин крові, зокрема мембрани або «тіні» еритроцитів. Одержують їх шляхом часткового гемолізу еритроцитів з подальшим заповненням ферментом та повним відновленням цілісності мембрани. Таким методом одержали «тіні» еритроцитів, які заповнені β-глюкозідазою, β-галактозідазою, β-глюкуронідазою, аспарагіназою.
Крім еритроцитів, використовуються і оболонки інших клітин. Так, одержані лікарські препарати, які включені в оболонки макрофагів (Березін І.В. та ін., 1987). Макрофаги мають тенденцію накопичуватись у вогнищах запалення, а значить і можуть транспортувати туди як низько-, так і високомолекулярний лікарський препарат. Позитивним щодо «тіней» клітин як носіїв є їх повна сумісність з організмом людини чи тварини, оскільки цей носій готують на основі клітин, виділених із організму пацієнта.
Певний інтерес становлять міцели — утворення, які менші за діаметром від ліпосом. Вони дуже перспективні як носії ферментів для виготовлення складних мазевих композицій, в яких ферменти нестійкі.