БІОТЕХНОЛОГІЯ - В. Г. Герасименко - 2006
Частина ІІ. Спеціальні біотехнології
РОЗДІЛ 10. ЗАСТОСУВАННЯ ІММОБІЛІЗОВАНИХ ФЕРМЕНТІВ У БІОТЕХНОЛОГІЇ
10.1.БІОТЕХНОЛОГІЯ ПЕРЕТВОРЕННЯ КРОХМАЛЮ НА ГЛЮКОЗУ
Глюкоза використовується як вихідна сировина для виробництва глюкозофруктозних сиропів, в органічному синтезі для одержання амінокислот і вітамінів, а також у медицині. Для одержання глюкози використовується дешева і доступна сировина - крохмаль.
Утворення глюкози з крохмалю - це двоступінчастий процес. На першому етапі під дією α-амілази з крохмалю утворюються декстрини невеликої молекулярної маси (олігоцукристі фрагменти) і певна кількість мальтози. На другому етапі під дією ферменту глюкоамілази від олігоцукристих фрагментів відщеплюються кінцеві залишки глюкози.
Для промислового виробництва α-амілазу одержують шляхом мікробного синтезу продуцентами Bacillis subtilis, грибами Aspergillus niger і A.oryzae. Для B.subtilis сполученням методів мутагенезу і селекції з методами генетичної інженерії було отримано штам, здатний до надсинтезу α-амілази, вихід якої у 200 разів перевершував вихідні форми. Доведено, що вихід цукристих речовин збільшується при підвищенні температури процесу гідролізу крохмалю. Японські дослідники отримали термостабільну α-амілазу шляхом введення в сінну паличку гена, який контролює синтез цього ферменту.
Перспективними продуцентами глюкоамілази є гриби з родин Rhizopus, Endomyces, Endomycopsis, а також бактерії із родин Aerobacter, Clostridium.
Технологічна схема одержання глюкози:
1. Желатинізація крохмалю при нагріванні (62-72 оС).
2. Декстринізація крохмалю за допомогою бактеріальної α-амілази (80-110°, рН 6,5-6,7).
3. Оцукрення декстринізованого крохмалю за участю грибної глюкоамілази (50-60°, рН 4-5). Одержання крохмальної патоки різного вуглеводного складу.
4. Очищення та одержання глюкозних сиропів. Кристалізація глюкози.
Лімітуючою ланкою у біотехнологічному процесі є третя стадія, проблема якої полягає в одержанні іммобілізованого препарату глюкоамілази, який би зберігав стабільність при параметрах технологічного процесу.
Процес одержання іммобілізованої α-амілази поки що не стоїть на порядку денному, тому що низька її вартість не викликає необхідності проведення регенерації ферменту.
У 1970-1980 рр. фірма «Корнінг Глас» продемонструвала першу пілотну установку з використанням глюкоамілази, іммобілізованої шляхом ковалентного приєднання до поверхні макропористого кремнезему. У реакційну колону висотою близько 2 м і діаметром 15 см подається 30% розчин частково гідролізованого крохмалю (декстрини), який протягом 9-хвилинного контакту з іммобілізованою глюкоамілазою перетворюється на глюкозний сироп. Для порівняння: час контакту розчинної глюкоамілази з декстринами для одержання глюкози - 724 хв. Протягом 80 днів роботи установки при 40 оС іммобілізована глюкоамілаза практично не інактивується. Однак до сьогодні промисловий процес одержання глюкози з використанням гетерогенного біокаталізатора не реалізований.
Основними перешкодами на шляху промислового освоєння процесу створення технології крупнотоннажного виробництва глюкозних сиропів за участю іммобілізованої глюкоамілази були такі обставини. По-перше, недостатньо висока стабільність одержаних препаратів іммобілізованої глюкоамілази при температурі пастеризації (60-65 оС); по-друге, зниження виходу глюкози на 7-10 % (90-93 %) при використанні іммобілізованого ферменту порівняно з нативним, який забезпечує конверсію крохмалю в глюкозу на рівні 98 %. Технологія може бути поставлена на комерційну основу за умови одержання стабільних препаратів з періодом інактивації тривалістю 3-4 тижні. Промислової установки з перетворення крохмалю у глюкозу з застосуванням іммобілізованої глюкоамілази поки що немає.
В результаті досліджень останнього десятиріччя з іммобілізації глюкоамілази на неорганічних матеріалах розроблені біокаталізатори з досить високою стабільністю іммобілізованої глюкоамілази (табл. 10.1). Глюкоамілаза, іммобілізована на попередньо оброблених частинках кістки свині, зберігала практично повністю первинну активність протягом 700 год роботи при температурі 37о. На носіях, поверхня яких покрита каталітичним волокнистим вуглецем (КВВ), іммобілізована глюкоамілаза мала найбільшу стабільність. Активність іммобілізованого ферменту зростала на порядок порівняно з його активності у розчині. Іммобілізована глюкоамілаза не втрачала каталітичної активності через 1-1,5 роки зберігання при кімнатній температурі. Використання макроструктурованих КВВ-містких носіїв дозволило виготовити ефективні гетерогенні біокаталізатори складної геометричної форми (сотові моноліти, пористі пеноматеріали), які мали високу стабільність і активність у процесі оцукрення крохмалю. При періодичному функціонуванні при 50 оС протягом 8-8,5 міс. ці біокаталізатори практично повністю зберігали ферментативну активність.
Традиційно в біотехнологічному процесі одержання глюкози з крохмалю використовуються проточні біореактори з розміщенням гетерогенного біокаталізатора у вигляді нерухомого шару. Останнім часом розроблений принципово новий тип біокаталітичного реактора - роторно-інерційний біореактор (РІБ) на рівні лабораторного зразка (Коваленко Г.А. та ін., 2004). Його основним функціональним елементом є контейнер з закріпленим гетерогенним біокаталізатором, який обертається навколо своєї осі (рис. 10.1). Частота обертів контейнера складає від 3 до 170 об./хв; загальний об’єм контейнера - 1,2 л; об’єм біокаталізатора становив 360 м3. Температура в біореакторі підтримувалася на рівні 50-55 оС. Біокаталізатор отримували шляхом адсорбційної іммобілізації глюкоамілази на вуглецевовмісній пенокераміці.
Випробування показали, що біореактор нового типу (РІБ) в оптимальних умовах роботи (частота обертів контейнера не менше 80 об./хв, швидкість подачі субстрату не більше 0,2 л/год) в 1,5-2 рази ефективніший за продуктивністю, ніж традиційний реактор з нерухомим шаром. Активність біокаталізатора в 3-3,5 рази вища, ніж у традиційному реакторі.
Таблиця 10. 1.
Глюкоамілаза, іммобілізована на piзних носіях
(м Коваленко Г.А. та ін. 2002)
Носій/спосіб іммобілізації |
Стабільність |
Тип реактора |
Конверсія субстрату, % субстрат |
Роботи 70-80-х р.р. ХХ ст. |
|||
Пористе скло/ ковалентне зв'язування |
Дезактивація через 300 год безперервної роботи при 37-60 С |
Проточний з нерухомим шаром гранул біокаталізатора |
до 30 (крохмаль) |
Алюмогель, оксид алюмінію /ковалентне зв'язування, поперечна зшивка ГА |
269-417 діб при 50 С та 300 год при 60 С |
Проточний з шаром гранул біокаталізатора |
92-93 (крохмаль) |
Активоване вугілля / адсорбція, поперечна зшивка ГА |
36 год без втрати активності; 1 міс. при 30 С збереться 80% активності |
Періодичний з перемішуванням |
- (мальтоза) |
Роботи останнього десятиріччя |
|||
Магнітні частинки, покриті поліетиленіміном/ковалентне зв’язування |
2 тижні. 50 С. зберігається 96% активності |
Проточний з шаром біокаталізатора |
71 |
Кісткова тканина, оброблена крохмалем/ поперечна зшивка ГА |
700 год безперервного гідролізу при 37 С без втрати активності |
Періодичний з перемішуванням |
95 (крохмаль) |
Полістеренові магнітні частини / адсорбція |
11 год роботи без втрати активності |
Проточний з шаром біокаталізатора |
- мальтоза |
Активоване вугілля / адсорбція |
2 тижні без втрати активності |
Проточний колончастий з нерухомим шаром гранул біокаталізатора |
10 (декстрини) |
Кістковий порошок / адсорбція |
Після 20 циклів роботи конверсія субстрату знизилося на 3% |
- |
98 після 11 циклів (крохмаль) |
КВВ-вмістимі керамічні носії |
40 год роботи без втрати активності |
Проточний реактор на основі сотового моноліту |
70 (крохмаль) |
ГА-глутариновий альдегід
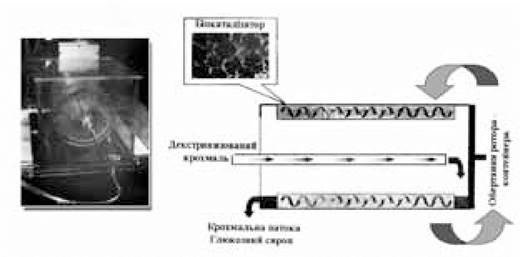
Рис. 10.1. Роторно-інерційний біореактор для гетерогенних біокаталітичних процесів
(Коваленко Г.А. та ін., 2004)