Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Технология рекомбинантных ДНК
Рестрицирующие эндонуклеазы
Технология рекомбинантных ДНК (ее называют также молекулярным клонированием или генной инженерией) — это совокупность экспериментальных процедур, позволяющая осуществлять перенос генетического материала (дезоксирибонуклеиновой кислоты, ДНК) из одного организма в другой. Никакого единого, универсального набора методик здесь не существует, но чаще всего эксперименты с рекомбинантной ДНК проводят по следующей схеме (рис. 4.1).
✵ Из организма — донора нужных генов — экстрагируют нативную ДНК (клонируемая ДНК, встраиваемая ДНК, ДНК-мишень, чужеродная ДНК), подвергают ее ферментативному гидролизу (расщепляют, разрезают) и соединяют (лигируют, сшивают) с другой ДНК (вектор для клонирования, клонирующий вектор) с образованием новой, рекомбинантной молекулы (конструкция «клонирующий вектор—встроенная ДНК»).
✵ Эту конструкцию вводят в клетку-хозяина (реципиент), где она реплицируется и передается потомкам. Этот процесс называется трансформацией.
✵ Идентифицируют и отбирают клетки, несущие рекомбинантную ДНК (трансформированные клетки).
✵ Получают специфический белковый продукт, синтезированный клетками-хозяевами, что служит подтверждением клонирования искомого гена.
Предпосылками к созданию технологии рекомбинантных ДНК послужили многие открытия в области молекулярной биологии, энзимологии нуклеиновых кислот и молекулярной генетики бактериальных вирусов и внехромосомных элементов бактерий (плазмид). Конструирование рекомбинантных молекул осуществляется с помощью целого арсенала ферментов — обязательного и незаменимого инструмента практически всех этапов этого сложнейшего процесса. Речь идет прежде всего о ферментах рестрикции (рестрицирующих эндонуклеазах, рестриктазах), которые узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК.
При молекулярном клонировании важно, чтобы расщепление донорной и векторной ДНК происходите в строго определенных участках (сайтах) с образованием дискретного и воспроизводимого набора фрагментов. Если пропустить хромосомную ДНК через шприц с иглой малого диаметра или обработать ее ультразвуком, то мы получим фрагменты длиной от 0,3 до 5 т.п.н. К сожалению, в ходе этих простых операций разрывы двухцепочечных молекул происходят случайным образом, так что при каждой обработке препарата ДНК получается совершенно новый набор фрагментов. Молекулярное клонирование стало возможным только после выделения высокоспецифичных бактериальных ферментов, которые узнают определенные последовательности оснований в двухцепочечной молекуле ДНК и расщепляют обе цепи. Эти ферменты называются рестрицирующими эндонуклеазами типа Н. Одна из первых рестрицирующих эндонуклеаз типа II была выделена из бактерии Escherichia coli и получила назване EcoRl. Этот фермент узнает участок ДНК, содержащий специфическую палиндромную последовательность (последовательность-перевертыш, идентичную в обеих цепях при прочтении в направлении 5'→3') из шести пар оснований и вносит разрыв между остатками гуанина и аденина в каждой цепи (рис. 4.2), расщепляя связь между атомом кислорода при 3'-атоме углерода сахарного остатка одного нуклеотида и фосфатной группой, присоединенной к 5’-углеродному атому сахарного остатка соседнего нуклеотида. Разрывы в цепи ДНК располагаются наискось друг от друга, в результате чего образуются одноцепочечные комплементарные концы с «хвостами» из четырех нуклеотидов в каждом (липкие концы). Каждый одноцепочечный «хвост» заканчивается 5'-фосфатной группой, а 3'-гидроксильная группа противоположной цепи как бы утоплена.
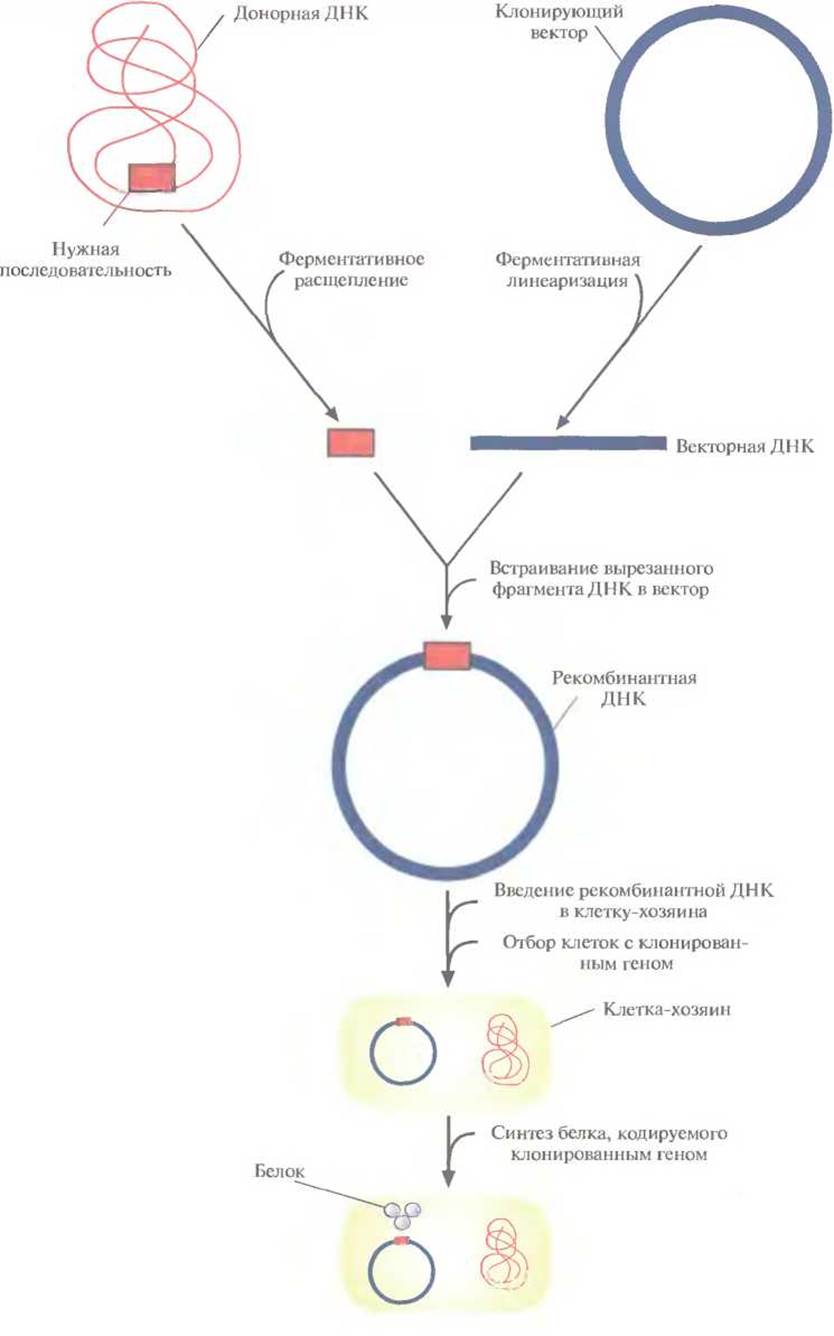
Рис. 4.1. Клонирование рекомбинантной ДНК. Донорную ДНК расщепляют рестрицирующей эндонуклеазой и встраивают в клонирующий вектор. Полученную конструкцию вводят в популяцию клеток-хозяев, идентифицируют те клетки, которые содержат рекомбинантную ДНК, и культивируют их. При необходимости можно индуцировать экспрессию клонированного гена в клетках-хозяевах и получить кодируемый им белок.
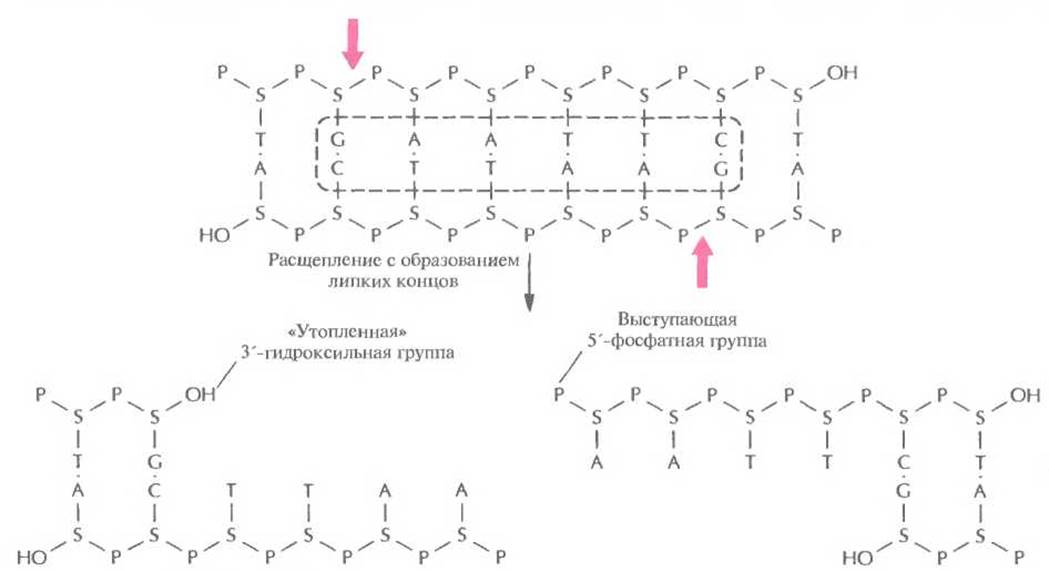
Рис. 4.2. Расщепление короткого фрагмента ДНК рестрицирующей эндонуклеазой типа II ЕсоRI с образованием липких концов. Стрелки — связи, по которым происходит расщепление в сахарофосфатном остове. S — дезоксирибоза, Р — фосфатная группа, ОН — гидроксильная группа. Последовательность, распознаваемая EcoRI, выделена штриховой линией.
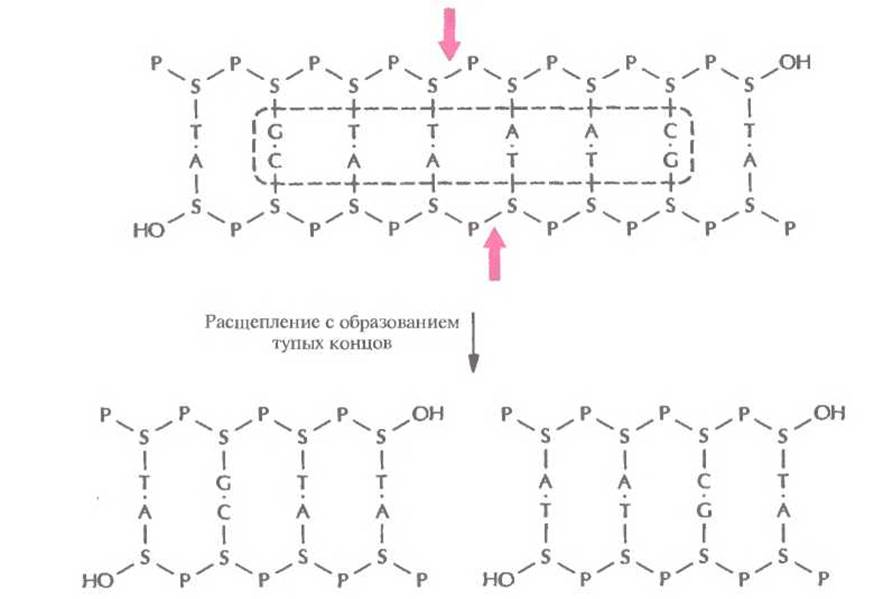
Рис. 4.3. Расщепление короткого фрагмента ДНК рестриктазой типа II HindII с образованием тупых концов. Стрелки — связи, по которым происходит расщепление в сахарофосфатном остове. Буквенные обозначения — те же, что и на рис. 4.2. Последовательность, распознаваемая рестриктазой HindII, выделена штриховой линией.
Помимо EcoRI, из бактериальных клеток были получены сотни рестрицирующих эндуклеаз типа II. Названия этим эндонуклеазам даются по такому же принципу, как и EcoRI: род микроорганизма обозначается прописной буквой, а вид — двумя строчными; штамм обычно не указывается. Римские цифры — порядковый номер данной эндонуклеазы в ряду прочих рестриктаз, выделенных из данного микроорганизма. Например, HpaI и НраII — это соответственно первая и вторая рестрицирующие эндонуклеазы типа II, выделенные из Haemophilus parainfluenzae.
Палиндромные последовательности, которые распознаются рестрицирующими эндонуклеазами типа II и в которых происходит расщепление молекулы ДНК, называются сайтами узнавания. Помимо рестриктаз, гидролизующих (расщепляющих) полинуклеотидную цепь с образованием липких концов, существуют рестриктазы, которые вносят разрывы в цепи строго друг против друга с образованием фрагментов ДНК с «тупыми» концами (рис. 4.3). Сайты узнавания могут состоять из четырех, пяти, шести, восьми или более пар нуклеотидов (табл. 4.1). От длины сайта узнавания зависит частота его распространения в молекуле ДНК; в большинстве случаев используют рестриктазы, узнающие тетра- и гексануклеотиды.
Рестрицирующие эндонуклеазы типа II играют ключевую роль при генном клонировании.
Таблица 4.1. Нуклеотидные последовательности, распознаваемые некоторыми ферментами рестрикции
|
Фермент Сайт узнавания |
Характер образуемых концов |
|
|
EcoRI |
G↓A—А—Т—Т—С С-Т-Т—A—A↑G |
Выступающие концы с 5' фосфатной группой |
|
ВаmНI |
G↓G—А—Т—С—С C—C—T—A—G↑G |
Выступающие концы с 5 -фосфатной группой |
|
PstI |
C—T—G—C—A↓G G↑A—C—G—T—C |
Выступающие концы с 3'-гидроксильной группой |
|
Sau3AI |
↓G—A—T—C C—T—A—G↑ |
Выступающие концы с 5'-фосфатной группой |
|
PvuII |
С—А—С↓С—Т—С G—T—C↑G—A—C |
Тупые концы |
|
HpaI |
G—T—T↓A—A—C C—A—A↑T—T—G |
Тупые концы |
|
НаеIII |
G—G↓C—C C—C↑G—G |
Тупые концы |
|
NotI |
G↓C—G—G—С—C—G—C C—G—С—C—G—G—C↑G |
Выступающие концы с 5'-фосфатной группой |
Обработка образца ДНК определенной рестриктазой всегда дает один и тот же набор фрагментов — при условии, что расщепление происходит по всем сайтам узнавания. Если использовать несколько ферментов рестрикции и сначала обработать ДНК каждой из рестриктаз в отдельности, а затем их комбинациями, можно построить физическую карту данной ДНК, т. е. установить порядок следования сайтов рестрикции вдоль молекулы. Определив размер полученных фрагментов с помощью гель-электрофореза, можно найти положение рестрикционных сайтов (дополнение 4.1). На рис. 4.4, А указаны размеры фрагментов, полученных в результате расщепления ДНК разными рестриктазами и их смесью. Из этих данных следует, что данный участок ДНК имеет по два сайта для ВаmHI и EcoRI. Чтобы построить рестрикционную карту, следует сравнить размеры фрагментов, полученных при раздельной рестрикции и при рестрикции смесью ферментов. Результат такого сравнения представлен на рис. 4.4, Б. Если при гидролизе ДНК каждой из двух рестриктаз (EcoRI и ВаmHI) образуются три фрагмента, значит, в исходном фрагменте ДНК было два сайта узнавания для каждой из использованных рестриктаз. Фрагмент размером 300 п. н., который образуется в результате гидролиза EcoRI, не расщепляется при гидролизе смесью ЕсоRI и ВаmHI в отличие от EcoRІ-фрагментов размером 850 и 500 п. н. Значит, два EcoRI-сайта находятся на расстоянии 300 п. н. друг от друга и между ними нет ВаmHI-сайта, а в EcoRI-фрагментах длиной 850 и 500 п.н. есть по одному ВаmHI-сайту. Фрагмент размером 950 п. н., который образуется при обработке ДНК рестриктазой ВаmHI, при двойном гидролизе расщепляется EсоRI на три фрагмента (250+300+400 = 950 п. н.). Значит, два ВаmHI-сайта находятся на расстоянии 250 и 400 и. н. по разные стороны от сайтов для EcoRI. ВаmНI расщепляет EсоRI-фрагмент длиной 850 п. н. на фрагменты длиной 250 и 600 п. н., а один из сайтов для ЕсоRI находится на расстоянии 250 п.н. от сайта для ВаmНI, значит, фрагмент 600 п. н. должен содержать один из концов исходной молекулы ДНК. Далее, мы видим, что ВаmНI расщепляет EcoRI-фрагмент длиной 500 п. н. на два фрагмента размером 100 и 400 п. н. и что один из EcoRI-сайтов отделен от BamНI-сайта 400 п. н.; значит, фрагмент длиной 100 и. н. должен содержать другой конец исходной молекулы. Карта на рис, 4.4, Б иллюстрирует четкое соответствие между положением сайтов рестрикции и размерами фрагментов, получающихся при каждом гидролизе.


Рис. 4.4. Картирование сайтов рестрикции. А. Результаты гель-электрофореза фрагментов ДНК, полученных ее расщеплением указанными ферментами. Очищенную ДНК гидролизовали рестриктазами EсоRI и BamHI раздельно, а затем их смесью, проводили гель-электрофорез и визуализировали продукты окрашиванием бромистым этидием. Числа слева от горизонтальных полос — длина фрагментов в парах оснований. Б. Рестрикционная карта, построенная по электрофоретическим данным. Числа — расстояние между сайтами узнавания соответствующих ферментов.
Расщепление рестрицирующими эндонуклеазами имеет еще одно применение. Когда два разных образца ДНК обрабатывают одной и той же рестриктазой с образованием фрагментов с липкими концами, а затем смешивают эти образцы, то благодаря комплементарному спариванию липких концов фрагментов разных образцов могут образовываться новые комбинации генов — рекомбинантные ДНК (рис. 4.5). Для осуществления молекулярного клонирования недостаточно одних только ферментов рестрикции. Во-первых, водородные связи между теми четырьмя основаниями, которые образуют липкие концы, недостаточно прочны, чтобы удержать два объединившихся фрагмента ДНК. Необходим какой-то инструмент для устранения разрыва в сахарофосфатном остове молекулы, т. е. для восстановления связи между 3'-гидроксильной концевой группой одной цепи и 5'-фосфатной группой другой. Таким инструментом является ДНК-лигаза бактериофага Т4. Этот фермент катализирует образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые уже удерживаются вместе благодаря спариванию липких концов. Кроме того, ДНК-лигаза Т4 «сшивает» тупые концы, которые сближаются друг с другом после того, как объединяемые фрагменты связываются с ферментом (рис. 4.6). Во-вторых, объединение разных молекул ДНК само по себе бесполезно, если вновь образованные комбинации (рекомбинантные ДНК) не будут реплицироваться в клетке-хозяине. Таким образом, если одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, то другая должна содержать информацию, необходимую для репликации в клетке рекомбинантной ДНК. Чтобы решить эту проблему, используют клонирующие векторы. 13-третьих, при рестрикции ДНК образуется смесь разнообразных фрагментов, и после их лигирования с векторной ДНК образуется множество различных комбинаций. Необходимо уметь распознавать те реципиентные клетки, которые содержат ДНК с нужной нуклеотидной последовательностью. Для этого используют различные системы скрининга.
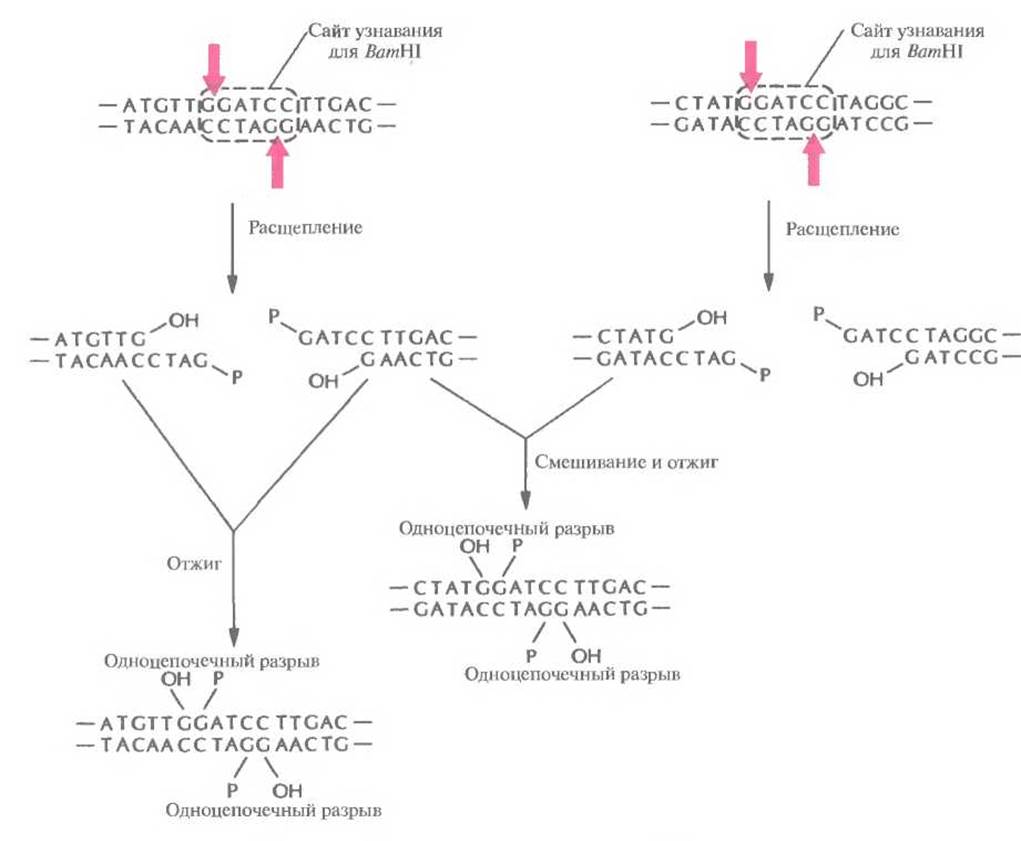
Рис. 4.5. Отжиг комплементарных липких концов фрагментов, образующихся при расщеплении двух разных образцов ДНК рестрицирующей эндонуклеазой BаmНІ. Четыре фрагмента, представленных на рисунке, могут соединиться друг с другом с образованием шести разных молекул ДНК (на рисунке показаны не все возможные комбинации). Фрагменты удерживаются вместе водородными связями, образующимися между четырьмя основаниями липких концов, но эти связи недостаточно прочны, чтобы молекулы в растворе оставались стабильными длительное время.