Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Оптимизация экспрессии генов, клонированных в прокариотических системах
Метаболическая перегрузка
Введение в клетку чужеродной ДНК и ее экспрессия часто приводят к нарушениям клеточного метаболизма. Эти нарушения весьма разнообразны и обусловлены давлением, которое оказывает чужеродная ДНК на все клеточные процессы. Метаболическая перегрузка может возникать по разным причинам.
✵ Увеличение числа копий и/или размера плазмид и связанное с этим увеличение количества энергии, необходимого для их репликации и сохранения.
✵ Недостаток растворенного кислорода в среде и невозможность обеспечения им и всех метаболических реакций, и процесса экспрессии плазмидных генов.
✵ Гиперпродукция чужеродных белков, приводящая к истощению пула некоторых аминоацил-тРНК (или даже некоторых аминокислот) и/или энергетических запасов (в виде АТР и GTP).
✵ Перегрузка системы экспорта и нарушение правильной локализации жизненно важных белков хозяйской клетки вследствие «перепроизводства» чужеродного белка, экспортируемого из цитоплазмы к клеточной мембране или в пери плазматическое пространство.
✵ Наличие у организма-хозяина необычных метаболических свойств (например, высокая дыхательная активность у Azotobacter spp.), что делает его более чувствительным к различным воздействиям, чем обычные клетки.
✵ Непосредственное влияние чужеродных белков на функционирование хозяйской клетки (например, превращение с их помощью важных незаменимых предшественников в неприемлемые, а иногда и токсичные соединения).
Метаболическая перегрузка может привести к разнообразным изменениям в физиологии и функционировании хозяйской клетки. Одно из наиболее частых — снижение скорости роста клеток после введения чужеродной ДНК. Так, клетки, содержащие плазмиду, растут медленнее, чем нетрансформированные, не содержащие плазмид (табл. 6.6), что часто сопровождается утратой рекомбинантной плазмиды. Иногда метаболическая перегрузка приводит к тому, что под давлением отбора из плазмиды делетируется рекомбинантный ген или его часть.
Таблица 6.6. Влияние числа копий плазмиды на скорость роста хозяйских клеток1)
|
Плазмиды, присутствующие в клетках Е. coli НВ102) |
Число копий плазмиды |
Относительная скорость роста |
|
Плазмида отсутствует |
0 |
1,00 |
|
А |
12 |
0,92 |
|
В |
24 |
0,91 |
|
С |
60 |
0,87 |
|
D |
122 |
0,82 |
|
Е |
408 |
0,77 |
1) Поданным работы Seo. Bailey, 1985, Biotechno. Bioeng. 27: 1668 1674.
2) Плазмиды, обозначенные буквами А, В, С, D и Е, кодируют только ß-лактамазу и имеют одинаковый размер.
Поскольку клеткам, растущим в условиях метаболической перегрузки, не хватает энергии для нормального функционирования, затрагиваются прежде всего такие энергоемкие метаболические процессы, как фиксация азота или синтез белков. Могут изменяться также размер и форма клеток, образовываться слишком много внеклеточного полисахарида, склеивающего клетки друг с другом и затрудняющего микрофильтрацию.
Как следствие метаболической перегрузки, обусловленной образованием избыточного количества чужеродного белка и нехваткой питательных веществ или «строительных блоков» — аминокислот, может произойти запуск стрессовых механизмов, в частности инициироваться синтез клеточных протеиназ, под действием которых произойдет быстрая деградация рекомбинантного белка. Истощение пула аминокислот может стать результатом эффективной экспрессии не только клонированных генов-мишеней, но и генов самого вектора, кодирующих маркеры устойчивости к антибиотикам.
Вероятность трансляционных ошибок для Е. coli составляет 2∙10-4—2∙10-3 на 1 клетку за генерацию. Однако в условиях нехватки определенных аминоацил-тРНК, что часто случается при суперпродукции чужеродных белков, вероятность включения в белковую молекулу неправильной аминокислоты вместо недостающей сильно увеличивается. Кроме того, точность трансляции еще больше снижается из-за недостатка GTP, который является необходимым компонентом корректирующего аппарата. В одной из работ было показано, что в условиях гиперпродукции фактора роста эпидермиса мыши в клетках Е. coli частота ошибочных включений аминокислот в рекомбинантный белок увеличивается в 10 раз. Это не позволяет использовать синтезируемый белок в качестве лекарственного средства, поскольку: 1) удельная активность и стабильность белка могут быть гораздо ниже ожидаемых; 2) наличие в молекуле «неправильных» аминокислот может вызвать нежелательную иммунологическую реакцию при введении такого белка в организм человека.
К счастью, правильно спланировав эксперимент, можно минимизировать влияние метаболической перегрузки, оптимизировать выход рекомбинантного белка и повысить стабильность трансформированных хозяйских клеток. Например, нагрузку можно снизить, если использовать малокопийные плазмидные векторы. А еще лучше вообще отказаться от векторов и встроить чужеродную ДНК в хромосомную ДНК организма-хозяина. В этом случае не нужно заботиться об обеспечении стабильности плазмиды. Кроме того, клетке не приходится расходовать свои ресурсы на синтез ненужных продуктов, кодируемых маркерными генами устойчивости к антибиотикам. Синтез продуктов таких генов, входящих в состав плазмидных векторов наряду с генами-мишенями, является одной из основных причин метаболической перегрузки. Интеграция в хромосому особенно важна в тех случаях, когда используется сам рекомбинантный микроорганизм, а не синтезируемый им продукт. Уменьшению метаболической перегрузки помогает также применение сильных, но регулируемых промоторов. В таких случаях ферментацию проводят в две стадии. На первой из них, во время роста, промотор, контролирующий транскрипцию гена-мишени, выключен, а на второй, во время индукции, - включен.
Если частота использования кодонов у чужеродного гена отличается от таковой у организма-хозяина, то проблему нехватки специфических аминоацил-тРНК можно решить, синтезировав часть гена-мишени или даже весь ген с более близким к хозяйскому организму набором кодонов. Так, в одном из исследований было показано, что количество стрептавидина, образующегося при экспрессии синтетического гена с GC-содержанием 54%, было в 10 раз больше, чем при экспрессии «природного» гена с GC-содержанием 69%. Однако этот подход довольно сложен и может применяться лишь в редких случаях.
Как это ни парадоксально, но один из способов увеличения количества чужеродного белка, синтезируемого рекомбинантным микроорганизмом, состоит в поддержании уровня экспрессии его гена на среднем уровне (так, чтобы на долю продукта приходилось примерно 5% суммарного клеточного белка), но зато в максимальном увеличении плотности культуры. Микробиологическая система с 5%-ным уровнем экспрессии чужеродного белка и низкой метаболической нагрузкой, в которой плотность может достигать 40 г/л (масса сухого вещества), оказывается более эффективной, чем система с 15%-ным уровнем экспрессии и плотностью 10 г/л.
Достичь одновременно и высокого уровня синтеза чужеродного белка, и высокой плотности культуры часто не удается из-за накопления вредных побочных продуктов (в первую очередь ацетата), подавляющих рост клеток и синтез белка. Чтобы уменьшить накопление ацетата в богатой среде, не нарушая роста клеток, можно снизить скорость поглощения глюкозы, добавив в среду ее аналог, метил-а-глюкозид. Альтернативный подход состоит в использовании клеток Е. coli, несущих мутацию в гене ptsG, который кодирует фермент II глюкозофосфотрансферазной системы. Максимальная плотность культуры Е. coli дикого типа составила примерно 10 г/л, а культуры Е. coli с мутацией в гене ptsG — 15 г/л. Кроме того, уровень синтеза ß-лактамазы в мутантных клетках был на 25% выше (на 1 г массы сухого вещества), чем в клетках дикого типа, так что суммарное различие достигает примерно двукратной величины. Достичь аналогичного результата можно гораздо проще и быстрее, если использовать методы генной инженерии, а не мутагенез и отбор. Один из подходов состоял во введении в Е. coli генов, кодирующих ацетолактатсинтазу. Этот фермент катализирует образование ацетолактата из пирувата, что приводит к уменьшению количества образующегося ацетата (рис. 6.17). Гены ацетолактатсинтазы вводят в клетки в составе одной плазмиды, а гены-мишени — в составе другой, из другой группы несовместимости. Трансформированные клетки синтезируют гораздо меньше ацетата, чем нетрансформированные; вместо него образуется ацетоин, соединение примерно в 50 раз менее токсичное, чем ацетат.
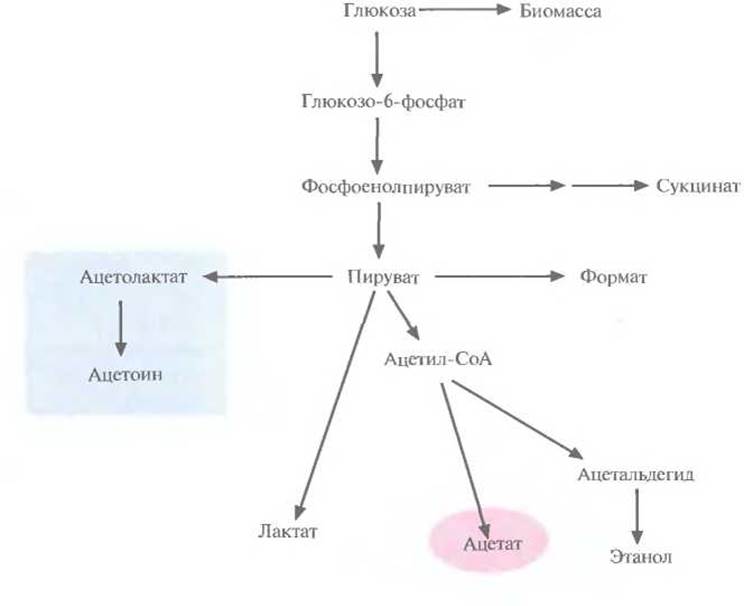
Рис. 6.17. Схематическое представление метаболизма глюкозы в клетках Е. coli, трансформированных плазмидой, несущей гены ацетолактатсинтазы.