Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Направленный мутагенез и генная инженерия белков
Генная инженерия белков
На долю 20 из многих тысяч изученных и охарактеризованных ферментов приходится более 90% всех ферментов, используемых в настоящее время в промышленности. В табл. 8.1 перечислены некоторые наиболее важные из них и указана область их применения. Остальные ферменты не используются потому, что присущая им активность не удовлетворяет требованиям, предъявляемым высокоспециализированными процессами, протекающими in vitro. Большинство ферментов быстро денатурируют при высокой температуре и в присутствии органических растворителей, а именно в этих условиях протекают многие промышленные процессы. Конечно, термостабильные ферменты можно выделить из термофильных микроорганизмов, однако эти организмы не всегда синтезируют именно те специфические ферменты, которые нужны. Впрочем, эти трудности можно преодолеть при помощи направленного мутагенеза и клонирования генов-мишеней.
Таблица 8.1. Некоторые ферменты и области их применения
|
Фермент |
Применение |
|
a-Амилаза |
Пивоварение, производство спирта |
|
Аминоацилаза |
Получение L-аминокислот |
|
Бромелаин |
Размягчение мяса, осветление соков |
|
Каталаза |
Антиоксидант в готовых к употреблению нишевых продуктах |
|
Целлюлаза |
Получение спирта и глюкозы |
|
Фицин |
Размягчение мяса, осветление соков |
|
Глюкоамилаза |
Пивоварение, производство спирта |
|
Глюкозоизомераза |
Производство сиропов с высоким содержанием фруктозы |
|
Глюкозооксидаза |
Антиоксидант в готовых к употреблению пищевых продуктах |
|
Инвертаза |
Инверсия сахарозы |
|
Лактаза |
Утилизация сыворотки, гидролиз лактозы |
|
Липаза |
Сыроварение, получение ароматизаторов |
|
Папанн |
Размягчение мяса, осветление соков |
|
Пектиназа |
Осветление соков, производство спирта |
|
Протеаза |
Детергент, производство спирта |
|
Реннет |
Сыроварение |
Образование дополнительных дисульфидных связей
Термостабильность белковых молекул можно повысить, внеся в них изменения, благодаря которым они дольше не разворачиваются при повышении температуры. Кроме того, такие термостабильные белки часто не разрушаются в органических растворителях и при нефизиологических условиях (например, при экстремальных pH). К значительному повышению стабильности белковой молекулы может привести образование в ней дополнительных дисульфидных связей. Основная проблема здесь заключается в том, чтобы эти связи не мешали нормальному функционированию белка. В одном из экспериментов при помощи олигонуклеотид-направленного мутагенеза были созданы шесть вариантов, лизоцима фага Т4 с новыми внутрицепочечными дисульфидными связями. Для этого два, четыре или шесть специфических аминокислотных остатков в полинуклеотидной цепи были заменены на остатки цистеина, в результате чего образовалась одна, две и три дисульфидных связи соответственно (табл. 8.2).
Аминокислотные остатки, замененные на остатки цистеина, располагались в активном ферменте близко друг к другу, так что при образовании новых дисульфидных связей общая конформация молекулы существенно не изменялась. Кроме того, они находились вне активного центра фермента — области, наиболее чувствительной к малейшим изменениям конформации. Связи образовывались между остатками 3 и 97, 9 и 164, 21 и 142 (начало нумерации с N-конца). После мутагенеза мутантные гены идентифицировали и экспрессировали в Е. coli, рекомбинантные белки очищали и определяли их ферментативную активность и термостабильность (табл. 8.2). Последняя обычно характеризуется температурой, при которой молекула денатурирует на 50%; степень денатурации определяется по изменению кругового дихроизма раствора белка. Исходная (нативная) форма лизоцима Т4 содержит два свободных остатка цистеина, не участвующих в образовании дисульфидных связей. У фермента так называемого «псевдодикого типа» они заменены на остатки Thr и Ala, при этом активность и термостабильность фермента остались прежними. Последовательность «псевдодикого типа» служила стандартом при сравнении вариантов с потенциально термостабилизирующими дисульфидными связями и также предотвращала образование случайных дисульфидных связей между вновь введенными остатками цистеина и остатками, присутствующими в нативном белке.
Таблица 8.2. Свойства лизоцима Т4 и шести его вариантов, полученных с помощью генной инженерии1)
|
Фермент |
Положения аминокислотных остатков |
Число связей S-S |
Активность, % |
|||||||
|
3 |
9 |
21 |
54 |
97 |
142 |
164 |
||||
|
Дикий тип |
Ilе |
Ilе |
Thr |
Cys |
Cys |
Thr |
Leu |
0 |
100 |
41,9 |
|
Псевдодикий тип |
Не |
Ilе |
Thr |
Thr |
Ala |
Thr |
Leu |
0 |
100 |
41,9 |
|
А |
Cys |
Ilе |
Thr |
Thr |
Cys |
Thr |
Leu |
1 |
96 |
46,7 |
|
В |
Ile |
Cys |
Thr |
Thr |
Ala |
Thr |
Cys |
1 |
106 |
48,3 |
|
С |
Ile |
Ile |
Cys |
Thr |
Ala |
Cys |
Leu |
1 |
0 |
52,9 |
|
D |
Cys |
Cys |
Thr |
Thr |
Cys |
Thr |
Cys |
2 |
95 |
57,6 |
|
Е |
Ile |
Cys |
Cys |
Thr |
Ala |
Cys |
Cys |
2 |
0 |
58,9 |
|
F |
Cys |
Cys |
Cys |
Thr |
Cys |
Cys |
Cys |
3 |
0 |
65,5 |
1) По данным работы Matsumura et al., Nature 342:291—293, 1989.
Результаты этого эксперимента показали, что термостабильность фермента повышается при образовании новых дисульфидных связей, при этом наиболее термостабильным является белок с максимальным числом таких связей. Однако некоторые варианты (С, Е и F), будучи более термостабильными, чем нативный фермент или фермент «псевдодикого типа», не обладают ферментативной активностью. Возможно, это обусловливается искажением конформации белковой молекулы при образовании дисульфидной связи между остатками 21 и 142. Хотя создание новых белков с помощью методов генной инженерии часто представляет собой эмпирический процесс (т. е. далеко не всегда бывает ясно, замены каких именно аминокислот позволяют получить «наилучший» вариант), описанный эксперимент показывает, что получение термостабильных белков с дополнительными дисульфидными связями вполне реально.
Была предпринята также попытка получения термостабильной мутантной ксиланазы Bacillus circulans — фермента, который можно использовать при производстве бумаги. Одним из этапов этого процесса является удаление гемицеллюлозы из пульпы с целью ее отбеливания, при этом образуются большие количества токсичных отходов. Обработка древесной массы ксиланазой позволяет использовать меньше отбеливающих химикатов. К сожалению, перед добавлением фермента пульпу обрабатывают горячей щелочью, а поскольку современные технологии имеют тенденцию к уменьшению количества воды, расходуемой на охлаждение пульпы, ксиланаза должна оставаться активной при относительно высоких температурах.
Чтобы определить, в какие участки полипептидной цепи могут быть введены одна, две или три дисульфидных связи для стабилизации фермента без нарушения его каталитической активности, использовали компьютерное моделирование пространственной структуры ксиланазы. Были получены восемь производных ксиланазы В. circulans. Все они обладали более высокой термостабильностью, чем нативный фермент, и при этом три были столь же активны при 60 °С, как и нативный белок, а один, содержащий дисульфидную связь между N- и С-концами, был даже в два раза более активным и сохранял свыше 85% своей активности после 2-часовой инкубации при 60 °С, в то время как нативный фермент полностью утрачивал активность в этих условиях уже через 30 мин. Успех этих экспериментов показывает, что данную стратегию можно использовать для повышения термостабильности различных ферментов, если только для них имеются достаточно полные рентгеноструктурные данные. И тем не менее пока нельзя быть уверенным, что термостабильная ксиланаза будет широко использоваться при производстве бумаги.
Замена аспарагина на другие аминокислоты
При высоких температурах остатки аспарагина и глутамина могут дезамидироваться с образованием аммиака. Теряя амидную группу, они превращаются в аспарагиновую и глутаминовую кислоты соответственно, что приводит к локальным изменениям конформации полипептидной цепи и как следствие — к утрате активности белков, в которые они входят.
Чтобы установить, какое влияние оказывает замена некоторых остатков аспарагина в молекуле триозофосфат-изомеразы Saccharomyces cerevisiae на свойства фермента, были поставлены специальные эксперименты. Триозофосфатизомераза состоит из двух идентичных субъединиц; каждая из них содержит два остатка аспарагина, замена которых может приводить к изменению термочувствительности белка, поскольку они расположены в месте соприкосновения субъединиц. При помощи олигонуклеотид-направленного мутагенеза были заменены остатки аспарагина в положениях 14 и 78 (табл. 8.3). Замена одного из них на остаток треонина или изолейцина приводила к повышению термостабильности фермента, на аспарагиновую кислоту — к понижению. Фермент, получающийся при замене обоих остатков аспарагина на остатки аспарагиновой кислоты, оказался нестабильным даже при нормальной температуре и обладал низкой ферментативной активностью (в табл. 8.3 не представлен).
Таблица 8.3. Стабильность при 100 °С триозофосфат-изомеразы дрожжей и ее генноинженерных вариантов1)
|
Фермент |
Положения аминокислотных остатков |
Время полужизни, мин |
|
|
14 78 |
|||
|
Дикий тип |
Asn |
Asn |
13 |
|
А |
Asn |
Thr |
17 |
|
В |
Asn |
Ile |
16 |
|
С |
Thr |
Ile |
25 |
|
D |
Asp |
Asn |
11 |
1) По данным работы Ahem et al., Рroc. Natl. Acad. Sci. USA 84:675—679, 1987.
Термостабильность фермента оценивают как время полужизни (скорость инактивации фермента) при 100 °С. Чем оно больше, тем более стабилен фермент
Оценка чувствительности рекомбинантных белков к протеолитическому расщеплению показала, что существует положительная корреляция между термостабильностью белка и его устойчивостью к протеолитическому расщеплению. Полученные данные говорят о возможности создания термостабильных форм других ферментов путем замены несущественных остатков аспарагина.
Уменьшение числа свободных сульфгидрильных групп
Чужеродный белок, синтезируемый в организме-хозяине, иногда оказывается менее активным, чем ожидалось, и чтобы повысить его активность, можно использовать методы генной инженерии. Например, при экспрессии в Е. coli клонированной комплементарной ДНК (кДНК) ß-интерферона человека (ИФβ) белковый продукт обладал в 10 раз меньшей противовирусной активностью, чем нативная гликозилированная форма. При этом ИФβ синтезировался в довольно большом количестве, однако почти все его молекулы образовывали димеры и более высокомолекулярные неактивные комплексы.
Как показал анализ нуклеотидной последовательности гена ИФβ, в нем присутствуют три остатка цистеина, и один из них или несколько, возможно, участвуют в образовании дисульфидных связей, приводящих к образованию димеров и олигомеров в клетках Е. coli, но не в клетках человека. Было высказано предположение, что замена одного или нескольких цистеиновых кодонов на сериновые приведет к синтезу интерферона, не образующего олигомеров. Серин был выбран потому, что его структура сходна со структурой цистеина за исключением того, что вместо серы он содержит кислород и поэтому не может образовывать дисульфидные связи.
Приступая к этим экспериментам, исследователи не располагали детальной информацией относительно молекулярной структуры ß-интерферона и были вынуждены опираться на соответствующие данные для родственных белков. Иными словами, они не знали, какой из трех остатков цистеина был ответствен за формирование межмолекулярных дисульфидных связей. К счастью, локализация остатков цистеина, участвующих в образовании внутримолекулярных дисульфидных связей в молекуле ИФа с аналогичной структурой, была известна, что делаю возможным сравнение аминокислотных последовательностей этих двух молекул (рис. 8.8). Как показали результаты анализа, остатки Cys-31 и Cys-141 в ИФß находятся в тех же позициях, что и остатки Cys-29 и Cys-138 в ИФа. Поскольку последние участвуют в образовании в ИФа внутримолекулярных дисульфидных связей, было разумно предположить, что Cys-17 в ИФß не вовлечен в формирование таких связей и его можно заменить.
Это предположение оказалось правильным: при синтезе в клетках Е. coli Ser-17-ИФß мультимерные комплексы не образовывались. Кроме того, этот интерферон обладал такой же удельной активностью, как и аутентичный нативный ИФß, и был более стабилен при длительном хранении, чем нативная форма.
Повышение ферментативной активности
С помощью направленного мутагенеза можно не только повышать стабильность ферментов, но и изменять их каталитическую активность. В настоящее время для существенного изменения ферментативной активности любого достаточно хорошо охарактеризованного фермента необходимо располагать детальной информацией о геометрии его активного центра. В этом случае можно предсказать, какие замены необходимо произвести для изменения специфичности фермента к данному субстрату.
Возможности данного подхода иллюстрируют результаты эксперимента по изменению специфичности связывания субстрата тирозил-тРНК—синтетазой из В. stearothermophilus. Этот фермент катализирует аминоацилирование тРНК, которая специфически связывает тирозин (тРНКТуr), в ходе двухступенчатой реакции:
![]()
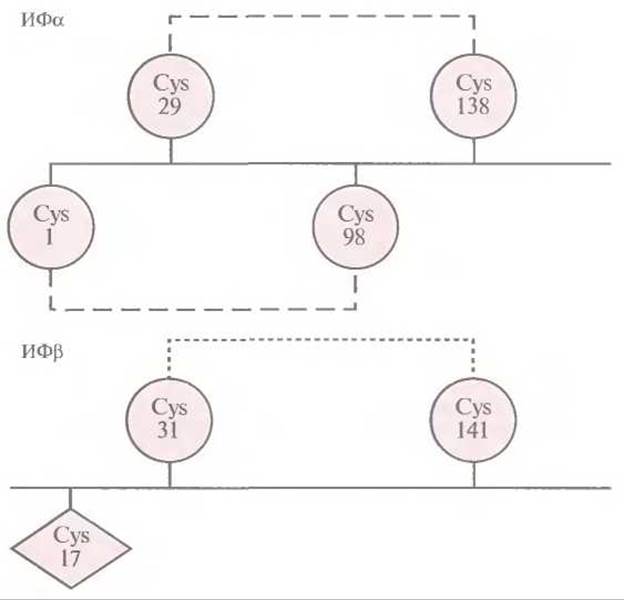
Рис. 8.8. Локализация остатков цистеина в молекулах ИФа и ИФβ, между которыми образуются дисульфидные связи. Выявленные внутримолекулярные дисульфидные связи в ИФа обозначены штриховыми линиями, а предполагаемая связь в ИФβ — пунктирной.
На стадии 1 ATP активирует тирозин (Туr), в результате чего образуется связанный с ферментом тирозиладенилат (Тут-А) и пирофосфат (РР). На стадии 2 тирозиладенилат гидролизуется при участии свободной 3'-гидроксильной группы молекулы тРНК, так что тирозин присоединяется к тРНК с высвобождением АМР. В ходе обеих реакций субстраты остаются связанными с тирозил-тРНК—синтетазой.
Ко времени постановки эксперимента была определена пространственная структура тирозил-тРНК—синтетазы В. stearothermophilus и локализован ее активный центр, так что при помощи компьютерного моделирования можно было предсказать влияние замены в нем одного или нескольких аминокислотных остатков на взаимодействие фермента с субстратами. Чтобы проверить правильность прогнозов, с помощью олигонуклеотид-направленного мутагенеза в ген тирозил-тРНК—синтетазы были внесены специфические мутации. Остаток треонина в положении 51 (Thr-51) был заменен на остаток аланина или пролина. В нативном ферменте гидроксильная группа Thr-51 образует водородную связь с атомом кислорода рибозного кольца тирозиладенилата. и предполагалось, что разрыв этой слабой связи увеличит сродство фермента к АТР.
Чтобы охарактеризовать получившиеся ферменты, определили их кинетические константы. В некоторых случаях изменения оказались более существенными, чем ожидалось (табл. 8.4). Так, если для Аlа-51-фермента константа связывания (KM) с АТР уменьшилась примерно в два раза без значительного изменения каталитической константы (kсаt), то для Рrо-51 -фермента — более чем в 100 раз. При этом каталитическая эффективность (kcat/KM) реакции аминоацилирования увеличилась в обоих случаях. Результат, полученный для Рго-51-фермента, был неожиданным, поскольку замена треонина на пролин должна была привести к нарушению (по крайней мере локальному) структуры а-спирали в этой области, что предположительно должно отрицательно сказаться на связывании субстрата.
Таблица 8.4. Эффективность аминоацилирования, осуществляемого нативной (Thr-51) и модифицированной (Аlа-51 и Рго-51) тирозил-тРНК—синтетазами1)
|
Фермент |
kcat, c-1 |
KM, мM |
kcat/KM, c-1, M-1 |
|
Thr-51 |
4,7 |
2,5 |
1860 |
|
Ala-51 |
4,0 |
1,2 |
3200 |
|
Pro-51 |
1,8 |
0,019 |
95 800 |
1) Поданным работы Wilkinson et al., Nature 307: 187—188, 1984.
Эти данные показывают, что несмотря на всю сложность прогнозирования результата специфических аминокислотных замен, с помощью описанного подхода все же можно идентифицировать боковые группы, замена которых приведет к улучшению кинетических свойств фермента. Кроме того, стало очевидно, что сродство данного фермента к субстрату, а также каталитическую эффективность реакции можно повысить in vitro, внося соответствующие изменения в клонированный ген.
Изменение потребности ферментов в металлических кофакторах
Субтилизины — сериновые протеиназы, секретируемые в культуральную среду грамположительными бактериями, — широко используются в качестве биодеградируемых детергентов. Все они прочно связывают один или несколько атомов кальция, повышающих их стабильность. К сожалению, субтилизины используются в таких промышленных процессах, где участвуют в больших количествах соединения, хелатирующие металлы, в том числе кальций, и в таких условиях субтилизины быстро теряют свою активность. Чтобы решить эту проблему, попытались сначала лишить субтилизин способности связывать кальций, а затем увеличить стабильность модифицированного фермента.
Получение модифицированного субтилизина было начато с идентификации гена BPN Bacillus amyloliquefaciens. Прежде всего с помoщью рентгеноструктурного анализа высокого разрешения была определена структура белка, а затем с использованием олигонуклеотид-направленного мутагенеза создан мутантный ген с делетированными нуклеотидами, кодирующими участок белковой молекулы от 75 до 83 аминокислотного остатка, который отвечал за связывание кальция. Белок с делецией не связывал кальций и, что удивительно, сохранял конформацию, сходную с таковой исходного белка.
Далее для повышения стабильности субтилизина без кальцийсвязывающего домена идентифицировали сайты, которые необходимо изменить, и аминокислотные остатки, которые нужно ввести в эти сайты. Было высказано предположение, что все аминокислоты, взаимодействующие с кальцийсвязывающим доменом в исходном ферменте, не являются оптимальными в новых условиях. В качестве кандидатов были выбраны 10 аминокислот, а поскольку заранее не было известно, включение какого именно аминокислотного остатка приведет к наибольшей стабилизации фермента, для внесения изменений в каждый из 10 сайтов использовали случайный мутагенез.
Выбранные аминокислоты были локализованы в четырех разных областях белковой молекулы: N-концевом участке (остатки со 2 по 5), в омега-петле (остатки с 36 по 44), в а-спиральной области (остатки с 63 по 85) и в одном из ß-слоев (остатки с 202 по 220). Чтобы идентифицировать оптимальную для данного сайта аминокислоту, мутантные клоны выращивали в плашках, прогревали при 65 °С в течение 1 ч, охлаждали и измеряли активность субтилизина. Для синтеза активного, не связывающего кальций субтилизина пришлось использовать В. subtilis, поскольку для Е. coli такой белок оказался токсичным.
Предварительный анализ выявил наличие стабилизирующих мутаций в 7 из 10 исследованных сайтов (табл. 8.5). Фермент, полученный при их внесении в один ген, обладал кинетическими свойствами, сходными с таковыми исходного субтилизина. Кроме того, мутантный субтилизин в отсутствие кальция был почти в 10 раз более стабилен, чем исходный и, как это ни удивительно, примерно на 50% более стабилен, чем исходный фермент в присутствии кальция. Полученные результаты показывают, что несмотря на трудоемкость этих экспериментов с помощью генной инженерии можно изменять свойства ферментов, которые зависят от большого числа аминокислотных остатков.
Таблица 8.5. Влияние случайных замен аминокислотных остатков в определенных участках на стабильность субтилизина BPN', лишенного кальцийсвязывающего домена1)
|
Участок |
Номер аминокислотного остатка |
Мутация2) |
Увеличение времени полужизни |
|
N-конец |
2 |
Clnn→Lys |
2,0 |
|
3 |
Ser→Cys |
17,0 |
|
|
4 |
Не обнаружена |
0 |
|
|
5 |
Pro→Ser |
1.2 |
|
|
Омега-петля |
41 |
Asp→Ala |
1,5 |
|
43 |
Lys→Asn |
1,2 |
|
|
a-Спираль |
73 |
Ala→Leu |
2,6 |
|
74 |
Не обнаружена |
0 |
|
|
ß-Слой |
206 |
Gln→Gys |
17,0 |
|
214 |
Не обнаружена |
0 |
1) По данным работы Strausberg et ab, Bio/Technology 13: 669—673, 1995.
2) Замены аминокислот в положениях 3 и 206 на Cys произошли в одном клоне: между этими остатками образовались дисульфидные связи, поэтому белок оказался настолько стабильным
Изменение специфичности фермента Олигонуклеотид-направленный мутагенез используют в основном для улучшения уже существующих свойств ферментов, но, вероятно, с его помощью можно изменять ферменты таким образом, чтобы они преобретали другую специфичность. Например, таким способом на основе относительно неспецифичной эндонуклеазы FokI были получены новые сайтспецифичные эндонуклеазы. К настоящему времени идентифицировано более 2500 ферментов рестрикции-модификации, происходящих из большого числа разных организмов. Многие из них узнают одну и ту же нуклеотидную последовательность, так что всего существует около 200 разных рестриктазных сайтов, при этом размер большинства из них составляет от 4 до 6 п. н. Эндонуклеазы рестрикции, узнающие такие сайты, расщепляют молекулу ДНК в очень многих местах и используются для получения больших фрагментов ДНК не столь широко, как эндонуклеазы рестрикции, узнающие нуклеотидные последовательности длинной в 8 п. н. или больше. Поиск новых эндонуклеаз рестрикции — весьма непростая задача, для ее решения требуется много времени. Вряд ли можно надеяться, что удастся найти достаточно много ферментов, узнающих сайты длинной 8 п. н. и больше, так что для получения новых рестриктаз необходимо использовать альтернативные генно-инженерные подходы.
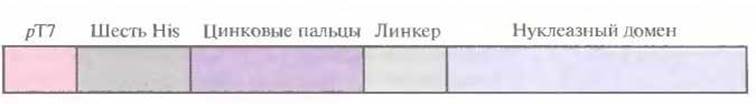
Рис. 8.9. Генноинженерная конструкция, кодирующая рекомбининтный белок «цинковые пальцы — эндонуклеаза рестрикции FokI».
Существует весьма интересный класс белков, в молекуле которых присутствуют уникальные структурные домены, связывающие атомы Zn2+, — так называемые цинковые пальцы. Эти белки связываются со специфической нуклеотидной последовательностью, встраиваясь своим a-спиральным участком в большую бороздку двойной спирали. Так, белок Zif268 из клеток мышей содержит три цинковых пальца, каждый из которых взаимодействует с определенным кодоном ДНК. Поскольку эти пальцы связываются с ДНК независимо друг от друга, их можно объединить в составе одного пептида таким образом, чтобы связывание происходило с определенным сайтом. Это позволяет создавать нуклеазы, расщепляющие ДНК в уникальных сайтах, объединив нуклеотидные последовательности, кодирующие цинковые пальцы, с частью гена неспецифичной нуклеазы FokI бактерии Flavobacterium okeanokoites. Чтобы проверить реальность этого предположения, был создан химерный ген, кодирующий участок из шести остатков гистидина на N-конце белковой молекулы для упрощения очистки рекомбинантного белка, три цинковых пальца, линкер (Gly4Ser)3 для придания гибкости рекомбинантной молекуле, а также содержащий часть гена нуклеазы FokІ (рис. 8.9). После очистки рекомбинантного белка N-концевые остатки гистидина были удалены обработкой тромбином.
Бактерии, синтезирующие эндонуклеазы рестрикции, защищают собственную ДНК от расщепления с помощью ферментов, метилирующих те участки молекулы, с которыми связывается соответствующая эндонуклеаза рестрикции. Однако геном клетки-хозяина не защищен от рекомбинантной рестриктазы FokI, и чтобы предотвратить гибель растущих клеток, синтез гибридного фермента подавляли, поместив ее ген под контроль системы экспрессии бактериофага Т7.
В результате этих экспериментов были получены две рекомбинантные эндонуклеазы рестрикции FokІ. Одна из них расщепляла ДНК фага λ, в том сайте, который и ожидался, а вторая — в ожидаемом сайте и — в меньшей степени — в двух других сайтах. Это не удивительно, поскольку цинковые пальцы распознают в основном два из трех оснований триплета. Хотя эти рекомбинантные ферменты пока нельзя использовать в лаборатории, описанный подход создания уникальных эндонуклеаз рестрикции представляется весьма перспективным.
Повышение стабильности и специфичности фермента
Фермент, называемый активатором тканевого плазминогена (tPA), — это сериновая протеиназа, состоящая из нескольких доменов; ее используют в клинике для растворения сгустков крови. К сожалению, tPA быстро выводится из системы кровообращения, поэтому его приходится вводить путем инфузии. Чтобы добиться желаемого терапевтического эффекта, необходимо использовать высокие концентрации фермента, а это может приводить к неспецифическому внутреннему кровотечению. Таким образом, было бы весьма желательно получить долгоживущий фермент tPA, обладающий высоким сродством к фибрину в тромбах и не вызывающий кровотечения. Белок с такими свойствами можно получить, внося специфические мутации в ген нативного tPA. Заменив Thr-103 на Asn, получили фермент, сохраняющийся в плазме кролика примерно в 10 раз дольше, чем нативный вариант. Заменив аминокислоты 296—299 с Lys-His-Arg-Arg на Аlа-Аlа-Аlа-Аlа. добились существенного повышения сродства фермента к фибрину. Заменив Asn-117 на Gln, получили фермент с такой же фибринолитической активностью, как у исходного фермента. Внеся эти три мутации в один белок, получили фермент, обладающий всеми тремя свойствами (табл. 8.6). Чтобы выяснить, можно ли использовать его вместо нативного tPA, нужно провести дополнительные исследования.
Таблица 8.6. Стабильность и активность различных мутантных вариантов фермента tPA1),2)
|
Вариант |
Модификация(и) |
Стабильность в плазме |
Сродство к фибрину |
Активность в плазме |
Эффективность растворения сгустков |
|
1 |
Thr( 103)→Asn |
10 |
0,34 |
0,68 |
0,56 |
|
2 |
LysHisArgArg(296-299)→AlaAlaAlaAla |
0,85 |
0,93 |
0,13 |
1,01 |
|
3 |
Thr(103)→Asn, LysHisArgArg(296-299)→AlaAlaAlaAla |
5,3 |
0,33 |
0,13 |
0,65 |
|
4 |
Thr(103)→Asn, Asn(117)→Gln |
3,4 |
1,0 |
1,13 |
1,17 |
|
5 |
LysHisArgArg(296-299)→AlaAlaAlaAla, Asn(117)→Gln |
1,2 |
1,33 |
0,16 |
1,38 |
|
6 |
Thr(103)→Asn, LysHisArgArg(296-299)→AlaAlaAlaAla, Asn(117)→Gln |
8,3 |
0,87 |
0,06 |
0,85 |
1) По данным работы Pena et al., Proc. Natl. Acad. Sсi. USA 91: 3670—3674, 1994.
2) Все значения нормированы относительно соответствующих значений для исходного фермента. Стабильность в плазме обратна времени, необходимому для осветления плазмы; чем больше приведенная величина, тем выше стабильность. Сродство к фибрину коррелирует с эффективностью растворения сгустков. По отношению к активности в плазме имеет место отрицательная корреляция.