Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Бактерии, стимулирующие рост растений
Биоконтроль патогенных микроорганизмов
Бактерии, стимулирующие рост растений, могут оказывать свое действие прямо или косвенно. Прямая стимуляция обычно состоит в поставке растению какого-либо соединения, синтезируемого бактерией (это может быть, например, связанный азот), или растительного гормона. Кроме того, бактерии могут облегчать поглощение растением из окружающей среды некоторых веществ, например железа или фосфора. Косвенная стимуляция заключается в том, что бактерии уменьшают или предотвращают вредное влияние одного или нескольких фитопатогенных организмов — грибов или бактерий. Фито-патогены могут уменьшать урожайность сельскохозяйственных культур на 25—100%, что наносит огромный ущерб. Обычно для борьбы с ними используют химикаты. К сожалению, в большинстве случаев симптомы заболеваний у растений не проявляются достаточно долго, до тех пор, пока изменения в окружающей среде не вызовут пролиферацию бактерий и не приведут к быстрому развитию болезни и к уничтожению всего урожая. Контроль таких обширных эпидемий трудноосушествим и требует больших денежных затрат.
Многие химикаты, использующиеся для борьбы с фитопатогенами, представляют опасность для животных и человека; они накапливаются в природных экосистемах и долго сохраняются в них. Поэтому было бы целесообразно заменить химические способы подавления патогенных микроорганизмов биологическими, более «благоприятными» для среды. Один из биологических подходов к контролю фитопатогенов заключается в создании трансгенных растений, устойчивых к одному или нескольким патогенным микроорганизмам (этот подход обсуждается в гл. 18). Были также предприняты попытки использовать в качестве инструмента биоконтроля бактерии, стимулирующие рост растений. Такие бактерии синтезируют соединения, которые можно использовать для уменьшения ущерба, наносимого растениям фитопатогенами. В их числе — сидерофоры и антибиотики, а также различные ферменты. Впрочем, несмотря на всю перспективность этого подхода, почти все исследования пока проводились в лабораторных условиях, ростовых камерах или в оранжереях. Окончательный же вывод о пользе той или иной стратегии, основанной на использовании какого-то конкретного механизма, можно будет сделать только после полевых испытаний.
Сидерофоры
Железо — один из наиболее распространенных на Земле элементов, абсолютно необходимых живым организмам. Однако в той форме, в какой железо присутствует в почве, оно не может прямо использоваться микроорганизмами. Дело в том, что его преобладающей природной формой являются трехвалентные ионы. Их растворимость очень мала — при pH 7,4 она равна примерно 10-18 М, и этого количества абсолютно недостаточно для поддержания роста микроорганизмов. Чтобы выжить в таких условиях, почвенные микроорганизмы синтезируют и секретируют небольшие низкомолекулярные железосвязывающие соединения мол. массой примерно 400—1000 Да, известные под названием сидерофоров (рис. 14.8). Они эффективно связывают Fe(III) и транспортируют его к клеткам микроорганизмов, где оно связывается с клеточными рецепторами и попадает внутрь клеток. Здесь железо высвобождается и может использоваться м икроорганизмом.
Бактерии, стимулирующие рост растений, подавляют пролиферацию фитопатогенных грибов, синтезируя сидерофоры, которые связывают большую часть Fe(III), находящегося в слое почвы, непосредственно прилегающем к корню растения (в ризосфере). Фитопатогенные грибы тоже синтезируют сидерофоры, но они обычно обладают более низким сродством к железу, чем сидерофоры, синтезируемые стимулирующими рост растений бактериями. Это позволяет последним одерживать верх в конкурентной борьбе с фитопатогенными грибами за имеющееся железо.
В отличие от фитопатогенных микроорганизмов, растения, как правило, не страдают от локального истощения железа в почве в результате поглощения его бактериями, стимулирующими рост растений. Большинство растений могут расти при значительно меньших концентрациях железа, чем микроорганизмы. Кроме того, есть данные, что железо, связанное бактериальными сидерофорами, может ассимилироваться растениями и использоваться ими для своих нужд. Поскольку связывание железа бактериальными сидерофорами может одновременно приводить к подавлению пролиферации самых разных фитопатогенных микроорганизмов, исследуется возможность использования их для создания более эффективных систем биоконтроля.
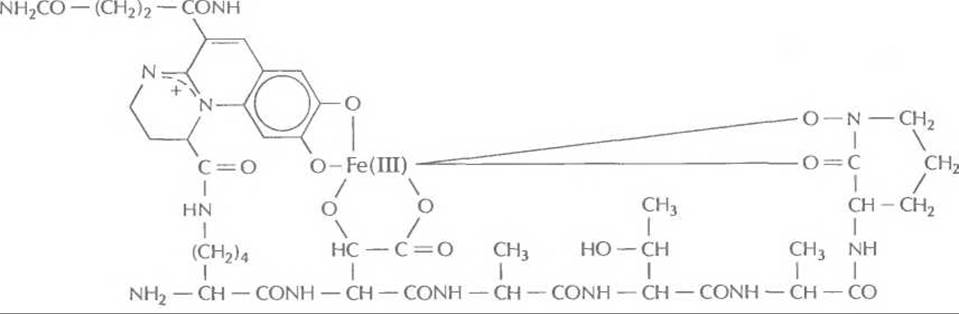
Рис. 14.8. Структура сидерофора псевдобактина, продуцируемого штаммом Pseudomonas В10. С одной молекулой сидерофора связан один ион Fe(III).
Многие стимулирующие рост растений флуоресцирующие псевдомонады секретируют сидерофор, представляющий собой линейный гексапептид, который состоит из чередующихся L- и D-аминокислот и связанного флуоресцентного хромофора (рис. 14.8). Один из таких сидерофоров, так называемый псевдобактин, обладает сродством к Fe(III) = 1025 л моль-1. Сходные сидерофоры синтезируют все флуоресцирующие псевдомонады.
Предприняты также первые попытки исследовать синтез псевдобактина у стимулирующей рост растений бактерии Pseudomonas putida WCS358. С помощью мутагенеза были получены 28 мутантов этого микроорганизма, не способных синтезировать сидерофор. Их отбор осуществляли по: 1) отсутствию флуоресценции в УФ- свете; 2) неспособности к росту в присутствии дипиридила — вещества, связывающего большую часть железа в культуральной среде. При очень малых концентрациях ионов железа растут только те клетки, которые синтезируют сидерофоры. Был создан банк клонов ДНК Р. putida WCS358 с помощью космидного вектора pLAFRl с широким кругом хозяев и путем конъюгации осуществлена трансформация всех 28 мутантных форм. Трансформанты были проверены на способность к флуоресценции в УФ-свете и/или способность к росту в присутствии дипиридила. Идентифицированы тринадцать разных комплементирующих космидных клонов со средним размером вставки 26 т. п. н. Детальные исследования показали, что эти клоны соответствуют по крайней мере пяти отдельным кластерам генов.
Один из этих кластеров был исследован более детально. Его минимальная длина составила примерно 33,5 т. п. н., он содержал пять оперонов по крайней мере с семью отдельными генами. Таким образом, как и фиксация азота и образование клубеньков, биосинтез сидерофоров — это сложный процесс. Поскольку каждый сидерофор кодируется несколькими генами, получение рекомбинантных бактерий, способных синтезировать модифицированный сидерофор, — задача не из легких. К счастью, есть другие способы повысить эффективность использования бактерий, стимулирующих рост растений, в качестве инструмента биоконтроля. Например, можно расширить круг узнаваемых одним бактериальным штаммом комплексов железо—сидерофор, так чтобы один рекомбинантный штамм мог узнавать и использовать сидерофоры, синтезируемые другими почвенными микроорганизмами, повышая тем самым свою конкурентоспособность. Для этого были клонированы гены рецепторов комплекса железо—сидерофор одной из бактерий, стимулирующих рост растений, и введены в другие штаммы.
Антибиотики
Один из наиболее эффективных механизмов, которые используют стимулирующие рост растений бактерии для подавления пролиферации фитопатогенов, — синтез антибиотиков. Так, псевдомонады, использующиеся для биоконтроля, синтезируют такие антибиотики, как агроцин 84, агроцин 434, 2,4-диацетилфлороглюцинол, гербиколин, оомицин, феназины, пиолутеорин и пирролнитрин.
Способность бактерий, стимулирующих рост растений, подавлять пролиферацию фитопатогенов можно повысить, если ввести в эти бактерии гены, кодирующие биосинтез антибиотиков, которые обычно синтезируются другими бактериями. Это позволит расширить спектр фитопатогенов, рост которых способна подавлять одна бактерия. Более того, ограничивая размножение других почвенных микроорганизмов, секретирующие антибиотик бактерии, стимулирующие рост растений, облегчают свою собственную пролиферацию, поскольку уменьшается число конкурентов за ограниченные пищевые ресурсы, а с помощью методов генной инженерии со временем удастся увеличить выход бактериальных антибиотиков.
Синтез большинства противогрибковых метаболитов, продуцируемых псевдомонадами, по-видимому, контролируется белком, который действует как общий регулятор транскрипции; следовательно, уровень синтеза антибиотика можно повысить изменением общей регуляции. Например, в случае Pseudomonas fluorescens CHAO его удалось повысить с помощью трансформации микроорганизма вектором, несущим ген «домашнего хозяйства» rроD который кодирует σ70-субъединицу РНК-полимеразы. Рекомбинантный штамм лучше защищал корни растений огурца от повреждений, вызываемых грибом Pythium ultimum (табл. 14.7). В другом исследовании синтез антибиотика пиолутеорина тем же микроорганизмом стимулировали инактивацией генов pqq, участвующих в биосинтезе пирролхинолинхинона — кофактора различных гидрогеназ. Механизм такой стимуляции до конца не установлен; возможно, в результате мутации поток метаболитов от других реакций биосинтеза переключается на биосинтез пиолутеорина.
В настоящее время на рынке имеется только один рекомбинантный микроорганизм, использующийся для биоконтроля: Agrobacterium radiobacter К84. Этот штамм продается в Австралии начиная с 1989 г. как средство борьбы с корончатым галлом — болезнью, которую вызывает Agrobacterium tumefaciens. Заболеванию подвержены миндаль и косточковые плодовые деревья, такие как персики. A. radiobacter синтезирует антибиотик агроцин 84, токсичный для A. tumefaciens. Однако при случайном попадании в него плазмиды от A. radiobacter, содержащей гены биосинтеза агроцина 84, могут возникнуть агроцинустойчивые штаммы A. tumefaciens. Чтобы избежать этого, из плазмиды pAgK84, несущей гены биосинтеза агроцина 84, был удален участок, ответственный за перенос плазмиды (рис. 14.9). В результате штамм A. radiobacter больше не мог передавать рекомбинантную агроциновую плазмиду патогенным агробактериям, но сохранял способность к биоконтролю.
Таблица 14.7. Влияние дополнительных копий rpoD-гена Pseudomonas fluorescens CHAO на способность этой бактерии защищать корни растений огурца от повреждений, вызываемых патогенным грибом Pythium ultimum1)
|
Бактерия, стимулирующая рост растений |
Средняя масса о вежего корня, мг2) |
|
|
в отсутствие Р. ultimum |
в присутствии Р. ultimum |
|
|
Отсутствует |
382 |
44 |
|
Р. fluorescens CHAO |
386 |
177 |
|
P.fluorescens CHAO, содержащая вектор |
365 |
146 |
|
Р. fluorescens CHAO, содержащая вектор с геном rpoD |
371 |
335 |
1) Из работы Schnider et al.. J. Bacterid 177: 5387—5392, 1995.
2) В отсутствие Р. fluorescens CHAO наблюдается значительное замедление роста корней, обусловленное влиянием патогенного гриба Р. ultimum. Когда плазмидный вектор, которым трансформировали Р. fluorescens CHAO, содержал ген rpoD, защитный эффект бактерии был гораздо больше. Массу корней определяли после выращивания растений в определенных условиях в течение 2 нед.
Ферменты
Некоторые бактерии, стимулирующие рост растений, синтезируют такие ферменты, как хитиназа, ß-1,3-глюканаза, протеаза и липаза, которые разрушают клеточную стенку грибов. В одном из экспериментов удалось снизить частоту возникновения болезней, вызываемых фитопатогенными грибами Rhizoctonia solani, Sclerotium rolfsii и Pythium ultimum, с помощью штамма Pseudomonas cepacia, синтезирующего фермент ß-1,3-глюканазу, который разрушал грибной мицелий. В ходе других исследований было показано, что противогрибковая активность трех штаммов Enterobacter agglomerans, стимулирующих рост растений, обусловлена наличием у них комплекса из четырех разных полипептидов, которые, действуя совместно, расщепляют хитин клеточной стенки грибов. Эти бактерии хорошо защищали растения хлопчатника от заражения Rhizoctonia so lani. В то же время Тn5-мутанты Е. agglomeransне продуцирующие активной хитиназы, не были способны защитить растения от патогенных грибов.
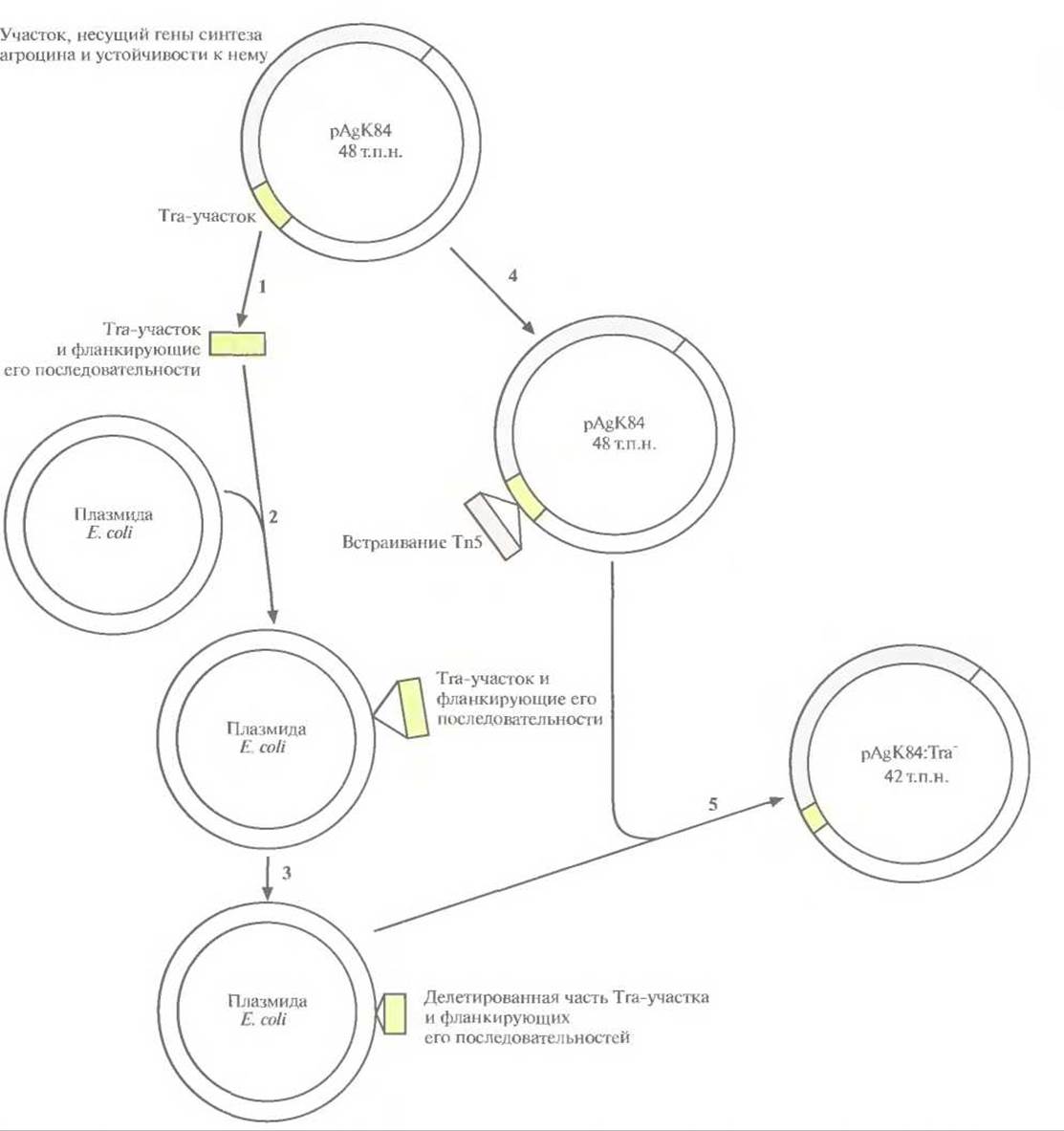
Рис. 14.9. Конструирование неспособной к переносу (Тrа-) модификации плазмиды pAgK84 A. radiobaaer, кодирующей гены биосинтеза агроцина 84 и гены устойчивости к нему. Используя рестрикционную карту pAgK84, из плазмиды вырезали (1) фрагмент, который содержал участок Tra, ответственный за перенос, вместе с фланкирующими его последовательностями, и встроили его в плазмиду Е. coli (2). С помощью рестриктазной обработки из клонированного фрагмента удалили примерно 80% Тrа-участка и часть фланкирующих его последовательностей (в сумме примерно 6 т.п.н.) (3). Осуществили гомологичную рекомбинацию между плазмидой Е. coli, содержащей «урезанный» Тrа-участок, и плазмидой pAgK84, которая содержала встроенный в Тrа-участок транспозон Тn5 с геном устойчивости к канамицину (4). Получили несколько производных плазмиды pAgK84 с частично удаленным Тrа-участком (5). Тrа--плазмида pAgK84 больше не могла передаваться другой агробактерии в ходе конъюгации, но все еще была способна детерминировать синтез агроцина 84 и обеспечивать устойчивость к нему. Рисунок выполнен без соблюдения масштаба.
Многие бактериальные ферменты, разрушающие клеточную стенку грибов, в том числе хитиназа и ß-глюканаза, кодируются одним геном. Было бы разумно выделить эти гены и ввести их бактериям, стимулирующим рост растений, с тем чтобы получить штаммы, синтезирующие, например, и антибиотики, и ферменты, разрушающие клеточную стенку грибов. Были проведены эксперименты, в которых ген хитиназы, выделенный из бактерии Serratia marcescens, был перенесен в клетки Trichoderma harzianum и R. meliloti. Оба трансформированных микроорганизма синтезировали хитиназу и обладали повышенной противогрибковой активностью. При введении гена хитиназы S. marcescens в штамм Р. fluorescens, стимулирующий рост растений, был получен трансформант, стабильно секретирующий хитиназу и эффективно подавляющий размножение фитопатогенного гриба Rhizoctonia solani.
Образование кристаллов льда и антифризные белки
Некоторые патогенные поражающие листья бактерии типа Pseudomonas syringae синтезируют при низких температурах специфические белки, служащие центрами образования кристаллов льда на поверхности листа при температурах ниже нуля. По мере своего роста кристаллы прокалывают растительные клетки и необратимо повреждают растение, а бактерии получают в свое распоряжение питательные вещества, высвободившиеся из разрушенных растительных клеток. Если белки — центры кристаллизации на поверхности листа — отсутствуют, то непродолжительные ночные заморозки могут и не принести вреда растению, поскольку образование кристаллов льда в цитоплазме растительной клетки обычно начинается при температуре на несколько градусов ниже точки замерзания (т. е. происходит ее переохлаждение). Чтобы предотвратить кристаллизацию на листьях таких культур, как земляника, можно еще до заморозков распылить над растениями мутантные бактерии Р. syringae, не способные синтезировать белки — центры кристаллизации. Такие мутантные формы могут быть созданы с помощью технологнии рекомбинантных ДНК или обычного мутагенеза с последующим отбором, и они при достаточной концентрации вытеснят бактерии дикого типа.
Одним из важных условий эффективности биоконтроля патогенных микроорганизмов с помощью бактерий, стимулирующих рост растений, является способность этих бактерий к распространению в естественных условиях. В Канаде, скандинавских странах и на севере США они должны сохранять жизнеспособность в условиях долгих холодных зим, а весной размножаться при относительно низких температурах почвы (-5—10 °С). Поскольку микроорганизмы используют разные адаптивные стратегии выживания в неблагоприятных условиях, можно попытаться сконструировать с помощью генной инженерии рекомбинантные бактерии, оптимально приспособленные к низким температурам. Недавно было показано, что некоторые почвенные бактерии (а среди них встречаются и такие, которые стимулируют рост растений) могут размножаться при 5 °С и секретировать в окружающую среду антифризные белки при низких температурах. Такие белки регулируют образование кристаллов льда внутри бактериальной клетки. Хотя в их присутствии кристаллы все же формируются, они не достигают больших размеров и не разрушают клетки. Как только будут идентифицированы гены бактериальных антифризных белков, их можно будет перенести в клетки бактерий, стимулирующих рост растений, с тем чтобы получить трансформированные бактерии, устойчивые к низким температурам. Пока нет никаких данных о наличии связи между антифризной активностью бактерий и механизмом, обеспечивающим их выживание при низких температурах. Очень интересно проверить, является ли синтез антифризного белка частью адаптивной стратегии, используемой некоторыми бактериями для обеспечения устойчивости к холоду.