Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Бактерии, стимулирующие рост растений
Образование клубеньков
Конкуренция среди организмов, образующих клубеньки
Одна из основных задач сельскохозяйственной биотехнологии — создание с помощью методов генной инженерии штаммов Rhizobium, которые повышали бы урожайность растений более эффективно, чем природные штаммы. Многие имеющиеся на рынке штаммы-инокуляты — превосходные азотфиксаторы — были созданы путем мутагенеза и последующего отбора, однако они в недостаточной степени стимулируют образование клубеньков на корнях растения-хозяина в условиях конкуренции с природными штаммами Rhizobium, уже присутствующими в почве. И наоборот, многие природные штаммы с успехом выдерживают конкуренцию с лабораторными штаммами, но малоэффективны в отношении фиксации азота. Таким образом, для того чтобы можно было реально использовать имеющиеся на рынке инокулирующие штаммы, необходимо либо повысить их способность образовывать клубеньки, либо устранить природные штаммы Rhizobium.
Были проведены исследования, направленные на определение генетической основы «конкурентоспособности» природных штаммов, с тем чтобы затем попытаться ввести соответствующие гены в штаммы-инокуляты.
Манипуляции с генами образования клубеньков
Для идентификации генов образования клубеньков (nod-генов) вновь использовали генетическую комплементацию. Не способный образовывать клубеньки (Nod-) мутантный штамм R. meliloti трансформировали банком клонов хромосомной ДНК R. meliloti дикого типа и выделяли колонии, приобретшие способность образовывать клубеньки на корнях люцерны (рис. 14.6). Стратегия заключалась в следующем.
1. С помощью частичного гидролиза ДНК R. meliloti рестриктазой EcoRI и встраивания фрагментов длиной до 40 т. п. н. в уникальный EcoRI-сайт космиды pLAFRl с широким кругом хозяев был создан банк клонов хромосомной ДНК R. meliloti дикого типа (Nod+).
2. Рекомбинантные плазмиды упаковали в частицы фага λ, ввели в Е. coli, а затем перенесли в клетки Nod- -штaммa R. meliloti при помощи конъюгации. Вектор содержал ген устойчивости к тетрациклину, который можно было использовать как селективный маркер и в случае Е. coli, и в случае R. meliloti.
3. После конъюгации суспензии, содержащие от 200 до 300 трансформированных клеток R. meliloti, проверяли на способность инициировать образование клубеньков у стерильных растений люцерны. Ожидалось, что этой способностью будут обладать только трансформанты, которые несут и экспрессируют ген, комплементирующий дефект образования клубеньков в клетках R. meliloti.
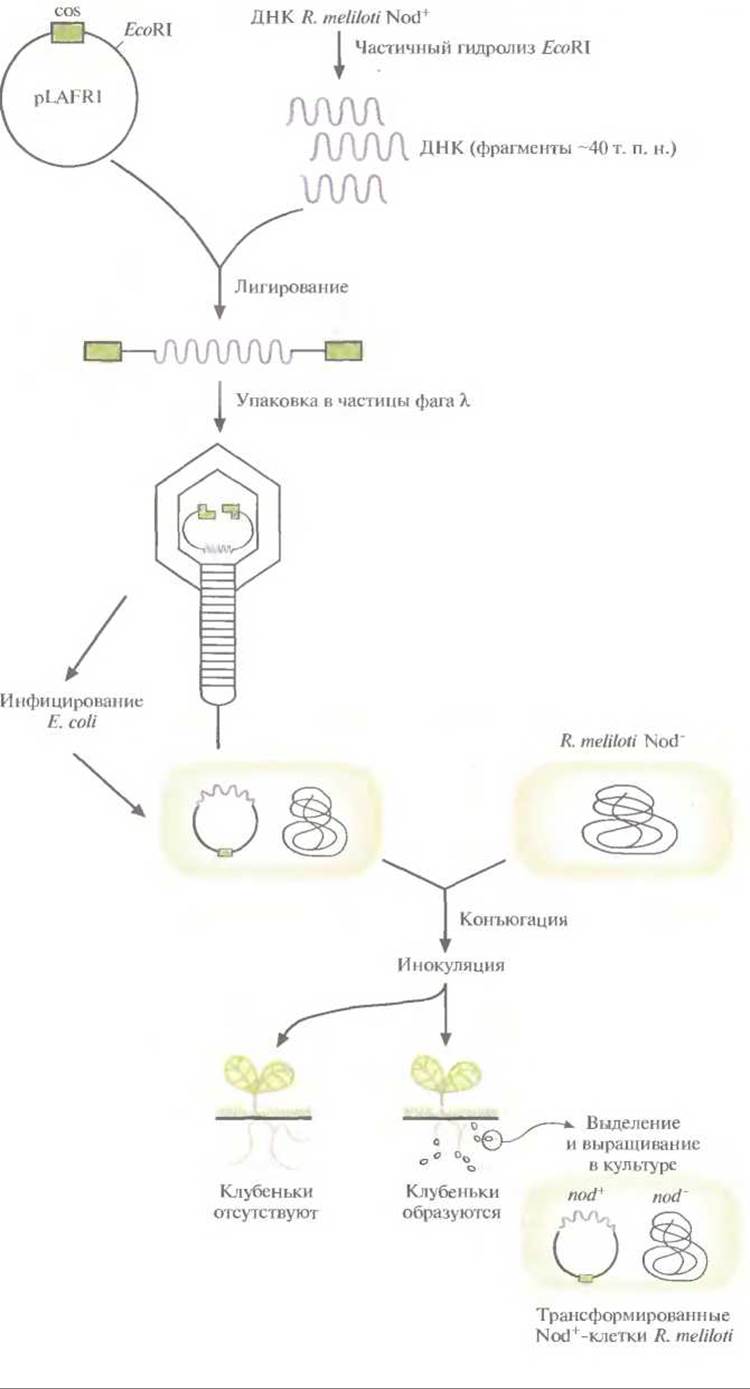
Рис. 14.6. Идентификация генов образования клубеньков R. meliloti. ДНК R. meliloti дикого типа встраивают в космиду pLAFRI с широким кругом хозяев, упаковывают в частицы фага λ и вводят в Е. coli. Банк клонов переносят из Е. coli в Nod- -штамм R. meliloti при помощи конъюгации. Растения люцерны инокулируют трансформированными R. meliloti Nod-: растения, образующие корневые клубеньки, инфицированы It meliloti Nod+ клетки которых, по-видимому, несут комплементирующий ген образования клубеньков в составе космидного вектора. Из корневых клубеньков выделяют трансформированные Nod+ -клетки R. meliloti.
4. Из клубеньков выделили бактерии, вызывающие образование клубеньков, а из бактерий — вектор, несущий комплементирующий ген. Содержащую этот ген большую вставку переклонировали и провели дальнейший анализ.
5. Идентифицированный ген образования клубеньков использовали в качестве зонда для обнаружения фланкирующих его участков хромосомной ДНК R. meliloti в геномной библиотеке.
В результате этих весьма трудоемких экспериментов удалось охарактеризовать весь набор генов образования клубеньков R. meliloti. Детальные биохимические и генетические исследования показали, что образование клубеньков и его регуляция — это сложные процессы, в которых задействованы продукты большого количества генов (примерно 20; табл. 14.6). Одни из этих генов высококонсервативны (одинаковы у всех микроорганизмов, образующих клубеньки), другие видоспецифичны. Их можно сгруппировать в три отдельных класса: консервативные, видоспецифичные и регуляторный ген nodD. Так, nodABC-тены одинаковы у всех видов Rhizobium и структурно взаимозаменяемы; у большинства видов они образуют один оперон. Установлено, что процесс образования клубеньков включает несколько этапов. Сначала продукт конститутивно экспрессирующегося гена nodD связывается с молекулой флавоноида, секретируемого клетками корней растения-хозяина. Флавоноиды — это растительные фенольные соединения, структурную основу которых составляют два ароматических кольца, соединенных друг с другом трехуглеродным мостиком. Они выполняют в растениях разные функции, в частности отвечают за их пигментацию и участвуют в защите от грибов и насекомых. Связывание флавоноидов с белком NodD — один из ключевых моментов идентификации растения-хозяина, поскольку каждый вид Rhizobium узнает ограниченное число флавоноидных структур, а каждая разновидность растений синтезирует свой специфический набор этих молекул. Одни штаммы, например R. leguminosarum biovar (bv.) trifolii, имеют очень узкий круг хозяев, поскольку узнают только несколько видов флавоноидов, а у других штаммов, например у NGR234 Rhizobium sp., круг хозяев очень широк.
Таблица 14.6. Некоторые белки, кодируемые генами образования клубеньков Rhizobium, и их возможные функции
|
Белок |
Характеристика1) |
|
NodА |
Консервативен, локализован в плазматической мембране, вместе с NodB стимулирует клеточное деление |
|
NodB |
Консервативен, локализован в плазматической мембране, вместе с NodA стимулирует клеточное деление |
|
NodC |
Консервативен, локализован в наружной мембране, хитинсинтаза |
|
NodD |
Консервативен, активатор транскрипции, синтез конститутивен |
|
NodE |
Локализован в плазматической мембране, ß-кетоацилсинтаза |
|
NodF |
Локализован в цитоплазме, ацилпереносящий белок |
|
NodG |
Видоспецифичен, дегидрогеназа |
|
NodH |
Видоспецифичен, сульфотрансфераза |
|
NodlJ |
Консервативен, локализован в плазматической мембране, участвует в секреции полисахарида оболочки |
|
NodK |
Влияет на инициацию образования клубеньков некоторыми штаммами Bradyrhizobium |
|
NodL |
Локализован в плазматической мембране, ацетилтрансфераза |
|
NodM |
D-глюкозаминсинтаза |
|
NodN |
Функция неизвестна |
|
NodO |
Секретируется, гемолизин |
|
NodP |
Комплекс с NodQ, АТР-сульфурилаза |
|
NodQ |
Комплекс с NodP, АТР-сульфурилаза |
|
NodS |
Метилтрансфераза |
|
NodT |
Локализован в наружной мембране, участвует в секреции |
|
NodU |
Функция неизвестна |
|
NodX |
Видоспецифичен |
1) Если биохимические или генетические данные о функции белка отсутствуют, то ему приписывают такие же функции, как у белка с гомологичной аминокислотной последовательностью. Разные штаммы Rhizobium содержат разные наборы этих белков. Слово «консервативен» означает, что белок выполняет одинаковую функцию у всех видов Rhizobium

Присоединение молекул флавоноида активирует белковый продукт NodD, по-видимому, вызывая его конформационное изменение. Далее комплекс флавоноид — NodD связывается с промоторным участком генов образования клубеньков, называемым «nod-блоком. Этот участок расположен перед всеми генами образования клубеньков, кроме гена nodD, и запускает их транскрипцию. Гены nodABC кодируют белки, которые вызывают набухание и скручивание корневых волосков, что считается первым шагом инфицирования корня растения бактерией. Вместе растение и бактерии синтезируют некий олигосахаридный фактор, который модифицируется генным продуктом NodH, а возможно, и продуктами NodQ и NodP. Этот фактор, обозначаемый NodRm-1 (рис. 14.7), обусловливает специфический ответ растения-хозяина, в том числе скручивание и деформацию корня.
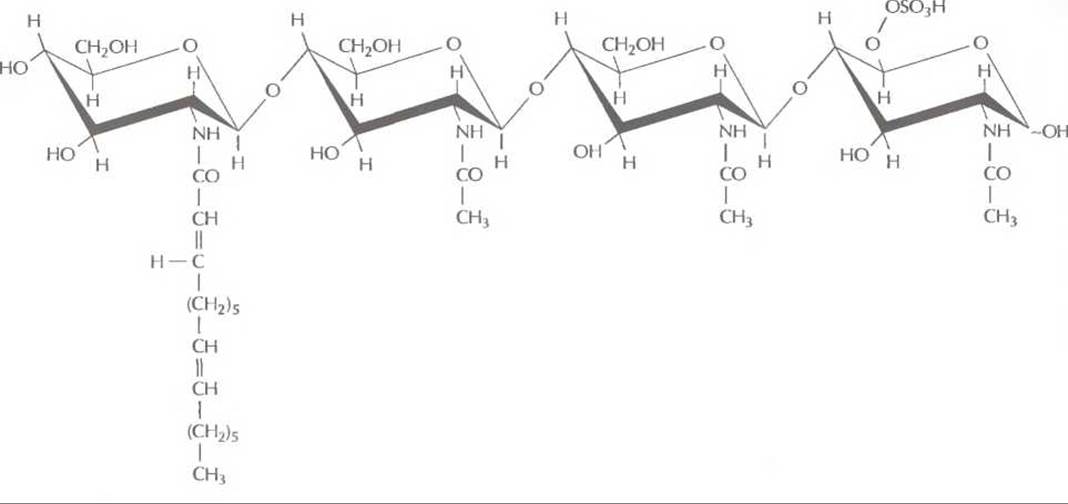
Рис. 14.7. Предполагаемая структура олигосахаридного фактора NodRm-1. Это соединение обусловливает специфический ответ растения-хозяина, в том числе скручивание и деформацию корня.
В зависимости от штамма Rhizobium или Bradyrhizobium, в конце концов синтезируется примерно 20 дополнительных продуктов nod-генов. Вместе с некоторыми белками, кодируемыми растениями, они участвуют в формировании клубенька.
Чтобы выяснить роль каждого из идентифицированных «nod-генов, необходимо провести дополнительные исследования; кроме того, не исключено, что со временем обнаружатся новые «nod-гены. Например, секвенирование ДНК и компьютерный анализ показали, что у медленнорастущей формы Bradyrhizobium sp. область ДНК между nodD- и nodABC-генами содержит открытую рамку считывания, а у быстрорастущей формы этой последовательности нет. Открытую рамку считывания обозначили nodK. При инокуляции растений штаммом Bradyrhizobium sp. с мутантным nodK-геном (NodK) клубеньки на них начинают образовываться на 5 дней раньше, чем у растений, зараженных штаммом дикого типа; при этом число клубеньков удваивается, а урожайность растений увеличивается на 120%.
К настоящему времени не удалось разработать простых генетических подходов, которые позволяли бы использовать nod-гены для повышения конкурентоспособности инокулирующих штаммов Rhizobium. Впрочем, можно изменить видоспецифичность бактерий путем переноса nodD-гена из штамма Rhizobium с широкой специфичностью в один из штаммов с узкой специфичностью. Так или иначе, ясно, что образование клубеньков — весьма сложный процесс, и для дальнейшего увеличения конкурентоспособности штаммов Rhizobium потребуются всесторонние исследования с использованием методов генной инженерии.