Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Генная инженерия растений: методология
Эксперименты по экспрессии чужеродных генов в растениях
После того как методика трансформации растений была полностью отработана, исследователи стали пытаться вводить различные растительные и бактериальные гены в клетки самых разных растений. Трансформированные растения проверяли на способность к синтезу чужеродного белка, проводили физиологические исследования, чтобы определить, как присутствие этого белка сказывается на всем растении. Во многих ранних экспериментах использовали промоторы, контролирующие конститутивную экспрессию в ряде растительных клеток. Не так давно были выделены и охарактеризованы растительные промоторы, контролирующие экспрессию чужеродных белков в специфических клетках на определенных стадиях роста и развития растения. Например, вместо сильного конститутивного 35S-пpoмотopa вируса мозаики цветной капусты, функционирующего во всех растительных тканях в течение всей жизни растения, исользовали промотор гена малой субъединицы фотосинтетического фермента рибулозобис-фосфат-карбоксилазы, работающего только в фотосинтезирующих тканях, например в листьях. Аналогично для контроля экспрессии некоторых чужеродных генов использовали растительные промоторы, функционирующие только в специфических тканях или только при неблагоприятных условиях.

Подавляющее большинство генов растений локализованы в ядерной ДНК, однако хлоропласта и митохондрии тоже содержат гены, кодирующие ряд важных и уникальных функций. При этом не все белки, присутствующие в этих органеллах, закодированы в их ДНК. Некоторые из них кодируются ядерной ДНК, синтезируются в цитоплазме, а затем с помощью специального механизма импортируются в соответствующую органеллу. Есть два способа введения специфического чужеродного белка в митохондрии или хлоропласты. Один способ — это слияние гена, кодирующего чужеродный белок, и последовательности сигнального пептида, направляющего белки в органеллы. Такая конструкция может быть встроена в хромосомную ДНК, и рекомбинантный белок будет импортироваться в соответствующую органеллу. Второй способ предполагает встраивание гена, кодирующего чужеродный белок, непосредственно в хлоропластную или митохондриальную ДНК.
Выделение различных промоторов и их использование
Для выделения растительных промоторов из некоторых видов растений использовали специализированные так называемые «промотор-направленные» векторы и систему трансформации на основе Ті-плазмид Agrobacterium. Суть подхода состоит в следующем. Ре портерный ген без промотора встраивают сразу за правой фланкирующей последовательностью вектора на основе Ti-плазмиды, и после переноса Т-ДНК в хромосому растения он оказывается в окружении растительной ДНК. Если Т-ДНК встроится в промоторный участок функционального гена, то произойдет транскрипция репортерного гена. Для идентификации растительных промоторов в качестве репортерного гена можно использовать ген неомицинфосфотрансферазы (npt). При этом экспрессию данного гена можно проконтролировать отбором канамицинустойчивых трансформантов. Однако таким способом трудно идентифицировать промоторы, функционирующие лишь на определенной стадии развития растения или индуцируемые специфическим фактором окружающей среды. Чтобы быть уверенным в отборе именно трансформированных клеток, в Т-ДНК следом за репортерным геном без промотора встраивают ген устойчивости к гигроминину, находящийся под контролем конститутивного промотора. Сначала отбирают гигромицинустойчивые клетки, а затем проверяют ферментативную активность трансформантов в условиях, обеспечивающих экспрессию репортерного гена. В результате обнаруживается, что от 5 до 30% трансформированных растительных клеток несут репортерный ген, находящийся под контролем активного промотора.
35S-пpoмотop вируса мозаики цветной капусты часто используют в растительных системах как сильный промотор, хотя уровень экспрессии контролируемого им гена, кодирующего чужеродный белок, часто оказывается ниже, чем хотелось бы. Чтобы решить эту проблему и найти наиболее эффективный промотор, необходимо протестировать в растениях различные конструкции «промотор—ген». Кроме промотора, экспрессию чужеродных генов могут усиливать некоторые другие элементы, в частности энхансерные последовательности, расположенные на расстоянии от одной до нескольких сотен нуклеотидов до промотора, интроны, стабилизирующие мРНК, и сигналы терминации транскрипции.
Были протестированы ДНК-конструкции, содержащие все или некоторые из следующих элементов: 35S-пpoмотop; сигнал терминации транскрипции гена нопалинсинтазы; от одного до семи тандемных повторов энхансерных элементов; так называемая Ω-последовательность, которая предположительно усиливает экспрессию гена на уровне трансляции. Наиболее эффективная конструкция содержала семь энхансерных элементов, при этом уровень экспрессии чужеродного гена в трансгенных растениях табака и риса был намного выше, чем в случае одного 358-промотора (табл. 17.5). Протестированные промоторные конструкции контролировали экспрессию в трансгенных растениях широкого круга чужеродных генов. Такое разнообразие, вероятно, объясняется тем, что Т-ДНК встраивалась в разные сайты в геноме растения. Используя этот подход, можно создавать сильные тканеспецифичные промоторы, регулируемые в процессе развития.
Введение чужеродных генов в хлоропластную ДНК
У большинства высших растений в каждой клетке листа присутствует примерно 100 хлоропластов и каждый хлоропласт содержит примерно 100 копий хлоропластной ДНК. Для стабильной генетической трансформации хлоропластов с целью изменения их функциональных характеристик необходимо вводить чужеродные гены в хлоропластную, а не в хромосомную ДНК. длина которой примерно в 104—105 раз больше. Кроме того, необходимо, чтобы чужеродные гены присутствовали во всех из примерно 104 молекул хлоропластной ДНК, содержащихся в одной клетке.
Таблица 17.5. Тестирование промоторных конструкций в трансгенных растениях1,2)
|
Растение |
Средний уровень экспрессии гена |
Максимальный уровень экспрессии гена |
||
|
35S-пpoмотop |
сложный промотор |
35S-пpoмотop |
сложный промотор |
|
|
Табак |
1.0 |
2,8 |
2,8 |
18,3 |
|
Рис |
1,0 |
14,4 |
7,2 |
47,1 |
1) Из работы Mitsuhara et al.. Plant Cell Physiol. 37:49—59, 1996.
2) В качестве репортерного гена использовали ген ß-глкжуронидазы Е. coli. Ферментативную активность нормировали по среднему значению для растения, когда ген находился под контролем 35S-пpoмотоpa. Фактические величины, полученные при тестировании на табаке, примерно в 30 раз превышают те, которые получены на рисе. Сложный промо гор включал 35S-пpoмoтop, сигнал терминации транскрипции гена нопалинсинтазы, семь тандемных повторов энхансерных элементов и Ω-последовательность ДНК вируса табачной мозаики. Средний уровень экспрессии генов — это среднее значение, полученное по данным для нескольких трансгенных растений, а максимальный уровень — это наибольшее значение, наблюдавшееся на каком-либо растении с данным промотором.
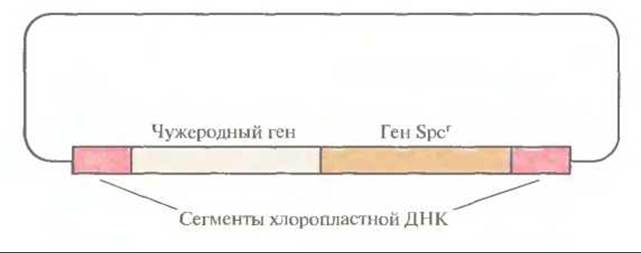
Рис. 17.7. Плазмидные векторы, используемые для введения тандемных генов в хлоропластную ДНК. Spcr — ген устойчивости к спектиномицину.
Вначале чужеродные гены вводили в ДНК хлоропласте» в составе плазмидного вектора, несущего неселективную чужеродную ДНК и селективный маркер, например ген устойчивости к антибиотику, фланкированные специфическими последовательностями хлоропластной ДНК (рис. 17.7). Такая стратегия была весьма эффективной, однако нередко селективный маркер мешал экспрессии фланкирующих хлоропластных генов. Чтобы решить эту проблему, разработали стратегию, в которой селективный маркер и чужеродный ген не были физически связаны друг с другом. Для этого растения табака трансформировали смесью одинаковых количеств двух разных плазмид: одна содержала селективный маркер (ген устойчивости к спектиномицину), фланкированный ДНК из одного участка хлоропластной ДНК, а вторая — чужеродный ген (ген устойчивости к канамицину), фланкированный последовательностями из другого участка хлоропластной ДНК (рис. 17.8). Оба гена имели прокариотические сигналы транскрипции, что обеспечивало их транскрипцию в хлоропластах, но не в ядре. Последовательности хлоропластной ДНК в плазмиде были организованы таким образом, что рекомбинация или встраивание в геном хлоропластов не приводила к нарушению работы какого-либо хлоропластного гена. Плазмиды вводили методом бомбардировки микрочастицами, а затем отбирали трансформированные растения табака на среде со спектиномицином. Хлоропласта из отобранных трансформантов проверяли на наличие продукта, детерминируемого геном устойчивости к канамицину (неселективным чужеродным геном). Удивительно, что примерно 30% спектиномицинустойчивых трансформантов экспрессировали также ген устойчивости к канамицину, что указывает на применимость котрансформации для введения чужеродных генов в хлоропластную ДНК.
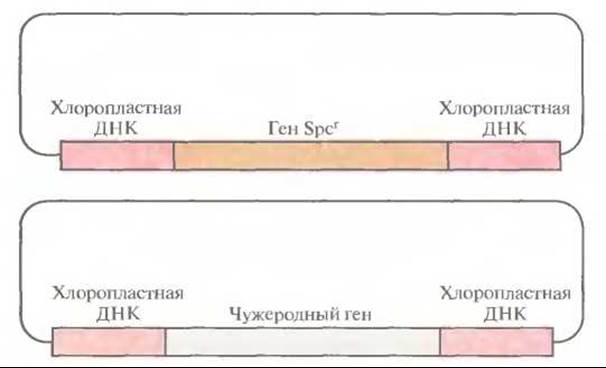
Рис. 17.8. Плазмидные векторы, используемые для встраивания в хлоропластную ДНК двух генов — селективного и неселективного. Spcr — ген устойчивости к спектиномицину.
![]()
Рис. 17.9. Схематическое представление Т-ДНК, входящей в состав вектора. После интеграции Т-ДНК в хромосомную ДНК растения транспозаза может вырезать селективный маркерный ген и встроить его в другой хромосомный сайт. Обозначения: Л и П — левая и правая фланкирующие последовательности, Ds — мобильный элемент. Промоторы и сигналы терминации транскрипции гена транспозазы, гена, интересующего исследователя, и селективного маркерного гена не показаны.