Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Как изучают клетки?
Изучение химической среды в живых клетках
Классические методы микроскопии позволяют судить о клеточной архитектуре, но не дают подробной информации о клеточной химии. Мы уже говорили о том, что для локализации в клетках специфических макромолекул можно использовать антитела. Но столь же важно знать распределение и концентрацию малых молекул. Поддержание жизни возможно только при быстрой и точной регуляции концентрации таких важнейших метаболитов, как АТР, глюкоза и неорганические ионы; содержание этих веществ в различных участках клеток и тканей может существенно варьировать. Более того, поскольку низкомолекулярные вещества, такие, как клеточный АТР, кальций и водород могут выполнять функцию внутриклеточных «мессенджеров», очень важно уметь прослеживать изменение их концентрации в ответ на внутриклеточные сигналы. В этом разделе мы будем обсуждать некоторые методы, заимствованные из химии, методы, которые позволяют определять химические условия в клетках в процессе их жизнедеятельности.
4.2.1. Для определения химических условий в популяции живых клеток можно использовать ядерный магнитный резонанс (ЯМР) [14]
Ядра многих атомов характеризуются магнитным моментом: следовательно, они, подобно магнитным стрелкам, обладают внутренним магнетизмом. Магнитные характеристики этих атомов подвержены влиянию со стороны окружающих атомов. Метод ядерного магнитного резонанса (ЯМР), являющийся безвредным для живых клеток, позволяет определить химическую природу вещества. Если ядра атомов, обладающие магнитным моментом, поместить в магнитное поле, они принимают одну из возможных ориентации. Каждая из ориентации характеризуется энергией, определяемой силой поля и химическим окружением. При облучении радиоволнами набора атомов в идентичном химическом окружении, энергия этих волн будет в значительной степени абсорбироваться, если волны обладают строго определенной частотой, соответствующей разности энергетических состояний двух возможных ориентации ядер в магнитном поле. Это так называемая резонансная частота. Образец ткани содержит атомы в различных молекулах и в различном окружении и будет поглощать энергию на различных резонансных частотах. Диаграмма поглощения на резонансных частотах для данного образца составит его спектр ЯМР. Такой спектр отражает структуру и относительное содержание каждого типа молекул, содержащих магнитные ядра.
В химических лабораториях ЯМР широко используется как аналитическая методика для определения структуры малых молекул в растворах. Совершенствование приборного парка сделало возможным применение метода ЯМР для изучения биологических объектов. Например, сигнал ЯМР, исходящий от протонов (ядер водорода), часто используется для изучения белков, нуклеиновых кислот и других макромолекул в растворе: взаимодействие частей макромолекулы влияет на спектр ЯМР, и поэтому спектр ЯМР содержит подробную информацию о молекулярной структуре и молекулярных движениях. В отличие от рентгеноскопии ЯМР не требует кристаллизации образцов. Однако для создания содержательного спектра ЯМР молекулы в растворах должны быстро «кувыркаться». Этим и объясняется существование верхнего предела (около 20 тыс. дальтон), ограничивающего размеры макромолекул, конформация которых может подвергаться эффективному анализу.
Лишь некоторые атомы имеют изотопы, создающие удовлетворительный сигнал ЯМР. Для изучения макромолекул, содержащихся внутри живой клетки, обычно используют широко распространенные изотопы 1Н, 23Na, 31P, 39K и редкие изотопы 13Cu15N. Ввиду важной роли соединений фосфора, которую они играют в метаболизме, эффективным оказывается определение ЯМР 13Р. Этот изотоп в норме присутствует в фосфорсодержащих веществах клеток. Сигналы, создаваемые им, можно использовать для слежения за изменением внутриклеточной концентрации в процессе мышечного сокращения таких соединений, как АТР и неорганический фосфат. Сигналы ЯМР от изотопа фосфора 31Р полезны также для точного измерения внутриклеточного рН, поскольку резонансная частота неорганического фосфата определяется состоянием его ионизации и, следовательно, рН раствора (рис. 4-31).
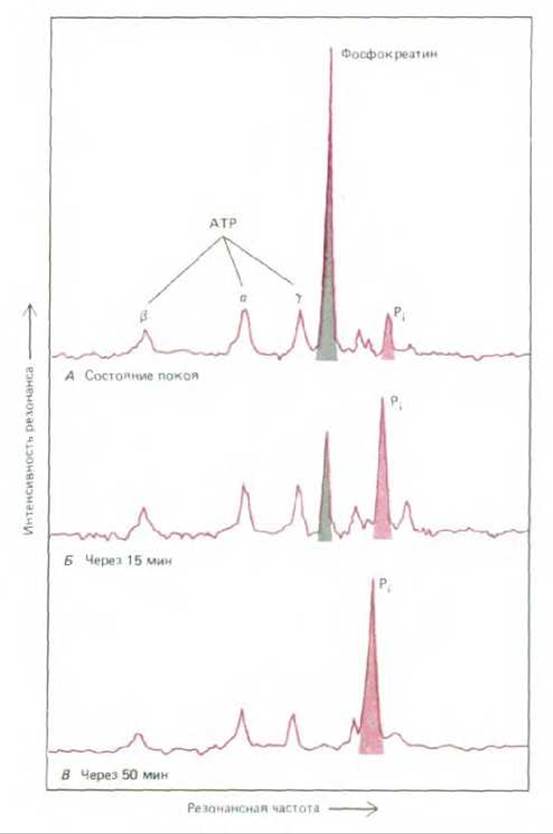
Рис. 4-31. Спектр ЯМР 31Р, записанный с мышцы лягушки (А - в расслабленном состоянии, Б после 15 мин стимулируемой активности в анаэробных условиях, В после 50 мин такой активности). Пять меченых пиков на спектре представляют сигналы от ядер Р, находящихся в различных атомах: один пик соответствует фосфокреатину, а, ß и у-трем фосфатным группам АТР и PI - неорганическому фосфату. В расслабленной мышце фосфокреатин содержится в высокой концентрации (А); он выполняет функцию депо свободной энергии в скелетных мышцах, поскольку его фосфат прямо переносится на ADP для восстановления АТР, гидролизуемого в процессе мышечного сокращения. Следовательно, в уставшей мышце депо фосфокреатина снижается, а концентрация неорганического фосфата (образующегося из АТР) соответственно возрастает. Пик Рітакже слегка смещается влево, отражая изменение клеточного рН за счет накопления молочной кислоты - побочного продукта анаэробного метаболизма. По расположению пика Pi, сравниваемого с таковым для известного стандарта, можно рассчитать, что в данном случае рН изменился от 7,5 (А) до 6,4 (В). (Изменено с разрешения M.J. Dowson, D. J. Gedian, D.R. Wilkie, Nature, 274, 861-866, 1978. Copyright 1978 McMillan Magazine Ltd.)
Редкие изотопы 13С и 15N в норме не содержатся в клетках в достаточных количествах, однако их можно вводить в специфические макромолекулы, имеющие биологическое значение. С помощью ЯМР удается следить впоследствии за их химической трансформацией. Если, например, выращивать клетки на среде с глюкозой 13С, то, измеряя в течение некоторого времени спектр ЯМР образца, можно определять скорость многих реакций, в которых участвует глюкоза. Используя другие меченные 13С и 15N соединения, можно в принципе следить за перемещением атомов углерода и азота по любым метаболическим путям.
Основным ограничением метода ЯМР является его низкая чувствительность. Например, для определения содержания какого-либо соединения с использованием современных модификаций метода 31Р-ЯМР, в грамме живой ткани должно содержаться не менее 0,2 мМ исследуемого соединения. Однако многие метаболиты присутствуют в живых тканях в более низких концентрациях. Более того, поскольку для снятия одного спектра ЯМР требуется, как правило, несколько минут, можно не уловить быстрые изменения цитохимических характеристик. С другой стороны, значительное преимущество ЯМР состоит в его безвредности для живых клеток, и это обстоятельство делает данный метод весьма перспективным для клеточной биологии.
4.2.2. Концентрацию ионов можно измерять внутриклеточными электродами [15]
Для изучения отдельных клеток необходимо использовать методы более чувствительные, чем ЯМР. Один из них основан на подходе, разработанном электрофизиологами для изучения разности потенциалов и тока на плазматической мембране. С этой целью готовят внутриклеточные микроэлектроды. Они состоят из тонких стеклянных трубок, диаметр конца которых измеряется долями микрона; такие трубочки заполняют электропроводным раствором (обычно это раствор соли КСl в воде). Кончик микроэлектрода вводят в цитоплазму через плазматическую мембрану, которая смыкается вокруг капилляра, плотно прилегая к стеклу, так что клетка остается относительно неповрежденной.
В исследовании клеточного содержимого микроэлектроды используют двояко: с их помощью можно измерять внутриклеточную концентрацию обычных ионов, таких, как ионы Н+, Na+, K+, Сl-, Са2+ и Mg2+. Они могут быть использованы и для инъекции молекул в клетки. Принцип измерения концентрации ионов микроэлектродом тот же, что и в рН-метре. Стремление ионов диффундировать по градиенту концентрации может быть уравновешено приложением электрического поля противоположной направленности: чем выше градиент концентрации, тем выше значение электрического поля. Величина электрического поля, необходимого для удержания градиента концентрации в стабильном состоянии, позволяет судить о величине градиента концентрации ионов. Для определения концентрации специфического иона необходимо создать преграду из материала, проницаемого только для данного иона, и поместить эту преграду между раствором известной концентрации и тем раствором, в котором измеряется содержание данного иона. Разность потенциалов на селективно проницаемом барьере в условиях отсутствия электрического поля может использоваться как мера соотношения концентрации определенного иона по обе стороны барьера (см. разд. 6.4.15). На практике кончик микроэлектрода заполняют соответствующим органическим соединением, создавая барьер, селективно проницаемый для определенного иона. Данный микроэлектрод и стандартный микроэлектрод затем вводят внутрь клетки, как показано на рис. 4-32.
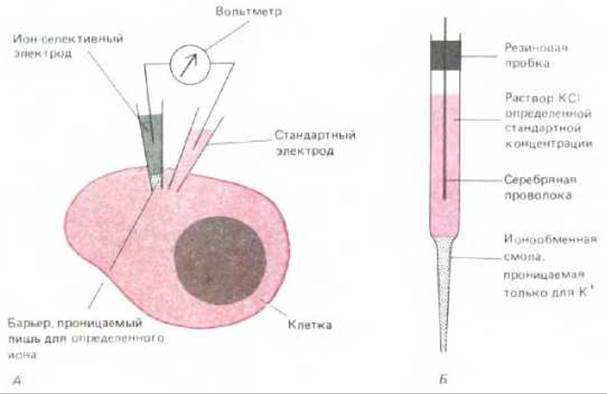
Рис. 4-32. Для измерения внутриклеточной концентрации ионов можно использовать ион-селективный электрод. А. Схема эксперимента. Б. Конструкция микроэлектрода, избирательного для К+. Обычно кончик ион-селективного внутриклеточного электрода выполнен из специального стекла либо заполнен особым органическим соединением, проницаемым для определенных ионов. Остальная часть трубки заполнена водным раствором ионов данной концентрации и содержит металлический проводник, присоединенный к одной из клемм вольтметра. Подобным образом другая клемма соединена со стеклянным стандартным микроэлектродом с открытым кончиком, содержащим обычный злектропроводящий раствор. Оба электрода вводят сквозь плазматическую мембрану в исследуемую клетку. Напряжение на вольтметре соответствует разнице потенциалов на селективном барьере и отражает содержание ионов в клетке (см. текст). Обычно крупные клетки прокалывать микроэлектродом проще; при диаметре клетки менее 10 мкм применение данного метода усложняется.
В последнее время микроэлектродную технику стали использовать для изучения транспорта ионов через специализированные белковые каналы (именуемые также ионными каналами), содержащиеся в небольших участках плазматической мембраны. В этом случае необходим стеклянный микроэлектрод с несколько более толстым кончиком. Его не вводят в плазматическую мембрану, а плотно и мягко прижимают к ней (рис. 4-33). Это позволяет регистрировать электрические характеристики небольшого участка мембраны, прилегающего к кончику микроэлектрода, который прикасается к клетке или находится на небольшом расстоянии от нее (рис. 4-34). Данный метод известен как «пэтч-регистрация» (регистрация в данном участке). Его применение произвело настоящую революцию в исследовании ионных каналов. Это единственный метод клеточной биологии, который дает возможность изучать функцию одиночной белковой молекулы в реальном времени; мы вернемся к рассмотрению данного вопроса в гл. 6.
4.2.3. Быстрые изменения концентрации внутриклеточных ионов можно измерять с помощью светоизлучающих индикаторов [16]
Электроды, чувствительные к определенным ионам, позволяют измерять их концентрацию только в одной точке на клеточной поверхности. Если же ионы представлены в клетках в низкой концентрации, например ионы Са2+, показания таких электродов зачастую оказываются ошибочными. Между тем изменения внутриклеточной концентрации ионов Са2+ очень важно учитывать при изучении реакции клеток на внеклеточные сигналы. Такие изменения можно анализировать, используя внутриклеточные индикаторы, излучающие свет. Некоторые из этих индикаторов по своей природе являются люминесцентными (излучающими свет спонтанно), другие флуоресцентными (излучающими свет в ответ на возбуждение светом). Так, например, люминесцентный белок экварин, выделяемый из морской медузы, излучает свет в присутствии Са2+ и реагирует на изменение концентрации Са2+ в пределах от 0,5-10 мкМ. Если акварин инъецировать в яйцеклетку, а затем ее оплодотворить, в цитоплазме происходит изменение концентрации Са2+, регистрируемое по вспышке света, который излучает экварин (рис. 4-35). Недавно были синтезированы флуоресцентные индикаторы, прочно связывающиеся с Са2+. Показано, что в свободном состоянии они излучают свет большей длины волны нежели связанная форма. Измеряя изменение интенсивности флуоресценции при двух длинах волн, излучаемых этим индикатором, можно определить соотношение свободной и Са-связанной фракций индикатора; благодаря этому можно точно оценить концентрацию свободных ионов Са2+. Два известных индикатора такого типа - квин-2 и фура-2 - используют для постоянного наблюдения за изменениями внутриклеточной концентрации Са2+ в различных участках клеток с помощью флуоресцентного микроскопа. Подобные внутриклеточные индикаторы созданы для измерения внутриклеточного рН. Некоторые из них проникают в клетки за счет диффузии и их не нужно микроинъецировать; в этом случае можно под флуоресцентным микроскопом одновременно наблюдать значительное количество отдельных клеток. Создание новых типов внутриклеточных индикаторов и их использование в комплексе с современными способами обработки изображения позволяет разработать быстрые и точные методы измерения внутриклеточной концентрации многих низкомолекулярных веществ.

Рис. 4-33. Микропипетки, используемые для «пэтч»-регистрации. Показано, как клетка - палочка из глаза саламандры - удерживается присасывающей пипеткой, а стеклянная пипетка с тонким кончиком прижата к клетке; стекло плотно соприкасается с плазматической мембраной и выполняет функцию микроэлектрода. (Из Т. D. Lamb, H.R. Mattews, V. Torre, J. Physiol, 37, 315-349, 1986.)
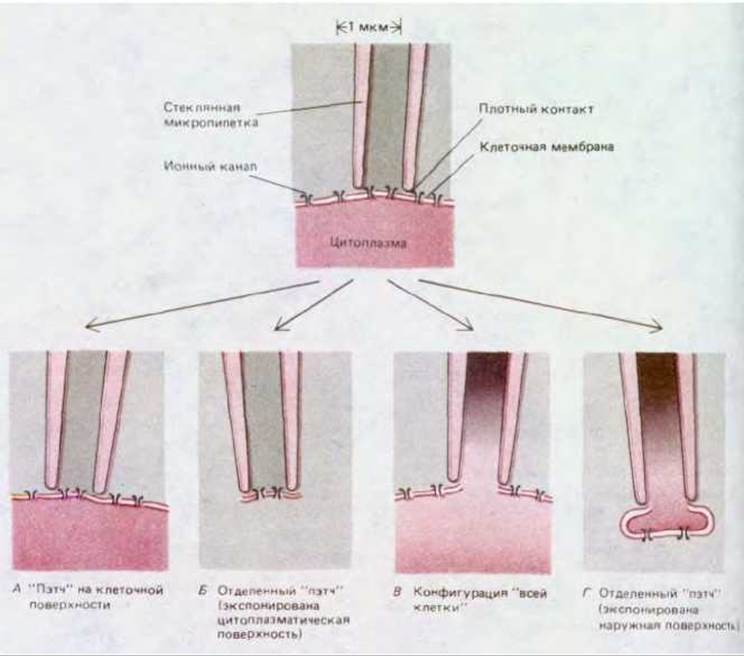
Рис. 4-34. Четыре стандартных варианта «пэтч»-регистрации. Отверстие стеклянной регистрирующей пипетки сперва прижимают к клеточной мембране, создавая плотный контакт (вверху). Величину тока проходящего через пипетку в данном участке мембраны можно определить, если участок мембраны сохраняет контакт с клеткой (А); участок мембраны отделен от клетки и цитоплазматическая поверхность этого участка обнажена (6); мембрана разрушена при мягком всасывании и электрод напрямую сообщается с внутренним содержимым клетки. Вариант, представленный в правой части рисунка (Г), позволяет регистрировать электрические характеристики клетки, как при использовании внутриклеточного электрода. В данном случае можно изменить химические условия в клетке за счет введения определенных веществ, диффундирующих в цитоплазму через сравнительно толстую регистрирующую пипетку. Конфигурация Г возникает из конфигурации 5, когда пипетка отделяется от клетки и соприкасающийся с электродом участок мембраны как бы затыкает пипетку. В случае Г с электродом, как правило, соприкасается не цитоплазматическая, а наружная поверхность мембраны (сравните с Б).
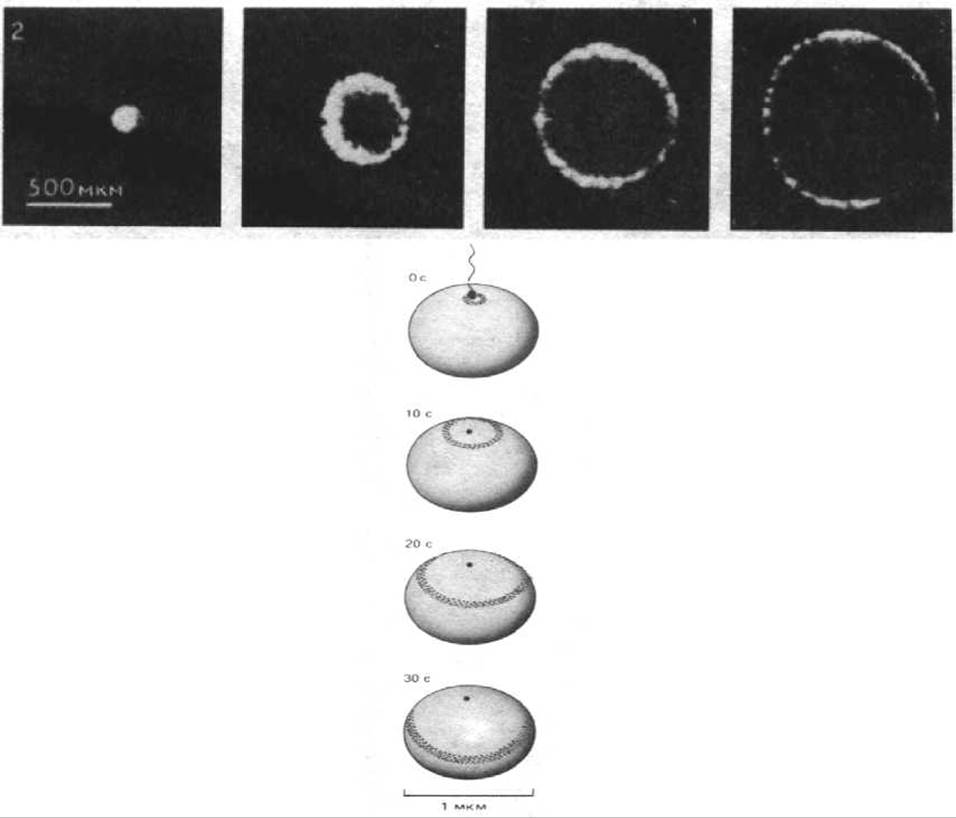
Рис. 4-35. Флуоресцирующий белок, акварин, излучает свет в присутствии свободных ионов Са++. В икринку рыбы вводили экварин, диффундировавший через цитозоль. Затем проводили искусственное оплодотворение и наблюдали за яйцом, применив метод усиления изображения. Были сделаны четыре фотоснимка со стороны точки проникновения спермия; интервал 10 с. Обнаружено появление в цитозоле волны ионов Са+, высвобождающихся из внутренних депо, которые расположены непосредственно под клеточной мембраной. Начиная от места проникновения спермия, эта волна проходит через все яйцо, как указано на диаграмме слева. (Фотографии воспроизводятся из J. С. Jinkey, L. F. Jafle, Е. В. Ridge-way, J.T. Reynolds J. Cell Biol., 76, 448-476, 1978 Copyright Rockefeller University Press.)
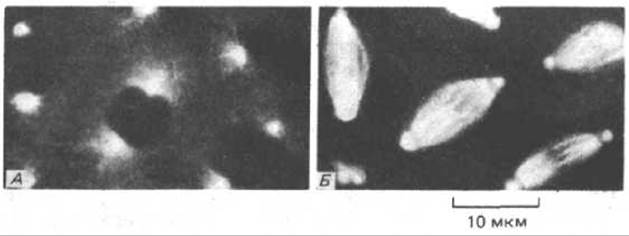
Рис. 4-36. Микрофотографии участка раннего эмбриона Drosophila, который инъецирован тубулином, предварительно меченным родамином (тубулин - белок микротрубочек). На этой ранней стадии развития ядра объединены общей цитоплазмой, и поэтому микротрубочки метятся во всем эмбрионе. А. Микротрубочки в живом эмбрионе исходят из двух ярких пятен по обе стороны от каждого из интерфазных ядер; в центре каждого пятна центросома. Б. Этот же эмбрион через несколько минут, когда все ядра синхронно входят в митоз. Микротрубочки сохраняют контакт с центросомами, но они подверглись реорганизации и сформировали митотическое веретено. (С любезного разрешения Douglas Kel-
4.2.4. Существует несколько методов для введения в клетки молекул, не проникающих через мембрану [17]
Иногда возникает потребность введения в клетки молекул, не проникающих через мембрану. Это могут быть светоизлучающие индикаторы (как акварин), клеточные белки, связанные с флуоресцентной меткой, молекулы, которые оказывают влияние на поведение клеток. Один из подходов состоит в микроинъекции молекул в клетки с помощью стеклянной микропипетки. Это очень эффективная методика, сущность которой состоит в следующем: очищенный белок связывается с флуоресцентной меткой и затем его инъецируют в клетки. Используя соответствующий микроскоп, исследователь получает возможность следить за поведением такого белка в процессе роста и деления клеток (рис. 436).
Микроинъекции - весьма эффективный и достаточно широко используемый метод, однако важно помнить, что в данном случае процедуре микроинъекции подвергается каждая клетка отдельно, поэтому количество клеток, которые можно наблюдать одновременно, ограничено. Существуют методы, позволяющие одновременно повышать проницаемость клеточных мембран у множества клеток, составляющих клеточные популяции. Для этого используют мощный электрический разряд или химическое воздействие, например, раствором детергента низкой концентрации. Электрический разряд создает в плазматической мембране большие поры без повреждения внутриклеточных мембран. Эти поры остаются открытыми в течение нескольких минут и даже часов в зависимости от типа клеток и интенсивности электрического воздействия. Через эти поры даже макромолекулы могут быстро входить в цитозоль или покидать его. При ограниченном воздействии мембрана у значительной части клеток восстанавливается и клетки выживают. Третий метод введения в клетки крупных молекул состоит в слиянии частиц, окруженных мембраной и содержащих необходимые молекулы, с плазматической мембраной клетки. Все три метода широко применяются в клеточной биологии (рис. 4-37).
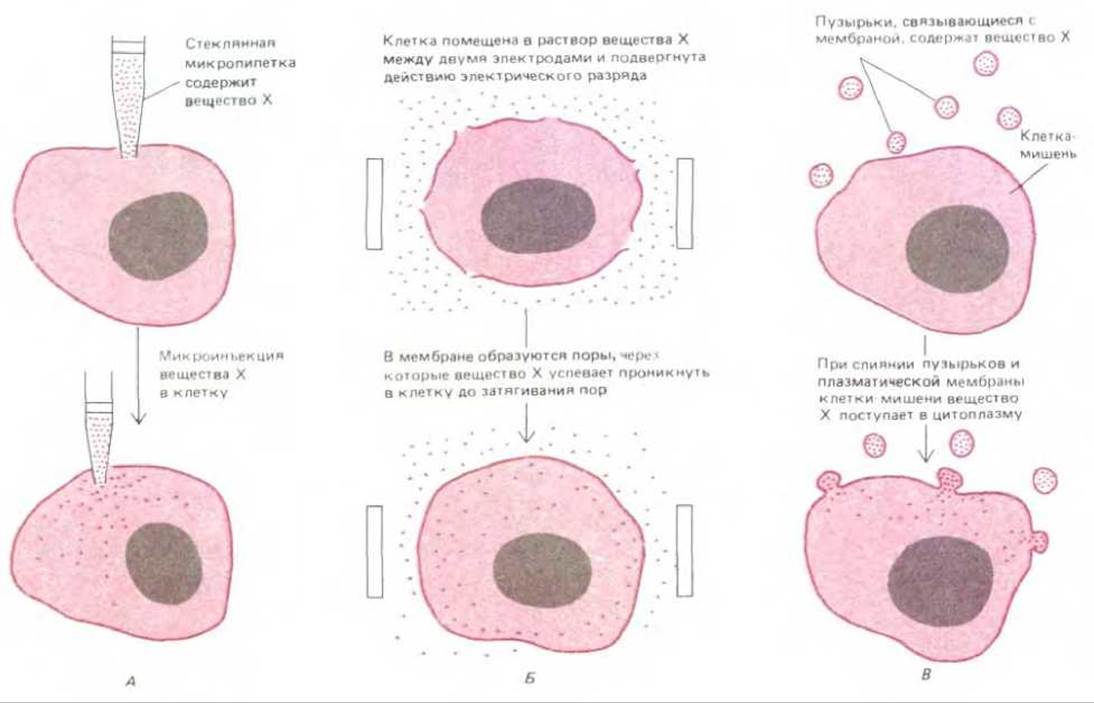
Рис. 4-37. Для внутриклеточного введения веществ, не проникающих через клеточную мембрану, используют три метода. А. Вещество в клетку вводят с помощью микропипетки за счет гидравлического давления поршня или электрического заряда вводимых молекул, вследствие чего вещество проникает в клетку в виде потока ионов (метод ионофореза). Б. Клеточная мембрана под действием короткого и мощного электрического разряда (2000 в/см в течение 200 мкс) нарушается, что обеспечивает вхождение в клетку определенных веществ. В. Использовано слияние мембран. В начале процедуры получают пузырьки, окруженные мембранами (липосомы). Затем липосомы загружают необходимым веществом, смешивая концентрированный раствор этого вещества и суспензию фосфолипидов. Другая модификация этого метода включает на первом этапе нарушение мембраны эритроцитов, приводящее к утрате ими клеточного содержимого, и последующее помещение полученных «теней эритроцитов» в раствор нужного вещества, где происходит их заполнение и затягивание плазматических мембран. Оба вида носителей (как липосомы, так и «тени эритроцитов») можно вводить в клетки-мишени за счет слияния мембран под действием определенных вирусных белков (синтезируемых вирусом для облегчения проникновения в клетки).
Заключение
Измерение концентрации и распределения неорганических ионов и других низкомолекулярных веществ в клетках необходимо выполнять на интактной живой ткани. Весьма эффективен для этого ядерный магнитный резонанс (ЯМР). ЯМР представляет собой полностью неинвазивный метод, он используется для измерения относительной концентрации многих малых молекул, но, к сожалению, его применение требует значительного количества образца. Для определения концентрации специфических ионов в отдельных клетках или в отдельных частях клеток можно применять флуоресцентные индикаторные красители. Стеклянные микроэлектроды незаменимы для измерения не только электрических потенциалов и потока ионов через плазматическую мембрану; с их помощью удается определять концентрацию специфических внутриклеточных ионов. Микроэлектроды можно использовать и для инъекции в клетки молекул, не проникающих через мембраны. Альтернативные подходы состоят во временном повышении проницаемости мембран или в слиянии клеток с частицами, окруженными мембранами и содержащими макромолекулы.