Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Как изучают клетки?
Разделение клеток и их культивирование
Структуру органелл и крупные молекулы можно изучать под микроскопом; для локализации специфических молекул в клетке разработаны эффективные методы окрашивания. Однако, чтобы разобраться в молекулярных основах клеточной организации, необходим детальный биохимический анализ. К сожалению, биохимические методы предполагают использование значительного количества клеток и в процессе исследования клетки разрушаются. Если в качестве образца для биохимического анализа использовать кусочек ткани, то после разрушения будет получена смесь фрагментов различных клеток. И если ткань образована клетками разного типа, что скорее является правилом, чем исключением, то разобраться в этой смеси будет просто невозможно. Пытаясь извлечь максимум информации о всех клетках, составляющих ткани, клеточные биологи разработали методы разделения тканей на клетки и методы выделения отдельных типов клеток. Полученную относительно гомогенную популяцию клеток можно подвергать анализу непосредственно либо предварительно размножив их путем культивирования.
4.3.1. Клетки можно выделить из тканей и разделить на различные типы [19]
Первый этап выделения клеток одного типа из ткани, содержащей различные их типы, состоит в превращении ткани в суспензию отдельных клеток. Это достигается разрушением внеклеточного матрикса и межклеточных контактов, удерживающих клетки. Обычно самый высокий выход жизнеспособных клеток получают из эмбриональных тканей или тканей новорожденных. В этом случае процедура разделения клеток включает обработку ткани протеолитическими ферментами (такими, как трипсин и коллагеназа) и соединениями, связывающими (или хелатирующими) Са2+ (такими, как этилендиаминтетрауксусная кислота - ЭДТА), определяющими адгезию клеток. Затем, подвергнув ткани мягкому механическому разрушению, их разделяют на отдельные клетки.
Для фракционирования смешанной суспензии клеток на отдельные типы используют несколько подходов. Один из них основан на различии в физических свойствах клеток. Например, с помощью центрифугирования можно отделить большие клетки от малых, а тяжелые от легких; эти методы будут рассмотрены нами при обсуждении проблем фракционирования клеток (для чего собственно эти методы и были разработаны). В основе другого подхода лежит способность некоторых клеток прочно прикрепляться к стеклу или пластмассе, что дает возможность отделять такие клетки от других, прикрепляющихся менее прочно.
Важное усовершенствование этого метода подразумевает использование антител. Антитела, специфически связывающиеся с клетками одного типа (из тех, что присутствуют в ткани), можно «пришить» к различным матриксам, например коллагену, полисахаридным шарикам или пластмассе. С такой поверхностью будут связываться лишь клетки, опознаваемые антителами. Связавшиеся клетки отделяют либо с помощью легкого встряхивания, либо путем разрушения матрикса (например, коллагена) ферментами (например, коллагеназой).
Наиболее тонкий метод разделения клеток включает мечение антителами, связанными с флуоресцирующими красителями. С помощью электронного флуоресцентно-активируемого клеточного анализатора (сортера) можно отделить меченые клетки от немеченых. Суть метода заключается в том, что отдельные клетки движутся одна за другой в узком потоке и проходят через лазерный луч, где производится оценка наличия флуоресценции. Затем вибрирующее сопло формирует крошечные капельки, большинство из которых содержит только одну клетку либо вообще не содержит клеток. В момент образования капля автоматически приобретает положительный или отрицательный заряд в зависимости от наличия в ней флуоресцирующей клетки. Затем сильное электрическое поле направляет капли в соответствующие контейнеры. Случайные комки клеток опознаются по усилению светорассеяния, они отбрасываются в контейнер для отходов (рис. 4-38). Клеточный анализатор способен отобрать одну клетку из тысячи; каждую секунду он сортирует около 5000 клеток. Получив популяцию одинаковых клеток любым из вышеперечисленных методов, исследователь может использовать их для биохимического анализа. Существует и другая возможность: такие клетки могут быть введены в культуру, что позволяет изучать их поведение и свойства в условиях культивирования.
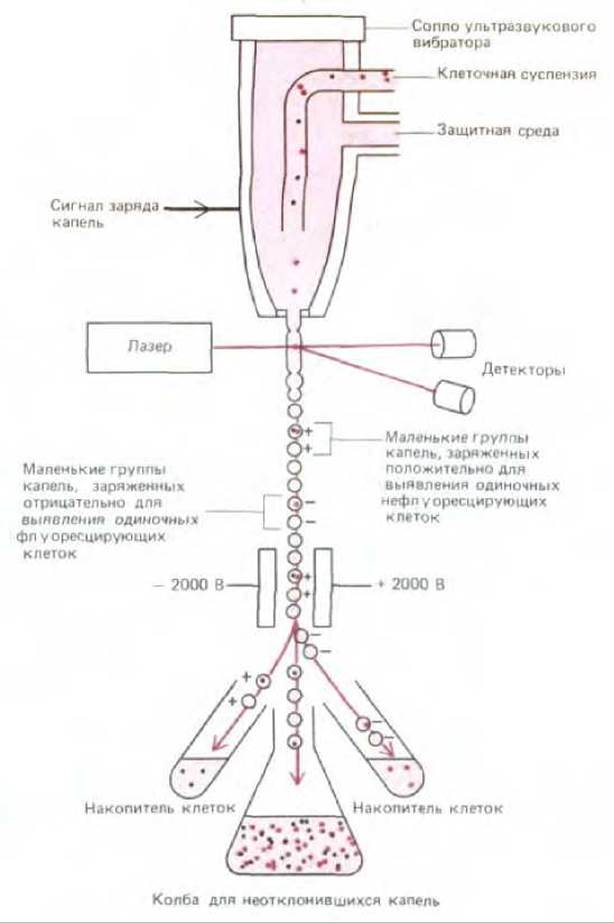
Рис. 4-38. Схема флуоресцентно-активируемого клеточного сортера. Лазерный луч анализирует флуоресценцию проходящих через него клеток. Капельки, содержащие отдельные клетки, в зависимости от наличия флуоресценции клеток заряжаются положительно или отрицательно. Затем капельки направляются в пробирки-накопители согласно заряду. Заметим, что концентрация клеток должна быть подобрана таким образом, чтобы большая часть капель не содержала клеток. Следовательно, большая часть капель наряду с любыми скоплениями клеток направляется в контейнер для отходов.
4.3.2. Клетки можно выращивать в культуральном сосуде [20]
Большинство видов клеток растений и животных в благоприятных условиях способны выжить, размножиться и даже дифференцироваться. Используя методы культуры ткани, можно изучать клетки под микроскопом или анализировать их биохимически. Кроме того, добавляя в культуральный сосуд и удаляя из него специфические молекулы, такие, как гормоны или факторы роста, мы можем судить об их влиянии на клетки. Применение смешанных культур позволяет изучать взаимодействие между различными типами клеток. В научной литературе часто любые эксперименты с клеточными культурами называют экспериментами, выполненными in vitro, что дословно означает «в стекле»; напротив, об экспериментах на живых организмах принято говорить, что они выполнены in vivo. Несколько иной смысл вкладывается в эти термины биохимиками и клеточными биологами. Для них in vitro относится к биохимическим реакциям, происходящим вне живых клеток, a in vivo ко всем реакциям, которые имеют место в живых клетках. Рождение метода культуры тканей следует отнести к 1907 году. В то время был задуман эксперимент, который должен был внести ясность в дискуссию среди нейробиологов. Гипотеза, правомочность которой следовало проверить (получившая название «нейронной доктрины»), сводилась к следующему: каждое нервное волокно образуется, вырастая из одной нервной клетки, а не путем слияния многих клеток. Для подтверждения этой гипотезы небольшие кусочки спинного мозга помещали в теплую влажную камеру и наблюдали под микроскопом через равные промежутки времени. Примерно через сутки можно было видеть, что от отдельных нервных клеток начинают отходить длинные тонкие отростки. Так были получены данные, свидетельствовавшие в пользу нейронной доктрины, и был заложен фундамент для переворота, происшедшего в результате применения метода клеточных культур.
Основополагающие эксперименты, проведенные в 1907 году, включали использование небольших фрагментов ткани или эксплантатов. В наше время культуры обычно готовят из клеточной суспензии, полученной путем диссоциации ткани. Большинство клеток, образующих ткани многоклеточных организмов, в отличие от бактериальных клеток не способны расти в суспензии. Для роста и деления им необходима твердая поверхность. Вначале, когда метод культивирования только появился, в качестве механической опоры использовали сгусток плазмы, но в настоящее время его обычно заменяют поверхностью пластиковой культуральной чашки (рис. 4-39). Клетки очень различаются по своим потребностям; некоторые из них способны расти или дифференцироваться только в том случае, если культуральная чашка покрыта компонентами внеклеточного матрикса, например коллагеном.
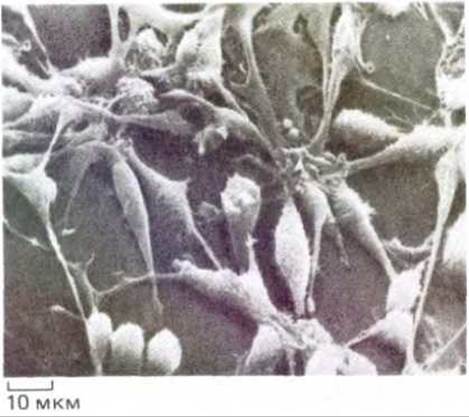
Рис. 4-39. Микрофотография фибробластов крысы, растущих в культуре ткани, полученная с помощью сканирующего электронного микроскопа. (С любезного разрешения Gunther Albrecht-Buchler.)
Культуры, приготовленные непосредственно из тканей организма, с использованием первичного этапа фракционирования клеток и без оного, называют первичными культурами. В большинстве случаев клетки первичной культуры можно перенести из культуральной чашки и использовать для получения большого количества вторичных культур, которые можно последовательно перевивать в течение недель или месяцев. Часто эти клетки сохраняют признаки дифференцировки тех тканей, из которых они были получены. Так, фибробласты продолжают синтезировать коллаген, клетки скелетных мышц эмбриона сливаются, образуя гигантские мышечные волокна, которые спонтанно сокращаются в чашках для культуры тканей; у нервных клеток возникают аксоны. характеризующиеся электровозбудимостью и способностью формировать синапсы с другими нервными клетками; клетки эпителия формируют обширные слои, сохраняющие многие свойства интактного эпителия. Поскольку все эти события можно наблюдать при росте клеток в культуре, для их изучения используют многие методы, недоступные при работе с интактными тканями.
4.3.3. С помощью сред определенного химического состава можно идентифицировать специфические факторы роста [21]
До начала 70-х годов культивирование ткани представляло собой нечто вроде смеси науки и колдовства. Хотя на смену сгусткам плазмы пришли пластмассовые чашки и жидкие среды с точно составленной смесью солей, аминокислот и витаминов, все же в большинстве сред содержалось небольшое количество плохо охарактеризованного биологического материала, например лошадиная сыворотка, очищенный экстракт из куриных эмбрионов или эмбриональная сыворотка коровы. Для большинства обычных тканевых культур такие среды используются до сих пор (табл. 4-4), но они не пригодны для изучения особых потребностей, возникающих в процессе роста и дифференцировки клеток.
Все это привело к тому, что были разработаны специальные среды определенного химического состава, используемые для культивирования клеток различных типов. В этих средах известен каждый из компонентов. Наряду с низкомолекулярными веществами они, как правило, содержат один или несколько различных белковых факторов роста, необходимых клеткам для выживания и пролиферации в культуре: например, некоторым нервным клеткам как в культуре, так и в организме животного необходимы следовые количества фактора, стимулирующего рост нервов. Были открыты и другие факторы подобного типа, имеющие жизненно важное значение для развития клеток определенных типов и поддержания их нормального существования. Появление сред определенного химического состава значительно облегчило поиск новых факторов.
Таблица 4-4. Состав стандартной среды для культивирования клеток млекопитающих 1)
|
Аминокислоты |
Витамины |
Соли |
Другие соединения |
|
Аргинин |
Биотин |
NaCl |
Глюкоза |
|
Валин |
Никотинамид |
КС |
Пенициллин |
|
Гистидин |
Пантотенат |
NaH2PO4 |
Стрептомицин |
|
Глутамин Изолейцин |
Пиридоксаль Рибофлавин (В2) |
NaHCO3 СаСl2 |
Феноловый красный |
|
Лейцин |
Тиамин (Bl) |
MgCl2 |
Сыворотка цельная |
|
Лизин |
Фолиевая кислота |
||
|
Метионин |
Холин |
||
|
Тирозин |
|||
|
Треонин |
|||
|
Триптофан |
|||
|
Фенилаланин |
|||
|
Цистин |
1) Концентрация глюкозы должна составлять 5-10 мМ. Все аминокислоты применяют в L-форме; за исключением одного или двух случаев, их используют в концентрации 1 или 2 мМ. Концентрация витаминов должна быть в 100 раз ниже, т. е. примерно 1 мкМ. Концентрация сыворотки (лошадиной или теленка) должна составить 10% от общего объема. Пенициллин или стрептомицин - антибиотики, добавляемые для подавления бактериального роста. Феноловый красный - индикатор рН; используется для поддержания рН 7,4.
Для культивирования обычно применяют пластиковые или стеклянные контейнеры, поверхность которых обработана так, чтобы к ней могли прикрепляться клетки. Контейнеры помещают в инкубатор при 37°С в атмосфере 5% СО2 и 95% воздуха.
4.3.4. Для получения гомогенных клеток обычно используют клеточные линии эукариот [18]
Большинство клеток млекопитающих в культуре погибает после определенного числа делений; клетки кожи человека, например, прежде чем погибнуть, делятся 50-100 раз. Существует предположение, что ограниченный срок жизни клеток в культуре отражает ограниченный срок жизни организма, из которого были получены эти клетки. Иногда в культуре появляются мутантные клетки, которые практически бессмертны. Они могут размножаться бесконечно и образуют клеточную линию (табл. 4-5). Эти клетки лучше растут на твердой поверхности и после образования непрерывного слоя их рост, как правило, прекращается.
Обычно мутантные клетки, способные к непрерывному делению, все же отличаются от раковых клеток, способных к непрерывному делению и in vilro, и in vivo. В отличие от других клеточных линий раковые клетки могут расти, не прикрепляясь к какой-либо твердой поверхности, и образуют в культуральных чашках популяцию более плотную, чем популяции обычных клеток. Аналогичное свойство можно вызвать экспериментально и у нормальных клеток путем трансформации их опухолеродными вирусами или каким-либо соединением. Полученные таким образом неопластически трансформированные клеточные линии способны вызывать образование опухолей после введения в организм животных. И трансформированные, и нетрансформированные клеточные линии служат источником большого количества клеток одного типа и поэтому представляют большую ценность для исследователя. Такие клеточные линии имеют еще то преимущество, что при — 70 °С их можно хранить неопределенно долго и при этом они сохраняют способность производить жизнеспособные клетки после размораживания. При этом необходимо отдавать отчет в том, что клетки обоих типов клеточных линий практически всегда существенным образом отличаются от своих нормальных предшественников в тканях, из которых они были получены.
Таблица 4-5. Некоторые наиболее известные клеточные линии
|
Клеточная линия1) |
Тип клеток и соответствующий организм |
|
ЗТЗ |
Фибробласт (мышь) |
|
ВНК21 |
Фибробласт (сирийский хомячок) |
|
HeLa |
Эпителиальная клетка (человек) |
|
PtKl |
Эпителиальная клетка (кенгуровая крыса) |
|
L6 |
Миобласт (крыса) |
|
РС12 |
Хромаффинная клетка (крыса) |
|
SP2 |
Плазматическая клетка (мышь) |
1) Многие из этих клеточных линий имеют опухолевое происхождение. Все они способны размножаться в культуре тканей бесконечно долго и проявляют (по крайней мере частично) свойства, характерные для тканей, из которых происходят. Клетки линий ВНК21, SP2, HeLa способны расти в суспензии, другим клеткам для размножения необходима твердая опора.
Генетическую однородность клеточных линий можно усилить еще больше путем клонирования, т. е. выделив отдельную клетку и позволив ей пролиферировать до образования большой колонии. Клон - этого популяция клеток, происходящих из одной клетки-предшественника, Клонирование клеток используется в основном для получения клеточных линий, у которых мутация затронула определенные гены. Исследование таких мутантных клеток, дефектных по специфическому белку, позволяет узнать много нового о функции белка в нормальных клетках.
4.3.5. Слияние клеток приводит к образованию клеточных гибридов [22]
Две клетки, сливаясь, образуют гетерокарион - одну комбинированную клетку с двумя ядрами. Обычно, чтобы осуществить слияние клеток, клеточную суспензию обрабатывают инактивированными вирусами, или полиэтиленгликолем. Оба этих агента повреждают плазматическую мембрану клетки, что и приводит к слиянию клеток. Образование гетерокарионов дает возможность смешивать компоненты двух отдельных клеток с целью изучения их взаимодействия. Например, если неактивное ядро куриного эритроцита попадает в результате слияния в цитоплазму клетки, растущей в культуре ткани, то такое ядро реактивируется: начинается синтез РНК, а затем и репликация ДНК. Именно в опытах по гибридизации клеток мыши и клеток человека впервые были получены данные, свидетельствующие о том, что белки поверхности клеток человека и мыши, находившиеся вначале на своих половинках гетерокариона, быстро диффундируют и перемешиваются по всей его поверхности.
По истечении определенного времени гетерокарион делится митотически, образуя в результате гибридную клетку. Ядерные оболочки у этой клетки разрушаются, все хромосомы объединяются в одно большое ядро (рис. 4-40). Хотя такие гибридные клетки можно клонировать и получить гибридную клеточную линию, первичные гибридные клетки оказываются нестабильными и теряют хромосомы. По неизвестным причинам гибридные клетки «мышь - человек» в основном теряют хромосомы человека. В результате образуется множество гибридных линий «мышь - человек», каждая из которых содержит одну или несколько хромосом человека. Это явление оказалось полезным для картирования и локализации генов в геноме человека. Например, инсулин человека синтезируют только те гибридные клетки, которые содержат хромосому 11 человека, следовательно, ген, кодирующий инсулин, находится именно на этой хромосоме.
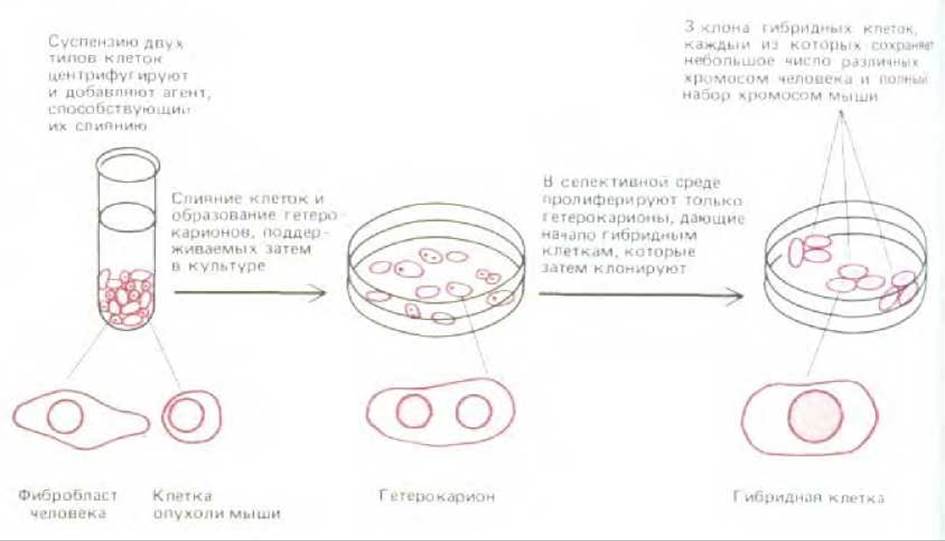
Рис. 4-40. Схема, иллюстрирующая слияние клеток человека и мыши, приводящее к образованию гетерокарионов, имеющих по одному или более ядер. В некоторых случаях из гетерокарионов образуются гибридные клетки с одним слившимся ядром. Такие гибридные клетки используются для картирования индивидуальных генов в определенных хромосомах человека. Возможность такого картирования обусловлена тем, что гибридизация сопровождается быстрой потерей большинства хромосом человека, происходящей случайным образом. В образующихся клонах сохраняется только одна или несколько хромосом человека. В гибридных клетках, образованных в результате слияния клеток других типов, часто сохраняется большинство исходных хромосом.
Таблица 4-6. Основные вехи в развитии метода культуры тканей
|
1885 - Ру (Roux) показал, что клетки куриного эмбриона сохраняют жизнеспособность в солевом растворе вне тела животного 1907 - Гаррисон (Harrison) культивировал спинной мозг амфибий в сгустке плазмы. Он пытался показать, что аксоны образуются в виде выростов отдельных нервных клеток 1910 - Раус (Raus) индуцировал опухоль, использовав профильтрованный экстракт куриной опухоли, содержащей, как позже было установлено, РНК-вирус (вирус саркомы Рауса) 1913 - Каррель (Carrel) доказал, что в асептических условиях клетки могут расти в культуре в течение длительного времени, если их обеспечить необходимыми питательными веществами 1948 - Эрл (Earle) и сотрудники установили, что одиночные клетки линии L в культуре формируют клоны клеток 1952 - Джей (Gey) и сотрудники получили перевиваемую клеточную линию из карциномы шейки матки; эта клеточная линия широко известна как HeLa 1954 - Леви-Монтальчини (Levy-Montalchini) и сотрудники показали, что в культуре ткани фактор, стимулирующий рост нервов, вызывает рост аксонов 1955 - Игл (Eagle) - впервые систематически исследовал пищевые потребности клеток в условиях культуры ткани и обнаружил, что клетки животных способны существовать в определенной смеси низкомолекулярных веществ, дополненной некоторым количеством белков сыворотки 1956 - Пак (Puck) и сотрудники отобрали мутантные клетки HeLa, потребности которых для роста в культуре существенно отличались от потребностей других клеток 1958 - Темин и Рубин (Temin, Roubin) количественно описали инфицирование клеток цыпленка в культуре очищенным вирусом саркомы Рауса. В течение следующего десятилетия Стокер, Дульбекко, Грин (Stocker, Dulbecco, Green) и другие вирусологи установили основные характеристики вирусной трансформации различных типов 1961 - Хайфлик и Мурхед (Hayflick, Moorhend) показали, что в культуре фибробласты человека погибают после определенного числа делений 1964 - Литлфилд (Littlefield) впервые использовал для выращивания гибридов соматических клеток селективную среду HAT. Это нововведение в сочетании с методом гибридизации клеток позволило приступить к изучению генетики соматических клеток Като и Такеуши (Kato, Takeuchi) получили целое растение моркови из растущей в культуре тканей клетки корня 1965 - Хэм (Ham) предложил бессывороточную среду определенного химического состава, которая способна поддерживать рост клонов некоторых клеток животных 1965 - Харрис и Уоткинс (Harris, Watkins) индуцировали вирусом слияние клеток мыши и человека и получили первые гетерокарионы клеток млекопитающих 1968 - Августи-Точчо и Сато (Augusti-Tocco, Sato) адаптировали к условиям культуры клеток опухолевые клетки мыши (нейробластомы) и выделили клоны, которые реагировали на раздражение электрическим током и разрастались в нервные волокна. Одновременно получено большое количество других дифференцированных клеточных линий, включая линии скелетных мышц и печени 1975 - Келер и Мильштейн (Kehler, Milstein) получили первые клеточные линии гибридом, секретирующих моноклональные антитела 1976 - Сато (Sato) и сотрудники опубликовали первую серию статей, в которых было показано, что для роста в бессывороточной среде разным клеточным линиям необходимы различные смеси гормонов и факторов роста |
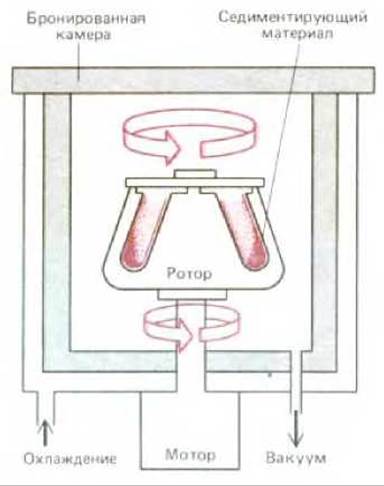
Рис. 4-41. Препаративная ультрацентрифуга. Исследуемый образец находится в пробирках, помещенных в расположенные по кругу цилиндрические гнезда в металлическом роторе. При быстром вращении ротора развивается значительная центробежная сила, под воздействием которой частицы исследуемого образца осаждаются. В условиях вакуума трение снижается; в результате ротор не нагревается и вмонтированная в ротор система поддерживает температуру образца при 4°С.
Некоторые важные этапы развития метода культуры тканей перечислены в табл. 4-6.
Заключение
Клетки эмбриональных тканей и тканей новорожденных используются в качестве исходного материала для выделения специфических типов клеток, которые можно исследовать биохимически либо использовать для создания клеточных культур. Многие клетки растений и животных выживают и часто способны пролиферировать в культуральной чашке при наличии питательной среды соответствующего состава. Разные типы клеток нуждаются в различных питательных веществах, в том числе в одном или нескольких белковых факторах роста. Большинство клеток животных погибает после конечного числа делений, но иногда в культуре клеток спонтанно возникают редкие варианты, способные поддерживаться бесконечно долго в виде клеточных линий. Клеточные линии можно использовать для получения клонов, которые происходят из одиночной клетки-предшественника. Так, можно выделить мутантные клетки, дефектные по одному белку. Можно осуществить слияние различных типов клеток с образованием гетерокарионов (клеток с двумя ядрами), из которых в конечном счете образуются гибридные клетки (ядра клеток которых слились воедино). Гибридные клетки можно использовать для изучения взаимодействия компонентов двух различных клеток. Кроме того, этот метод позволяет ответить на вопрос, в каких конкретно хромосомах находятся те или иные гены.