Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Основные генетические механизмы
Синтез РНК и белка
На долю белков приходится обычно более половины сухой массы клетки и синтез их играет главную роль в таких процессах, как рост и дифференцировка клеток, поддержание их структуры и функции. Синтез белка зависит от совместного действия нескольких классов молекул РНК и ему предшествует ряд подготовительных этапов. Сначала в результате копирования ДНК, несущей информацию о синтезируемом белке, образуется молекула матричной РНК (мРНК). Одновременно в цитоплазме клетки к каждой из 20 аминокислот, из которых строится белок, присоединяется молекула специфической транспортной РНК (мРНК), а к субъединицам рибосомы, на которой происходит синтез, присоединяются некоторые вспомогательные белковые факторы. Началом синтеза белка считается тот момент, когда эти компоненты объединяются в цитоплазме, образуя функциональную рибосому. По мере того как молекула мРНК шаг за шагом продвигается сквозь рибосому, ее нуклеотидная последовательность переводится (транслируется) в соответствующую последовательность аминокислот, в результате чего создается определенная белковая цепь. Однако прежде всего необходимо ответить на вопрос о том, как образуются в клетке различные молекулы РНК.
5.1.1. РНК-полимераза «переписывает» заключенную в ДНК информацию в виде РНК: процесс транскрипции [1]
Синтез РНК на ДНК-матрице называется транскрипцией. В результате транскрипции образуются молекулы мРНК, несущие информацию да синтеза белка, а также транспортные, рибосомные и другие виды молекул РНК, выполняющие структурные и каталитические функции. Синтез этих молекул РНК, т. е. синтез РНК-копий нуклеотидных последовательностей тех или иных участков молекулы ДНК, катализируется ферментами, которые называются РНК-полимеразами. У эукариот различные виды РНК синтезируются разными РНК-полимеразами, тогда как у прокариот весь синтез РНК осуществляется одним-единственным ферментом этого типа. Почти все, что мы знаем об РНК-полимерах, было выяснено на бактериях.
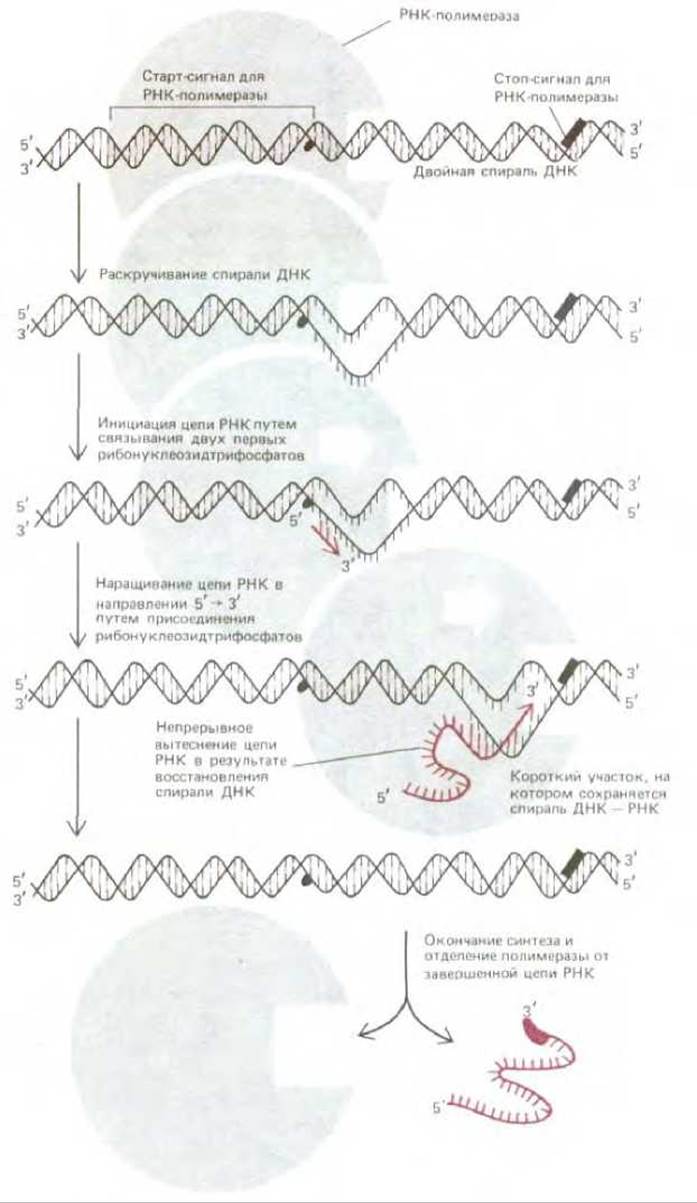
Рис. 5-1. Синтез молекулы РНК, катализируемый РНК-полимеразой. Фермент начинает синтез у специального старт-сигнала в ДНК, называемого промотором, и заканчивает его у стоп-сигнала (сигнал терминации транскрипции), после чего полимераза и синтезированная готовая цепь РНК отделяются друг от друга. Скорость полимеризации при 37°С составляет примерно 30 нуклеотидов в 1 с, поэтому синтез цепи РНК длиной 5000 нуклеотидов длится около 3 мин.
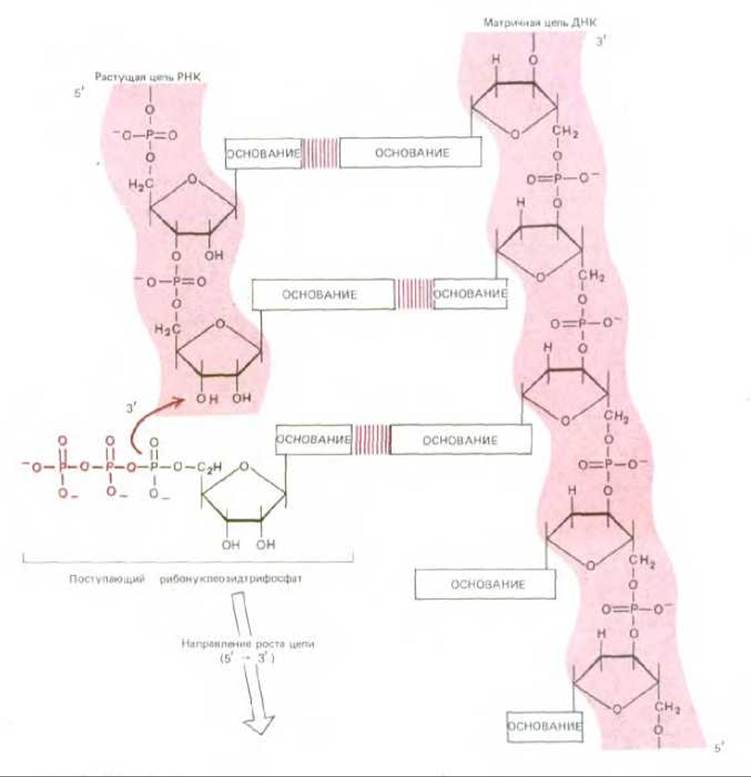
Рис. 5-2. Реакция элонгации, катализируемая ферментом РНК-полимеразой. На каждом этапе из поступающих рибонуклеозидтрифосфатов отбирается один, способный к комплементарному спариванию с открытой матричной цепью ДНК, в результате к растущему 3'-ОН-концу цепи РНК добавляется рибонуклеозидмонофосфат (цветная стрелка), а пирофосфат (выделен цветом) высвобождается. Таким образом новая цепь РНК растет в направлении 5' → 3' и оказывается комплементарной матричной цепи ДНК. Движущей силой реакции является термодинамически выгодное изменение свободной энергии, сопровождающее высвобождение пирофосфата, и гидролиз пирофосфата до неорганического фосфата. Перемещающаяся вдоль спирали ДНК РНК-полимераза непрерывно раскручивает спираль впереди той точки, где происходит полимеризация, и вновь закручивает ее позади этой точки, высвобождая новосинтезированную цепь РНК. Поэтому небольшой участок РНК-ДНК-спирали (для бактериального фермента - около 17 пар нуклеотидов) существует лишь короткое время. Готовый РНК-продукт высвобождается в виде одно-цепочечной копии одной из двух цепей ДНК.
Бактериальная РНК-полимераза - это крупный, состоящий из нескольких субъединиц фермент, связанный с рядом вспомогательных белковых субъединиц, которые на разных этапах транскрипции присоединяются к комплексу полимераза-ДНК, а затем покидают его (см. разд. 9.4.1). Свободные молекулы РНК-полимеразы, сталкиваясь с хромосомой случайным образом, присоединяются к большинству участков ДНК весьма непрочно. Однако эта связь оказывается очень прочной, если РНК-полимераза присоединяется к специфической последовательности ДНК, к так называемому промотору, содержащему старт-сигнал для синтеза РНК, т. е. к сайту, с которого этот синтез должен начаться. Реакции, которые за этим следуют, показаны на рис. 5.1. Присоединившись к промотору, РНК-полимераза раскручивает определенный участок двойной спирали, обнажая таким образом нуклеотиды на коротком отрезке каждой из двух цепей ДНК. Одна из этих двух разделенных цепей должна теперь служить матрицей для комплементарного спаривания оснований ДНК с основаниями поступающих мономеров - рибонуклеозидтрифосфатов; полимераза соединяет между собой два первых поступающих мономера и тем самым кладет начало синтезируемой цепи РНК. Затем РНК-полимераза, продвигаясь шаг за шагом вдоль ДНК, раскручивает перед собой спираль ДНК, обнажая всякий раз новый участок матрицы для комплементарного спаривания оснований. Таким путем, добавляя к растущей цепи РНК по одному нуклеотиду, она постепенно наращивает эту цепь в направлении 5' → 3' (рис. 52). Процесс удлинения цепи РНК продолжается до тех пор, пока фермент не встретит на своем пути еще одну специфическую нуклеотидную последовательность в цепи ДНК, а именно сигнал терминации транскрипции (стоп-сигнал). Достигнув этой точки, полимераза отделяется и от матричной ДНК, и от новосинтезированной цепи РНК (см. также рис. 5-6, 6).
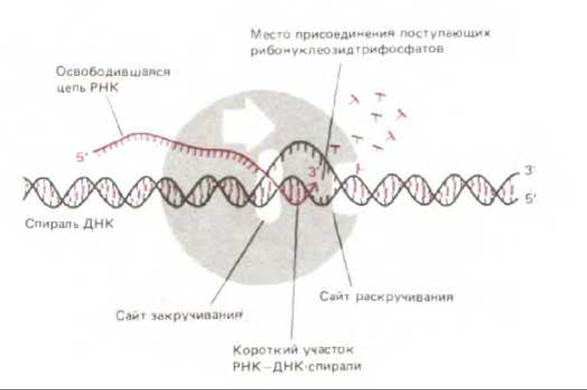
Рис. 5-3. Перемещающаяся вдоль спирали ДНК РНК-полимераза непрерывно раскручивает спираль впереди той точки, где происходит полимеризация, и вновь закручивает ее позади этой точки, высвобождая новосинтезированную цепь РНК. Поэтому небольшой участок РНК-ДНК - спирали (для бактериального фермента — около 17 пар нуклеотидов) существует лишь короткое время. Готовый РНК-продукт высвобождается в виде одноцепочечной копии одной из двух цепей ДНК.
Во время продвижения фермента вдоль матричной цепи в его активном центре образуется двойная спираль РНК-ДНК. Она очень коротка, так как позади молекулы полимеразы немедленно восстанавливается спираль ДНК-ДНК, а РНК вытесняется (рис. 5-3). Поэтому каждая завершенная цепь РНК отделяется от ДНК-матрицы в виде свободной одноцепочечной молекулы, в которой число нуклеотидов колеблется обычно от 70 до 10000.
5.1.2. Промоторная последовательность определяет, какая именно цепь ДНК будет транскрибироваться [2]
В принципе любой участок ДНК может быть транскрибирован с образованием двух различных молекул мРНК - по одному на каждую из двух цепей двойной спирали ДНК. В действительности же в любом участке ДНК транскрибируется только одна из двух цепей, так как образовавшаяся РНК соответствует по своей нуклеотидной последовательности другой, нематричной цепи ДНК. Какая из двух цепей будет транскрибироваться, определяется промотором, нуклеотидная последовательность которого ориентирована таким образом, чтобы направить РНК- полимеразу на тот или иной путь. Поскольку цепи РНК растут лишь в направлении 5' → 3', именно от промотора зависит выбор цепи ДНК для транскрипции (рис. 5-4). У двух соседних генов нередко транскрибируются разные цепи ДНК, как это можно видеть на рис. 5-5, где изображен небольшой участок хромосомы.
Анализ (см. разд. 4.6.6) показывает, что РНК-полимераза Е. coli, присоединяясь к промотору, охватывает довольно большой участок ДНК: примерно 40 нуклеотидов «вверх» и 20 нуклеотидов «вниз» от старт-сигнала, т. е. от места начала транскрипции. Сравнение многих последовательностей ДНК, играющих роль сильных промоторов для этой полимеразы, показало, что она узнает в молекуле ДНК в первую очередь две строго определенные (консервативные) шестинуклеотидные последовательности, расположенные выше старт-сигнала и отделенные одна от другой приблизительно 17 нуклеотидами (рис. 5-6, Л). Такие консервативные последовательности, обнаруживаемые во всех образцах определенного типа регуляторных участков ДНК, носят название консенсусных последовательностей (consensus sequences). В результате сравнения многих промоторов Е. coli были выявлены две консенсусные шестинуклеотидные последовательности: T82T84G78A65C54A95 и Т80А95Т45А60А50Т96 (цифры показывают ожидаемую частоту (в процентах), с которой данный нуклеотид встречается в указанном положении последовательности: 100 означает, что он присутствует здесь всегда, а 25, что из четырех промоторов он встречается в одном). Последовательности сильных промоторов, как правило, довольно близки к этим двум консенсусным последовательностям, у слабых же промоторов (связанных с генами, продуцирующими сравнительно мало мРНК) это сходство менее выражено.
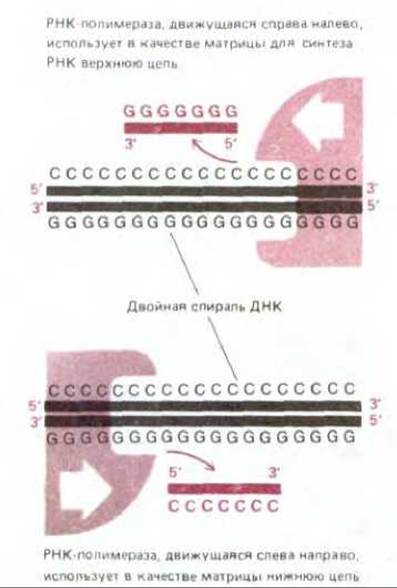
Рис. 5-4. Поскольку цепь ДНК, выполняющая функцию матрицы, должна считываться от 3'-конца к 5'-концу (см. рис. 5-2), выбор одной из двух цепей ДНК на роль матрицы для синтеза РНК определяется направлением движения РНК-полимеразы. В свою очередь направление движения РНК- полимеразы задается ориентацией нуклеотидной последовательности промотора, с которого РНК-полимераза начинает считывание.
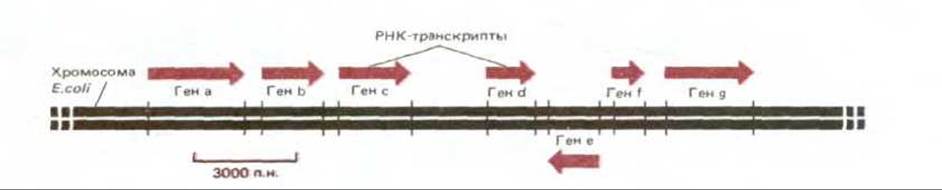
Рис. 5-5. Короткий участок типичной бактериальной хромосомы. Схема показывает, каким образом происходит транскрипция ДНК, связанная с экспрессией нескольких соседних генов.
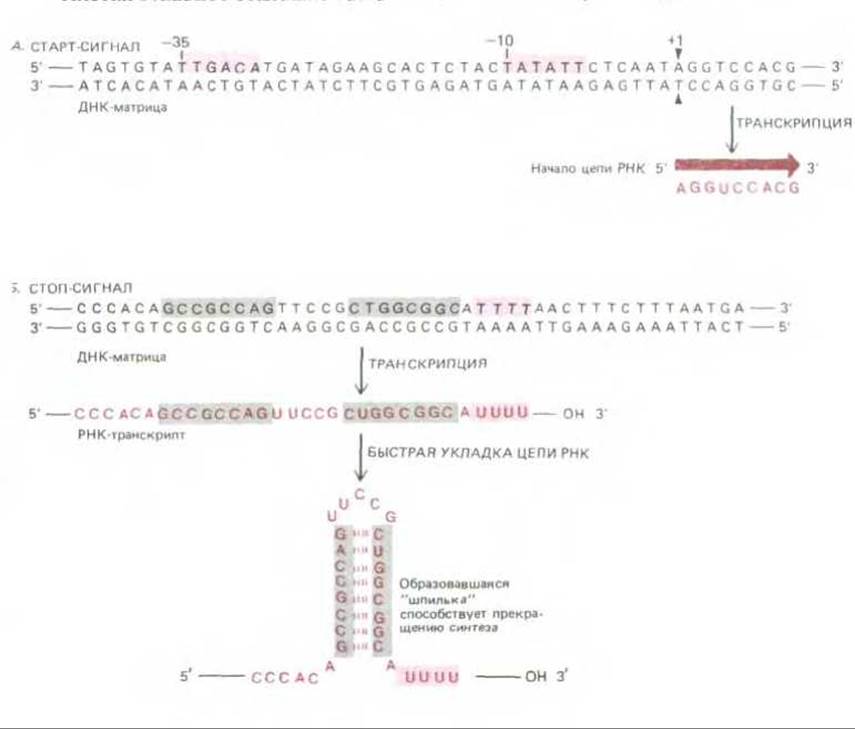
Рис. 5-6. Старт- и стоп-сигналы для РНК-полимеразы, осуществляющей синтез РНК у Е. coli. Обратите внимание, что матричной цепью служит нижняя цепь ДНК, верхняя же по своей нуклеотидной последовательности соответствует синтезированной РНК (за исключением того, что вместо Т, присутствующего в ДНК, в РНК стоит U). Принято указывать нуклеотидную последовательность применительно к нематричной цепи. А. Полимераза начинает синтез у промоторной нуклеотидной последовательности. Считается, что прикрепление полимеразы определяют два коротких участка (выделены красным), отстоящие от начала синтеза РНК приблизительно на 35 и 10 нуклеотидов, вместе с точкой начала синтеза эти последовательности образуют промотор. Сколько-нибудь значительные модификации в любой из них ведут к утрате промоторной активности, изменения в других участках цепи ДНК такого эффекта не вызывают. Б. Полимераза прекращает синтез, после того как будет синтезирован участок из нескольких остатков U (что соответствует нескольким А на матрице) и самокомплементарная нуклеотидная последовательность (выделена серым). Соответствующее сочетание нуклеотидных последовательностей в ДНК служит стоп-сигналом. Порядок нуклеотидов в самокомплементарной последовательности может быть различным, решающим для прекращения транскрипции является быстрое образование в этом участке новосинтезированной РНК двойной спирали - так называемой шпильки.
Клетки эукариот содержат три разные РНК-полимеразы. Одна из них катализирует синтез всех РНК, кодирующих белок (т.е. мРНК), тогда как две другие синтезируют молекулы РНК, выполняющие структурные или каталитические функции (например, рибосомные и транспортные РНК). Все три РНК-полимеразы представляют собой крупные мультимерные молекулы, напоминающие бактериальный фермент, но промоторы, которые они узнают, сложнее по своему строению и пока еще не столь хорошо изучены (см. разд. 9.4.3). Неясно, почему столь сложны молекулы и бактериальной РНК-полимеразы, и РНК-полимеразы эукариот. Эти молекулы состоят из нескольких субъединиц с общей массой свыше 500 000 дальтон. Между тем известно, что РНК-полимеразы некоторых бактериофагов, состоящие из одной цепи и имеющие впятеро меньшую массу, катализируют синтез РНК не менее эффективно, чем соответствующий фермент клетки-хозяина. Можно предположить, что мультимерное строение клеточных РНК-полимераз имеет какое-то отношение к регуляторным аспектам клеточного синтеза РНК, пока еще недостаточно хорошо выясненным.
В приведенном выше описании транскрипции ДНК опущены многие подробности; обычно синтез молекулы мРНК включает и ряд других сложных этапов. Известно, например, что в определении того, какие участки ДНК будут транскрибироваться РНК-полимеразой, важную роль играют особые белки, регулирующие активность генов, а значит, именно от них в первую очередь и зависит, какие белки будет вырабатывать клетка. Далее, в то время как у прокариот молекулы мРНК образуются непосредственно путем транскрипции ДНК, в клетках высших эукариот большинство РНК-транскриптов, прежде чем покинуть клеточное ядро и перейти в цитоплазму в виде мРНК, претерпевает существенные изменения - подвергается сплайсингу. Все эти аспекты процесса образования мРНК мы обсудим в гл. 9 и 10, где речь пойдет о клеточном ядре и о регуляции экспрессии генов. Здесь же мы просто будем исходить из того, что в клетке так или иначе образуются функциональные молекулы мРНК, и познакомимся с тем, как они направляют белковый синтез.
5.1.3. Молекулы транспортных РНК служат адаптерами, переводящими нуклеотидные последовательности в аминокислотные [3]
Во всех клетках имеется набор транспортных РНК (тРНК)- небольших молекул, размеры которых колеблются от 70 до 90 нуклеотидов. Эти РНК, присоединяясь одним своим концом к специфическому кодону мРНК, а другим присоединяя аминокислоту, кодируемую данным триплетом, позволяют аминокислотам выстраиваться в порядке, диктуемом нуклеотидной последовательностью мРНК. Каждая тРНК может переносить только одну из 20 аминокислот, используемых в синтезе белка. Транспортную РНК, переносящую глицин, обозначают тРНКGlу и т. д. Для каждой из 20 аминокислот имеется по меньшей мере один тип тРНК, для большей же части аминокислот их имеется несколько. Прежде чем включиться в синтезируемую белковую цепь, аминокислота присоединяется своим карбоксильным концом к 3'-концу соответствующей молекулы тРНК. Этим достигаются две цели. Во-первых, и это наиболее важно, аминокислота ковалентно присоединяется к тРНК, содержащей правильный антикодон - трехнуклеотидную последовательность, комплементарную трехнуклеотидному кодону, определяющему эту аминокислоту в молекуле мРНК. Спаривание кодона с антикодоном позволяет каждой аминокислоте включиться в растущую белковую цепь в том порядке, который диктуется нуклеотидной последовательностью мРНК, так что генетический код используется для перевода (трансляции)
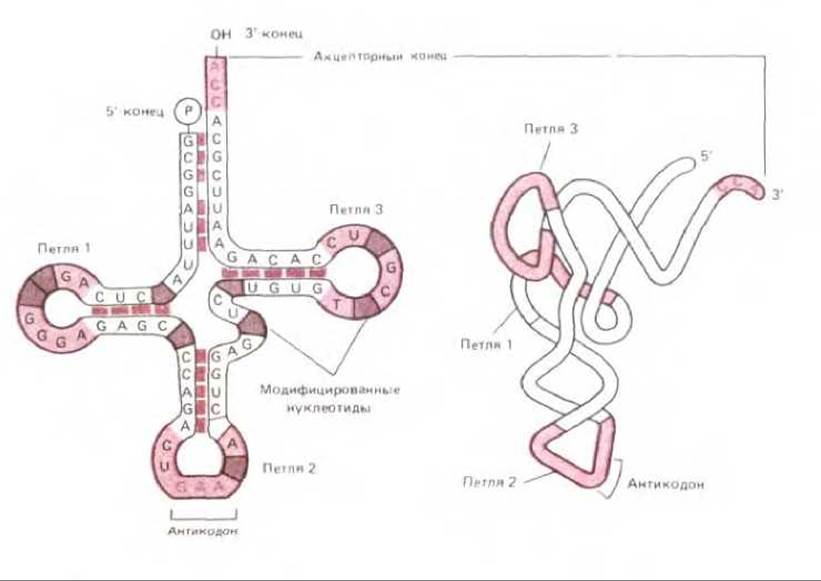
Рис. 5-7. Строение типичной молекулы тРНК. Слева представлен механизм спаривания оснований в соответствующих участках молекулы (структура «клеверного листа»), а справа - общая трехмерная информация молекулы, установленная с помощью дифракции рентгеновских лучей.
Отметим, что молекула напоминает по форме букву L, один ее конец (акцепторный) предназначен для присоединения аминокислоты, а второй содержит антикодон, состоящий из трех нуклеотидов. Аминокислота присоединяется к остатку А последовательности ССА на 3'-конце молекулы (см. рис. 5-11).
нуклеотидных последовательностей нуклеиновых кислот в аминокислотные последовательности белков. В этом заключается важная «адапторная» функция тРНК: присоединяясь одним концом к аминокислоте, а другим спариваясь с кодоном, тРНК переводит последовательность нуклеотидов в последовательность аминокислот.
Вторая цель, достигаемая присоединением аминокислоты к тРНК, заключается в том, что аминокислота таким путем активируется - на ее карбоксильном конце возникает богатая энергией связь, что дает ей возможность реагировать с аминогруппой соседней аминокислоты в данной аминокислотной последовательности, т, е. возможность образовать пептидную связь. Этот процесс активации - необходимый этап белкового синтеза, поскольку неактивированные аминокислоты не могут прямо присоединяться к растущей полипептидной цепи. (Спонтанно способен идти лишь обратный процесс - гидролитический разрыв пептидных связей.)
Функция тРНК зависит от трехмерной структуры ее молекулы. Несколько видов тРНК удалось получить в кристаллическом виде, что позволило определить их точную структуру методом рентгеноструктурного анализа. Для надлежащего свертывания молекулы тРНК требуется комплементарное спаривание оснований и взаимодействие необычных оснований (см. разд. 3.2.9, рис. 3-16). Изучение вторичной структуры молекулы тРНК из многих различных организмов показало, что она имеет вид «клеверного листа»; полагают, что петли и прямолинейные отрезки этой структуры затем свертываются дополнительно, вследствие чего возникает обнаруживаемая кристаллографическим анализом L-конформация (рис. 5-7). К одному концу этой «буквы» присоединяется аминокислота, а на другом конце находится антикодон (рис. 5-8).
В готовой цепи нуклеиновой кислоты нуклеотиды (подобно аминокислотам в белках) могут претерпевать ковалентную модификацию, приводящую к изменению активности данной нуклеиновой кислоты. Такие посттранскрипционные модификации особенно свойственны молекулам тРНК, в которых обнаруживается много модифицированных нуклеотидов (рис. 5-9). Некоторые из них оказывают влияние на конформацию и на спаривание оснований антикодона, что облегчает узнавание соответствующего кодона мРНК молекулой тРНК.
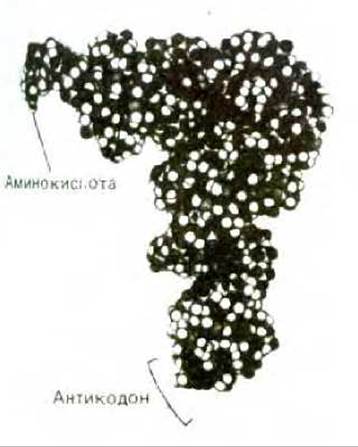
Рис. 5-8. Пространственная модель молекулы тРНК с присоединенной аминокислотой. Существует много различных видов тРНК - не менее одного на каждую аминокислоту. Хотя эти молекулы тРНК различаются по своей нуклеотидной последовательности, все они свернуты сходным образом. Изображенная здесь молекула тРНК связывает аминокислоту фенилаланин, поэтому ее условно обозначают тРНКРhе. (С любезного разрешения Sung-Hou Kim.)
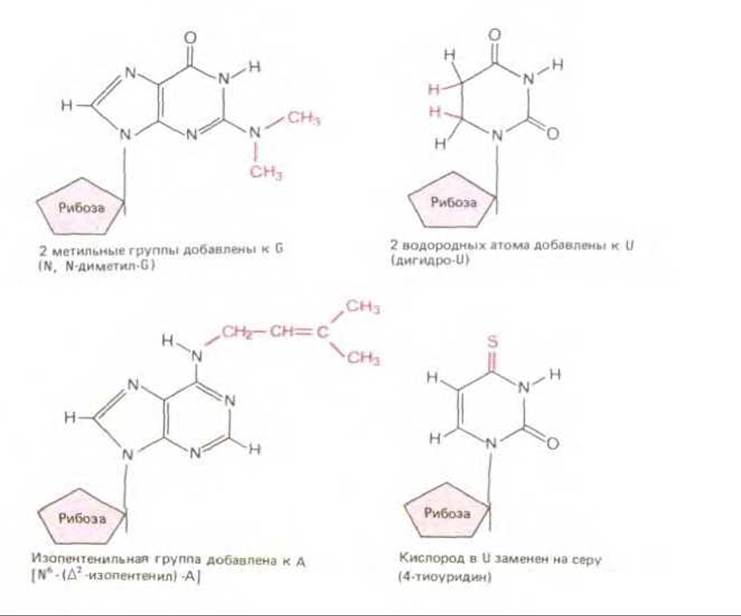
Рис. 5-9. Некоторые необычные нуклеотиды, встречающиеся в молекулах тРНК. Они возникают в результате ковалентной модификации обычного нуклеотида уже после того, как он включился в полинуклеотидную цепь. В большинстве молекул тРНК подобным образом видоизменено приблизительно 10% нуклеотидов (см. рис. 5-7).
5.1.4. Каждая аминокислота присоединяется к соответствующей молекуле тРНК при помощи специфического фермента [4]
В каком именно месте будет присоединена к растущей полипептидной цепи данная аминокислота, зависит не от самой аминокислоты, а от присоединившей ее молекулы тРНК. Выяснить это удалось при помощи изящного эксперимента, в котором аминокислоту, присоединенную к специфической тРНК, химическим путем превращали в другую аминокислоту (цистеин в аланин). Когда затем такие гибридные молекулы участвовали в синтезе белка в бесклеточной системе, неправильная аминокислота включалась в белковую цепь во всех тех положениях, которые «обслуживались» данной тРНК. Успешное декодирование, следовательно, решающим образом зависит от точности того механизма, который в норме обеспечивает связь между каждой активированной аминокислотой и соответствующей молекулой тРНК.
Почему молекула тРНК ковалентно присоединяется именно к той аминокислоте из всех двадцати стандартных аминокислот, которая и является ее настоящим партнером? Механизм этот связан с участием ферментов, называемых аминоацил-тРНК-синтетазами, которые присоединяют каждую аминокислоту к соответствующему набору молекул тРНК. Для каждой из аминокислот имеется своя особая синтетаза (всего таких синтетаз 20): одна присоединяет глицин к тРНКGlу, другая - аланин к тРНКАlа и т. д. Реакция присоединения протекает в два этапа, как это видно на рис. 5-10, и приводит к образованию молекулы аминоацил-тРНК. Характер связи аминоацил-тРНК ясен из рис. 5-11.
Молекулы тРНК играют роль конечных «адапторов», переводящих информацию, заключенную в нуклеотидной последовательности нуклеиновой кислоты, на язык белка. Не менее важную роль, однако, играет и второй набор молекул - ферментов аминоацил-тРНК-синтетаз. Таким образом, генетический код расшифровывается при помощи двух последовательно действующих посредников, каждый из которых осуществляет высокоспецифическую подгонку одной молекулярной поверхности к другой; в результате совместного действия этих адапторных молекул каждая аминокислота может быть отождествлена с определенной последовательностью из трех нуклеотидов в молекуле мРНК, иными словами, со своим кодовом (рис. 5-12).
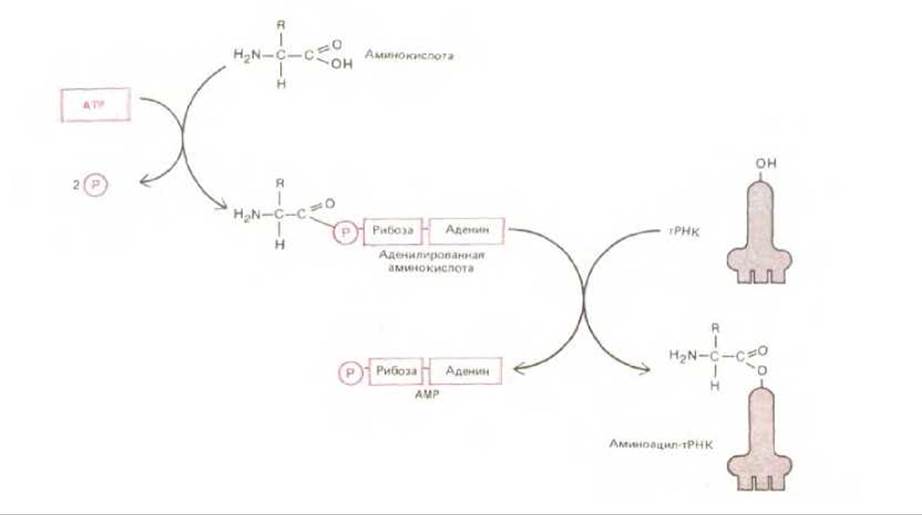
Рис. 5-10. Двухэтапный процесс, в котором аминокислота под действием аминоацил-тРНК-синтетазы переводится в активированную форму, вовлекаемую в синтез белка. Для присоединения каждой аминокислоты к соответствующей молекуле тРНК используется, как здесь показано, энергия гидролиза АТР, поскольку возникающая связь принадлежит к числу богатых энергией. Сначала аминокислота активируется путем связывания ее карбоксильной группы непосредственно с AMP, т. е. образуется аденилированная аминокислота; источником энергии для реакции аденилирования, в обычных условиях невыгодной в термодинамическом смысле, служит гидролиз АТР (играющего роль донора AMP). Оставаясь связанной с аминоацил-тРНК-синтетазой, аденилированная карбоксильная группа аминокислоты переносится затем на гидроксильную группу аминокислоты остатка сахара, находящуюся на 3'-конце молекулы тРНК. В результате этого переноса образуется молекула аминоацил-тРНК, в которой аминокислота присоединена к тРНК активированной сложноэфирной связью.
5-6
5.1.5. Аминокислоты присоединяются к карбоксильному концу растущей полипептидной цепи
Основная реакция в синтезе белка - это реакция, приводящая к образованию пептидной связи между карбоксильной группой на конце растущей полипептидной цепи и свободной аминогруппой аминокислоты. Белковая цепь синтезируется, следовательно, путем ее постепенного наращивания от аминного конца к карбоксильному. На протяжении всего процесса растущий карбоксильный конец полипептидной цепи остается в активированном состоянии, будучи связан ковалентной связью с тРНК (в молекуле пептидил-тРНК). В каждом цикле синтеза происходит разрыв этой ковалентной связи, однако она тут же замещается точно такой же связью, образуемой следующей присоединенной к цепи аминокислотой (рис. 5-13). Таким образом, в процессе синтеза белка каждая добавляемая аминокислота несет с собой энергию активации, необходимую не для ее собственного присоединения, а для присоединения следующей аминокислоты. Это один из примеров «роста с головы», описанного в гл. 2 (рис. 234).
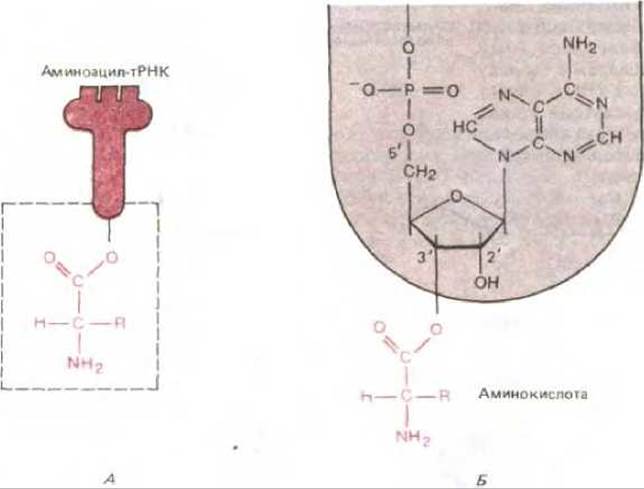
Рис. 5-11. Связь между аминокислотой и тРНК. Карбоксильная группа аминокислоты присоединена сложноэфирной связью к рибозе. Поскольку гидролитический разрыв этой сложноэфирной связи сопровождается термодинамически выгодным изменением свободной энергии, аминокислота, удерживаемая подобной связью, активирована. А, Схематическое изображение. Б. Реальная структура области, выделенной в левой части рисунка в рамку. R в аминокислотной части молекулы, как и на рис. 5-10, означает одну из 20 возможных боковых цепей.
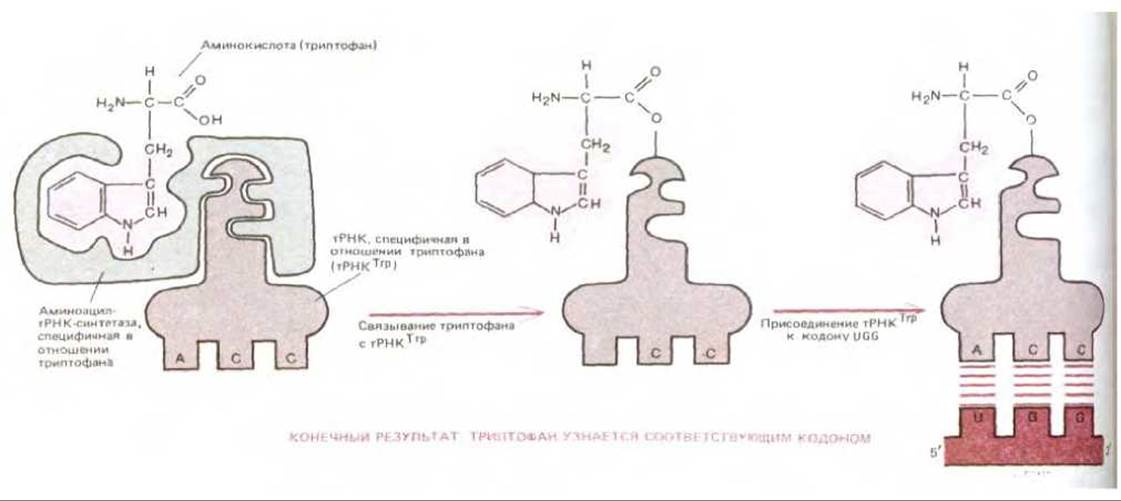
Рис. 5-12. Схема, показывающая, как осуществляется трансляция генетического кода при помощи двух совместно действующих «адапторов»: одним из них является фермент аминоацил-тРНК-синтетаза, присоединяющий данную аминокислоту к соответствующей тРНК, а вторым - молекула тРНК, которая связывается затем с надлежащей нуклеотидной последовательностью в мРНК.
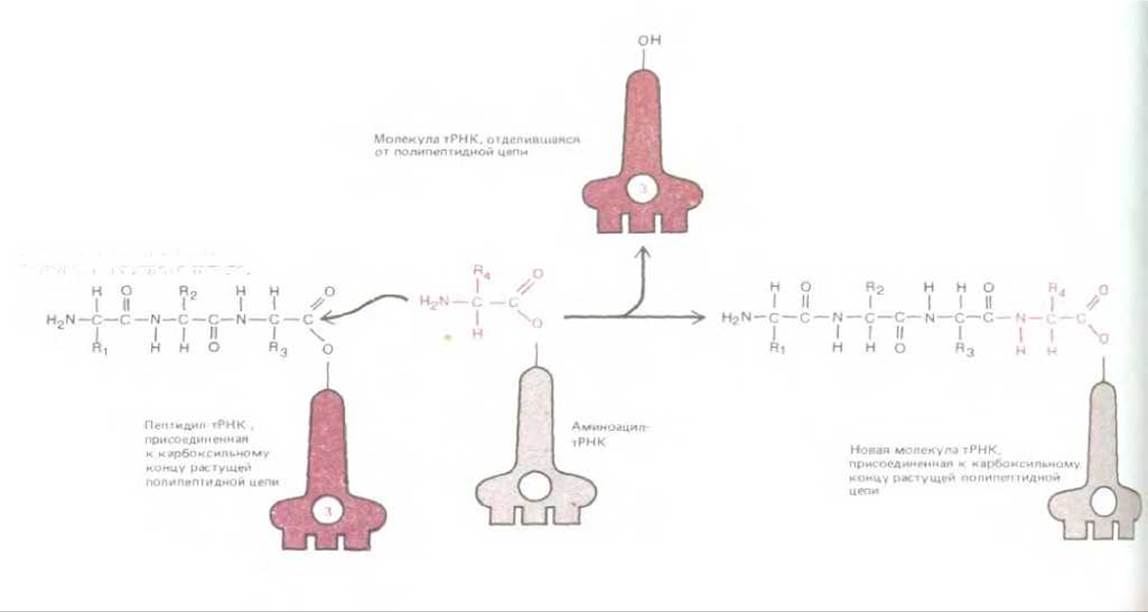
Рис. 5-13. Полипептидная цепь растет путем последовательного добавления новых аминокислот к ее карбоксильному концу. Образование каждой пептидной связи в энергетическом смысле выгодно, так как растущий карбоксильный конец цепи активирован благодаря тому, что он ковалентно связан с молекулой тРНК. Пептидил-тРНК-связь, поддерживающая растущий конец полипептидной цепи в активированном состоянии, восстанавливается заново в каждом цикле.
5-3
5.1.6. Генетический код вырожден [5]
В процессе синтеза белка нуклеотидная последовательность мРНК считывается группами по три нуклеотида, по мере того как считывающий «аппарат» перемещается вдоль молекулы мРНК в направлении 5' → 3'. Каждая аминокислота соответствует определенному триплету нуклеотидов (кодону) в молекуле мРНК, который спаривается с последовательностью из трех комплементарных нуклеотидов в антикодоновой петле определенной молекулы тРНК. Поскольку спариваться с данным кодовом способен только один из многих различных видов молекул клеточной тРНК, выбор аминокислоты, присоединяемой в каждый данный момент к растущему концу полипептидной цепи, определяется кодовом (рис. 5-14).
Число возможных сочетаний трех нуклеотидов четырех типов равно 64 (4 х 4 х 4). Большинство этих сочетаний действительно встречается почти во всех молекулах мРНК. Три кодона из шестидесяти четырех не кодируют никаких аминокислот; эти кодоны определяют собой прекращение (терминацию) синтеза полипептидной цепи, и потому их называют стоп-кодонами или терминирующими кодонами. Остается, таким образом, 61 кодон, тогда как число различных встречающихся в белках аминокислот равно только 20. Отсюда следует, что большая часть аминокислот представлена более чем одним кодоном. Поэтому генетический код называют вырожденным. Для двух аминокислот, метионина и триптофана, имеется лишь по одному кодону; именно эти аминокислоты встречаются в белках реже всего.
Вырожденность генетического кода можно истолковывать двояко: 1) для каждой аминокислоты имеется более одной тРНК и 2) каждая молекула тРНК может спариваться более чем с одним кодоном. В действительности справедливо и то и другое. Для некоторых аминокислот существует более одной тРНК. Кроме того, некоторые тРНК таковы, что требуют точного спаривания только по первым двум положениям кодона; в третьем же положении допускается и неверное спаривание (так называемое неоднозначное соответствие). Этим объясняется, почему многие альтернативные кодоны аминокислот различаются лишь по своему третьему нуклеотиду (рис. 5-15). Спаривание при неоднозначном соответствии позволяет «привязать» 20 аминокислот к 61 кодону при наличии всего 31 вида тРНК; в митохондриях животных неоднозначное соответствие выражено еще более резко и здесь для синтеза белка оказывается достаточно 22 видов тРНК (см. разд. 7.5.5).
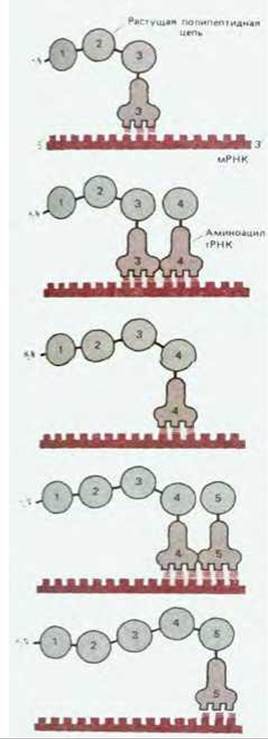
Рис. 5-14. Выбор каждой аминокислоты, добавляемой к растущему концу полипептидной цепи, определяется комплементарным спариванием оснований между антикодоном присоединившей аминокислоту тРНК и очередным кодоном цепи мРНК.

Рис. 5-15. Генетический код. Под трехбуквенным обозначением каждой аминокислоты дано общепринятое однобуквенное обозначение. При таком изображении кодонов 5'-концевой нуклеотид находится слева. Отметим, что почти все аминокислоты представлены более чем одним кодоном и что изменения затрагивают в основном третий кодон (см. также рис. 3-15).
5.1.7. Реакции синтеза белка протекают на рибосомах [6]
Для осуществления реакций белкового синтеза, которые мы только что описали, требуется сложный каталитический аппарат. Растущий конец полипептидной цепи должен, например, определенным образом подстраиваться к молекуле мРНК, для того чтобы каждый последующий кодон мРНК мог точно соединиться с антикодоном тРНК, не проскочив ни на один нуклеотид, ибо это привело бы к сдвигу рамки считывания (см. разд. 3.2.8). Эти и другие этапы белкового синтеза осуществляются рибосомами - крупными комплексами, состоящими из молекул белков и РНК. Рибосомы эукариот и прокариот очень сходны по своей структуре и функции. Каждая из них состоит из двух субъединиц - большой и малой, образующих в совокупности комплекс с массой в
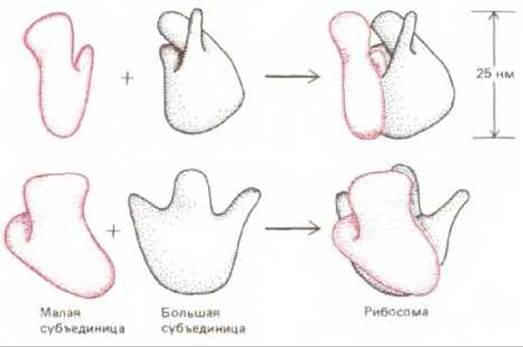
Рис. 5-16. Трехмерная модель бактериальной рибосомы (вид с двух разных сторон). Положение многих рибосомных белков в этой структуре выявлено с помощью электронного микроскопа, позволяющего обнаружить места прикрепления специфических антител, а также по рассеянию нейтронов от рибосом, содержащих один или несколько дейтерированных белков. (По J. A. Lake, Ann. Rev. Biochem., 54, 507-530, 1985.)
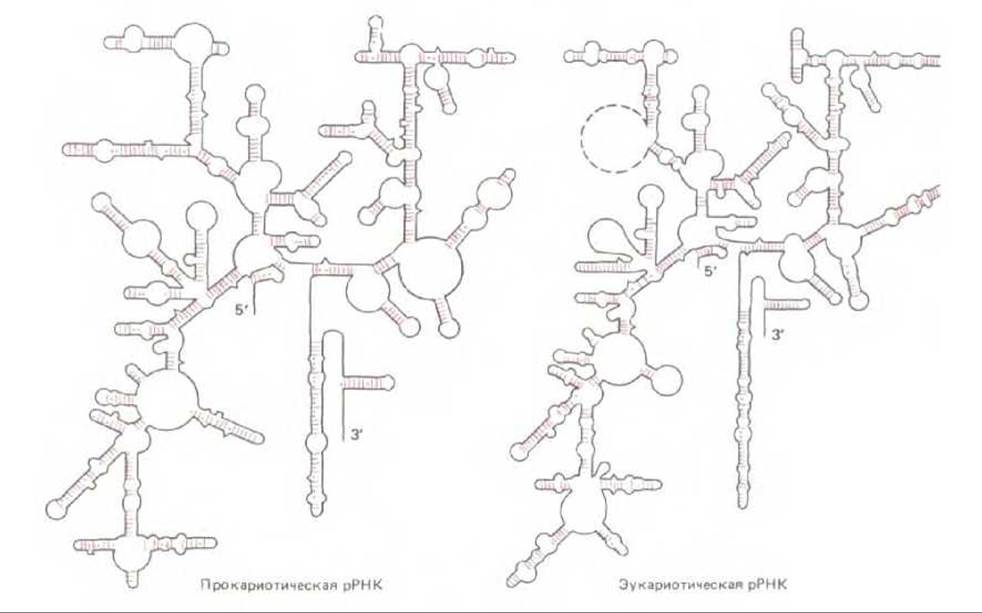
Рис. 5-17. Сложное расположение петель и спаренных прямых участков в трехмерной структуре 16S-pPHK E. coli (А) и 18S-рРНК дрожжей (S. cerevisiae) (Б). В главных чертах такое строение характерно для всех видов рРНК, подобных 16S-pPHK, в том числе и для рРНК архебактерий. Точки обозначают постулированные слабые взаимодействия между основаниями, например в парах G-U. (По R. R. Gutell, В. Weiser, С. R. Woese, Н. F. Noller, Prog. Nucleic Acid Res. Моі. Biol., 32, 155-216, 1985.)
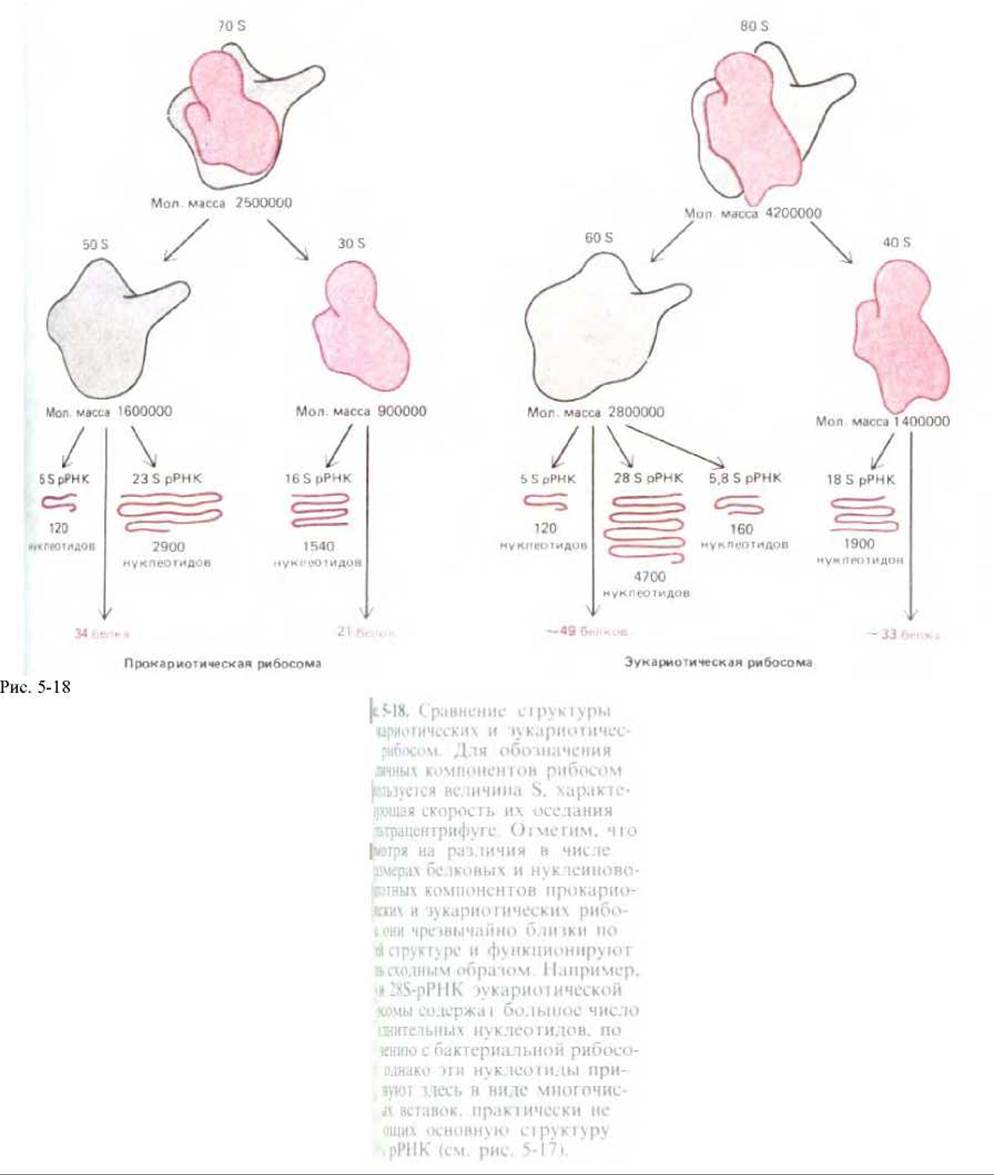
несколько миллионов дальтон (рис. 5-16). Малая субъединица удерживает мРНК и тРНК, а большая катализирует образование пептидной связи.
Более половины массы рибосомы составляет РНК, и накапливается все больше данных, указывающих, что именно рибосомная РНК (рРНК) играет ключевую роль в каталитической активности рибосомы. Размеры молекул рРНК в малой рибосомной субъединице у разных организмов варьируют, но сложная ее структура остается весьма постоянной (рис. 5-17); между молекулами рРНК больших рибосомных субъединиц также выявляется у разных организмов высокая степень гомологии. В состав рибосомы входит значительное число белков (рис. 5-18), но их аминокислотные последовательности на протяжении эволюции довольно сильно менялись. Удивление вызывает тот факт, что многие из этих белков для функционирования рибосом, по-видимому, не являются необходимыми. Можно предположить (ниже мы останавливаемся на этом подробнее; см. разд. 5.1.16), что рибосомные белки нужны в основном для усиления функции рРНК и что не белковые молекулы, а молекулы РНК катализируют многие из реакций, протекающих на рибосомах.
5.1.8. Рибосома продвигается шаг за шагом вдоль цепи мРНК [6, 7]
В рибосоме имеются три различных участка, с которыми связывается РНК, - один для мРНК и два для тРНК. Из двух последних один участок удерживает молекулу тРНК, присоединенную к растущему концу полипептидной цепи (поэтому его называют пептидил-тРНК- связывающим участком или Р-участком), а второй служит для удержания только что прибывшей молекулы тРНК, нагруженной аминокислотой; называют аминоацил-тРНК-связывающим участком или А-участком. К обоим участкам молекула тРНК прочно прикрепляется лишь в случае, если ее антикодон спаривается с комплементарным ему ко, мРНК. А- и Р-участки располагаются очень близко друг к другу, так что две связанные с ними молекулы тРНК спариваются с двумя соседними кодонами в молекуле мРНК (рис. 5-19).
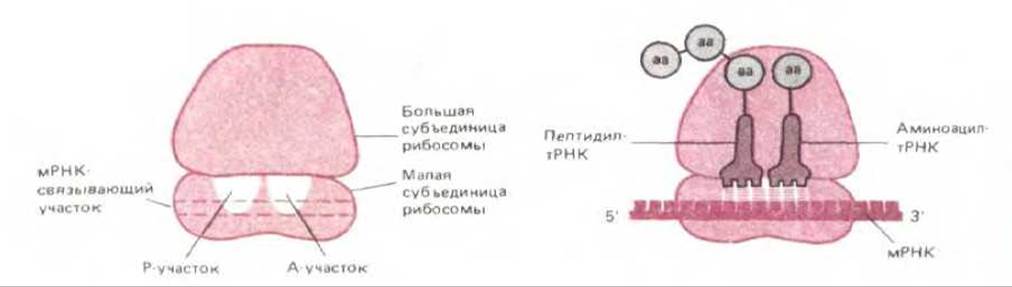
Рис. 5-19. Три главных участка связывания, в которых молекулы РНК присоединяются к рибосоме. Слева представлена ненагруженная рибосома, справа - нагруженная. На этом рисунке так же, как и на трех следующих, рибосомы изображены схематично, более точное представление об их форме дают рис. 5-16 к 5-23.
Процесс наращивания (элонгации) полипептидной цепи на рибосомах может рассматриваться как цикл, слагающийся из трех отдельных этапов (рис. 5-20). На первом этапе молекула аминоацил-тРНК связывается со свободным участком рибосомы, примыкающим к занятому Р- участку. Связывание осуществляется путем спаривания нуклеотидов антикодона с тремя нуклеотидами мРНК, находящимися в А-участке На втором этапе карбоксильный конец полипептидной цепи отделяется в Р-участке от молекулы тРНК и образует пептидную связь с аминокислотой, присоединенной к молекуле тРНК в А-участке. Эта реакция катализируется пептидилтрансферазой - ферментом, активность которой зависит от целостности рибосомы, а также, как полагают, от участка некоторой специфической области в главной молекуле рРНК большой субъединицы рибосомы. На третьем этапе новая пептидил-тРНК переносится в Р-участок рибосомы, в то время как рибосома продвигается вдоль молекулы мРНК ровно на три нуклеотида. Этот этап требует затраты энергии; движущей силой служит для него ряд конформационных изменений, индуцируемых в одном из компонентов рибосом гидролизом связанной с ним молекулы GTP (см. разд. 3.4.11).
Процесс транслокации, составляющий третий этап, включает в себя и возвращение свободной молекулы тРНК, отделившейся от полипептидной цепи в Р-участке во время второго этапа, в цитоплазматический пул тРНК. Поэтому после завершения третьего этапа незаняты А-участок может принять новую молекулу тРНК, нагруженную очередной аминокислотой, т. е. цикл может начаться снова. В бактериальной клетке продолжительность одного цикла элонгации полипептидной составляет при оптимальных условиях около 1/20 с, так что синтез среднего по размерам белка, состоящего из 400 аминокислот, занимает приблизительно 20 с. Рибосомы продвигаются вдоль молекулы мРНК в направлении 5' → 3', т. е. в том же направлении, в каком идет синтез РНК (см. рис. 5-2).
В большей части клеток синтез белка - самый энергоемкий из всех биосинтетических процессов. Образование каждой новой пептидной связи сопровождается расщеплением по меньшей мере четырех высоко энергетических фосфатных связей. Две из них расходуются на то, чтобы нагрузить аминокислотой молекулу тРНК (см. рис. 5-10), а две - на сам синтез в цикле реакций, протекающих на рибосоме: при связывании аминоацил-тРНК на первом этапе цикла и при транслокации рибосомы на третьем этапе.
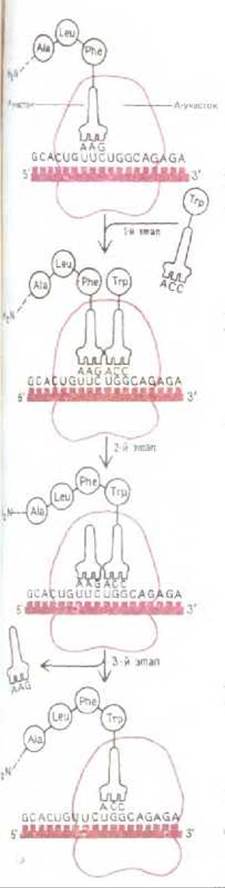
Рис. 5-20. Фаза элонгации в синтезе белка, протекающая на рибосоме. Представленный здесь трехэтапный цикл многократно повторяется во время синтеза белковой цепи. На первом этапе молекула аминоацил-тРНК присоединяется к А-участку рибосомы, второй этап характеризуется образованием новой пептидной связи, на третьем этапе рибосома продвигается вдоль цепи мРНК на расстояние, соответствующее трем нуклеотидам, высвобождая предыдущую молекулу тРНК, т.е. устанавливается в таком положении, чтобы цикл мог повториться сначала.
5-5
5-8
5.1.9 Белковая цепь отделяется от рибосомы, как только она достигает одного из трех терминирующих кодонов [6, 8]
Из 64 возможных кодонов мРНК три, а именно UAA, UAG и UGA, являются терминирующими или стоп-кодонами: они останавливают трансляцию. Особые цитоплазматические белки, называемые факторами освобождения, непосредственно связываются с любым стоп-кодоном, достигшим А-участка рибосомы. Это связывание изменяет активность пептидилтрансферазы. Фермент с измененной активностью присоединяет теперь к пептидил-тРНК не аминокислоту, а молекулу воды. Вследствие этого карбоксильный конец растущей полипептидной цепи отделяется от молекулы тРНК. А поскольку растущий полипептид удерживается на рибосоме только посредством его связи с молекулой тРНК, завершенная белковая цепь оказывается свободной и, отделившись от рибосомы, немедленно поступает в цитоплазму (рис. 5-21). После этого рибосома освобождает мРНК и распадается на две субъединицы; эти субъединицы могут затем объединиться на другой молекуле мРНК и начать новый цикл белкового синтеза посредством процесса, который мы опишем ниже.
5-4
5.1.10. Рамка считывания матрицы устанавливается в момент инициации синтеза полипептидной цепи [6, 9]
Теоретически нуклеотидная последовательность РНК может быть декодирована с помощью любой из трех различных рамок считывания, причем образующиеся полипептидные цепи будут в этих трех случаях совершенно разными (см. рис. 3-14). Как в действительности пойдет считывание, определяется в тот момент, когда рибосома соединяется с молекулой мРНК. В фазе инициации белкового синтеза сборка рибосомы из двух ее субчастиц на молекуле мРНК происходит в том самом месте, с которого должен начаться синтез полипептидной цепи.
Процесс инициации сложен. Он слагается из ряда этапов, катализируемых белками, которые носят название факторов инициации (IF); многие из них сами состоят из нескольких полипептидных цепей. В силу этой сложности инициации многие ее детали до сих пор не вполне выяснены. Известно, однако, что сборка каждой рибосомы на цепи мРНК проходит в два этапа: сначала нагруженная факторами инициации малая субъединица рибосомы находит на мРНК старт-кодон, а затем к ней присоединяется большая субъединица.
Прежде чем рибосома может начать синтез новой полипептидной цепи, к ее Р-участку, обычно удерживающему пептидил-тРНК, должна присоединиться молекула аминоацил-тРНК (рис. 5-22). Для этого требуется особая молекула тРНК, называемая инициаторной тРНК. Инициаторная тРНК поставляет аминокислоту, с которой должен начаться синтез полипептидной цепи. Роль этой аминокислоты всегда играет метионин или (у прокариот) его аминоформилированное производное. У эукариот малая субъединица рибосомы нагружается инициаторной тРНК, прежде чем присоединиться к мРНК. С инициаторш тРНК прочно связывается важный фактор инициации, называемый эукариотическим фактором инициации 2 (eIF-2); он необходим для того, чтобы инициаторная тРНК заняла правильное положение на малой субъединице рибосомы. В некоторых клетках от этого фактора зависит общая скорость белкового синтеза (см. ниже).
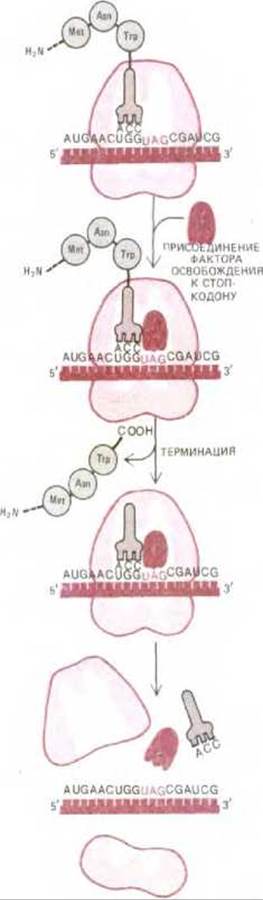
Рис. 5.21. Последняя фаза синтеза белка. Присоединение фактора освобождения к стоп-кодону прекращает трансляцию, завершенный полипептид освобождается, а рибосома распадается на две отдельные субъединицы.
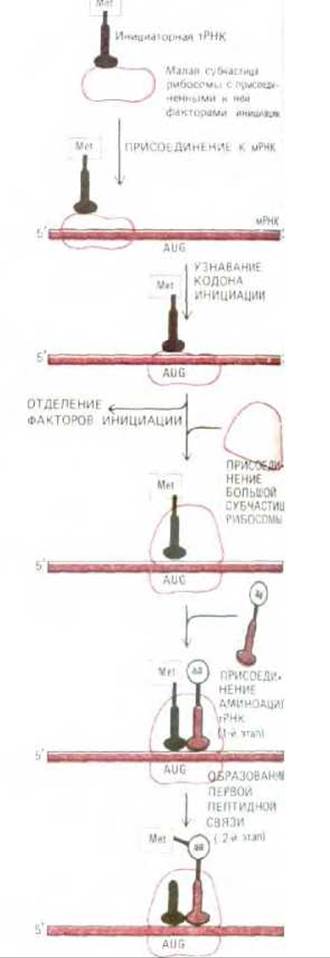
Рис. 5-22. Фаза инициации в синтезе белка. Здесь представлена последовательность событий, свойственная эукариотам, но очень сходный процесс протекает и у бактерий. Этапы 1 и 2 относятся к фазе элонгации (см. рис. 5-20).
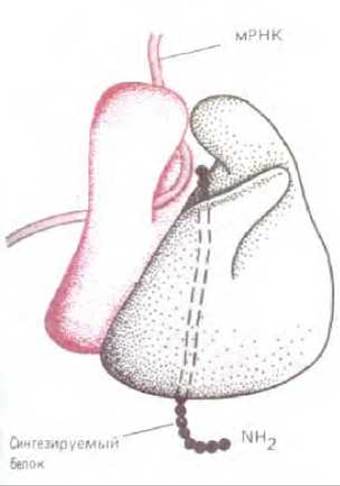
Рис. 5-23. Трехмерная модель функциональной рибосомы бактерий. Малая (красная) субъединица и большая (серая) образуют комплекс, сквозь который протянута нить мРНК. Точно траектория движения мРНК и наращиваемой полипептидной цепи неизвестны, однако участок, где происходит присоединение аминокислот, указан здесь правильно. (С изменениями по J. A. Lake, Annu. Rev. Biochem., Я 507-530, 1985.)
В следующем разделе мы расскажем, как малая субъединица рибосомы помогает присоединенной к ней инициаторной тРНК отыскать на молекуле мРНК среди всех встречающихся здесь кодонов AUG один особый кодон (старт-кодон). Как только это произойдет, несколько факторов инициации, связавшихся ранее с малой субъединицей, отделяются от нее, освобождая место для присоединения к ней большой субъединицы рибосомы. Поскольку молекула инициаторной тРНК связывается с Р-участком рибосомы, синтез полипептидной цепи может начаться прямо с присоединения второй молекулы аминоацил-тРНК к А-участку (рис. 5-22). Тем самым завершается сборка функциональной рибосомы с проходящей сквозь нее нитью мРНК (рис. 5-23). Далее следуют очередные этапы фазы элонгации белкового синтеза, описанные выше (см. второй этап на рис. 5-20). Поскольку инициаторная тРНК всегда несет аминокислоту метионин или (у прокариот) его аминоформилированное производное, у всех новосинтезированных белковых цепей на N-конце обнаруживается остаток метионина. Этот метионин часто вскоре после включения удаляется специфичной аминопептидазой, что весьма существенно, потому что аминокислота, стоящая на аминном конце, может определять время жизни клеточных белков, воздействуя на убиквитин - зависимый путь деградации (см. разд. 8.2.5).
Выбор правильной точки инициации синтеза на молекуле мРНК определяется, очевидно, малой субъединицей, действующей совместно с факторами инициации (но в отсутствие большой субъединицы); вследствие этого, вероятно, все рибосомы и состоят из двух субъединиц. Теперь мы познакомимся с тем, как осуществляется этот выбор.
5-45
5.1.11. У эукариот на каждой молекуле мРНК синтезируется только один вид полипептидных цепей [10]
В молекуле мРНК имеется обычно много триплетов AUG, и каждый из них кодирует метионин. Однако у эукариот лишь один из этих триплетов AUG узнается инициаторной тРНК, т. е. выступает в качестве старт-кодона. Как рибосома узнает этот старт-кодон?
Механизм для выбора старт-кодона у эукариот и прокариот различен. Молекулы эукариотических мРНК (за вычетом тех, которые синтезируются в митохондриях и хлоропластах) сразу же по завершении транскрипции подвергаются в клеточном ядре весьма существенным модификациям (см. разд. 9.4.8). Два главных изменения такого рода состоят в добавлении к 5'-концу особой структуры, так называемого кэпа, состоящего из остатка 7-метилгуанозина, связанного с трифосфатом (рис. 5-24), а к 3'-концу - фрагмента, состоящего приблизительно из 200 остатков адениловой кислоты (polyA). Играет ли polyA какую-нибудь роль в процессе трансляции, мы пока не знаем. Что же касается кэпа на 5'- конце, то он для эффективного белкового синтеза необходим. Опыты с экстрактами эукариотических клеток показали, что малая рибосомная субъединица присоединяется к 5'-концу цепи мРНК, чему способствует узнавание ею 5'-кэпа (рис. 5.22). Затем эта малая субъединица, несущая связанную с нею инициаторную тРНК, перемещается вдоль цепи мРНК в поисках старт-кодона AUG. Требования к старт-кодону не являются, по- видимому, слишком жесткими: необходимо всего несколько дополнительных нуклеотидов помимо самого триплета AUG. У большинства видов РНК используется первый подходящий кодон AUG поблизости от 5'-конца, при этом ни один из многих других триплетов AUG в цепи мРНК служить точкой инициации полипептидной цепи уже не может. Поэтому на данной молекуле мРНК синтезируется, как правило, лишь один какой-нибудь вид полипептидной цепи. По всем этим признакам прокариотические мРНК совершенно отличны от эукариотических (рис. 5-25). У бактериальных матриц 5'-кэп отсутствует. Вместо этого они содержат специфические инициаторные последовательности примерно из шести нуклеотидов, встречающиеся на протяжении одной и той же цепи мРНК неоднократно в разных ее участках. Такие последовательности располагаются обычно перед очередным триплетом AUG, отделенные от него несколькими (от 4 до 7) нуклеотидами; они спариваются со специфическим участком рРНК рибосомы и это служит сигналом для инициации синтеза белка у ближайшего старт-кодона. Более того, хотя бактериальные рибосомы и узнают терминирующие кодоны как сигналы для окончания синтеза одной полипептидной цепи, они могут «проскользнуть» дальше по матрице. Поэтому бактериальные мРНК обычно полицистронны, т.е. кодируют многие белки, синтезируемые на одной и той же молекуле мРНК. В отличие от них эукариотические мРНК, как правило, моноцистронны, иными словами, на одной такой молекуле мРНК может идти синтез только одного вида полипептидной цепи (рис. 5.25).
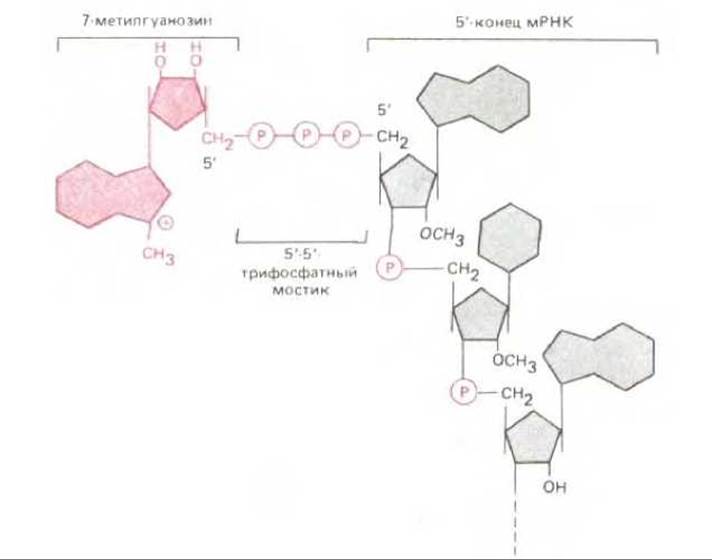
Рис. 5-24. 5'-Кэп, имеющийся в молекулах мРНК у эукариот. Отметим необычную 5' → 5'-связь с положительно заряженным остатком 7-метилгуанозина и метилирование 2'-гидроксила первого остатка рибозы в РНК. (Второй остаток рибозы метилирован не всегда.)
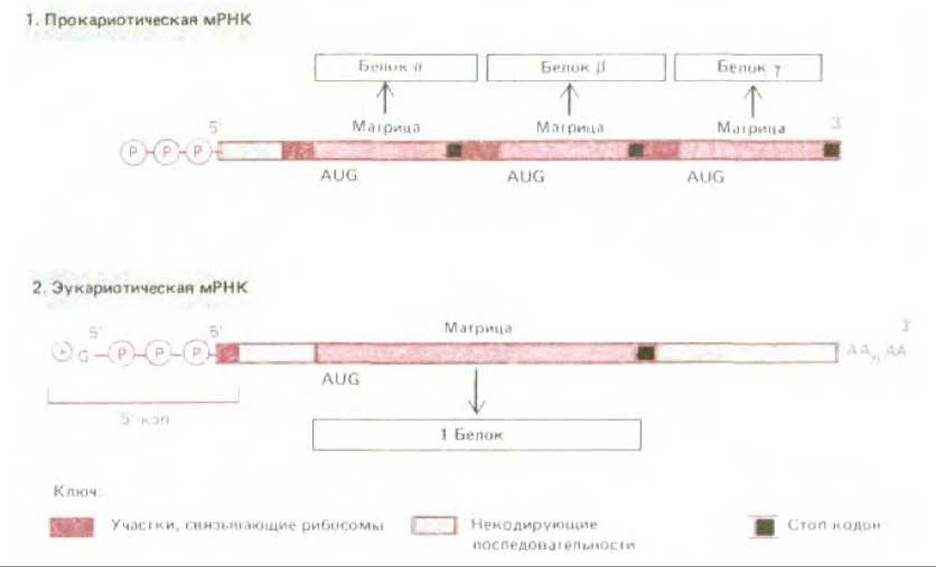
Рис. 5-25. Сравнение структуры прокариотической и эукариотической мРНК. В момент завершения синтеза обе эти мРНК имеют на 5'-конце трифосфат, но эукариотическая мРНК немедленно вслед за тем приобретает 5'-кэп. У эукариот малая рибосомная субъединица узнает 5'-конец мРНК именно благодаря 5'-кэпу. Поэтому синтез белка начинается со старт-кодона, ближайшего к 5'-концу (см. рис. 5-22). В отличие от этого у прокариот 5'-конец не имеет особого значения и рибосомы могут присоединяться ко многим участкам нити мРНК, что всякий раз дает начало синтезу иного белка.
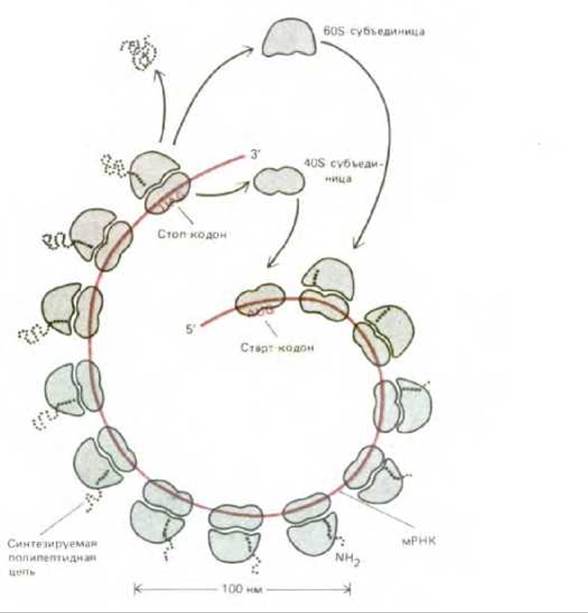
Рис. 5-26. Схематическое изображение полирибосомы, показывающее, как ряд рибосом одновременно осуществляет трансляцию на одной и той же молекуле мРНК. В эукариотических клетках синтез каждой полипептидной цепи начинается с присоединения малой рибосомной субъединицы к единственному подходящему для этого участку на молекуле мРНК и трансляция идет вдоль этой молекулы в направлении 5' → 3'. По завершении данной полипептидной цепи обе субъединицы рибосомы отделяются от молекулы мРНК.
5.1.12. Множество рибосом, присоединившихся к одной молекуле мРНК, образуют полисому [11]
Синтез одного белка длится в среднем от 20 до 560 секунд. Однако даже за этот очень короткий период на каждой молекуле мРНК, где идет процесс трансляции, инициация синтеза обычно осуществляется многократно. Новая рибосома присоединяется к 5'-концу молекулы мРНК сразу же после того, как предыдущая свяжет между собой достаточное количество аминокислот, чтобы освободить ей место. Молекулы мРНК в этом случае входят в состав полирибосом (или полисом) - структур, в которых на одну молекулу мРНК нанизано много рибосом, отстоящих друг от друга на расстояние приблизительно в 80 нуклеотидов (рис. 5-26 и 5-27). У прокариот (в отличие от эукариот) рибосомы могут присоединяться к мРНК, как только она образовалась. Они начинают синтез белка на 5'-конце новой молекулы мРНК и движутся вслед за РНК-полимеразой, достраивающей цепь мРНК.
Полирибосомы весьма характерны для клеток. От находящихся в цитозоле свободных рибосом их отделяют ультрацентрифугированием после лизиса клеток (рис. 5-28). Выделенную из полирибосомы мРНК можно использовать, чтобы убедиться в том, что белок, кодируемый данной последовательностью ДНК, активно синтезируется клетками, из которых были получены полирибосомы. Она может послужить также исходным материалом для создания специальных библиотек кДНК (см. разд. 5.6.3).
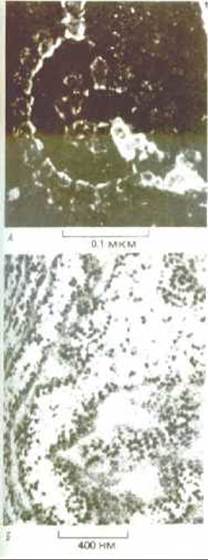
Рис. 5-27. Электронные микрофотографии типичных полирибосом, осуществляющих синтез белка в эукариотической клетке. А. Глубокое травление. (С любезного разрешения John Heuser.) Б. Тонкий срез. Цитоплазма клетки обычно заполнена такими полирибосомами лежащими в цитозоле свободно или прикрепленными к мембранам. (С любезного разрешения George Palade.)
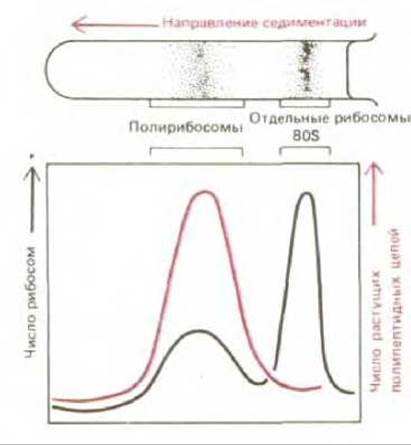
Рис. 5-28. Отделение полирибосом от свободных рибосом (и от их субъединиц) с помощью центрифугирования. Метод основан на том, что крупные молекулярные агрегаты движутся в сильном гравитационном поле быстрее, нежели мелкие. Обычно седиментацию проводят в градиенте сахарозы, чтобы стабилизировать раствор - предотвратить его перемешивание за счет конвекции.
10-25
5.1.13. Общая скорость белкового синтеза регулируется у эукариот факторами инициации [12]
Известно (подробнее об этом см. гл. 13), что клетки многоклеточного организма размножаются только тогда, когда они находятся в соответствующем окружении и на них воздействуют специфические факторы роста. Механизм действия этих факторов роста не совсем ясен, но несомненно, что одним из главных эффектов должно быть увеличение общей скорости белкового синтеза (см. разд. 13.3.4). Чем определяется эта скорость? Прямые исследования на тканях крайне сложны, но если клетки в культуре не получают достаточного количества питательных веществ, то резко снижается скорость инициации синтеза полипептидных цепей, причем можно показать, что это торможение обусловливается инактивацией одного из факторов инициации белкового синтеза, а именно IF-2. Показано, что по крайней мере у одного типа клеток (в незрелых эритроцитах) активность IF-2 снижается контролируемым образом в результате фосфорилирования одной из трех его белковых субъединиц. Можно предположить поэтому, что скорость белкового синтеза у эукариот регулируется в известной степени специфическими протеинкиназами, которые в своей активной форме тормозят его инициацию. Возможно, что действие факторов роста осуществляется при посредстве каких-то регуляторных веществ, которые инактивируют эти протеинкиназы или нейтрализуют их эффект.
У эукариот факторы инициации, необходимые для синтеза белка, более многочисленны и более сложны, нежели у прокариот, хотя и у тех, и у других они выполняют одни и те же основные функции. Многочисленные дополнительные компоненты, возможно, представляют собой регуляторные белки, реагирующие на разные факторы роста и координирующие рост и размножение клеток в многоклеточных организмах. У бактерий нет потребности в такой регуляции: они растут с той скоростью, какую допускает наличие в среде питательных веществ.
5-9
5.1.14. Точность белкового синтеза обеспечивается двумя различными механизмами [13]
Судить о частоте ошибок в процессе белкового синтеза можно, определив, как часто включается в данный белок какая-нибудь аминокислота, в норме в нем отсутствующая. Наблюдения показывают, что в среднем на каждые 104 аминокислот включается одна «неправильная» аминокислота, и, значит, только одна ошибка приходится на каждые 25 синтезируемых белков среднего размера (400 аминокислот). Точность процесса декодирования зависит от надежности двух адапторных механизмов, о которых мы уже говорили выше: от связывания каждой аминокислоты с соответствующей молекулой тРНК и от спаривания кодонов в мРНК с антикодонами тРНК (см. рис. 5-12). Неудивительно, что в ходе эволюции в клетках возникли механизмы, которые обеспечивают снижение числа ошибок на этих двух ключевых этапах белкового синтеза.
Два механизма, действующие на этих двух этапах, совершено различны; каждый из них отражает стратегию, используемую клеткой в других процессах. Оба механизма сопряжены, однако, с затратой свободной энергии, поскольку, как уже отмечалось в гл. 2 (см. разд. 2.2), за всякое возрастание упорядоченности приходится платить. Надежность связывания аминокислоты с тРНК обеспечивается сравнительно простым механизмом. У многих аминоацил-тРНК-синтетаз имеется два отдельных активных центра: один, ответственный за реакцию, в результате которой тРНК нагружается аминокислотой (рис. 5-10), и другой, распознающий неправильную аминокислоту, присоединившуюся к тРНК, и удаляющий ее путем гидролиза. Подобный процесс коррекции обходится дорого, поскольку работать эффективно он может лишь в том случае, если будет удалять заодно и довольно значительное число правильно присоединившихся аминокислот. Аналогичный дорогостоящий двухэтапный процесс коррекции используется и в репликации ДНК (см. разд. 5.3.3).
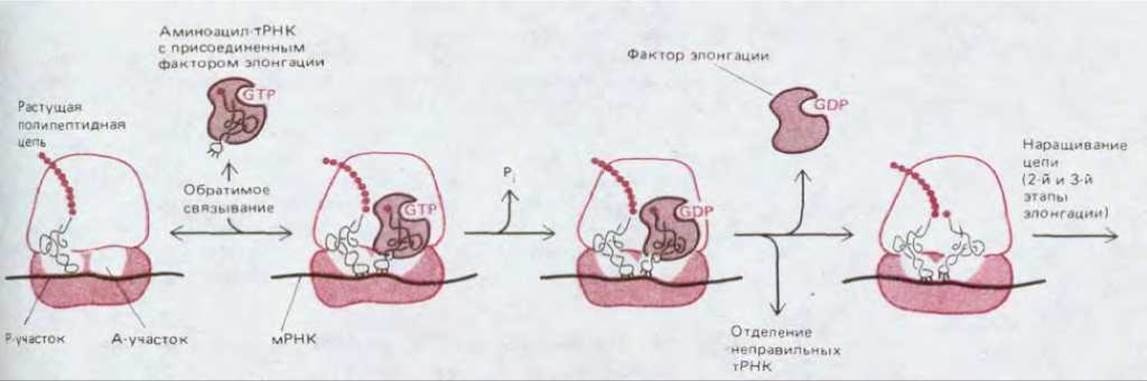
Рис. 5-29. Более подробное изображение первого этапа фазы элонгации белкового синтеза, позволяющее видеть, как отбирается на рибосоме правильная тРНК. На начальной стадии связывания молекула аминоацил-тРНК с присоединенным фактором элонгации временно спаривается с кодоном в А-участке. Спаривание служит сигналом для гидролиза GTP, вызываемого фактором элонгации, благодаря этому фактор элонгации получает возможность отделиться от молекулы аминоацил-тРНК, которая теперь стоит точно на своем месте в А-участке и может сыграть предназначенную ей роль в элонгации полипептидной цепи (см. рис. 5-20). Только тРНК с правильным антикодоном остаются спаренными с мРНК достаточно долго для того, чтобы участвовать в элонгации цепи. Фактор элонгации (имеющий белковую природу) у прокариот обозначается EF-Tu (ФЭ-Tu), а у эукариот-EF-1 (ФЭ-1).
Точность спаривания кодона с антикодоном обеспечивается более тонким механизмом «кинетической коррекции». Ранее мы ограничивались лишь упрощенным описанием этого спаривания. В действительности, после того как молекулы тРНК присоединят соответствующую аминокислоту, они образуют комплекс с особым белком, так называемым фактором элонгации (ФЭ, EF), который прочно связывается с аминоацильным концом молекулы тРНК и с молекулой GTP. Именно этот комплекс, а не свободная молекула тРНК спаривается с надлежащим кодоном в молекуле мРНК. Связанный таким образом фактор элонгации обеспечивает возможность правильного спаривания антикодона с кодоном, но при этом препятствует включению данной аминокислоты в растущую полипептидную цепь. Однако начальное узнавание кодона служит для фактора элонгации сигналом к гидролизу связанного с ним GTP (до GDP и неорганического фосфата), после чего сам фактор отделяется от рибосомы без своей тРНК, так что синтез белка может продолжиться. Из рис. 5-29 видно, что благодаря фактору элонгации возникает короткий разрыв во времени между спариванием антикодона с кодовом и элонгацией полипептидной цепи, что позволяет присоединившейся молекуле тРНК отделиться от рибосомы. Неправильная молекула тРНК образует в паре кодон-антикодон меньше водородных связей, чем правильная; поэтому она слабее удерживается на рибосоме и, значит, за данный промежуток времени имеет больше шансов отделиться. Поскольку из-за вызванной фактором элонгации задержки большая часть неправильно присоединившихся молекул тРНК удаляется с рибосомы и не используется в белковом синтезе, ясно, что этот фактор снижает долю неправильных аминокислот в синтезируемом белке.
5.1.15. Многие ингибиторы белкового синтеза прокариот-эффективные антибиотики [14]
Многие из наиболее эффективных антибиотиков, применяемых в современной медицине, действуют, подавляя в бактериальных клетках синтез белка. Ряд таких лекарственных препаратов создан с учетом структурных и функциональных различий между рибосомами прокариот и эукариот, т. е. с расчетом на то, что они будут действовать преимущественно на прокариотические рибосомы. Именно в силу избирательности их действия эти соединения можно назначать человеку в относительно высоких концентрациях, не опасаясь токсических эффектов. Разные антибиотики связываются с различными участками бактериальных рибосом и поэтому часто ингибируют разные этапы процесса синтеза. В табл. 5-1 перечислены наиболее известные соединения этой группы и указано их специфическое действие. В таблицу включены также и некоторые другие часто применяемые ингибиторы белкового синтеза, в том числе и такие, которые действуют на эукариотические клетки; эти последние, разумеется, в качестве антибиотиков применять нельзя.
Таблица 5-1. Ингибиторы синтеза белка или РНК
|
Ингибитор |
Специфическим эффект |
|
Эффективен только для прокариот 1 |
|
|
Тетрациклин |
Блокирует связывание аминоацил-тРНК с А-участком рибосомы |
|
Стрептомицин |
Препятствует переходу от инициаторного комплекса к рибосоме, осуществляющей удлинение цепи; нарушает декодирование |
|
Хлорамфеникол |
Блокирует пептидил-трансферазную реакцию на рибосомах (2-й этап на рис. 5-20) |
|
Эритромицин |
Блокирует реакцию транслокации на рибосомах (3-й этап на рис. 5-20) |
|
Рифамицин |
Блокирует инициацию цепей РНК, присоединяясь к РНК-полимеразе (препятствует синтезу РНК) |
|
Эффективен и для прокариот, и для эукариот Пуромицин Актиномицин D |
Присоединяясь к растущему концу синтезируемой полипетидной цепи, вызывает ее преждевременное отделение от рибосомы Связывается с ДНК и блокирует перемещение РНК- полимеразы (препятствует синтезу РНК) |
|
Эффективен только для эукариот |
|
|
Циклогексимид |
Блокирует реакцию транслокации на рибосомах (3-й этап на рис. 5-20) |
|
Анизомицин |
Блокирует пептидил-трансферазную реакцию на рибосомах (2-й этап на рис. 5-20) 1 |
|
а-Аманитин |
Блокирует синтез мРНК вследствие преимущественного связывания с РНК-полимеразой II |
1) Рибосомы в митохондриях (и хлоропластах) эукариот по своей чувствительности к ингибиторам часто близки к рибосомам прокариот.
Многие из соединений, перечисленных в табл. 5-1, блокируют совершенно определенные этапы передачи генетической информации от ДНК к белку, поэтому они находят широкое применение при изучении различных клеточных механизмов. Среди лекарственных препаратов, используемых для этой же цели, следует назвать хлорамфеникол, циклогексимид и пуромицин. Все они ингибируют белковый синтез специфическим образом. Хлорамфеникол, например, в эукариотических клетках ингибирует белковый синтез только на рибосомах в митохондриях (и в хлоропластах растений), что, возможно, отражает происхождение этих органелл от прокариот (см. разд. 7.5.16). Циклогексимид, наоборот, действует только на рибосомы в цитозоле. Различная чувствительность белкового синтеза к этим двум препаратам позволяет весьма надежно определять, в каком именно клеточном компартменте идет трансляция с образованием того или иного белка. Особенно интересен пуромицин, поскольку он по своей структуре весьма напоминает концевой аминоациладенилат в составе аминоацил-тРНК и потому реагирует на рибосоме с С-концом растущей пептидил-тРНК, как это должно было бы произойти с соответствующей аминокислотой. Дальнейшая элонгация, однако, в результате этого становится невозможной - происходит преждевременный обрыв цепи и пептидилпуромицин покидает рибосому. Естественно поэтому, что пуромицин ингибирует все виды белкового синтеза.
5.1.16. Эволюция белкового синтеза [15]
Молекулярные процессы, лежащие в основе синтеза белка, необъяснимо сложны. Хотя мы теперь в состоянии многие из них описать, смысл их остается для нас непонятным в отличие, например, от процессов транскрипции, репарации и репликации ДНК. Как мы уже знаем, синтез белка у современных организмов происходит на очень крупном рибонуклеопротеиновом комплексе - на рибосоме, состоящей из различных белков, группирующихся вокруг сердцевины из молекул рРНК. Зачем вообще нужны молекулы рРНК и как случилось, что они приобрели главенствующую роль в структуре и функции рибосом? Ответ на этот вопрос, несомненно, поможет нам лучше понять и сам белковый синтез. Ранее, до того как в начале 60-х годов была открыта мРНК, предполагалось, что значительные количества РНК в рибосомах несут информативную функцию - осуществляют передачу генетической информации от ДНК к белкам. Теперь, однако, мы знаем, что во всех рибосомах клетки имеется один и тот же набор молекул рРНК и что эти молекулы такой информативной роли не играют. В отношении бактериальных рибосом удалось выяснить, что отдельные небольшие участки рРНК выполняют каталитические функции в белковом синтезе; установлено, например, что рРНК малой субъединицы прокариотических рибосом при спаривании с инициаторной последовательностью в молекуле мРНК образует короткую спираль, что помогает поместить соседний старт-кодон AUG в Р-участок. Аналогичные взаимодействия на основе спаривания возможны также между молекулами тРНК и рРНК, хотя убедительно продемонстрировать это пока не удалось.
В белковом синтезе важную роль играет также большое число различных белков, связанных с рРНК рибосом. Чрезвычайная сложность процесса, в который вовлечено столько компонентов, заставила многих биологов разувериться в том, что когда-нибудь будут поняты пути его эволюции. Однако недавнее открытие - обнаружение молекул РНК, способных действовать как ферменты (см. разд. 3.2. 11), - позволило по-новому взглянуть на данный предмет. Как уже отмечалось в гл. 1, в первых биологических реакциях катализаторами могли служить не белковые молекулы, а молекулы РНК. Возможно, что на ранних этапах. в первых клетках, молекулы тРНК сами, без участия аминоацилт РНК-синтетаз, формировали каталитические поверхности, которые позволяли им связывать и активировать аминокислоты. Не исключено, что в то время роль целой «рибосомы» выполняли молекулы рРНК, свертывавшиеся таким образом, что возникала сложная система поверхностей, обеспечивающая и направленное спаривание тРНК с кодонами мРНК, и катализ полимеризации связанных с тРНК аминокислот (см. рис. 1-7). В ходе эволюции к этому аппарату могли присоединяться отдельные белки, каждый из которых делал рассматриваемый процесс более надежным и эффективным. Высокая доля РНК в современных рибосомах, вероятно, сохранилась от тех очень ранних этапов эволюции, когда белки еще не занимали главного места в биологическом катализе.
Заключение
Для того чтобы мог начаться синтез какого-нибудь определенного белка, должна сначала образоваться соответствующая мРНК (путем транскрипции ДНК). К этой мРНК, к ее старт-кодону, присоединяется малая рибосомная субъединица; узнает старт-кодон особая инициаторная тРНК. Присоединение большой субъединицы завершает сборку рибосомы, Далее следует фаза элонгации белкового синтеза. Во время этой фазы разные аминоацил-тРНК, нагруженные каждая своей аминокислотой, поочередно связываются с соответствующим кодоном на мРНК путем спаривания его оснований с основаниями антикодона тРНК. Каждая очередная аминокислота присоединяется к карбоксильному концу растущего полипептида в результате циклического процесса, состоящего из трех последовательных этапов: связывания аминоацил-тРНК, образования пептидной связи и транслокации рибосомы. Рибосома перемещается вдоль молекулы мРНК в направлении 5' → 3' от одного кодона к другому до тех пор, пока не будет достигнут какой-либо из трех стоп-кодонов. К этому стоп-кодону присоединяется затем фактор освобождения, вызывающий отделение завершенного полипептида от рибосомы.
Рибосомам прокариот и эукариот свойственна высокая степень гомологии, несмотря на довольно существенные различия в числе и в размерах обоих видов компонентов - рРНК и белков. Преобладающая роль рРНК в структуре и функции рибосом, возможно, отражает происхождение белкового синтеза, на ранних этапах эволюционировавшего в среде, где катализ осуществляется с помощью РНК.