Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Основные генетические механизмы
Механизмы репарации ДНК
В то время как шансы на долговременное существование вида могут возрастать вследствие изменений в его генетической конституции, выживание в каждый конкретный момент требует безусловного сохранения генетической информации. Для поддержания такого постоянства генетического материала требуется не только чрезвычайно точный механизм копирования нуклеотидных последовательностей ДНК в каждом новом клеточном поколении, но и механизм исправления повреждений, спонтанно возникающих в ДНК. Большая часть таких повреждений носит временный характер, поскольку они действительно устраняются с помощью особого механизма, который носит название репарации ДНК. Если этот обеспечивающий клеточное постоянство механизм не срабатывает, изменение закрепляется. Подобное изменение называют мутацией. Он может оказаться гибельным для организма, если затронет какую-нибудь жизненно важную последовательность ДНК.
Прежде чем говорить о механизмах репарации ДНК, коснемся вкратце вопроса о том, как воспроизводятся нуклеотидные последовательности ДНК из поколения в поколение.
5.2.1. Высокая надежность сохранения нуклеотидных последовательностей ДНК [17]
Частоту изменений в нуклеотидных последовательностях ДНК (частота возникновения мутаций или скорость мутирования) удается определять только косвенным путем. Один из способов состоит в сравнении аминокислотных последовательностей одного и того же белка у нескольких биологических видов. Долю аминокислот, которые окажутся при этом различными, сопоставляют затем с числом лет, прошедших с того момента, как два данных вида дивергировали в процессе эволюции от общего предка (этот срок оценивают на основе данных палеонтологической летописи). Исходя из этого можно вычислить среднее число лет, необходимое для того, чтобы какое-либо стойкое изменение затронуло одну из аминокислот данного белка. Поскольку каждое такое изменение отражает, как правило, одиночное изменение в нуклеотидной последовательности гена, кодирующего этот белок, мы тем самым узнаем и среднее число лет, требующееся для возникновения в данном гене одной стабильной мутации.
Такого рода определения дают нам всегда сильно заниженные оценки скорости мутирования, так как большая часть мутаций нарушает функцию данного белка и исчезает из популяции под давлением отбора. Есть, однако, среди изученных белков одно семейство, для которого это возражение почти не имеет силы. Это так называемые фибринопептиды - фрагменты из 20 аминокислотных остатков, отщепляемые от белка фибриногена, когда он при свертывании крови, активируясь, превращается в фибрин. Фибринопептиды не выполняют никакой прямой функции, а потому они толерантны почти ко всем возможным аминокислотным заменам. Анализ фибринопептидов показывает, что белок среднего размера, состоящий из 400 аминокислот, изменяется случайным образом в результате одной аминокислотной замены приблизительно каждые 200000 лет. Позже с разработкой методов определения нуклеотидных последовательностей ДНК (см. разд. 4,6.6), появилась возможность выявить степень сходства нуклеотидных последовательностей ДНК в гомологичных некодирующих участках генома у разных видов млекопитающих. Полученные таким путем оценки частоты мутаций прекрасно согласуются с теми, какие дает анализ фибронопептидов.
5.2.2. Скорость мутирования в растущих клетках совпадает с оценками, полученными на основе эволюционных исследований [18]
Скорость мутирования можно оценить прямым способом, подсчитывая количество генетических изменений, спонтанно возникающих в большой популяции клеток за относительно короткий промежуток времени. Для этого определяют частоту возникновения новых мутантов в очень больших популяциях животных (например, у плодовой мушки или в колониях мышей), либо проводят скрининг с целью выявить изменения в активности определенных ферментов у клеток, растущих в культуре. Хотя такие оценки носят лишь приближенный характер, они в обоих случаях согласуются с представлением о том, что при репликации на 109 пар оснований (в среднем) происходит одна ошибка, т. е. одна замена пары оснований. Следовательно, для того чтобы в гене, кодирующем средний по размерам белок и насчитывающем примерно 103 кодирующих пар оснований, могла возникнуть мутация, требуется около 106 клеточных поколений. Эта величина достаточно удовлетворительно согласуется с оценкой, полученной на основе эволюционных исследований, согласно которой мутация в среднем гене зародышевой линии возникает один раз каждые 200000 лет.
5-16
5.2.3. Большинство мутаций, изменяющих белки, вредны и элиминируются естественным отбором [17]
Если число различий в аминокислотном составе одного и того же белка у двух разных биологических видов представить как функцию времени, прошедшего с момента дивергенции этих видов, то мы получим прямую линию. Иными словами, чем длиннее период, прошедший с момента дивергенции, тем больше число таких различий. Для удобства наклон прямой может быть охарактеризован через единицу эволюционного времени для данного белка (среднее время, необходимое для того, чтобы в последовательности из 100 аминокислот появилась одна аминокислотная замена). Сделав это для разных белков, мы убедимся в том, что каждый из них характеризуется своей особой скоростью эволюции (рис. 5-30).
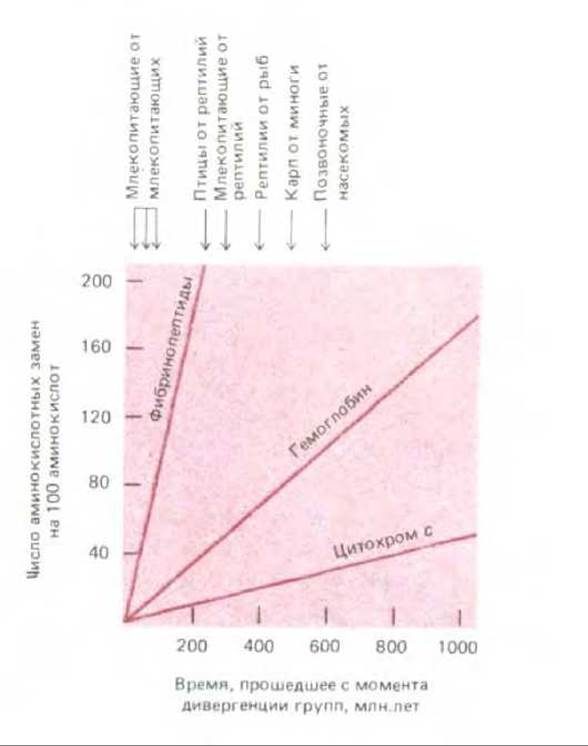
Рис. 5-30. Сравнение частот аминокислотных замен в гемоглобине и цитохроме с с соответствующей величиной для фибринопептидов. Гемоглобин и цитохром с изменяются в процессе эволюции гораздо медленнее, чем фибринопептиды. Определяя частоты замен (табл. 5-2) в расчете на год, важно помнить, что два организма, дивергировавшие от общего предка 100 млн. лет назад, отделены друг от друга 200 млн. лет эволюционного времени.
5.2.5. Низкие частоты мутаций означают, что родственные организмы построены практически из одних и тех же белков [17]
Человек как род, отличный от крупных человекообразных обезьян, возник всего несколько миллионов лет назад. В каждом гене, следовательно, могло произойти за это время лишь сравнительно немного нуклеотидных замен, причем большинство из них естественный отбор должен был элиминировать. Сравнение человека и обезьян показывает, например, что их цитохромы с различаются лишь по 1% аминокислотных остатков, а их гемоглобины - приблизительно по 4%. Значительная часть нашего генетического наследия сформировалась, несомненно, задолго до появления Homo sapiens, в процессе эволюции млекопитающих (начавшейся приблизительно 3 ∙ 108 лет назад) и даже ранее.
|
Белок |
Единица эволюционного времени 1), |
|
млн. лет |
|
|
Фибринопептид |
0,7 |
|
Гемоглобин |
5 |
|
Цитохром с |
21 |
|
Гистон Н4 |
500 |
1) Единица эволюционного времени - среднее время, необходимое для того, чтобы в данном белке на каждые 100 содержащихся в нем аминокислот могла появиться одна приемлемая аминокислотная замена.
Неудивительно поэтому, что у таких филогенетически далеких млекопитающих, как кит и человек, белки очень сходны. Эволюционный процесс, породивший резкие морфологические различия между млекопитающими, «добился» этих различий при поразительно малых изменениях в том материале, из которого мы все построены. Предполагается, что эти морфологические различия в значительной мере определяются неодинаковым временным и пространственным характером экспрессии генов во время эмбрионального развития. В гл. 10 мы обсудим, как подобные изменения в экспрессии генов могли возникнуть (см. разд. 10.5.8).
5-13
5-17
5.2.6. Без коррекции спонтанные повреждения в ДНК быстро изменили бы ее нуклеотидные последовательности [20]
Физик Эрвин Шрёдингер в 1945 г. высказал мнение, что ген независимо от его химической природы (а она в то время еще не была известна) должен быть крайне мал - не более нескольких атомов. В противном случае, полагал Шрёдингер, огромное число генов, необходимое, как считалось, каждому организму, не могло бы уместиться в клеточном ядре. Было ясно, однако, что при столь малых размерах ген должен быть подвержен значительным изменениям вследствие спонтанных реакций, обусловленных беспорядочными тепловыми соударениями с окружающими молекулами. Возникала, таким образом, серьезная дилемма, поскольку генетические данные свидетельствуют о том, что вещество генов весьма стабильно и спонтанные изменения (мутации) происходят в нем чрезвычайно редко.
Эта шрёдингеровская дилемма вполне реальна. ДНК действительно претерпевает значительные изменения, связанные с тепловыми флуктуациями. Мы знаем, например, что ДНК каждой клетки человеческого организма теряет за сутки около 5000 пуриновых оснований (остатков аденина и гуанина) вследствие термального разрыва М-гликозидных связей между пурином и дезоксирибозой (процесс апуринизации). Аналогичный пример составляют спонтанно происходящие в ДНК реакции дезаминирования цитозина в урацил, частота которых, согласно оценкам, достигает 100 на один геном в сутки (рис. 5-31). Содержащиеся в ДНК основания изменяются также под влиянием реакционноснособных метаболитов, нарушающих их нормальное спаривание, а также под действием ультрафиолетовой радиации Солнца, которая может вызвать образование ковалентной связи между двумя соседними остатками пиримидиновых оснований в ДНК (образование димеров тимина; рис. 5-32). Все перечисленное выше - это лишь небольшая часть тех многочисленных изменений, которые происходят спонтанно в нашей ДНК. Большинство из них должно было бы привести либо к выпадению одной или нескольких пар оснований в дочерней цепи ДНК после цикла репликации, либо к замене пары оснований (например, каждое дезаминирование С → U должно было бы вызвать в конце концов замену пары C-G на пару Т-А, поскольку U ведет себя сходно с Т и образует комплементарную пару с А). Как мы уже знаем, такие изменения, если бы они происходили достаточно часто, имели бы роковые последствия для живых организмов.
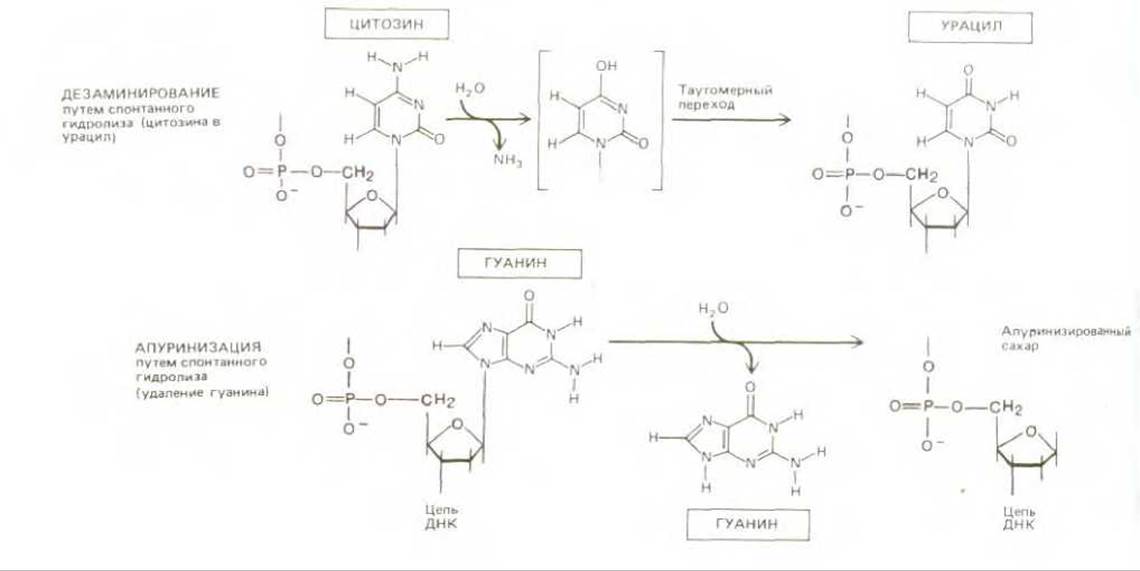
Рис. 5-31. Дезаминирование и апуринизация две часто встречающиеся спонтанные химические реакции, вызывающие в клетках серьезное повреждение ДНК. Здесь приведено лишь по одному примеру реакций этих двух типов.
5-14
5.2.7. Стабильность генов обеспечивается репарацией ДНК [21]
Хотя в ДНК любой клетки человека под влиянием тепловой энергии происходят ежедневно тысячи случайных изменений, за год в каждой клетке накапливается (если только вообще накапливается) лишь очень небольшое число стабильных изменений нуклеотидной последовательности ДНК. Мы знаем теперь, что среди множества случайных замен оснований в ДНК лишь одна на тысячу приводит к возникновению мутации, все же остальные повреждения очень эффективно ликвидируются в процессе репарации ДНК. Все репарационные механизмы основаны на том, что в клетке имеются две копии генетической информации - по одной в каждой из двух цепей молекулы ДНК. Если нуклеотидная последовательность одной из цепей случайно оказывается измененной, информация не утрачивается, поскольку вторая ее копия хранится в нуклеотидной последовательности другой цепи ДНК. Из схемы на рис. 5-33 видно, что основной путь репарации ДНК включает три этапа.
1. Измененный участок поврежденной цепи ДНК распознается и удаляется при помощи специфических ферментов, носящих название ДНК-репарирующих нуклеаз; они осуществляют гидролиз фосфодиэфирных связей между поврежденными нуклеотидами и остальной частью молекулы ДНК, в результате чего в спирали ДНК в этом месте возникает брешь.
2. Другой фермент, ДНК-полимераза, связывается с 3'-концом поврежденной цепи ДНК и заполняет эту брешь путем присоединения одного нуклеотида за другим, копируя информацию, содержащуюся в «хорошей» (матричной) цепи.
3. В заключение фермент, называемый ДНК-лигазой, «сшивает» ДНК и тем самым завершает восстановление интактной молекулы.
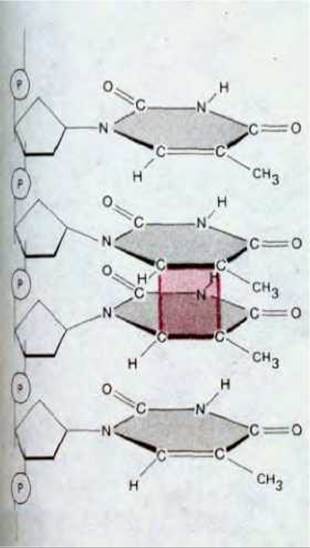
Рис. 5-32. Образование тиминового димера распространенный тип повреждения ДНК под действием ультрафиолетовых лучей (в частности, пол действием солнечного света). Подобный димер способны образовать два любых соседних пиримидиновых основания (С или Т).
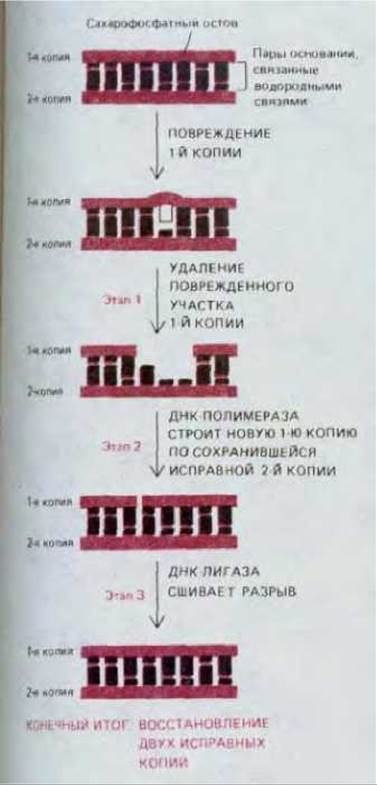
Рис. 5-33. Три этапа репарации ДНК. На первом этапе вырезается поврежденный участок, на втором и третьем этапах происходит восстановление исходной нуклеотидной последовательности ДНК. ДНК-полимераза заполняет брешь, возникшую вследствие удаления поврежденной части цепи (2-й этап), а ДНК-лигаза сшивает разрыв, оставшийся в «исправленной» цепи (3-й этап). Сшивание осуществляется путем восстановления разорванной фосфодиэфирной связи (см. рис. 5-35).
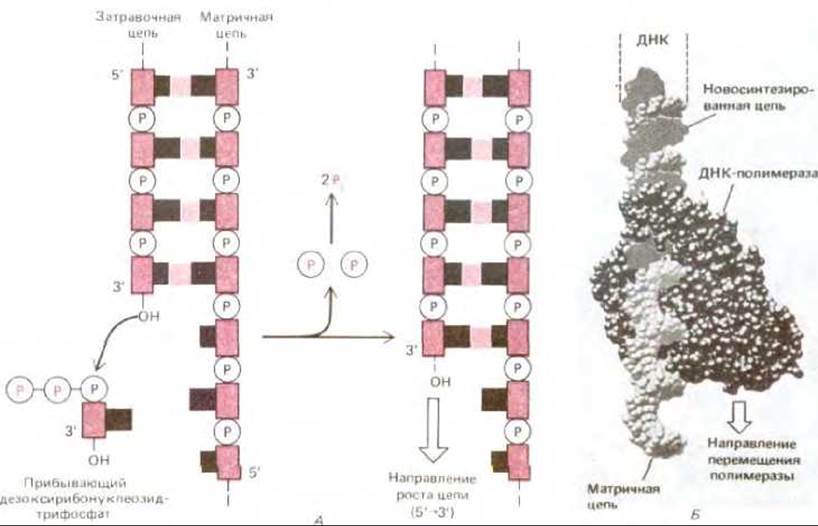
Рис. 5-34. Фермент ДНК-полимераза. А. Реакция, катализируемая ДНК-полимеразой. Этот фермент катализирует поэтапное присоединение дезоксирибонуклеотидов к 3'-концу полинуклеотидной (затравочной) цепи, спаренной с другой (матричной) полинуклеотидной цепью. Таким образом, новая цепь ДНК растет в направлении 5' → 3'. Поскольку каждый прибывающий дезоксирибонуклеозидтрифосфат должен спариться с матричной цепью, для того чтобы его могла узнать ДНК-полимераза, именно матричная цепь определяет, какой из четырех возможных дезоксирибонуклеотидов (А, С, G или Т) присоединится к 3'-концу синтезируемой цепи. Как и в случае РНК-полимеразы, движущей силой реакции служит значительное выгодное изменение свободной энергии (см. рис. 5-2). Б. Структура ДНК-полимеразы Е. coli, определенная методом рентгеноструктурного анализа. ДНК-полимераза изображена здесь в момент участия в синтезе ДНК. (С любезного разрешения Тот Steitz.)
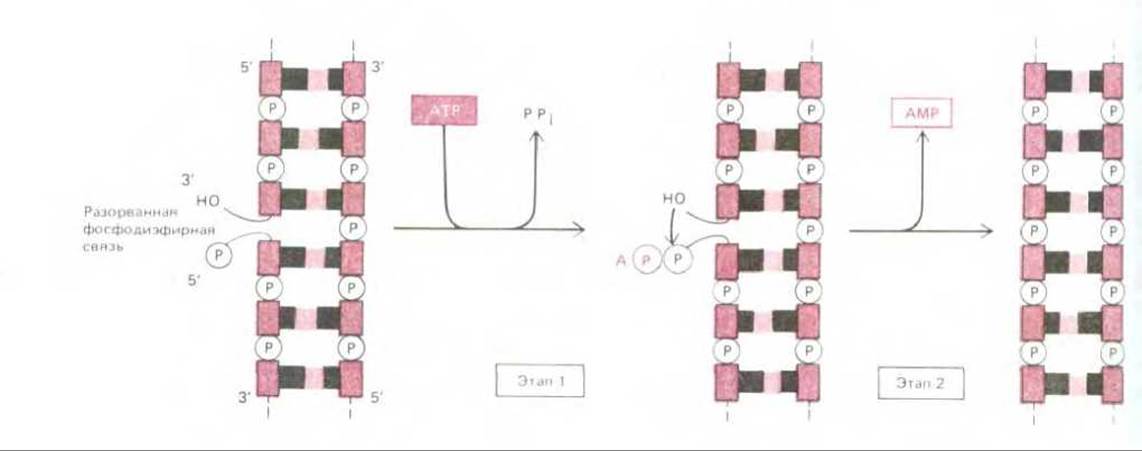
Рис. 5-35. Фермент ДНК-лигаза восстанавливает разорванную фосфодиэфирную связь. Из схемы видно, что ДНК-лигаза использует сначала молекулу АТР, для того чтобы активировать в точке разрыва 5'-конец поврежденной цепи (1-й этап), и лишь после этого образует новую связь (2-й этап). Энергетически невыгодная реакция сшивания разрыва осуществляется, таким образом, благодаря сопряжению с энергетически выгодным процессом гидролиза АТР. У больных синдромом Блума (одно из наследственных заболеваний) обнаружена частичная недостаточность ДНК- лигазы. В связи с этим у них нарушена репарация повреждений ДНК и как следствие повышена частота заболевания раком.
Ферменты ДНК-полимераза и ДНК-лигаза играют важную роль в метаболизме ДНК: оба этих фермента участвуют не только в репарации, но и в репликации ДНК. Катализируемые ими реакции иллюстрируют соответственно рис. 5-34 и 5-35.
5-18
5-19
5.2.8. Различные типы повреждений в ДНК распознаются разными ферментами [22]
Способ, каким в процессе репарации осуществляется удаление поврежденного участка, зависит от типа повреждения. Например, при апуринизации (наиболее часто встречающемся повреждении ДНК) один из остатков дезоксирибозы лишается ранее находившегося при нем основания (см. рис. 5-31). Фермент АП-эндонуклеаза быстро распознает данный остаток дезоксирибозы и разрывает в этом измененном участке цепи фосфодиэфирную связь. После этого поврежденный нуклеотид удаляется и правильная последовательность нуклеотидов восстанавливается при помощи механизма, представленного на рис. 5-33.
Другой, близкий к этому, путь репарации связан с участием особого набора ферментов, называемых ДНК-гликозилазами. Каждый из этих ферментов узнает какой-либо один определенный тип измененных оснований в ДНК и катализирует гидролитическое отщепление такого основания. Существует, как полагают, не менее шести типов ферментов, входящих в эту группу. Среди них имеются ферменты, удаляющие дезаминированный цитозин, дезаминированный аденин, алкилированные основания разных типов, основания с разомкнутым кольцом и основания, в которых двойная углерод-углеродная связь заменена простой. Общий для всех случаев механизм проиллюстрирован на рис. 5-36 конкретным примером. Здесь представлено удаление дезаминированного цитозина. Сначала фермент урацил-ДНК-гликозилаза удаляет измененное основание (урацил). Дезоксирибозу, утратившую бывшее при ней основание, узнает другой фермент-АП-эндонуклеаза. Поскольку это тот самый фермент, который узнает апуринизированные участки ДНК, восстановление правильной последовательности идет далее тем же путем, который мы уже описали для случая апуринизации. В итоге U, возникший вследствие случайного дезаминирования, вновь замещается на С. Важность процесса удаления из ДНК случайно дезаминированных оснований удалось продемонстрировать непосредственно на конкретных примерах. Один из них касается бактериальных штаммов, у которых вследствие мутации отсутствует фермент урацил-ДНК-гликозилаза. Выяснилось, что у таких мутантов частота спонтанных замен C-G на Т-А (в норме низкая) возрастает приблизительно в 20 раз.
В клетках имеется особый путь для удаления почти любого типа повреждения в ДНК, затрагивающего очень большой ее участок. Такие обширные повреждения возникают, например, при ковалентных взаимодействиях между основаниями ДНК и объемистыми углеводородами, в частности бензпиреном, обладающим канцерогенными свойствами. К ним же относятся и различные пиримидиновые димеры (Т-Т, Т-С и С-С), возникающие под действием солнечных лучей (см. рис. 5-32). В подобных случаях крупный мультиферментный комплекс узнает не какое-либо одно специфическое изменение основания, а обширное повреждение двойной спирали ДНК. Фосфодиэфирные связи поврежденной цепи по обе стороны от повреждения разрываются и измененный участок удаляется весь целиком. После этого восстановление нормальной последовательности происходит как обычно.
О роли репарационных процессов свидетельствует тот факт, что клетки затрачивают большую часть своих ресурсов на производство репарационных ферментов. Обширные исследования, проведенные на дрожжах, выявили у них свыше 50 различных генов, кодирующих такие ферменты. Не менее сложны пути репарации ДНК у человека. Выяснилось, что у больных с пигментной ксеродермой нарушен процесс репарации обширных повреждений, в котором, как показывает генетический анализ, участвует не менее 7 различных генных продуктов. У таких больных в клетках накапливаются пиримидиновые димеры, что приводит к тяжелому поражению кожи, включая рак.
5-15
5.2.9. Клетки синтезируют репарирующие ферменты в ответ на повреждение ДНК [23]
В процессе эволюции клетки выработали много различных механизмов, обеспечивающих их выживание в этом мире, полном всевозможных опасностей. Часто какое-нибудь резкое воздействие среды активирует целый набор именно тех генов, продукты которых способны защитить клетки от этого воздействия. Всем клеткам присущ, например, такой механизм, как реакция на тепловой шок; ее можно наблюдать в клетках, подвергшихся действию чрезмерно высоких температур. При этом индуцируется синтез особых «шоковых» белков; часть из них, по- видимому, помогает стабилизировать и репарировать другие клеточные белки, частично денатурированные тепловым шоком.
Во многих клетках существуют также механизмы, дающие им возможность синтезировать ферменты для репарации ДНК, так сказать, в аварийных ситуациях, в ответ на серьезные повреждения ДНК. Среди примеров такого рода лучше всего изучен SOS-ответ (SOS-репарация) у Е. соli. У этой бактерии любое нарушение репликации ДНК, вызванное ее повреждением, ведет к появлению сигнала (таким сигналом служит, по- видимому, избыток одноцепочечной ДНК), усиливающего транскрипцию более чем 15 различных генов, многие из которых кодируют белки, участвующие в репарации ДНК. Сигнал активирует у Е. coli белок (см. разд. 5.4.4), который затем разрушает другой белок - отрицательный регулятор активности генов (репрессор). Действие этого репрессора заключается в подавлении у Е. coli транскрипции всего набора генов, участвующих в SOS-ответе. Изучение бактериальных мутантов с различными нарушениями SOS-репарации показало, что новосинтезированные белки обусловливают два эффекта. Во-первых, их индукция повышает выживаемость клеток: если мутанты, у которых синтез таких ферментов нарушен, подвергнуть действию тех или иных агентов, вызывающих повреждение ДНК (например, ультрафиолетовых лучей), то процент погибших клеток окажется необычно высоким. Во-вторых, некоторые из индуцированных белков вызывают временное повышение частоты мутаций, вследствие чего генетическая изменчивость бактериальной популяции возрастает. Выгода здесь, видимо, заключается в том, что таким путем увеличивается шансы на появление мутантной клетки с повышенной приспособленностью.
Существуют и другие индуцируемые системы репарации ДНК. Известно, например, что одна из них у бактерий активируется присутствием в ДНК метилированных нуклеотидов. Аналогичная система функционирует в клетках дрожжей. Есть сведения, что и некоторые высшие эукариотические клетки адаптируются к повреждениям ДНК аналогичным путем.
5.2.10. Особенности структуры и химические свойства двойной спирали ДНК облегчают ее репарацию
Молекула ДНК имеет структуру, по-видимому, наилучшим образом приспособленную для репарации. Если гипотеза о том, что РНК появилась в процессе эволюции раньше, чем ДНК верна (см. разд. 1.1.7), возникает вопрос, почему присутствующий в РНК урацил (U) был в ДНК заменен на тимин (Т). Очевидно, это можно объяснить тем, что механизм, осуществляющий удаление дезаминированных остатков цитозина (рис. 536), не смог бы функционировать, если бы четвертым нуклеотидом в ДНК был урацил, а не тимин (т. е. не 5-метилурацил). Спонтанное дезаминирование С дает U, и потому фермент, узнающий и удаляющий такие случайно возникшие остатки U, наряду с ними удалял бы и остатки U, которые были бы нормальными компонентами этой ДНК.
Аналогичным образом обстоит дело и в другом случае, а именно в выборе гуанина вместо гипоксантина. Простейший пурин, специфически спаривающийся с С, - это гипоксантин. Но гипоксантин является непосредственным продуктом дезаминирования А (рис. 5-37). Добавив к гипоксантину вторую аминогруппу, эволюция создала гуанин, который не может образоваться из А в результате его спонтанного дезаминирования. Таким образом, любое возможное дезаминирование в ДНК ведет к появлению необычного основания, которое именно в силу своей необычности может быть сразу же распознано и удалено специальной ДНК-гликозилазой (рис. 5-37).
Итак, сама химическая природа оснований гарантирует, что дезаминирование не останется незамеченным. Однако точная репарация (а вместе с тем и радикальное решение шрёдингеровской дилеммы) возможна благодаря существованию двух копий генетической информации, каждая из которых представлена одной из двух цепей двойной спирали ДНК. Лишь в случае крайне маловероятного события, а именно одновременного повреждения обоих членов одной и той же пары оснований, в клетке не окажется ни одной правильной копии, которая могла бы служить матрицей для репарации ДНК.
Генетическая информация может также храниться в одноцепочечной ДНК или РНК, и некоторые очень мелкие вирусы обладают одноцепочечными геномами, содержащими лишь несколько тысяч нуклеотидов. Описанные выше механизмы не в состоянии осуществлять репарацию таких нуклеиновых кислот, и потому частота мутаций у этих вирусов весьма велика. Лишь организмы с совсем крошечными геномами могут позволить себе хранить генетическую информацию не в двойной спирали ДНК, а в иных структурах.
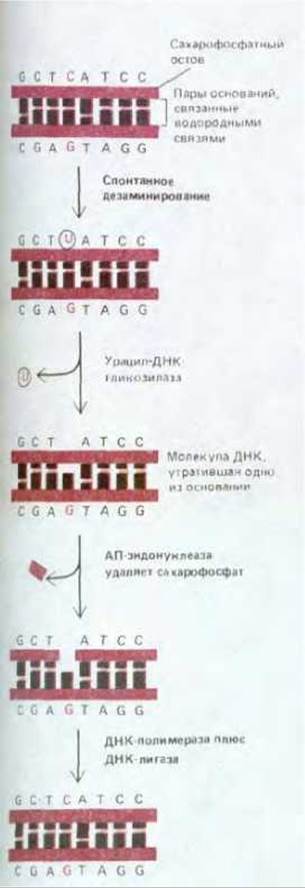
Рис. 5-36. Путь репарации ДНК с участием урацил-ДНК-гликозилазы, восстанавливающий в цепи ДНК цитозин после его случайного дезаминирования. После действия ДНК-гликозилазы сахарофосфат, утративший бывшее при нем основание, удаляется из цепи АП-эндонуклеазой, тем же ферментом, который участвует и в репарации апуринизированных участков. Далее следуют этапы, показанные на рис. 5-33. В названии «АП-эндонуклеаза» отражен тот факт, что данный фермент распознает в спирали ДНК любой участок, содержащий остаток дезоксирибозы, утративший бывшее при нем основание. Утраченное основание может быть либо пурином (апуринизированные участки), либо пиримидином (апиримидинизированные участки).
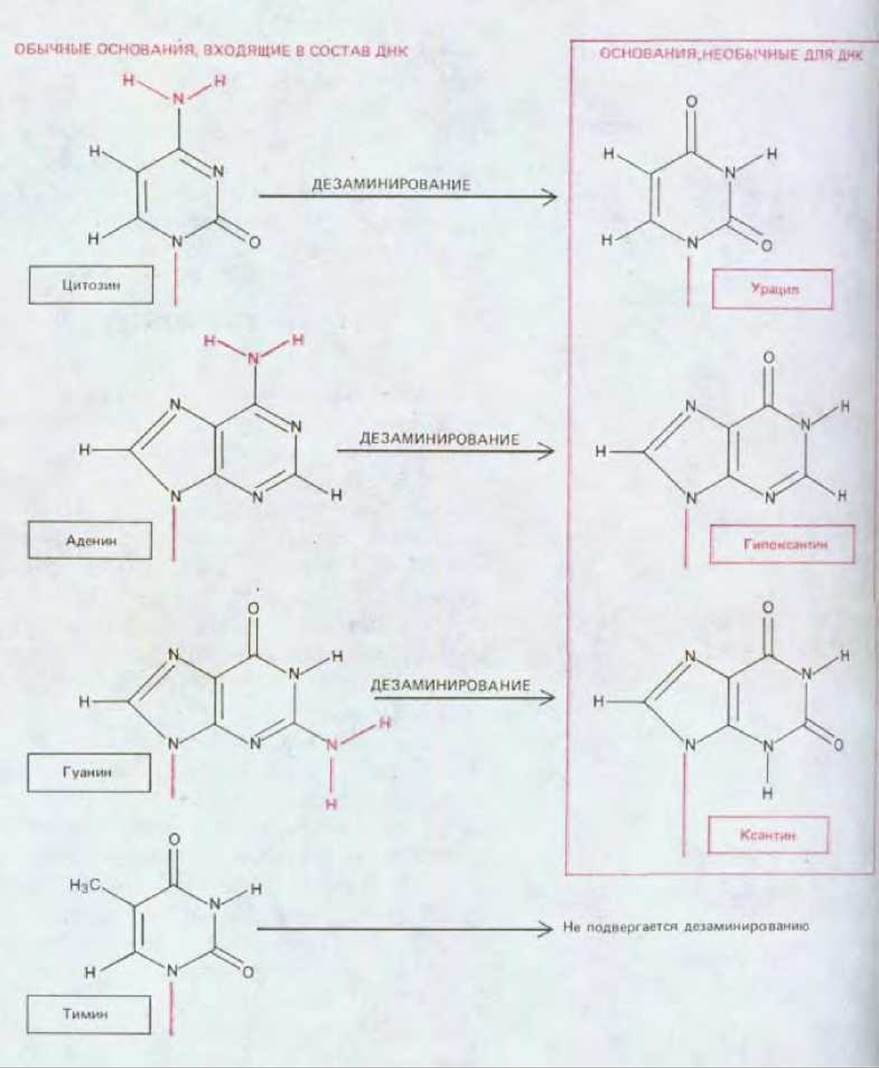
Рис. 5-37. Продукты спонтанного дезаминирования различных оснований ДНК. Все эти продукты дезаминирования необычны в составе ДНК и распознаются именно по этой причине.
Заключение
Судить о надежности сохранения нуклеотидных последовательностей ДНК у высших эукариот можно, исходя из скорости изменения аминокислотных последовательностей второстепенных белков и нуклеотидных последовательностей ДНК на протяжении эволюционного времени. Эта надежность столь велика, что за год в геноме млекопитающего, насчитывающем 3 ∙ 109 пар оснований, в среднем происходит всего лишь 10-20 замен оснований, затрагивающих клетки зародышевой линии. В то же время в геноме такого размера из-за неизбежных процессов химического распада ежедневно повреждаются тысячи нуклеотидов ДНК. Генетическая информация может надежно храниться в нуклеотидных последовательностях ДНК лишь потому, что широкий набор различных репарирующих ферментов осуществляет непрерывный «осмотр» ДНК и удаляет из нее поврежденные нуклеотиды.
Процесс репарации ДНК основан на том, что генетическая информация представлена в этой молекуле двумя копиями - по одной в каждой из двух цепей двойной спирали ДНК. Благодаря этому случайное повреждение в одной из цепей может быть удалено репарирующим ферментом и данный участок цепи ресинтезирован в своем нормальном виде за счет информации, содержащейся в неповрежденной цепи.