Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Основные генетические механизмы
Механизмы генетической рекомбинации
В двух предыдущих разделах этой главы мы рассмотрели механизмы, благодаря которым нуклеотидные последовательности ДНК передаются в ряду клеточных поколений почти неизменными. Генетическая стабильность крайне важна для выживания, когда речь идет о сравнительно коротких сроках, но для длительного существования вида необходима генетическая изменчивость, которая позволяла бы приспосабливаться к изменяющейся среде. Следовательно, важным свойством ДНК следует считать ее способность к перестройкам, которые могут изменять и комбинацию генов в данном геноме, и их экспрессию (ее время и степень). Перестройки в ДНК представляют собой результат генетической рекомбинации. События, из которых слагается генетическая рекомбинация, могут быть подразделены на два больших класса: общая рекомбинация и сайт-специфическая рекомбинация. В процессе общей рекомбинации генетический обмен происходит между гомологичными нуклеотидными последовательностями ДНК, по большей части между двумя копиями одной и той же хромосомы. Одним из самых известных примеров такого рода служит обмен участками гомологичных хромосом (гомологов) в процессе мейоза. Этот обмен (кроссинговер), происходящий между плотно конъюгированными хромосомами на ранних стадиях развития яйца или сперматозоида (см. разд. 15.2.3), создает возможность для опробования разных вариантов (аллелей) одного и того же гена в новых комбинациях с другими генами и тем самым повышает шансы на выживание в изменяющейся среде (по крайней мере для некоторых членов скрещивающейся популяции (см. разд. 15.2.2). Мейоз свойствен только эукариотам, но преимущества подобного комбинирования генов настолько велики, что и у прокариотических организмов развились в ходе эволюции такие процессы, как скрещивание и перегруппировка генов путем общей генетической рекомбинации. Сайт-специфическая рекомбинация отличается от общей рекомбинации тем, что для ее осуществления не требуется гомологии ДНК. В обмен вступают короткие специфические нуклеотидные последовательности одной и той же или обеих спиралей ДНК, участвующих в этом процессе, распознаваемые особым сайт-специфическим рекомбинационным ферментом. Таким образом, сайт-специфическая рекомбинация изменяет распределение нуклеотидных последовательностей в геноме. Иногда эти изменения приурочены к каким-то этапам и определенным образом организованы, как, например, при исключении интегрированного бактериофага из бактериальной хромосомы. Однако они могут носить и совершенно случайный характер, например при включении в геном подвижных (мобильных) элементов.
Что касается биохимии генетической рекомбинации, то как и в случае репликации ДНК, большую часть того, что мы знаем об этих процесса, удалось выяснить в исследованиях на простых организмах, в частности на Е. coli и ее вирусах.
5-31
5.4.1. Процессы общей рекомбинации направляются взаимодействиями, обусловленными спариванием основами между комплементарными цепями гомологичных спиралей ДНК [36]
Общая рекомбинация включает ряд промежуточных этапов, для понимания которых необходимо затратить определенные усилия. Кроме того механизм обмена между цепями ДНК, по-видимому, несколько различается у разных организмов. Однако детальный генетический анализ скрещивания у бактерий, вирусов и грибов дает основания считать, что в целом результаты общей рекомбинации всегда одинаковы:
1. Две гомологичные двойные спирали ДНК разрываются и разорванные концы одного гомолога соединяются с соответствующими концами другого, так что вновь получаются две целые спирали ДНК но теперь уже каждая из них состоит из частей двух исходных молекул ДНК (рис. 5-55).
2. Точка обмена (т.е. то место, где на рис. 5-55 красная спираль соединяется с черной) может прийтись на любой участок гомологичных нуклеотидных последовательностей хромосом.
3. В точке обмена каждая полинуклеотидная цепь одной из спиралей соединяется путем спаривания оснований с цепью другой спирали, и между двумя разными спиралями ДНК возникает ступенчатое (гетеродуплексное) соединение (рис. 5-56). Такие соединения могут состоять из нескольких тысяч пар оснований. Как именно они возникают, мы объясним позже.
4. В точке обмена не происходит изменения нуклеотидных последовательностей. Точность разрыва и воссоединения настолько велика, что ни один нуклеотид не утрачивается, не добавляется и не превращается в какой-нибудь другой.
Механизм общей рекомбинации таков, что в обмен могут вступать только два участка спирали ДНК, нуклеотидные последовательности которых обладают высокой степенью гомологии. Обеспечивается это наличием гетеродуплексного соединения в точке обмена, поскольку такое соединение может образоваться лишь в том случае, если комплементарные взаимодействия между цепями, принадлежавшими двум исходным спиралям, происходят на достаточно длинном участке. Но как именно возникает это ступенчатое соединение и как две гомологичные спирали ДНК, которые должны спариться, распознают гомологию своих нуклеотидных последовательностей? Как мы увидим, гомологичные участки сначала узнают друг друга непосредственно путем комплементарного спаривания. В дальнейшем образование пар оснований между комплементарными цепями, принадлежащими двум спиралям ДНК, направляет общую рекомбинацию таким образом, что она происходит лишь в пределах достаточно протяженной области гомологии двух нуклеотидных последовательностей ДНК. Однако и при соблюдении этого условия общая рекомбинация нередко ведет к перераспределению нуклеотидных последовательностей ДНК; гетеродуплексное соединение может заключать в себе небольшое число неправильных пар оснований и, что еще более важно, две спирали ДНК, претерпевающие кроссинговер, бывают обычно не вполне одинаковыми по обе стороны от этого соединения.
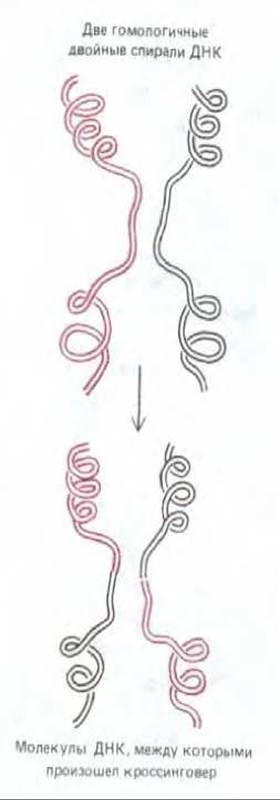
Рис. 5-55. Разрыв и воссоединение двух гомологичных двойных спиралей ДНК в процессе общей рекомбинации. В результате образуются две кроссоверные хромосомы.
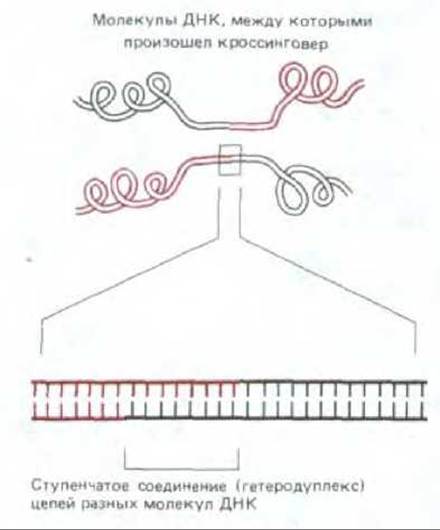
Рис. 5-56. Ступенчатое соединение, связывающее две хромосомы в том месте, где между ними произошел кроссинговер. Длина таких соединений часто достигает нескольких тысяч нуклеотидов.
5-32
5.4.2. Общая рекомбинация инициируется в точке разрыва одной из двух цепей двойной спирали ДНК [36]
Каждая из двух цепей молекулы ДНК закручена вокруг другой цепи. Вследствие этого любые комплементарные взаимодействия между двумя гомологичными двойными спиралями ДНК возможны лишь в том случае, если сначала в какой-либо одной из двух цепей возникнет разрыв, который освободит эту цепь для необходимого раскручивания и повторного закручивания. По той же причине для любого взаимного обмена цепями между двумя двойными спиралями ДНК нужно не меньше двух разрывов, т. е. по одному одноцепочечному разрыву в каждой из двух двойных спиралей. Ясно, наконец, что для образования ступенчатого (гетеродуплексного) соединения, изображенного на рис. 5-56, должны разорваться все четыре цепи, потому что лишь в этом случае каждая из них может воссоединиться с другим партнером. При общей рекомбинации все эти разрывы и воссоединения осуществляются и координируются таким образом, что они могут происходить лишь тогда, когда в двух спиралях ДНК имеются достаточно протяженные участки с гомологичными нуклеотидными последовательностями.
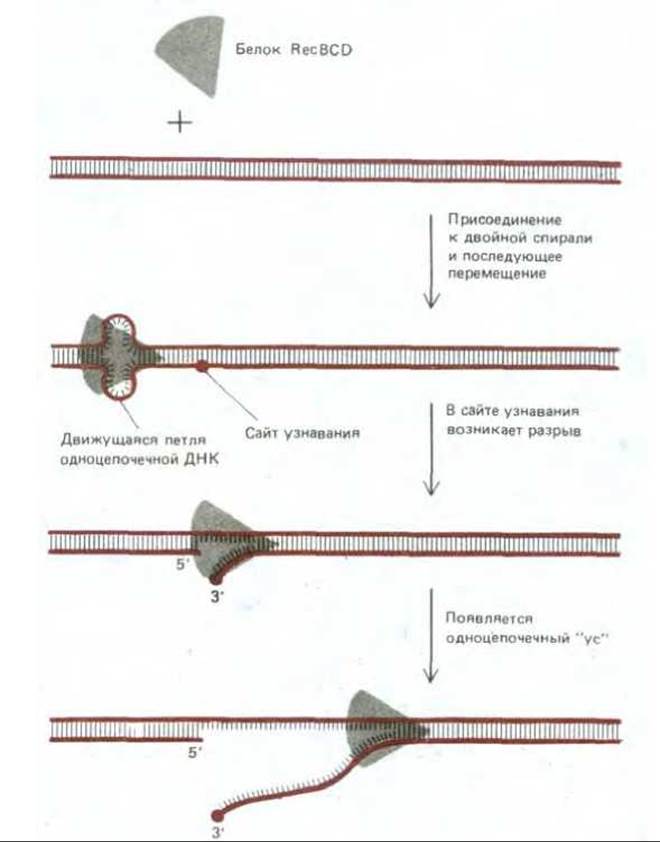
Рис. 5-57. Реакция, катализируемая белком recBCD - ферментом, участвующим в общей рекомбинации у Е. coli. Белок присоединяется к двойной спирали ДНК с одного конца и движется к другому ее концу со скоростью около 300 нуклеотидов в секунду, используя для своего движения энергию, высвобождающуюся при гидролизе связанного АТР. Одновременно с белком движется возникшая под его воздействием петля ДНК.
Когда она достигает на спирали особой восьминуклеотидной последовательности, называемой сайтом узнавания (recognition site; такие последовательности имеются в разных участках хромосомы Е. coli), одна из цепей разрывается, высвобождая небольшой одноцепочечный «ус». Этот «ус» может инициировать генетическую рекомбинацию путем спаривания с гомологичной спиралью (см. рис. 5-58).
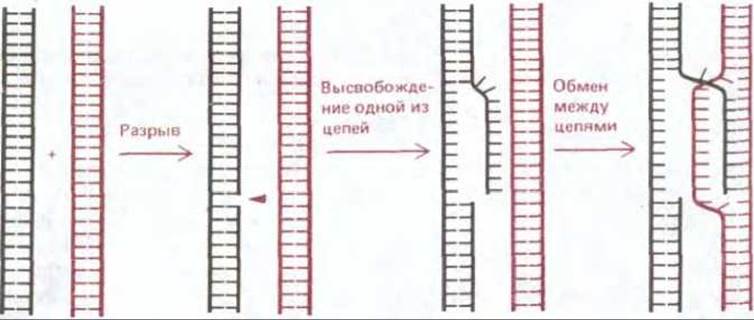
Рис. 5-58. Схема, иллюстрирующая начальный одноцепочечный обмен между двумя гомологичными двойными спиралями ДНК в процессе общей рекомбинации. Разрыв в одной из цепей ДНК высвобождает эту цепь и она внедряется во вторую спираль, образуя здесь короткий спаренный участок. Спариваться таким путем и тем самым инициировать общую рекомбинацию могут только такие две молекулы ДНК, у которых нуклеотидные последовательности комплементарны. Известны ферменты, катализирующие все представленные здесь этапы (см. рис. 5-57 и 5-60).
В экспериментах со многими различными организмами выяснилось, что для инициации событий, из которых слагается общая рекомбинация, достаточно одного разрыва только в одной из двух цепей ДНК. Оказалось, что факторы, вызывающие появление таких одноцепочечных разрывов, например химические агенты или некоторые виды излучения, могут инициировать генетическую рекомбинацию. Более того, удалось показать, что один из специфических белков, необходимых для рекомбинации у Е. соlі, а именно белок recBCD, вызывает в молекулах ДНК одноцепочечные разрывы. Белок recBCD представляет собой ДНК-зависимую АТРазу, которая действует как ДНК-геликаза - перемещается по спирали ДНК и расплетает ее, делая ее цепи доступными. Под влиянием белка recBCD, сочетающего нуклеазную и геликазную активность, на двойной спирали ДНК возникает одноцепочечный участок - «ус» (whisker) (рис. 5-57). Рис. 5-58 дает представление о том, как наличие такого одноцепочечного участка может индуцировать начальное взаимодействие между двумя комплементарными участками двойной спирали ДНК.
5-33
5.4.3. Гибридизация ДНК может служить моделью этапа общей рекомбинации, связанного с комплементарным спариванием [29, 37]
В простейшей форме комплементарные взаимодействия, играющие в общей рекомбинации центральную роль, можно воспроизвести в экспериментах in vitro по ренатурации ДНК, разделенной на отдельные цепи. Такая ренатурация (или гибридизация) происходит, когда в растворе вследствие случайного соударения одиночных цепей ДНК комплементарные нуклеотидные последовательности оказываются одна напротив другой и образуют короткий отрезок двойной спирали. За этим сравнительно медленным этапом нуклеации спирали следует очень быстрый этап «застегивания молнии»: двойная спираль при этом растет до тех пор, пока не образуется максимально возможное число водородных связей (рис. 5-59). Для образования таким путем новой двойной спирали разделившиеся цепи во время отжига должны быть выпрямлены, чтобы их основания были открытыми. По этой причине эксперименты с гибридизацией ДНК in vitro проводят при высокой температуре или в присутствии таких органических растворителей, как формамид; в этих условиях «плавятся» и короткие спирали («шпильки»), возникающие в одиночной цепи ДНК вследствие комплементарных взаимодействий при ее складывании саму на себя. Бактериальные клетки не переносят, разумеется, столь жестких воздействий. В них распрямление спиралей достигается под воздействием специального дестабилизирующего белка, или SSB-белка. У Е. coli SSB-белок необходим и для репликации ДНК, и для общей рекомбинации; кооперативно связываясь с сахарофосфатным остовом всех одноцепочечных участков ДНК, он поддерживает их в растянутой конформации и делает основания доступными. В такой конформации одноцепочечная ДНК способна присоединять путем спаривания оснований либо молекулы нуклеозидтрифосфатов (при репликации ДНК), либо комплементарные участки другой одноцепочечной ДНК (при генетической рекомбинации). Если гибридизацию ДНК проводят in vitro в условиях, напоминающих внутриклеточные, то белок SSB ускоряет нуклеацию спирали ДНК, а значит, и весь процесс отжига более чем в 1000 раз.
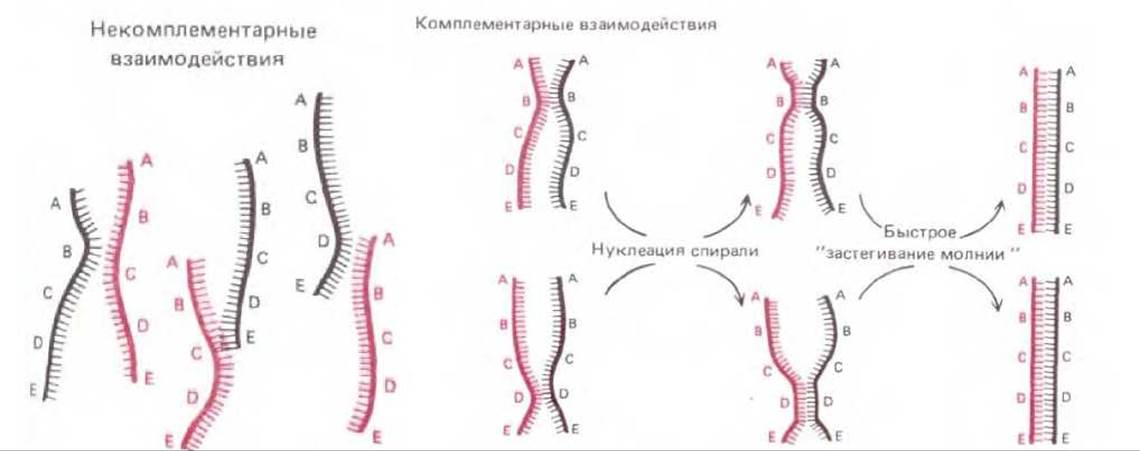
Рис. 5-59. При гибридизации ДНК in vitro двойные спирали ДНК образуются заново из ранее разделившихся цепей. Восстановление спиралей зависит от случайного соударения двух комплементарных целей. Большинство таких соударений безрезультатно (как это видно из левой части рисунка), но некоторые из них приводят к спариванию на коротком участке комплементарных оснований (т. е. к нуклеации спирали). За этим следует быстрое «застегивание молнии» и двойная спираль готова. Посредством такого процесса - методом проб и ошибок каждая цепь ДНК может найти себе комплементарного партнера среди миллионов «неподходящих» цепей. По-видимому, общая рекомбинация всегда инициируется именно таким путем: комплементарные партнеры узнают друг друга методом проб и ошибок.
5-34
5.4.4. Белок rесА у Е. coli дает возможность одиночным цепям ДНК спариваться с гомологичным участком двойной спирали ДНК [38]
Общая генетическая рекомбинация - более сложный процесс, нежели описанная выше простая гибридизация ДНК. При общей рекомбинации в двойную спираль ДНК должна внедриться одиночная цепь ДНК, высвободившаяся из другой двойной спирали (см. рис. 5-58). У Е. coli для этого необходим белок reсА. Этот белок представляет собой продукт гена rесА, который, как выяснилось в 1965 г., играет главную роль в конъюгации хромосом. Биохимики долго вели поиски важного, но неуловимого продукта этого гена, и наконец, в 1976 г. его удалось получить в чистом виде. Он оказался белком с молекулярной массой 38000 дальтон. Подобно дестабилизирующему белку, он прочно связывается в виде крупных кооперативно образованных кластеров с одиночными цепями ДНК, однако есть у recA-белка и некоторые особые свойства. В частности, у него имеются два участка (сайта) для связывания ДНК, благодаря чему он способен удерживать вместе одиночную цепь и двойную спираль. Эти два участка для связывания ДНК позволяют белку reсА катализировать образование синапсиса - между двойной спиралью ДНК и гомологичным участком одноцепочечной ДНК, как это показано на рис. 5-60. Ключевым этапом в этой реакции является определение области гомологии путем начального спаривания между комплементарными нуклеотидными последовательностями (2-й этап на рис. 5-60). Это взаимодействие кладет начало процессу спаривания (см. рис. 5-58) и тем самым инициирует обмен одноцепочечными участками между двумя двойными спиралями ДНК, претерпевающими рекомбинацию. В экспериментах in vitro было показано, что дестабилизирующий белок Е. coli (белок SSB) и белок гесА действуют кооперативно, облегчая реакции спаривания. Быть может, именно по этой причине генетическая рекомбинация в клетках Е. coli резко ослабевает, если хоть один из этих белков оказывается дефектным.
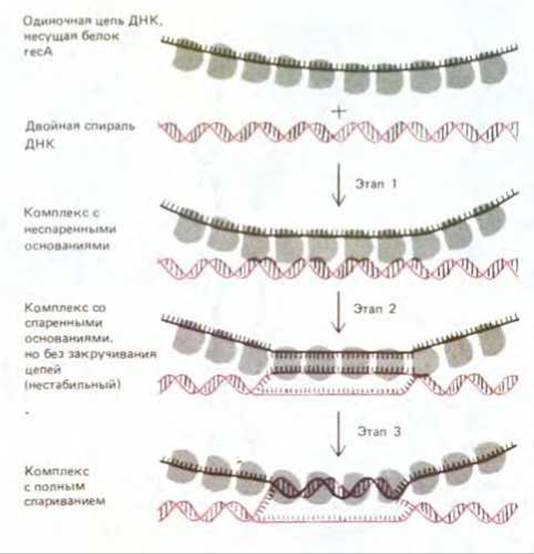
Рис. 5-60. Эксперименты in vitro показывают, что между одноцепочечной ДНК, несущей белок recA, и двойной спиралью может образоваться несколько различных комплексов. Сначала (1-й этап) возникает комплекс с неспаренными основаниями. Далее он, как только будет найден участок с гомологичной нуклеотидной последовательностью (2-й этап), превращается в комплекс со спаренными основаниями, в котором, однако, цепи на закручены. Такой комплекс нестабилен, потому что ДНК находится в нем в необычной форме: две ее цепи либо вообще не закручены в спираль, либо закручены так, что в ней чередуются участки правой (т.е. нормальной) и левой спиралей. На 3-м этапе обмен цепями стабилизируется. Для этого в одной из двух цепей, образующих спираль, должен возникнуть разрыв (здесь не показан), а затем одна цепь должна быть закручена в спираль вокруг другой.
После того как образование синапсиса произошло, короткий участок гетеродуплекса, в котором начали спариваться цепи, принадлежащие двум разным молекулам ДНК, увеличивается за счет направляемой белком миграции ветви, которая также катализируется белком rесА. Миграция ветви может происходить в любой точке там, где две одинаковые по своей последовательности одиночные цепи ДНК пытаются спариться с одной и той же комплементарной цепью; неспаренный участок одной цепи вытесняет спаренный участок другой, смещая таким образом точку ветвления, хотя само число спаренных оснований при этом не изменяется. Спонтанно миграция ветви идет с равной вероятностью в обоих направлениях и потому трудно ожидать, чтобы она могла привести к эффективному завершению процесса рекомбинации (рис. 5-61, А). В присутствии белка rесА эта миграция приобретает направленный характер, так что гетеродуплексный участок быстро увеличивается, достигая нескольких тысяч спаренных нуклеотидов (рис. 6-61, Б).
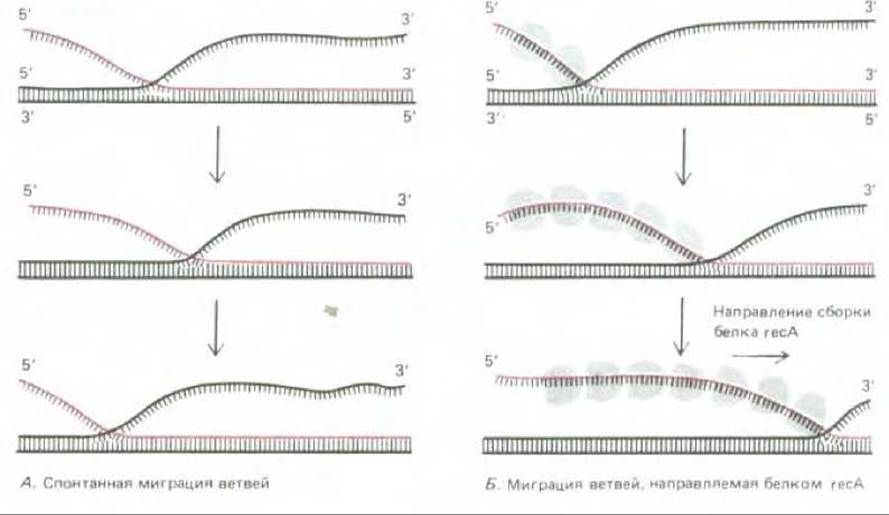
Рис. 5-61. Два типа миграции ветвей, наблюдаемые в экспериментах in vitro. Спонтанно миграция идет в обоих направлениях, подчиняясь закону случая, поэтому реальное перемещение при этом очень невелико. Миграция же с участием белка reсА идет с постоянной скоростью только в одном направлении, энергию для нее, очевидно, поставляет процесс поляризованной сборки белка reсА на одиночной цепи ДНК, идущий в указанном направлении.
Катализ процесса миграции ветви связан и с другой особенностью белка rесА. Помимо наличия двух ДНК-связывающих сайтов этот белок (подобно белку recBCD) имеет и еще один дополнительный участок - для связывания и гидролиза АТР, т.е. он представляет собой ДНК-зависимую АТРазу. Он связывается с ДНК намного прочнее, когда к нему присоединен не ADP, а АТР. Более того, новые несущие молекулы rесА предпочтительно связываются с одним из концов белковой нити, и АТР гидролизуется при этом до ADP. Можно видеть, таким образом, что нити белка rесА, выстраивающиеся на ДНК, в смысле динамики сборки имеют много общего с нитями тубулина или актина, образующими цитоскелет; об этом свидетельствует, в частности, тот факт, что направленное продвижение белка rесА вдоль цепи ДНК способно служить движущей силой для реакции миграции ветви, как это показано на рис. 5-61, Б.
5-35
5.4.5. Общая генетическая рекомбинация включает обычно обмен с перекрещиванием цепей [39]
Трудным и медленным этапом общей генетической рекомбинации является одноцепочечный обмен между двумя двойными спиралями (см. рис. 5-58). После этого начального обмена гомологичные нуклеотидные последовательности двух взаимодействующих спиралей устанавливаются в строгом соответствии одна с другой, и потому расширение области спаривания и «закладка» новых обменов между двумя спиралями происходят быстро. Во время этих событий часто наблюдаются удаление некоторого количества нуклеотидов и локальный ресинтез ДНК, сходные с теми, какие имеют место при репарации ДНК. Однако возможных вариантов здесь много, так что разные организмы нередко используют на этой стадии различающиеся в деталях механизмы. Большая часть механизмов включает в качестве промежуточного этапа обмен с перекрещиванием цепей между двумя спиралями ДНК. Один из самых простых путей образования соответствующей структуры показан на рис. 562.
В структуре с перекрещивающимися цепями (ее называют также структурой Холлидея) две гомологичные спирали ДНК после первоначального этапа спаривания удерживаются вместе благодаря перекрестному обмену двумя цепями из имеющихся четырех - по одной цепи от каждой спирали. Для поддержания этой структуры не требуется, чтобы нарушалось спаривание оснований. Структура обладает некоторыми интересными и важными свойствами. 1. Точка обмена между двумя гомологичными спиралями ДНК, расположенная там, где скрещиваются две их цепи (рис. 5-62), может быстро перемещаться по спирали взад и вперед (миграция двух ветвей). 2. Структура, образующаяся при обмене с перекрещиванием цепей, содержит две перекрещенные и две неперекрещенные цепи. Эта структура может существовать в различных изомерных формах, возникающих в результате вращения составляющих ее элементов относительно друг друга, как показано на рис. 5-63. Изомеризация меняет положение двух пар цепей: две ранее перекрещивавшиеся цепи становятся неперекрещивающимися, и наоборот.
Для того чтобы вновь восстановились две отдельные спирали ДНК и тем самым прекратился процесс спаривания, в каждой из двух перекрещенных цепей должен произойти разрыв. Если он произойдет до того, как структура с перекрещенными цепями подвергнется изомеризации, то две исходные спирали ДНК отделятся друг от друга почти неизменными - у каждой из них будет изменена только одна из цепей и только на коротком отрезке (рис. 5-63, вверху). Если же разрыв двух перекрещенных цепей произойдет после изомеризации, то часть каждой исходной спирали ДНК окажется присоединенной (ступенчатым соединением) к части другой спирали; иными словами, между двумя спиралями произойдет кроссинговер (рис. 5-63, внизу).
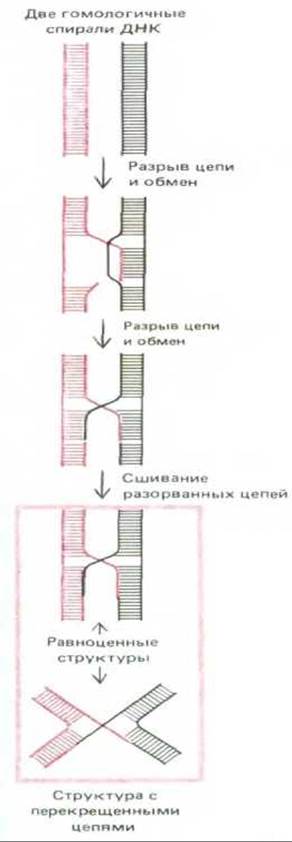
Рис. 5-62. Обмен с перекрещиванием цепей. Много возможных путей ведет от структуры, представленной на рис. 5-58 (одноцепочечный обмен), к структуре с перекрещенными цепями. Здесь показан один из таких путей. Более точное представление о структуре с перекрещенными цепями дает, вероятно, верхнее из - приведенных здесь изображений, однако нижнее позволяет лучше понять реакцию изомеризации, которую иллюстрирует рис. 5-63.
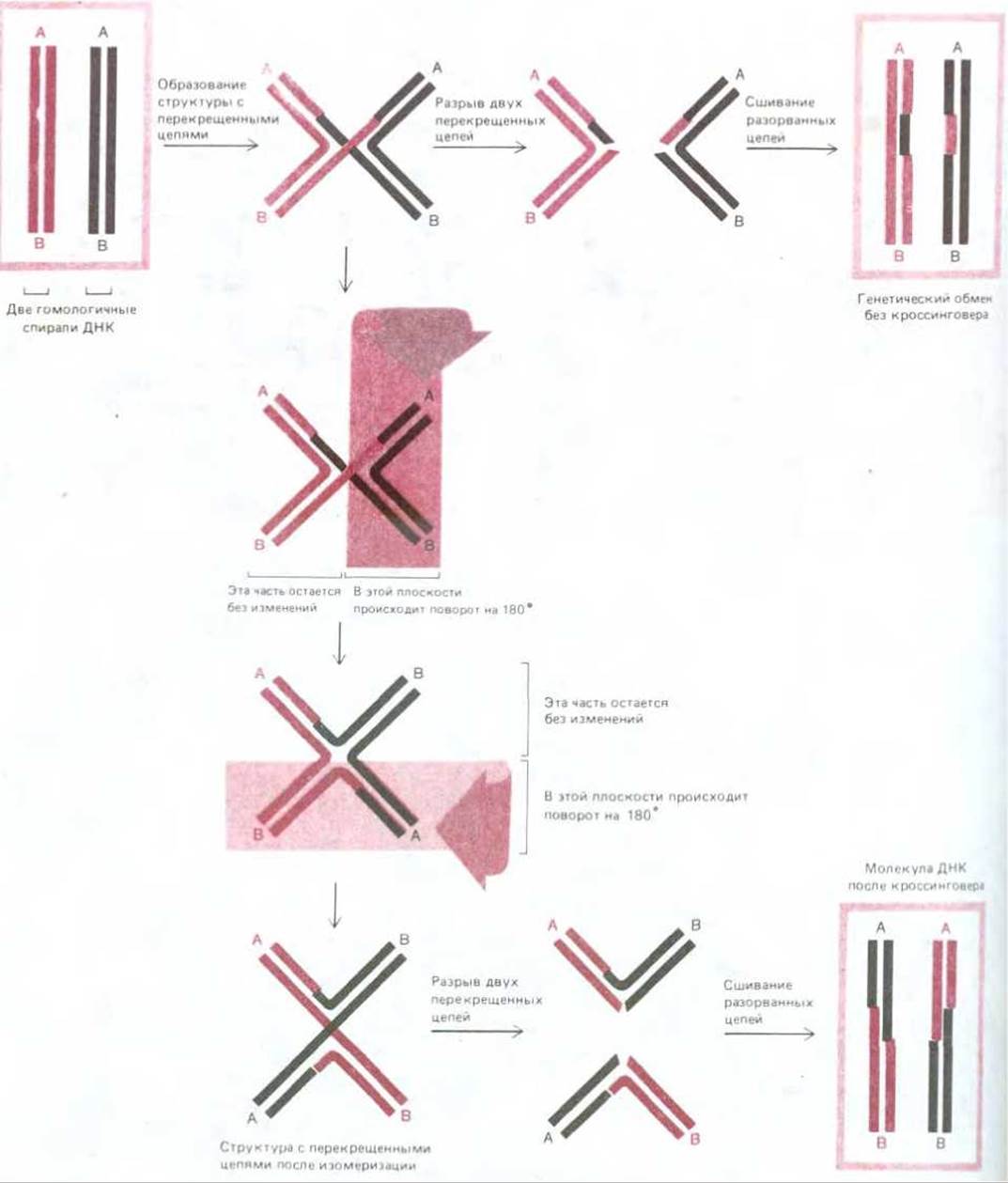
Рис. 5-63. Изомеризация структуры с перекрещенными цепями. При отсутствии изомеризации разрыв двух перекрещенных цепей приводит к тому, что обмен завершается без кроссинговера (вверху). В случае изомеризации разрыв перекрещенных цепей дает две кроссоверные хромосомы (внизу). Полагают поэтому, что изомеризация требуется для разрыва и воссоединения двух гомологичных двойных спиралей ДНК при общей генетической рекомбинации.
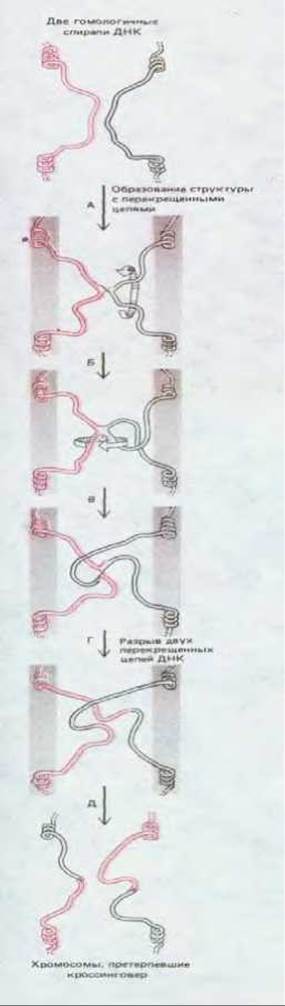
Рис. 5-64. Общая генетическая рекомбинация между двумя гомологичными хромосомами, приводящая к кроссинговеру. Изомеризация структуры с перекрещенными цепями происходит так, как это представлено на рис. 5-63.
Изомеризация, как предполагают, необходима для того, чтобы между двумя хромосомами мог произойти кроссинговер. Рис. 5-64 показывает, как мог бы протекать этот процесс между двумя сестринскими хроматидами в митотических клетках или между несестринскими хроматидами во время мейоза. Хотя изомеризация должна происходить спонтанно с определенной частотой, в клетках она, возможно, ускоряется или регулируется каким-либо иным путем. Какая-то регуляция осуществляется, по всей вероятности, во время мейоза, когда две спаривающиеся двойные спирали ДНК оказываются прижатыми одна к другой в синаптонемальном комплексе.
5.4.6. Общая генетическая рекомбинация в сочетании с ограниченным синтезом ДНК ведет к конверсии генов [40]
Один из фундаментальных законов генетики гласит, что оба родителя вносят равный вклад в генетическую конституцию потомства, поскольку один полный набор генов потомок получает от матери, а другой - от отца. Таким образом, когда из одной диплоидной клетки путем мейоза образуются четыре гаплоидные (разд. 15.2.1), в каждой из этих клеток ровно половину всех генов должны составлять материнские гены, а другую половину - отцовские. Проверить справедливость этого утверждения для сложного организма, в частности организма человека, разумеется, невозможно. К счастью, существуют и такие организмы, например грибы, у которых можно выделить и подвергнуть анализу все четыре дочерние клетки, образовавшиеся в результате мейоза из одной-единственной клетки. Подобный анализ показал, что из строгих генетических правил есть исключения. Иногда мейоз дает три копии материнского варианта (аллеля) данного гена и лишь одну копию отцовского аллеля, что свидетельствует о превращении одной из двух копий отцовского аллеля в копию материнского аллеля. Этот феномен получил название конверсии генов. Часто конверсия генов бывает связана с общей генетической рекомбинацией, и возможно, это явление играет немаловажную роль в эволюции некоторых генов (см. разд. 10.5.2). Полагают, что конверсия генов представляет собой прямое следствие действия двух механизмов - общей генетической рекомбинации и репарации ДНК.
При мейозе в точках кроссинговера между гомологичными материнскими и отцовскими хромосомами возникают гетеродуплексные соединения. Если нуклеотидные последовательности материнской и отцовской ДНК слегка различаются, то образуется несколько неправильных пар. Появившееся в результате этого нарушение двойной спирали ДНК может быть исправлено репаративным аппаратом (см. разд. 5.2.7): он либо удаляет какие-то нуклеотиды из отцовской цепи и заменяет их нуклеотидами, комплементарными материнской цепи, либо выполняет противоположную операцию - репарирует материнскую цепь. Результатом этой репарации неправильного спаривания оказывается конверсия генов. Существуют и некоторые другие механизмы, способные осуществлять конверсию генов, но во всех случаях для этого требуется некое событие, имеющее отношение к общей генетической рекомбинации, которое сведет вместе две копии ДНК с очень близкой нуклеотидной последовательностью. Поскольку при этом образуется лишняя копия одной из двух последовательностей, должен иметь место также и синтез некоторого количества ДНК. Генетический анализ показывает, что конверсия генов происходит обычно лишь на небольшом отрезке ДНК, а во многих случаях изменяется вообще только часть одного какого-нибудь гена.
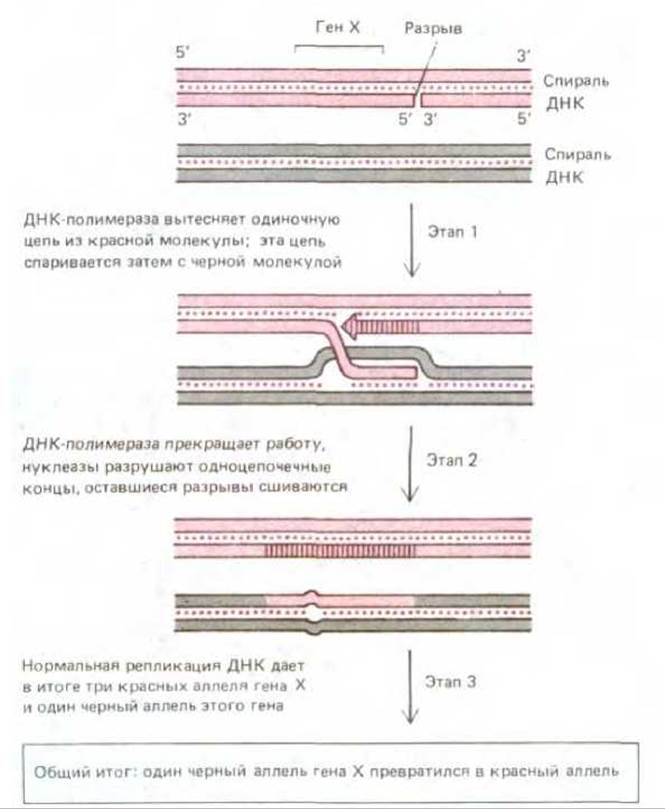
Рис. 5-65. Гипотетический механизм общей рекомбинации, приводящий к конверсии генов. На 1-м этапе ДНК-полимераза начинает синтез дополнительной копии одной из цепей красной спирали, вытесняя прежнюю копию из спирали в виде одиночной цепи. Эта одиночная цепь спаривается с гомологичным участком черной спирали способом, который иллюстрирует рис. 5-60. На 2-м этапе короткий неспаренный участок черной цепи подвергается разрушению, чем и завершается перенос нуклеотидной последовательности из одной спирали в другую. Общий результат произошедших изменений выявляется обычно в следующем клеточном цикле, после того как репликация ДНК приведет к разделению двух «неподходящих» цепей (3-й этап).
При митозе также может происходить конверсия генов, хотя и несколько реже. Вероятно, как и в процессе мейоза, она возникает здесь вследствие репарации гетеродуплексов ДНК, содержащих неправильные пары. Рис. 5-65 иллюстрирует еще один гипотетический механизм конверсии генов, пригодный и для мейоза, и для митоза.
5-36
5.4.7. Ферменты сайт-специфической рекомбинации вводят в геном особые нуклеотидные последовательности ДНК и выводят их из геномов [41]
Сайт-специфическая рекомбинация отличается от общей тем, что в этом случае особый рекомбинационный фермент узнает специфические нуклеотидные последовательности в одной или в двух рекомбинирующих молекулах ДНК. Спаривания оснований здесь не требуется (даже в тех системах, где оно все-таки происходит, в образовании гетеродуплекса участвует не более нескольких пар оснований). Эта форма рекомбинации дает возможность различным типам мобильных последовательностей ДНК перемещаться в пределах хромосом или переходить из одной хромосомы в другую.
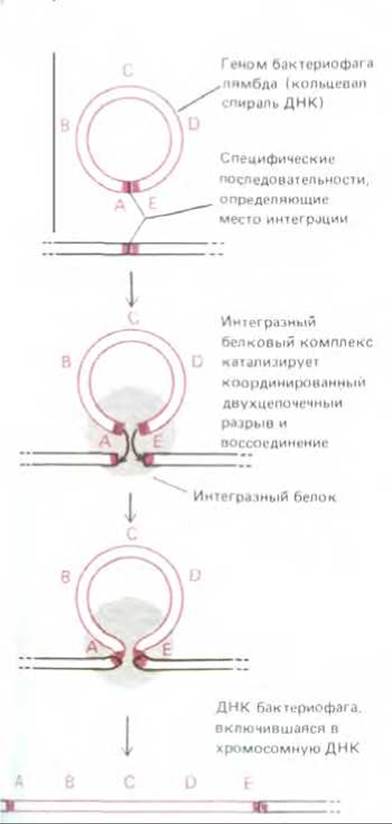
Рис. 5-66. Сайт-специфическая рекомбинация, посредством которой ДНК бактериофага λ внедряется в хромосому клетки-хозяина (Е. coli). Особые участки (сайты), которые узнает интеграза (серый круг), представляют собой определенные нуклеотидные последовательности ДНК. Здесь их символизируют красные прямоугольники (см. также рис. 5-74 и 9-19).
Сайт-специфическая рекомбинация впервые была описана для бактериофага лямбда. Именно с ее помощью происходит включение этого фага в хромосому Е. coli и его исключение из нее. В интегрированном состоянии бактериофаг лямбда реплицируется как составная часть ДНК клетки-хозяина (см. разд. 5.5.6). Когда фаговая частица проникает в клетку, в этой клетке синтезируется фермент лямбда-интеграза, кодируемый одним из фаговых генов. Этот фермент катализирует процесс рекомбинации, начинающийся с того, что многие копии интегразного белка прочно связываются с особыми нуклеотидными последовательностями на кольцевой хромосоме бактериофага. Возникший таким путем ДНК-белковый комплекс присоединяется теперь к другой специфической последовательности ДНК, на этот раз на хромосоме бактерии, тесно сближая таким образом хромосомы бактерии и бактериофага (рис. 5-66). Сведя их вместе, интеграза катализирует необходимые реакции разрыва и сшивания ДНК; при этом короткий участок, на котором нуклеотидные последовательности гомологичны, используется для образования в точке соприкосновения небольшого ступенчатого соединения (рис. 5-67, A). Интеграза обладает ДНК-топоизомеразной активностью, однако отдельные этапы рекомбинации следуют друг за другом столь быстро, что уловить какие-либо промежуточные формы ДНК, которые, по-видимому, все же образуются, не представляется возможным.
Механизм сайт-специфической рекомбинации обеспечивает и исключение фага из бактериальной хромосомы, после чего начинается его быстрое размножение в бактериальной клетке. Реакция исключения катализируется комплексом, в состав которого входит помимо интегразы еще один белок бактериофага, который этот вирус начинает продуцировать лишь в том случае, если клетка-хозяин подвергается стрессу (см. рис. 9-20).
Многие другие ферменты, катализирующие сайт-специфическую рекомбинацию, сходны с лямбда-интегразой в том отношении, что им также необходим короткий участок гомологии в двух отрезках ДНК, подлежащих соединению. Данное требование предполагает довольно высокую избирательность каждого из этих ферментов в отношении рекомбинируемых последовательностей ДНК.
В другом классе ферментов, осуществляющих сайт-специфическую рекомбинацию, эта избирательность выражена не столь сильно. Подобно лямбда-интегразе, каждый из этих ферментов узнает специфическую последовательность ДНК в том мобильном генетическом элементе, рекомбинацию которого он катализирует. Отличает же эти ферменты от лямбда-интегразы то обстоятельство, что им не требуется специфической последовательности-мишени, а также то, что они не образуют ступенчатого (гетеродуплексного) соединения. Вместо этого под их воздействием в ДНК-мишени возникает ступенчатый (зигзагообразный) разрыв и появляются свободные концы цепей ДНК, которые затем ковалентно связываются со специфической последовательностью ДНК мобильного генетического элемента (рис. 5-67, Б). Благодаря этому весь мобильный элемент оказывается включенным в молекулу ДНК-мишени. По обе стороны от включившегося мобильного элемента в рекомбинантной молекуле ДНК остаются короткие одноцепочечные участки, которые достраиваются ДНК-полимеразой, завершающей процесс рекомбинации. Как ясно из рис. 5-61, Б, при этом по обе стороны от включившегося элемента появляются две короткие идентичные нуклеотидные последовательности; по всей вероятности, ферменты сайтспецифической рекомбинации узнают именно эти примыкающие к мобильному элементу идентичные последовательности.
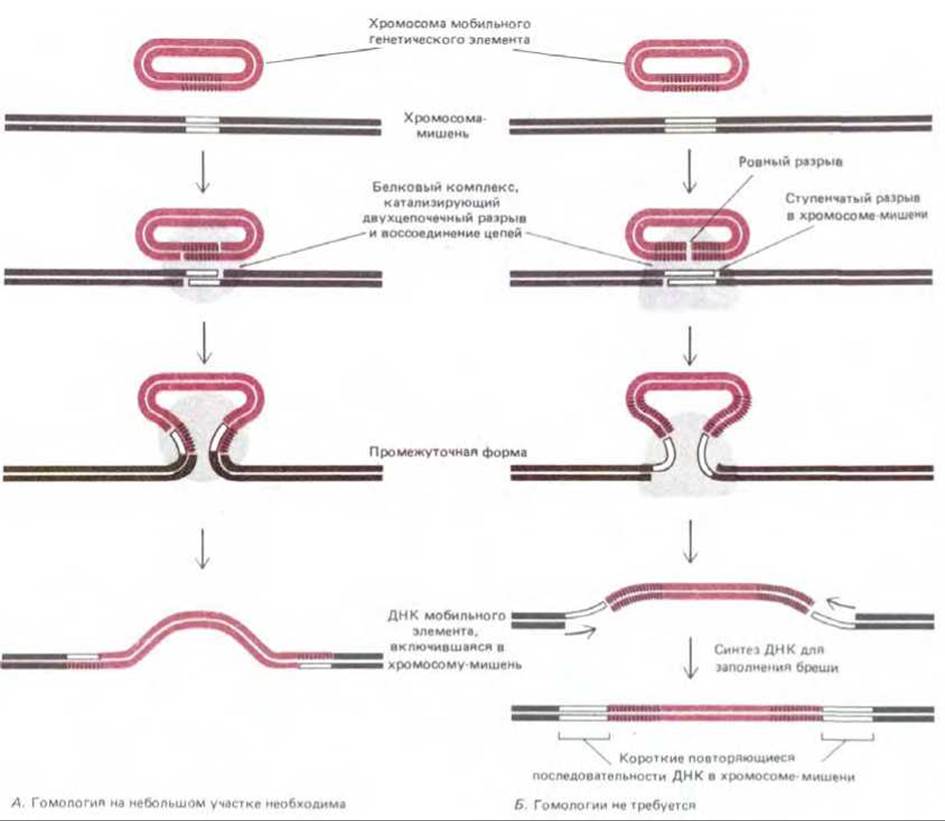
Рис. 5-67. Два механизма, используемых разными классами ферментов сайт-специфической рекомбинации. В обоих случаях специфичный фермент (показан серым) связывается с особой нуклеотидной последовательностью в хромосоме мобильного генетического элемента (отмечена штриховкой) и удерживает эту последовательность в тесном контакте с определенным участком хромосомы-мишени. А. Фермент делает ступенчатый разрез по обе стороны очень короткой гомологичной последовательности на обеих хромосомах (12 нуклеотидов в случае лямбда-интегразы), а затем соединяет цепи партнеров коротким ступенчатым соединением. Б. Фермент делает ступенчатый разрез в хромосоме-мишени и присоединяет выступающие ее концы к ровно срезанным концам мобильного элемента. В этом случае по обе стороны включившегося элемента появляются две короткие идентичные нуклеотидные последовательности - дупликации соответствующего участка ДНК-мишени (от 3 до 12 нуклеотидов, в зависимости от фермента).
Один из таких неизбирательно действующих ферментов был выделен в активной форме из бактериофага Ми. Подобно ДНК-топоизомеразе он способен катализировать все реакции разрыва и воссоединения без какого бы то ни было источника энергии (например, АТР). Данный фермент принадлежит одному из бактериофагов, однако есть все основания полагать, что подобные ферменты имеются и у других организмов, таких, например, как бактерии, плодовая мушка или человек. Предположение это вытекает из того, что мобильные генетические элементы у всех этих организмов сходны.
Заключение
Механизмы генетической рекомбинации обеспечивают возможность перемещения из хромосомы в хромосому больших фрагментов ДНК. Выработавшиеся для этого в процессе эволюции последовательности реакций таковы, что две спирали ДНК, разрываясь и воссоединяясь вновь, претерпевают минимальное повреждение, так что легко происходит восстановление двух целых хромосом. Существует два класса рекомбинационных событий. При общей рекомбинации начальные реакции зависят от комплементарных взаимодействий, происходящих на обширных участках между цепями двух двойных спиралей ДНК, вовлекаемых в рекомбинацию. Общая рекомбинация может поэтому происходить лишь между двумя гомологичными молекулами ДНК; и, хотя хромосомы при этом обмениваются генами, общая последовательность расположения генов в хромосоме не нарушается. При сайт-специфической рекомбинации реакции спаривания зависят от узнавания - при посредстве специального белка - двух нуклеотидных последовательностей, которым предстоит рекомбинировать; сколько-нибудь заметной гомологии при этом не требуется. Сайт-специфическая рекомбинация обычно изменяет относительное расположение нуклеотидных последовательностей в хромосомах.