Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Плазматическая мембрана
Мембранные белки
Хотя основные структурные особенности биологической мембраны определяются свойствами липидного бислоя, большинство их специфических функций осуществляется белками. Вот почему типы белков и их количества в мембране сильно варьируют: в миелиновой мембране, которая служит преимущественно для изоляции аксонов, Белки составляют менее 25% массы мембраны, а в мембранах, связанных с процессами превращения энергии (например, во внутренних мембранах митохондрий и хлоропластов) на их долю приходится около 75% массы мембраны. В обычной плазматической мембране количество белков равно приблизительно половине ее массы, т. е. значение этого показателя среднее между указанными выше крайними величинами. Поскольку размер липидной молекулы весьма мал по сравнению с размерами молекулы белка, можно сделать вывод, что в мембране всегда содержится значительно больше молекул липидов, чем белков. Например, если белки составляют 50% массы мембраны, то на одну молекулу белка приходится приблизительно 50 липидных молекул.
6-10
6-11
6.2.1. Полипептидная цепь многих мембранных белков пронизывает липидный бислой один или несколько раз [8]
Многие мембранные белки пронизывают бислой насквозь (пример 1 и 2 на рис. 6-14). Подобно их липидным соседям эти, так называемые трансмембранные белки, обладают амфипатическими свойствами: у них есть гидрофобные участки, проходящие через мембрану и взаимодействующие с гидрофобными хвостами липидных молекул внутри бислоя, и гидрофильные участки, обращенные к воде с обеих сторон мембраны. Гидрофобность некоторых мембранных белков увеличивается за счет ковалентного присоединения цепи жирной кислоты, которая внедряется в бислой с его цитоплазматической стороны (примеры 1 и 2 на рис. 6-14). Некоторые внутриклеточные мембранные белки присоединены к бислою только с помощью цепи жирной кислоты (пример 3 на рис. 6-14), есть и такие поверхностные белки, которые ассоциированы с бислоем за счет ковалентных взаимодействий (через специфический олигосахарид) с фосфатидилинозитолом - минорным фосфолипидом, находящимся во внешнем липидном монослое плазматической мембраны (пример 4 на рис. 6-14).
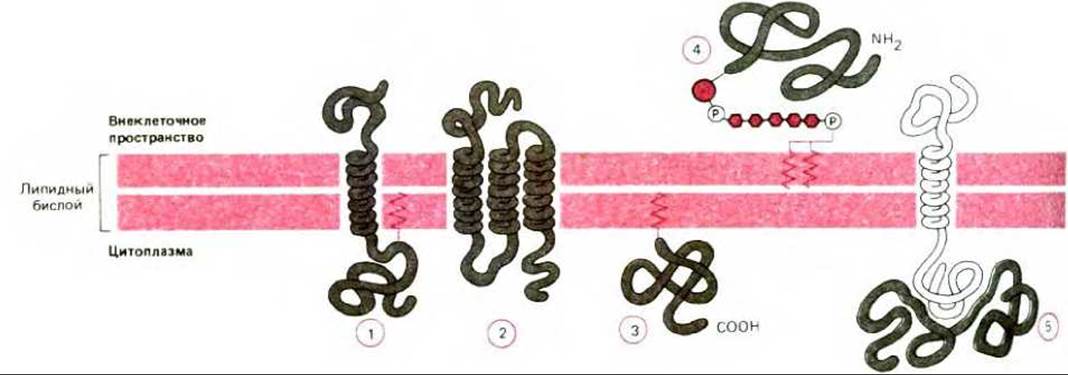
Рис. 6-14. Пять способов ассоциации мембранных белков с липидным бислоем. Трансмембранные белки пронизывают бислой в виде одиночной а-спирали (1) или нескольких а-спиралей (2). Некоторые из таких белков (1 и 2) имеют присоединенную ковалентно цепь жирной кислоты, погруженную в цитоплазматический монослой (1). Другие мембранные белки ассоциируют с бислоем только за счет ковалентно присоединенного к ним липида - либо цепи жирной кислоты, погруженной в цитоплазматический монослой (3), либо, гораздо реже, через фосфолипид фосфатидилинозитол, погруженный во внешний монослой и соединенный с белком через олигосахарид (4). Наконец, многие белки ассоциируют с мембраной только благодаря нековалентным взаимодействиям с другими мембранными белками (5). Детали обсуждаются в гл. 8.
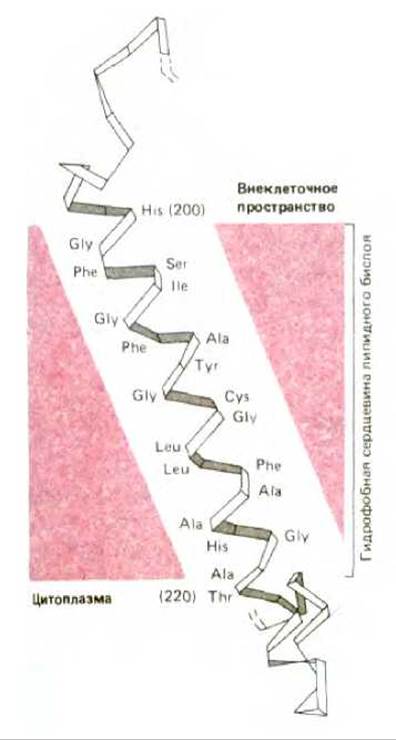
Рис. 6-15. Сегмент цепи трансмембранного полипептида, пронизывающего липидный бислой в виде а-спирали (по данным рентгеноструктурного анализа кристаллов мембранного белка). Показана только скелетная модель полипептидной цепи. Гидрофобные аминокислоты выделены цветом. Торчащие неполярные боковые группы аминокислотных остатков (не показаны) взаимодействуют с гидрофобными цепями жирных кислот внутри липидного бислоя. Полярные пептидные группы образуют между собой водородные связи (не показаны) и, таким образом, экранируются от гидрофобного окружения бислоя. Представлен фрагмент полипептида из бактериального фотосинтезирующего реакционного центра, изображенного на рис. 6-32. (J. Deisenhofer et al., Nature 318, 618-624, 1985 и H. Michel et al., EMBO J., 5, 1149-1158, 1986.)
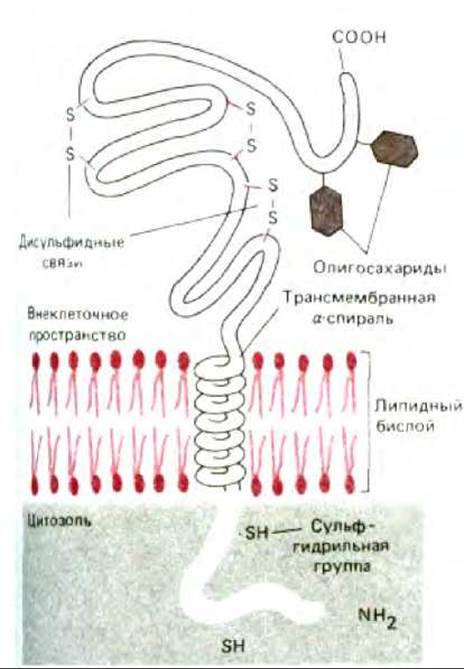
Рис. 6-16. Типичный трансмембранный гликопротеин, пересекающий мембрану 1 раз. Обратите внимание, что полипептидная цепь пронизывает липидный бислой в виде правозакрученной а-спирали, и что олигосахаридные группы и дисульфидные связи в цитоплазматическом домене не образуются из-за восстановительных условий в цитозоле клетки.
Некоторые белки, связанные с мембранами, вовсе не взаимодействуют с гидрофобной внутренностью липидного бислоя. Они соединены с той или другой стороной мембраны за счет нековалентных взаимодействий с другими мембранными белками (пример 5 на рис. 6-14). Многие из них высвобождаются из мембраны в сравнительно мягких условиях, например путем экстракции растворами с очень высокой или низкой ионной силой или растворами с крайними значениями рН, которые влияют на взаимодействия белок-белок, но оставляют интактным липидный бислой. Такие белки называют периферическими мембранными белками. Напротив, трансмембранные белки, белки, связанные с фосфатидилинозитолом, и некоторые белки, удерживаемые в бислое с помощью цепи жирной кислоты (так же как и другие, крепко связанные белки, которые могут быть высвобождены только после разрушения бислоя детергентами или органическими растворителями) называются интегральными мембранными белками.
Та часть полипептидной цепи трансмембранных белков, которая погружена в гидрофобное окружение липидного бислоя, состоит в основном из аминокислотных остатков с неполярными боковыми группами. Однако, поскольку пептидные группы полярны, а молекулы воды недоступны, все пептидные группы в бислое стремятся образовать водородные связи между собой (см. рис. 3-26). Число водородных связей между пептидными группами оказывается максимальным, если участок полипептидной цепи, проходящей через бислой, образует регулярную а-спираль. Именно так большинство полипептидных цепей пересекает мембрану (рис. 6-15). В тех же случаях, когда через бислой проходит несколько участков полипептидной цепи, пептидные группы могут в принципе быть насыщены водородными связями, если эти участки организованы в виде В-СЛОЕВ. Однако чаще полипептидная цепь белков, пронизывающих мембрану несколько раз, образует серию а-спиралей, а не В-СЛОЕВ (пример 2 на рис. 6-14). Строгое условие максимизации числа водородных связей в отсутствие молекул воды (запрет на дегидратацию) означает также, что полипептидная цепь, пронизывающая мембрану, вероятно, не меняет своего первоначального направления до полного пересечения мембраны, поскольку наличие изгиба в цепи привело бы к уменьшению числа регулярных водородных связей. Видимо, по этой причине до сих пор не обнаружено мембранных белков, погруженных в мембранный слой лишь частично.
Трансмембранные белки всегда имеют уникальную ориентацию в липидном бислое. Это отражает асимметричный характер их биосинтеза и встраивания в мембранный бислой эндоплазматического ретикулума, а также различные функции цитоплазматических и внеклеточных доменов этих белков. Основная масса трансмембранных белков гликозилирована. Как и в случае с гликолипидами, олигосахаридные цепи всегда присутствуют на внеклеточной стороне мембраны, поскольку сахарные остатки присоединяются в цистернах эндоплазматического ретикулума и аппарата Гольджи. Другая асимметрия заключена в белковых сульфгидрильных группах (SH), которые остаются восстановленными (цистеины) в цитоплазматических доменах, но часто используются для формирования внутри- или межцепных дисульфидных (S — S) связей во внеклеточных доменах (рис. 6-16).
6.2.2. Мембранные белки могут быть растворены и очищены в растворах детергентов [9]
Как правило, трансмембранные белки (и некоторые другие, прочно связанные с мембраной) могут быть солюбилизированы только с помощью реагентов, разрушающих гидрофобные взаимодействия и, в конечном счете, бислой. Наиболее успешно это можно сделать, используя детергенты - небольшие амфипатические молекулы, стремящиеся образовать в воде мицеллы (рис. 6-17). При смешивании детергента с мембраной гидрофобные концы его молекул связываются с гидрофобными участками мембранных белков, вытесняя оттуда молекулы липидов. Поскольку противоположный конец молекулы детергента полярный, такое связывание приводит к тому, что мембранные белки переходят в раствор в виде комплексов с детергентом. Некоторые прочно связанные с белками молекулы липидов также остаются в этих комплексах (рис. 6-18). Полярные концы детергентов могут быть либо заряженными (ионными), как в додецилсулъфате натрия (ДСН), либо незаряженными (неионными), как в случае тритонов. Структуры этих двух используемых повсеместно детергентов изображены на рис. 6-19.
Сильным ионным детергентом типа ДСН можно солюбилизировать даже самые гидрофобные белки мембран. Это позволяет анализировать такие белки методом электрофореза в полиакриламидном геле, содержащем ДСН. Разработка данной методики произвела настоящую революцию в изучении мембранных белков. Детергенты такого типа разворачивают (денатурируют) полипептидную цепь белка, внедряясь в его внутреннее «гидрофобное ядро» (см. рис. 3-22). Обычно при этом белки утрачивают активность и становятся непригодными для исследования их функции. Тем не менее белки могут быть легко очищены в денатурированной под действием ДСН форме. В некоторых случаях удаление детергента приводит к ренатурации и восстановлению функциональной активности.
Менее гидрофобные мембранные белки можно солюбилизировать при низких концентрациях мягкого детергента. Это позволяет получить их если не в нативной, то по крайней мере в функционально активной форме. Если же детергент затем удалить в отсутствие фосфолипидов, то мембранные белки обычно агрегируют и выпадают в осадок (рис. 6-20). Однако если очищенные белки смешать с фосфолипидами до удаления детергента, то белки в активной форме обычно встроятся в липидный бислой, формируемый молекулами фосфолипидов (рис. 6-21). Таким образом можно реконструировать функционально активные системы мембранных белков из очищенных компонентов. Это один из возможных подходов к изучению их функциональной активности. Например, если удается показать, что очищенный белок перекачивает ионы через синтетический липидный бислой в отсутствие других белков, можно со всей определенностью сказать, что это ионный насос. Более того, контролируя в экспериментах условия реакции (доступность белков для АТР и ионов), можно выяснить детальный механизм действия этого белка (см. разд. 6.4.4).
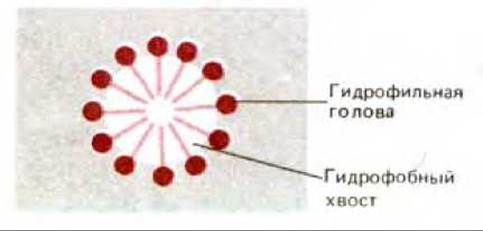
Рис. 6-17. Поперечный разрез мицеллы, образовавшейся в воде из молекул детергента. Молекулы детергента являются амфипатическими, поскольку имеют полярный и неполярный концы.
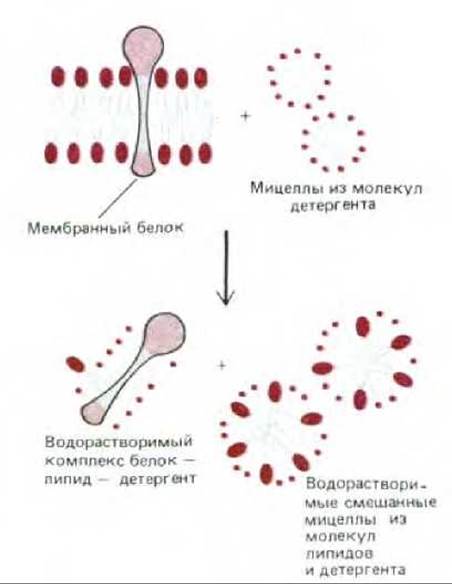
Рис. 6-18. Солюбилизация мембранных белков с помощью детергента. Детергент разрушает липидный бислой, в результате чего белки оказываются в растворе в виде комплексов с молекулами липидов и детергента. Фосфолипиды мембран также солюбилизируются с помощью детергента.
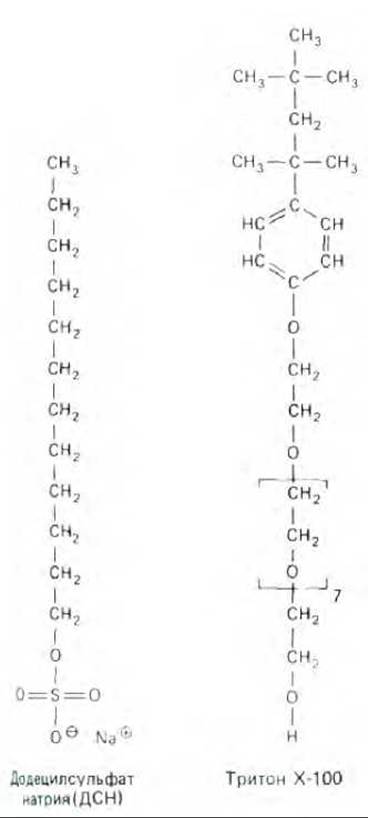
Рис. 6-19. Структуры молекул двух широко распространенных детергентов: додецилсульфата натрия (ДСН, анионного детергента) и тритона Х-100 (неионного детергента). Заметьте, что участок в скобках повторяется семь раз.
6-12
6.2.3. Поверхность мембранных белков, обращенную к цитоплазме, можно изучать на примере «теней» эритроцитов [10]
О плазматической мембране эритроцитов человека (рис. 6-22) известно гораздо больше, чем о любой другой мембране эукариотической клетки. Такая ситуация сложилась вследствие ряда причин. 1) Эритроциты можно получать в большом количестве (например, из банков крови). При этом они практически не загрязнены клетками других типов. 2) Поскольку эритроциты не имеют ядра и внутренних органелл, их плазматическая мембрана - это единственная мембрана данных клеток и ее можно выделить в чистом виде, без примеси внутренних мембран. Между тем при получении плазматической мембраны из клеток других типов, в которых она обычно составляет менее 5% от массы всех мембран (см. табл. 8-2), это представляет серьезную проблему. 3) Мембраны эритроцитов, или «тени» (пустые оболочки), легко получить, поместив клетки в гипотетический солевой раствор. Концентрация соли в таком растворе ниже, чем в клетке, поэтому вода устремляется внутрь эритроцитов, заставляя их разбухать и лопаться (лизис), высвобождая гемоглобин (главный немембранный белок). 4) Мембранные «тени» можно изучать как в поврежденном виде (в этом случае реагенты взаимодействуют с молекулами на обеих сторонах мембраны), так и после самопроизвольного восстановления их целостности, когда водорастворимые реагенты не могут проникать во внутреннее пространство. Кроме того, из теней эритроцитов можно получить замкнутые, вывернутые наизнанку пузырьки (рис. 6-23); это дает возможность изучать независимо друг от друга внешнюю и внутреннюю (цитоплазматическую) стороны мембраны. Использование теней эритроцитов с разрывами и без разрывов впервые позволило установить, что некоторые мембранные белки пронизывают липидный бислой (см. ниже), и что состав липидов на двух сторонах бислоя различен. Как и в большинстве основных принципов, первоначально установленных при изучении мембран эритроцитов, эти факты постепенно были подтверждены и при изучении мембран ядерных клеток.
Характер расположения в мембране того или иного белка можно определить несколькими способами. Один из них основан на том, что меченные (флуоресцентными красителями или радиоактивными изотопами) водорастворимые реагенты не способны проникать через мембрану и поэтому ковалентно связываются со специфическими группами только на ее наружной стороне. После этого мембраны растворяют, белки разделяют методом электрофореза в полиакриламидном геле, а меченые белки идентифицируют либо по радиоактивности (радиоавтография гелей), либо по флуоресценции в ультрафиолетовом свете. Используя такое направленное мечение, можно определить, как конкретный белок (полоса в геле) ориентирован в мембране: если он метится одновременно и на внешней стороне (вместе с нативными клетками и тенями без разрывов), и на цитоплазматической стороне (вместе с замкнутыми вывернутыми наизнанку пузырьками), то это, несомненно, трансмембранный белок. Альтернативный подход состоит в обработке либо наружной, либо внутренней поверхности мембраны не проникающими через нее протеолитическими ферментами: если какой-либо белок частично расщепляется в обоих случаях, то он должен быть трансмембранным. Кроме того, с помощью меченых антител можно определить, на какой стороне мембраны находится специфическая часть трансмембранного белка.
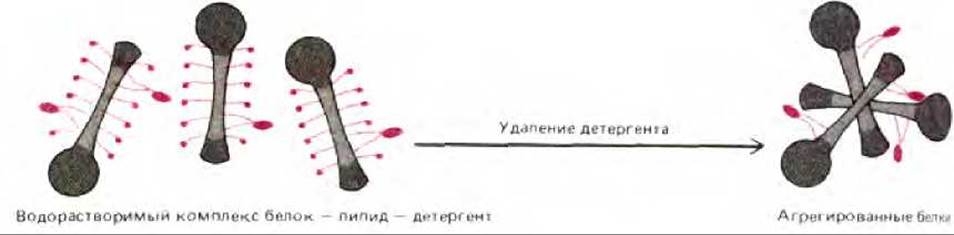
Рис. 6-20. Схема, показывающая, что при удалении детергента из солюбилизированных с его помощью мембранных белков, почти не защищенные от контактов с водой гидрофобные участки на поверхности белков стремятся взаимодействовать друг с другом, в результате чего образуются большие агрегаты белков, осаждающиеся из раствора.
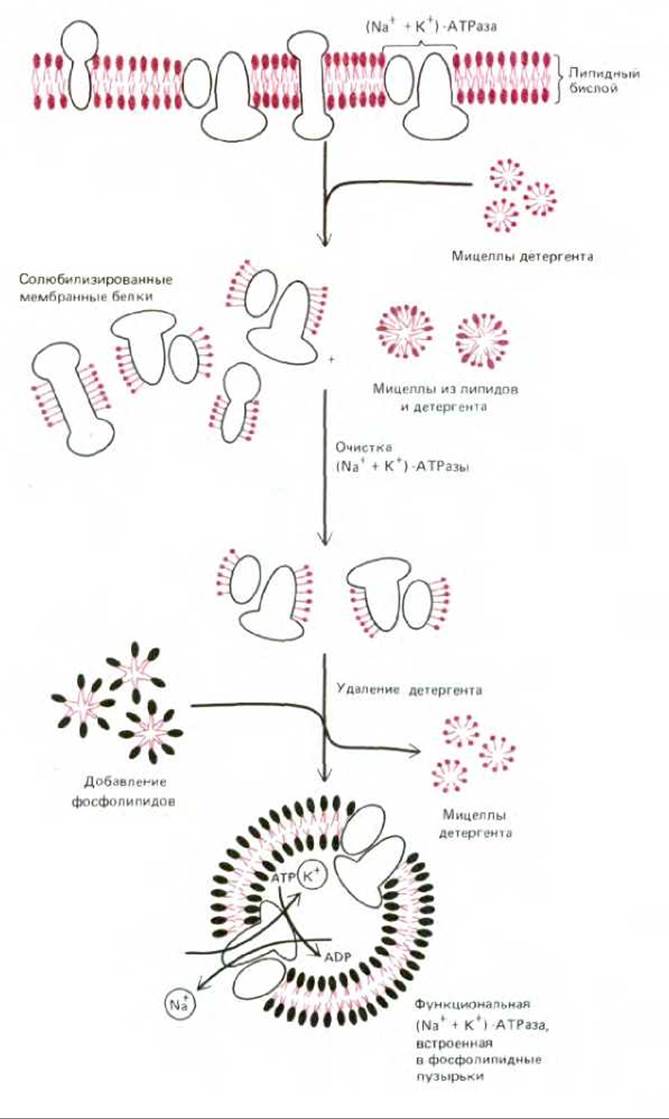
Рис. 6-21. Солюбилизация, очистка и реконструкция функциональных молекул (Na+ + К+)-АТРазы в фосфолипидных пузырьках (Na+ + К+)-АТРаза - это анионный насос, присутствующий в плазматических мембранах большинства животных клеток. Он использует энергию гидролиза АТР для перекачки ионов Na+ из клетки, а К+ внутрь клетки. Реконструкция проводится в присутствии высоких концентраций Na+ и АТР, так как АТРаза функционирует в качестве насоса только при достаточной концентрации этих веществ внутри пузырьков. Детергент удаляется продолжительным диализом или с помощью хроматографии.
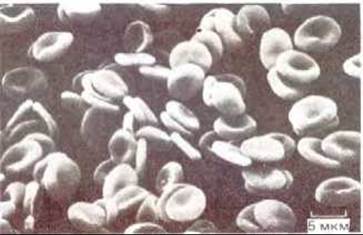
Рис. 6-22. Микрофотография эритроцитов человека, полученная с помощью сканирующего электронного микроскопа. Клетки имеют двояковогнутую форму и не содержат ядер. (С любезного разрешения Barnadette Chialley.)
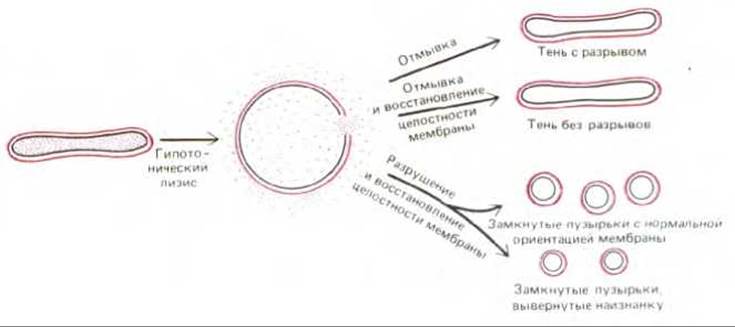
Рис. 6-23. Получение теней эритроцитов с разрывами и без разрывов, а также замкнутых пузырьков с правильной ориентацией бислоя и вывернутых наизнанку. Показано, что эритроциты разрываются только в одном месте, давая тени с единственным отверстием. Маленькие пузырьки получаются при механическом разрушении теней. Ориентация мембран в пузырьках определяется ионными условиями во время процедуры разрушения.

Рис. 6-24. Картина, полученная при электрофорезе белков, входящих в состав мембраны эритроцитов человека, в присутствии ДСН. Окрашивание проводилось кумасси синим (А). Положение в геле некоторых белков (Б); полоса, соответствующая гликофорину, выделена цветом для облегчения её идентификации вблизи полосы 3. Другие полосы в геле на рисунке опущены. Многочисленные углеводные остатки в гликофорине замедляют движение молекул этого белка настолько, что они движутся почти так же, как значительно более крупные молекулы полосы 3. (С любезного разрешения Ted Steck.)
При изучении белков плазматической мембраны эритроцитов человека методом электрофореза в ПААГ в присутствии ДСН удается идентифицировать около 15 главных белков с молекулярной массой от 15000 до 250000. Три из них - спектрин, гликофорин и так называемая полоса 3-составляют в сумме более 60% (по весу) всех мембранных белков (рис. 6-24). Все три белка связываются с мембраной по-разному. Поэтому мы рассмотрим данные белки в качестве примеров трех главных способов ассоциации белков с мембранами.
6-14
6.2.4. Спектрин - белок цитоскелета, нековалентно связанный с цитоплазматической стороной мембраны эритроцитов [11]
Большинство мембранных белков эритроцитов человека - это периферические мембранные белки, ассоциированные с бислоем на его плазматической стороне. Самый распространенный из таких белков спектрин представляет собой длинную, тонкую, гибкую «палочку» длиной около 100 нм. Его масса составляет около 25% массы мембранных белков, что соответствует 2,5 х 105 копий на клетку. Спектрин является важным компонентом белковой сети (цитоскелета), поддерживающей структурную целостность и двояковогнутую форму эритроцитов (см. рис. 6-22). Если цитоскелет экстрагировать из теней эритроцитов растворами с низкой ионной силой, мембрана фрагментируется на мелкие пузырьки.
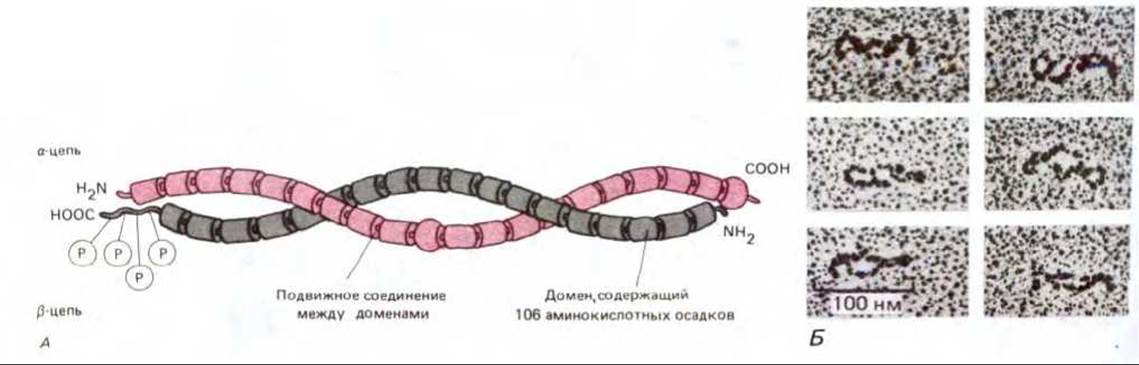
Рис. 6-25. Молекулы спектрина из эритроцитов человека. А. Схематическое изображение. Б. Электронная микрофотография. Каждый гетеродимер состоит из двух антипараллельных слегка перекрученных друг с другом, гибких полипептидных цепей, которые нековалентно взаимодействуют во множестве точек, включая оба конца. Фосфорилированная «головка» - место, где объединяются два димера, образуя тетрамер, расположена слева.
Каждая из а и (3 цепей состоит из большого числа повторяющихся доменов, длиной 106 аминокислотных остатков. Предполагают, что каждый домен организован группой из трех а-спиралей (не показано), связанных нерегулярными перетяжками. На (Б) показаны спектриновые молекулы, оттененные платиной. (A-D. W. Speicher и V.T. Marcher, Nature 311, 177-180; Б - с любезного разрешения D. М. Shotten et al., J. Моl. Biol., 131, 303329, 1979. Academic Press Inc. (London) Ltd.)
Молекула спектрина состоит из двух больших полипептидных цепей: а-спектрина (около 240 000 дальтон) и ß-спектрина (около 220 000 даль-тон). По-видимому, каждая цепь должна быть построена из множества а-спиральных сегментов, объединенных в группы по три и связанных между собой неспиральными участками (рис. 6-25). Такие спектриновые гетеродимеры самопроизвольно агрегируют (голова к голове), образуя тетрамеры длиной 200 нм. Концы пяти или шести тетрамеров соединяются между собой, связываясь с короткими активными филаментами и с другим белком (полосой 4.1), в так называемый «узловой комплекс». Таким образом, образуется гибкая сетеподобная структура на цитоплазматической поверхности мембраны (рис. 6-26). Именно цитоскелет, в основу которого входит спектрин, позволяет эритроцитам противостоять давлению на мембрану при прохождении через узкие капилляры. У анемичных мышей и людей с наследственной аномалией спектрина эритроциты имеют сферическую (а не двояковогнутую) форму и повышенную хрупкость. Степень тяжести анемии прямо пропорциональна степени недостаточности спектрина.
При связывании радиоактивно меченного спектрина с мембранами эритроцитов, из которых предварительно был удален спектрин и некоторые другие периферические белки, удалось идентифицировать белок, ответственный за соединение спектринового цитоскелета с плазматической мембраной. Крупный внутриклеточный белок был назван анкирином. Он связывал как ß-спектрин, так и цитоплазматический домен трансмембранного белка полосы 3 (см. рис. 6-26). Соединяя белок полосы 3 со спектрином, анкирин связывал сеть, образуемую спектрином, с мембраной. При этом сильно уменьшалась скорость диффузии молекул белка полосы 3 в липидном бислое. Однако цитоскелет на основе спектрина может соединяться с мембраной и по другому механизму. Было показано, что цитоскелетный белок полосы 4.1 (который связывает спектрин и актин) соединяется с цитоплазматическим доменом гликофорина, другого трансмембранного белка эритроцитов.
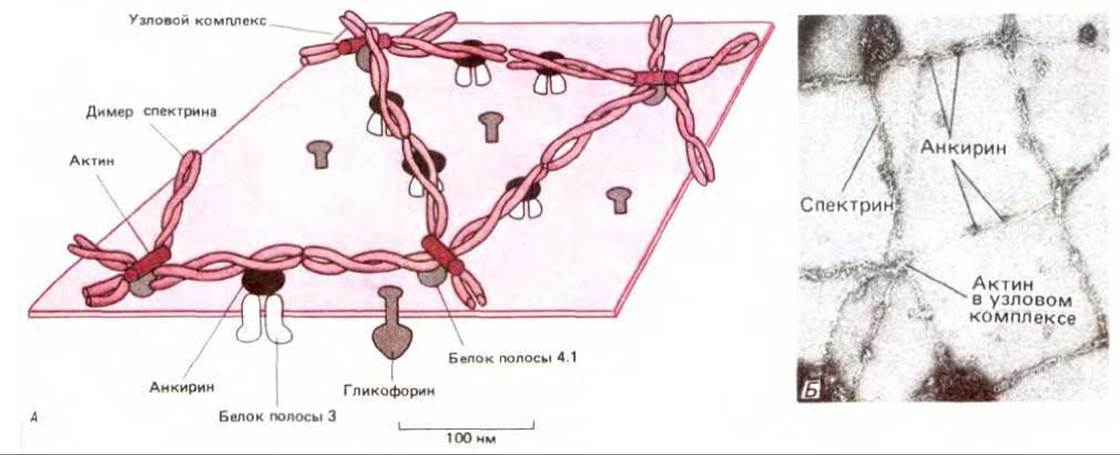
Рис. 6-26. Схематическое изображение (А) и электронная микрофотография (Б) цитоскелета (на основе спектрина) на цитоплазматической поверхности мембраны эритроцитов человека. Структура, представленная на (А), вытекает главным образом из исследований взаимодействия очищенных белков in vitro. Спектриновые димеры ассоциируют «голова к голове», образуя тетрамеры, которые объединяются с помощью коротких актиновых филаментов (содержащих 15 мономеров) и белка полосы 4.1 (а два или три других белка не показаны), в результате чего образуется сеть. Эта цитоскелетная сеть связана с мембраной благодаря взаимодействию спектриновых тетрамеров с молекулами белка полосы 3, но не прямо, а через молекулы анкирина. Она может также связываться с мембраной при взаимодействии белка полосы 4.1 с молекулами гликофорина (не показано). Электронная микрофотография демонстрирует эритроциты после фиксации и негативного контрастирования. Спектриновая сеть была специально растянута, для того чтобы были видны отдельные детали структуры; в нормальной клетке такая сеть занимает лишь 1/10 изображенной площади. (С любезного разрешения Т. Byers и D. Branton, Proc. Natl. Acad. Sci. USA, 82, 6153-6157, 1985.)
Аналогичные, но гораздо более совершенные и сложные цитоскелетные сети лежат в основе плазматических мембран ядерных клеток. Такие сети, состоящие из кортикальных областей (или кортексов) цитоплазмы, содержат множество актиновых филаментов, которые, по-видимому, соединены с плазматическими мембранами несколькими различными способами. В кортексе обнаружены белки, структурно гомологичные спектрину, анкирину и белку полосы 4.1, но их организация и функции до сих пор не поняты.
6.2.5. Гликофорин пронизывает липидный бислой в виде одиночной а-спирали [11]
Гликофорин - это один из двух главных белков, выступающих не внешней поверхности эритроцитов человека. Он оказался первым мембранным белком, для которого была определена полная аминокислотная последовательность. Гликофорин представляет собой небольшой трансмембранный гликопротеин (131 аминокислотный остаток). Большая часть массы этого белка находится на наружной поверхности мембраны, где локализован и его гидрофильный N-концевой участок. С этой областью белковой молекулы связаны 15 отдельных олигосахаридных боковых цепей, в которых в сумме содержится около 100 сахарных остатков, что составляет примерно 60% массы молекулы гликопротеина. Фактически подавляющую часть углеводов клеточной поверхности (включая более 90% сиаловой кислоты) и, следовательно, большую часть всех отрицательных зарядов клеточной поверхности несут на себе молекулы гликофорина. Гидрофильные С-концевые хвосты этих молекул погружены в цитозоль, а гидрофобный а-спиральный участок, насчитывающий приблизительно 20 аминокислотных остатков, пронизывает липидный бислой.
Несмотря на то что в клетках содержится много молекул гликофорина (более 6 х 105), их функция остается неизвестной. Более того, люди, в эритроцитах которых отсутствует большинство этих молекул, производят впечатление совершенно здоровых. Гликофорин обнаружен только в эритроцитах, однако в структурном отношении его можно отнести к общему классу мембранных гликопротеинов, пронизывающих липидный бислой в виде одиночной а-спирали (см. пример 1 на рис. 6-14 и рис. 6-16). Различные рецепторы на поверхности клеток принадлежат именно к этому классу белков.
6-14
6.2.6. Полоса 3 из мембраны эритроцитов человека представляет собой белок, транспортирующий анионы [13]
О белке полосы 3 известно (в отличие от гликофорина), что он играет важную роль в функционировании клетки. Этот белок называется полосой 3, поскольку при электрофорезе в ПААГ в присутствии ДСН он занимает соответствующее положение относительно других белков (см. рис. 6-24). Как и гликофорин, полоса 3 является трансмембранным белком. Однако в отличие от него этот белок имеет глобулярную конформацию, а его полипептидная цепь (длиной около 930 аминокислотных остатков) пересекает бислой по крайней мере 10 раз. Каждый эритроцит содержит около 106 молекул белка полосы 3, которые, по-видимому, образуют в мембране димеры и, возможно, тетрамеры.
Основная функция эритроцитов, как известно, заключается в переносе О2 из легких ко всем тканям и СО2 из тканей к легким. Белок полосы 3 принимает участие в этом обмене. Находясь в легких, эритроциты избавляются от СО2, аккумулированного в тканях, путем замены ионов НСО3- на Сl-. В мембране есть специальный анионный транспортный белок для осуществления данного процесса. Газообмен можно заблокировать специфическим ингибитором, связывающимся с транспортным белком. При использовании ингибиторов, меченных радиоактивными изотопами, этот анионный транспортный белок был идентифицирован. Им оказался белок полосы 3. Совсем недавно процесс анионного транспорта был реконструирован in vitro с использованием очищенного белка полосы 3, встроенного в фосфолипидные пузырьки. Очень похожие анионные транспортные белки были обнаружены и во многих других ядерных клетках, где они помогают контролировать внутриклеточный рН.
Белок полосы 3 можно зарегистрировать в виде внутримембранных частиц с помощью электронной микроскопии в сочетании с замораживанием - скалыванием. В этом случае клетки замораживают в жидком азоте и полученный кусочек льда раскалывают острым ножом. Плоскость скола обычно проходит через гидрофобную сердцевину мембранного бислоя, разделяя его на два монослоя. Затем на образовавшиеся поверхности напыляют платину и рассматривают платиновые реплики в электронный микроскоп. С помощью этой методики открываются (рис. 6-27) две различные гидрофобные внутренние поверхности: цитоплазматической (или протоплазматической) половины бислоя (Р-поверхность) и внешней половины бислоя (Е-поверхность, от англ. external). Мембраны человеческих эритроцитов в таких препаратах выглядят усеянными относительно гомогенными по размеру (7.5 нм в диаметре) внутримембранными частицами. Как оказалось, их больше на Р-поверхности, чем на Е-поверхности (рис. 6-28). По-видимому, это главным образом белки полосы 3, поскольку такие же частицы обнаружены при скалывании синтетических липидных бислоев, реконструированных вместе с белком полосы 3. Рис. 6-29 убеждает нас в том, что именно молекулы белка полосы 3, а не молекулы гликофорина, видны на электронных микрофотографиях мембран эритроцитов, полученных с помощью метода замораживания - скалывания. Ведь нетрудно себе представить, каким образом трансмембранный белок, такой, например, как белок полосы 3, основная масса которого расположена в пределах липидного бислоя, может осуществлять пассивный транспорт полярных молекул через неполярный бислой. Ясно, что белок полосы 3 (или его димер либо тетрамер) способен обеспечить трансмембранный гидрофильный проход, по которому ионы С- и HCO-3 переносятся без контакта с гидрофобным окружением липидного бислоя (см. рис. 6-43, А). Маловероятно, что подобный транспорт может осуществлять молекула гликофорина, пронизывающая бислой в виде простой а-спирали. Для того чтобы понять механизм функционирования мембранных транспортных белков, необходима точная информация об их трехмерной структуре в составе бислоя. Первым транспортным белком, для которого подобные детали стали известны, оказался бактериородопсин - белок, работающий как фотоактивируемый протонный (Н+) насос в плазматической мембране некоторых бактерий. Структура бактериородопсина аналогична структуре других мембранных белков. Этот белок заслуживает того, чтобы остановится на нем поподробнее.
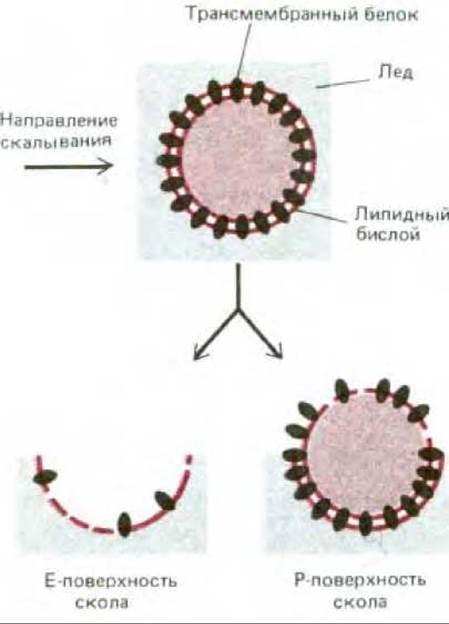
Рис. 6-27. Схема, показывающая, как с помощью электронной микроскопии образцов, приготовленных методом замораживания - скалывания, можно получить изображения внутренней гидрофобной поверхности цитоплазматической (или протоплазматической) половины бислоя (называемой Р-поверхностью) и наружной половины бислоя (называемой Е-поверхностью). После показанного здесь процесса скалывания открытые поверхности сколов оттеняют платиной и углеродом, органические вещества удаляют, а полученную платиновую реплику рассматривают в электронный микроскоп (см. также рис. 4-23).
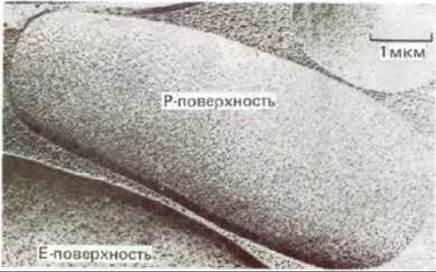
Рис. 6-28. Электронная микрофотография скола эритроцитов человека. Обратите внимание, что плотность внутримембранных частиц на цитоплазматической (Р) поверхности выше, чем на наружной (Е). (С любезного разрешения L. Engstrom и D. Branton.)
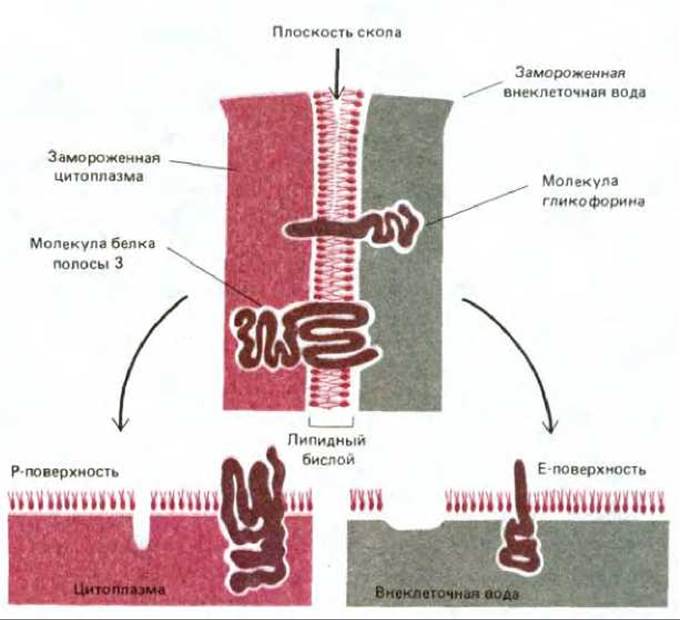
Рис. 6-29. Схема, показывающая, что может произойти с молекулами гликофорина и белка полосы 3 в мембранах эритроцитов человека во время процедуры замораживания - скалывания. При расщеплении липидного бислоя из замороженного монослоя выдергивается либо внутренняя, либо внешняя половина трансмембранного белка. Преимущественно белки остаются на той половине, с которой ассоциирована более крупная часть белковой молекулы. Поэтому молекулы белка полосы 3 обычно остаются на внутренней (Р) поверхности скола. Поскольку при этом над поверхностью скола экспонирована достаточно большая часть белка, они видны на микрофотографиях в виде внутримембранных частиц. Молекулы гликофорина обычно остаются на внешней (Е) поверхности скола, но их экспонированных цитоплазматических хвостов не хватает для того, чтобы создать изображение каких-либо четко различимых частиц.
6.2.7. Бактериородопсин - это протонный насос, пронизывающий бислой в виде семи а-спиралей [14]
«Пурпурная мембрана» бактерий Holobacterium halobium - это четко очерченный участок (пятно) неправильной формы на плазматической мембране (рис. 6-30), которая содержит молекулы одного белка - бактериородопсина, В каждой молекуле имеется одна поглощающая свет простетическая группа, или хромофор (называемый ретиналем), родственная витамину А и идентичная хромофору, обнаруженному в родопсине палочек сетчатки глаза у позвоночных (см. разд. 19.6.6). Ретиналь ковалентно связан с боковой цепью лизина в белке. При активации одним квантом света возбужденный хромофор вызывает конформационные изменения в белке, в результате чего два протона переносятся с внутренней поверхности клетки на наружную. Вследствие такого переноса в клетке создается градиент концентрации протонов и градиент электрического потенциала, которые в свою очередь обусловливают синтез АТР с помощью второго белка клеточной плазматической мембраны.
Молекулы родопсина образуют в клеточной мембране плоскую кристаллическую решетку, подобную двумерному кристаллу. Сочетание методов электронной микроскопии низкой интенсивности и малоуглового рассеяния электронов позволило определить трехмерную структуру белка и его ориентацию в мембране с разрешением 0,7 нм. Последний метод аналогичен рентгеноструктурному анализу, который используется для получения трехмерных кристаллов растворимых белков. Изучение бактериородопсина показало, что его молекула состоит из семи а-спиралей (каждая из которых содержит около 25 аминокислотных остатков), плотно упакованных друг с другом (рис. 6-31). Эти спирали пересекают линейный бислой примерно под прямым углом к плоскости мембраны. Весьма возможно, что протоны проходят через мембрану при участии хромофора по сопряженной системе боковых цепей а-спиралей, однако детальные механизмы этого процесса еще неизвестны.
Бактериородопсин относится к семейству мембранных белков, обладающих сходной структурой, но различными функциями. Например, рецептор света - белок родопсин - в палочках сетчатки глаза позвоночных и некоторые другие белки-рецепторы клеточной поверхности, связывающие специфические гормоны, также уложены в виде семи трансмембранных а-спиралей. Эти белки функционируют скорее как переносчики сигнала, чем как транспортные белки, поскольку каждый из них в ответ на внешний сигнал активирует другой белок плазматической мембраны, который генерирует химический сигнал в цитозоле.
Для полного понимания механизмов функционирования бактериородопсина необходимо определить точное положение всех его атомов методами рентгеноструктурного анализа кристаллов белка. Однако из-за амфипатической природы мембранных белков их чрезвычайно трудно кристаллизовать. Это удалось сделать лишь в 1985 году при изучении фотосинтезирующего реакционного центра у бактерий методами рентгеноструктурного анализа. Впервые было показано, как множество полипептидов могут ассоциировать в мембране, образуя сложную белковую машину.

Рис. 6-30. Схематическое изображение бактерии Halobacterium halobrium, показывающее пятна пурпурной мембраны, содержащей молекулы бактериородопсина. У этих бактерий, живущих в солнечных озерах и получающих много солнечного света, в процессе эволюции появились разнообразные белки, активируемые светом, в том числе и бактериородопсин - фотоактивируемый протонный насос плазматической мембраны.
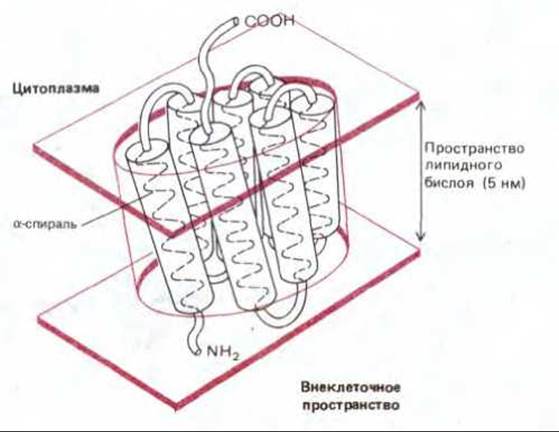
Рис. 6-31. Структура молекулы родопсина и ее расположение в липидном бислое. Полипептидная цепь пересекает бислой в виде семи а-спиралей. (По данным R. Henderson и R.N.T. Onwin, Nature, 257, 28-32, 1975.)
6.2.8. Четыре различных полипептидных цепи в мембраносвязанном комплексе образуют фотосинтезирующий реакционный центр у бактерий [15]
В гл. 3 шла речь о том, что различные полипептиды ассоциируют, образуя большие мультиферментные комплексы, которые с высокой эффективностью катализируют сложные реакции благодаря кооперативной работе субъединиц. Аналогичные комплексы белков обнаружены и в мембранах. Наиболее изучен среди них бактериальный фотосинтезирующий реакционный центр. Этот белковый комплекс находится в плазматической мембране пурпурных фотосинтезирующих бактерий Rhodopseudomonas viridis. Он использует поглощенную энергию света для создания электрона с высокой энергией, позволяющей ему пересекать мембрану быстрее чем за наносекунду. Затем электрон переходит к другим переносчикам электронов, находящимся в мембране, которые используют часть энергии, высвобождаемой в процессе электронного транспорта для синтеза АТР в цитозоле. Реакционный центр построен из четырех различных полипептидов: L, М, Н и цитохрома. Для изучения трехмерной пространственной структуры этот комплекс был солюбилизирован в растворе детергента, закристаллизован в виде комплекса белков с детергентом и изучен методом рентгеноструктурного анализа. Как оказалось, реакционный центр содержит четыре молекулы хлорофилла и восемь других коферментов, переносящих электроны. В гл. 7 мы будем говорить о том, что для понимания фотосинтеза очень важным оказалось установление точного положения каждого из коферментов в комплексе. Не менее значимым (в большой степени относящимся к теме данной главы) событием стало выяснение организации четырех белковых субъединиц в трансмембранном комплексе. Субъединицы L и М гомологичны и состоят каждая из пяти а-спиралей, пронизывающих липидный бислой плазматической мембраны (рис. 6-32). Эти две субъединицы образуют гетеродимер, представляющий собой ядро реакционного центра: 10 его а-спиралей окружают переносчиков электрона. Субъединица Н имеет лишь одну трансмембранную а-спираль, а остальная часть полипептидной цепи уложена в виде глобулярного домена, находящегося на цитоплазматической стороне мембраны, где он связан с L-М- гетеродимером. Цитохром представляет собой периферический мембранный белок, связанный с гетеродимером L-H на внешней стороне мембраны (см. рис. 6-32).
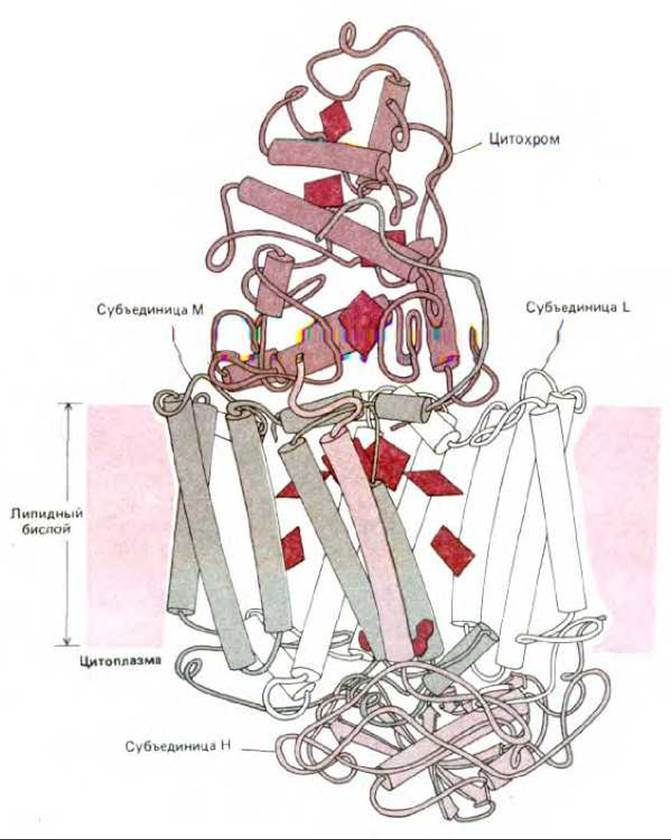
Рис. 6-32. Структура фотосинтезирующего реакционного центра бактерий Rhodopseudomonas viridis по данным рентгеноструктурного анализа кристаллов трансмембранного белкового комплекса. Белковый комплекс состоит из четырех субъединиц: L, М, Н и цитохрома. Субъединицы L и М образуют ядро реакционного центра. Каждая из субъединиц L и М содержит по 5 а-спиралей, пересекающих бислой. Положение коферментов-переносчиков электронов показано цветом. (Изображено J. Richardson по работе Deisenhafer et al. Nature. 318, 618-624, 1985.)
Две «дополнительных» субъединицы (Н и цитохром) сильно увеличивают эффективность фотосинтетической реакции, катализируемой, в общем-то, гетеродимером L-М: цитохром снабжает гетеродимер электронами, а субъединица Н предположительно объединяет реакционный центр со множеством белков. Гетеродимер L-М эволюционно оказался очень консервативным белком, по-видимому, пара тесно связанных между собой белков образует ядро одного из фотосинтезирующих реакционных центров в зеленых растениях.
6-15
6.2.9. Многие мембранные белки диффундируют в плоскости мембраны [16]
Мембранные белки так же, как и мембранные липиды, не могут перескакивать с одной стороны бислоя на другую (такой перескок носит название флип-флоп), но они способны вращаться вокруг оси, перпендикулярной плоскости бислоя (вращательная диффузия). К тому же многие мембранные белки могут перемещаться в плоскости мембраны (латеральная диффузия). То, что некоторые белки плазматической мембраны способны передвигаться в плоскости бислоя, было впервые прямо показано в 1970 г. с помощью экспериментов на гибридных клетках (гетерокарионах), полученных искусственным путем в результате слияния клеток мыши и человека. Для того чтобы различить белки плазматических мембран мыши и человека, были использованы две группы меченых антител. Первоначально мышиные и человеческие белки располагались только в своих областях гетерокариона. Однако примерно за полчаса оба набора белков диффундировали и распространялись по всей поверхности клетки (рис. 6-33). Еще более убедительные доказательства подвижности мембранных белков были получены благодаря открытию процесса, названного пэтчингом (см. разд. 6.5.13). Суть этого феномена заключается в следующем. Если белки клеточной поверхности «сшить» с помощью антител, они собираются в большие кластеры, образуя на поверхности клетки дискретные зоны неправильной формы (пэтчи, от англ. patch). Однако, чтобы антитела могли «сшить» мембранные белки в большие комплексы, эти белки должны свободно перемещаться в плоскости бислоя.
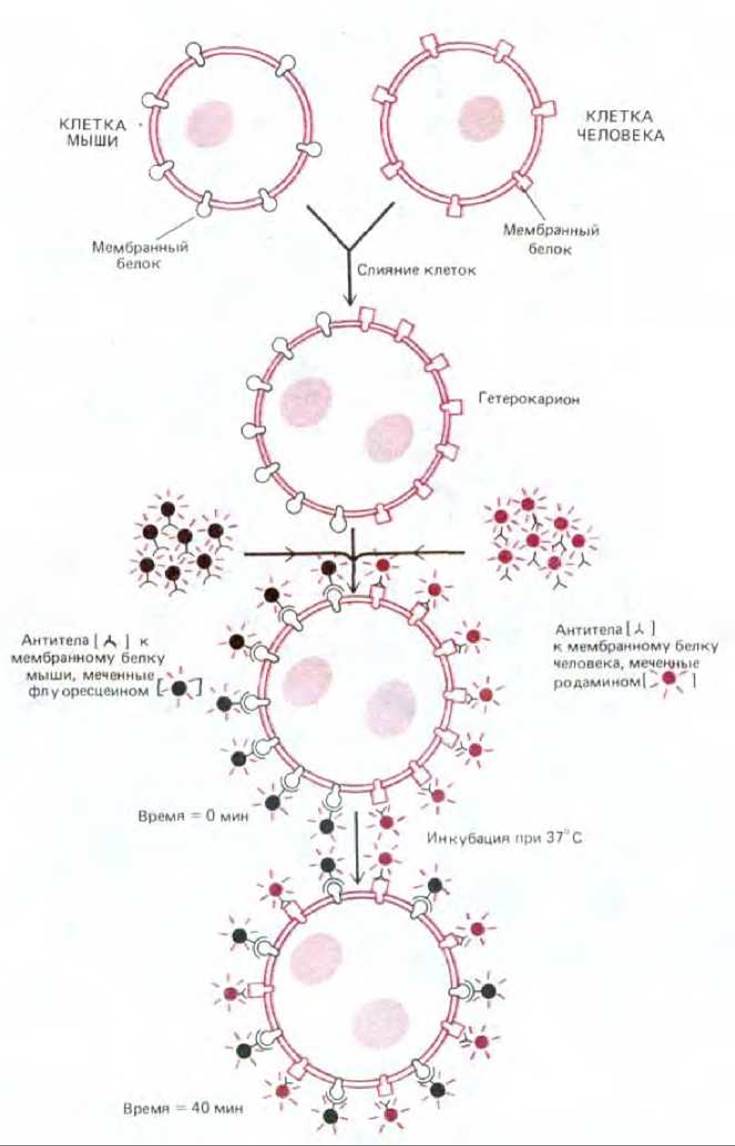
Рис. 6-33. Схема эксперимента, демонстрирующего перемешивание белков плазматической мембраны в клеточных гибридах мышь-человек. Белки мыши и человека первоначально располагаются на своих собственных половинах новообразованной плазматической мембраны гетерокариона, но со временем перемешиваются. Для визуализации белков использовали два вида антител, меченных разными лигандами. (В флуоресцентном микроскопе флуоресцеин имеет зеленый цвет, а родамин - красный.) (По данным L. D. Frye и М. Edidin, J. Cell. Sci., 7, 319-335, 1970, с разрешения The Company of Biologists.)
Скорость латеральной диффузии можно измерить с помощью метода восстановления флуоресценции после ее угашения светом (FRAP, от англ. fluorescence recovery after photobleaching.) Впервые этот метод использовали для измерения скорости диффузии индивидуальных молекул родопсина в мембранах дисков, присутствующих в палочках сетчатки глаза у позвоночных. Как мы уже говорили, родопсин имеет структуру, сходную со структурой бактериородопсина и содержит такую же хромофорную группу-ретиналь. Диффузия молекул родопсина может быть измерена следующим образом. В молекулах родопсина, находящихся на одной стороне палочки, с помощью хорошо сфокусированного луча света большой интенсивности обесцвечивают хромофор, а затем измеряют время, в течение которого обесцвеченные молекулы перемешиваются с необеспеченными за счет диффузии (рис. 6-34), Скорость диффузии (или коэффициент диффузии, D) оказалась равной примерно 5 х 10-9 см2 с-1. Это в 2 раза меньше коэффициента диффузии в мембране молекул фосфолипидов (см. разд. 6.1.2) и одновременно - наибольший коэффициент среди всех известных мембранных белков.
Эту же технику использовали для изучения мембранных белков, не содержащих хромофоров. Вначале к таким белкам присоединяли флуоресцентные лиганды. Обычно для этой цели брали флуоресцентно меченные моновалентные антитела (т. е. фрагменты антител с одним участком связывания антигена и, следовательно, неспособных к сшиванию соседних молекул). Затем эти привязанные лиганды обесцвечивали лазерным лучом, после чего измеряли время, необходимое для того, чтобы мембранные белки, несущие необеспеченные антитела, переместились путем диффузии в обесцвеченную область (рис. 6-35). Измеренные таким образом скорости диффузии различных гликопротеинов плазматической мембраны обычно оказывались по крайней мере в 5-50 раз меньше, чем у молекул родопсина. Относительно низкие скорости диффузии не являются свойством, внутренне присущим индивидуальным молекулам гликопротеинов, поскольку эти же молекулы гликопротеинов в реконструированных синтетических бислоях диффундируют гораздо быстрее. Истинная причина низких скоростей диффузии при измерении методом FRAP для гликопротеинов плазматической мембраны остается неясной. Одно из возможных объяснений заключается в том, что объемные полисахаридные цепи внеклеточных доменов этих молекул взаимодействуют с цепями олигосахаридов других мембранных гликопротеинов, обусловливая медленную диффузию. По крайней мере в некоторых случаях удаление углеводных цепей сильно увеличивало скорость диффузии белков.
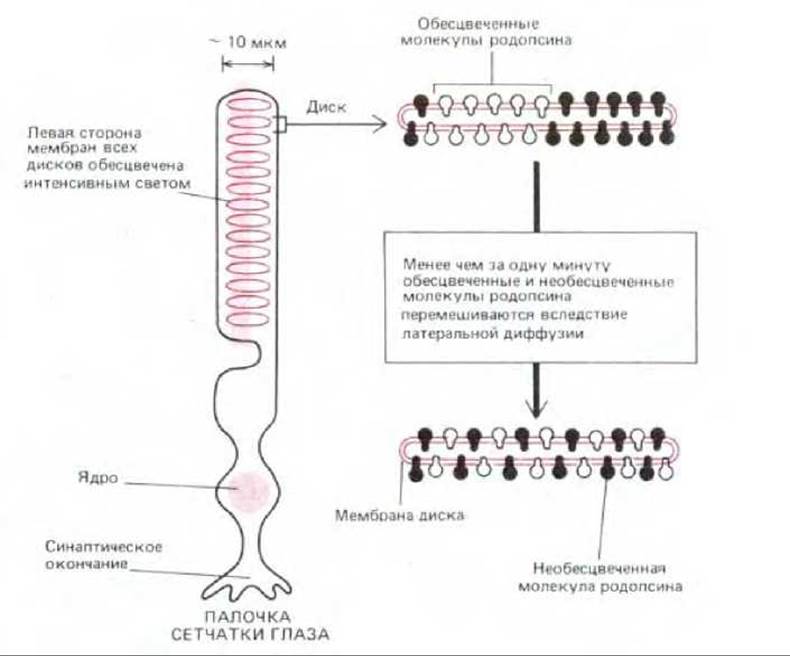
Рис. 6-34. Измерение скорости латеральной диффузии молекул родопсина в мембранах дисков палочки сетчатки. Хромофоры родопсиновых молекул обесцвечиваются на одной стороне клетки; затем измеряется скорость, с которой обесцвеченные и необеспеченные молекулы родопсина перемешиваются при диффузии. (По данным М. Роо и R.A. Cone, Nature, 247, 438-441, 1974.)
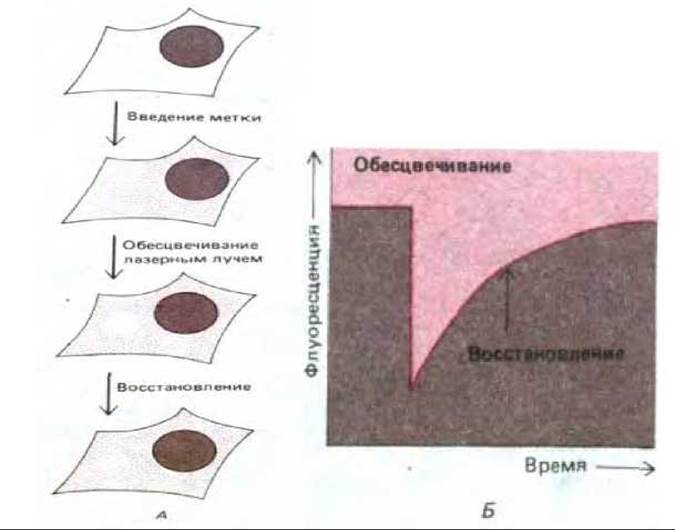
Рис. 6-35. Измерение скорости латеральной диффузии гликопротеина плазматической мембраны. А. Специфический гликопротеин метят флуоресцирующим моновалентным антителом, связывающим только этот белок. После обесцвечивания антител лазерным лучом малого сечения измеряют восстановление интенсивности флуоресценции за счет диффузии обесцвеченных молекул из, а необеспеченных в область облучения. Б. График, показывающий скорость восстановления флуоресценции. Чем больше коэффициент диффузии мембранного гликопротеина, тем быстрее происходит восстановление.
6.2.10. Клетки могут объединять белки и липиды в специфические домены на мембране [17]
Значительным шагом вперед в понимании структуры и функции мембран следует считать осознание того, что биологические мембраны - это двумерные жидкости. Однако ясно, что представление о мембране как о липидном море, в котором свободно плавают белки, оказалось сильно упрощенным. Многие клетки обладают способностью удерживать мембранные белки в специфических доменах в непрерывном липидном бислое. Например, в эпителиальных клетках, выстилающих кишечник или почечные канальцы, некоторые ферменты плазматической мембраны и транспортные белки располагаются только на апикальной поверхности клеток, тогда как другие - только на базальной и латеральной (рис. 6-36). Такое асимметричное распределение мембранных белков существенно для функционирования эпителия (мы обсудим это позже, см. разд. 6.4.11). Липидный состав этих двух мембранных доменов также различен, что указывает на то, что эпителиальные клетки могут ограничивать диффузию между доменами как молекул белка, так и молекул липидов (хотя эксперименты с мечеными молекулами липидов наводят на мысль, что это справедливо лишь для липидных молекул внешнего монослоя мембраны). Такое пространственное разделение белков и липидов, по-видимому, поддерживается (по крайней мере частично) благодаря барьерам, образованным межклеточными контактами особого рода - плотными контактами (см. разд. 14.1.1). Вопрос о том, почему мембранные белки, формирующие межклеточные контакты, не перемещаются латерально во взаимодействующих мембранах (см. рис. 6-38, 5), обсуждается ниже.
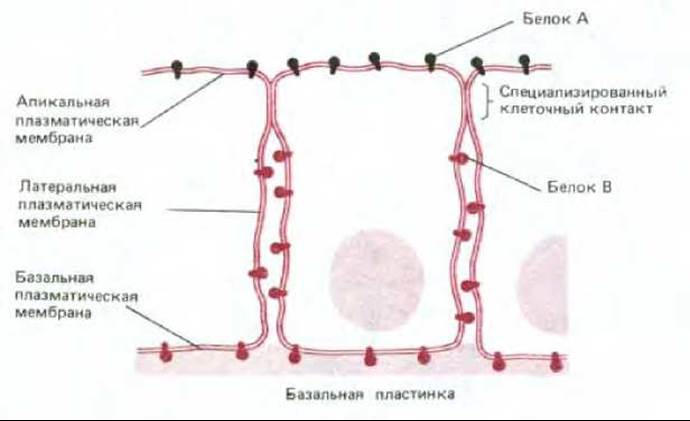
Рис. 6-36. Схематическое изображение клетки эпителия, показывающее, каким образом может ограничиваться область распределения различных белков в плазматической мембране. Белки А (в апикальной мембране) и В (в базальной и латеральной мембранах) способны латерально диффундировать только в пределах соответствующих областей мембраны, а проникнуть в другие участки им мешают, вероятно, специализированные клеточные контакты, называемые плотными контактами. Липидные молекулы внешнего (нецитоплазматического) монослоя плазматической мембраны также не могут диффундировать между двумя доменами, а липиды внутреннего (цитоплазматического) монослоя могут это делать.
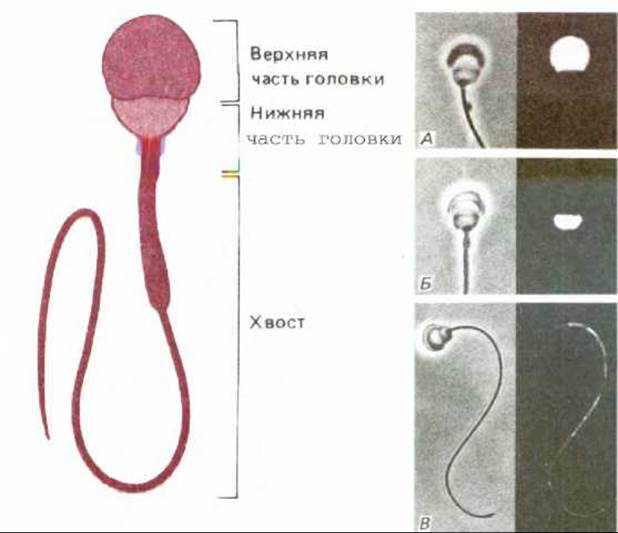
Рис. 6-37. Три домена плазматической мембраны сперматозоида морской свинки, выявляемые с помощью моноклональных антител. Сперматозоид показан схематически в верхней части рисунка. На каждой из трех микрофотографий (А, Б и В) иммунофлуоресцентное окрашивание клеточной поверхности различными моноклональными антителами сочетается с фазово-контрастным изображением тех же клеток. Антитела на (А) метят только верхнюю часть головки, на (Б) - только нижнюю часть головки, а на (В) - только хвост. (А и Б предоставлены D. G. Myles et al., Cell, 23, 434439, 1981. В-предоставлена P. Primakoff и D. G. Myles, Dev. Biol., 98, 417-428, 1983.)
Мембранные домены могут поддерживаться клеткой и без межклеточных контактов. К примеру, сперматозоид животных - это отдельная клетка, состоящая из двух структурно и функционально различных частей - головки и хвоста, покрытых непрерывной плазматической мембраной. При исследовании клеток спермы методом иммунофлуоресцентной микроскопии с использованием различных антител к антигенам поверхности клетки обнаружили, что плазматическая мембрана состоит по крайней мере из трех различных доменов (рис. 6-37). В некоторых случаях антигены могут диффундировать внутри собственных обособленных доменов. Однако остается непонятным механизм того, каким образом поддерживается обособленность этих доменов.
В двух рассмотренных примерах диффузия белков и липидов ограничивалась специализированными доменами, расположенными на непрерывной плазматической мембране. У клеток есть и более сильные способы иммобилизации определенных мембранных белков. Это хорошо видно на примере пурпурных мембран Halobacterium. В данном случае молекулы бактериородопсина собраны в большие двумерные кристаллы, в которых отдельные белковые молекулы фиксированы по отношению друг к другу. Крупные агрегаты такого типа диффундируют очень медленно. В более общем случае ограничение латеральной подвижности специфических мембранных белков связано с их взаимодействием с макромолекулярными образованиями, находящимися снаружи или внутри клеток. Мы уже говорили о том, что некоторые мембранные белки эритроцитов тесно связаны с внутренним цитоскелетом. В клетках других типов белки плазматической мембраны могут быть также связаны с цитоскелетом или внеклеточным матриксом, либо и с тем и с другим. Четыре известных способа иммобилизации специфических мембранных белков показаны на рис. 6-38.
Заключение
Липидный бислой определяет основные структурные особенности биологических мембран, тогда как белки ответственны за большинство мембранных функций. Они выступают в качестве специфических рецепторов и ферментов, осуществляют транспорт через мембрану различных веществ и т. д. Большинство мембранных белков пронизывает бислой в виде одиночной а-спирали; но есть и такие, которые пересекают бислой несколько раз в виде серии а-спиралей. Следующая группа белков ассоциирует с мембраной, не пересекая бислой, а прикрепляясь к той или другой стороне мембраны. Многие из этих белков связаны нековалентными взаимодействиями с трансмембранными белками, есть и такие, которые имеют ковалентную связь с молекулами липидов. Большинство мембранных белков, так же как и липидов, способны свободно перемещаться в плоскости мембраны. С другой стороны, клетки могут и иммобилизовывать специфические мембранные белки, и удерживать их, как впрочем и липиды, в виде специальных доменов в непрерывном липидном бислое.
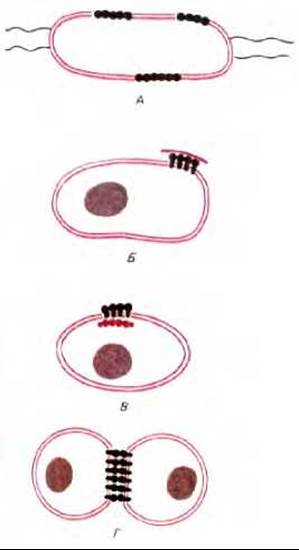
Рис. 6-38. Четыре способа ограничения латеральной подвижности белков плазматической мембраны. Белки могут ассоциировать в большие комплексы (как молекулы бактериородопсина в пурпурной мембране Halobacterium) (А), могут связываться с комплексами макромолекул снаружи (Б) или внутри клетки (В) или взаимодействовать с белками на поверхности другой клетки (Г).