Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Введение в биологию клетки
Малые молекулы, энергия и биосинтез
Биосинтез и создание упорядоченности
В каждый момент времени в клетке протекают тысячи различных химических реакций. Реакции эти связаны между собой и образуют последовательности, в которых продукт одной реакции служит субстратом для следующей. Большинство внутриклеточных реакций можно, вообще говоря, отнести к двум типам: катаболические и биосинтетические. Катаболические реакции мы уже рассмотрели в предыдущем разделе, теперь речь пойдет о реакциях биосинтеза. Такие реакции начинаются от промежуточных продуктов гликолиза и цикла лимонной кислоты (и родственных им соединений) и приводят в результате к образованию более крупных и сложных молекул клетки.
2.4.1. Возможность протекания реакции определяется величиной изменения свободной энергии [18]
Хотя ферменты ускоряют энергетически выгодные реакции, они никак не могут индуцировать энергетически невыгодные реакции. Используя аналогию с водой, можно сказать, что сами по себе ферменты не способны заставить воду течь вверх. Но чтобы клетка могла расти и делиться, в ней должны происходить именно такие процессы: клетки обязаны строить большие и сложные молекулы из малых и простых. Мы уже видели, что это происходит главным образом благодаря ферментам, под действием которых энергетически выгодные реакции, использующие солнечную энергию и производящие тепло, сопрягаются с энергетически невыгодными реакциями, увеличивающими степень биологической неупорядоченности. Рассмотрим более подробно, как достигается такое связывание.
Прежде всего следует более внимательно отнестись к выражению «энергетически выгодная» реакция, которым до сих пор мы пользовались слишком свободно. Как уже указывалось выше, спонтанно могут протекать только те реакции, в результате которых неупорядоченность во Вселенной увеличивается. Неупорядоченность возрастает в том случае, когда энергия выделяется в виде тепла; критерием увеличения неупорядоченности может служить величина, называемая свободной энергией G. Эта величина определяется таким образом, что ее изменение, обозначаемое ∆G, устанавливает меру неупорядоченности, возникающей во Вселенной в результате реакции (схема 2-7). По определению «энергетически выгодными» являются те реакции, при протекании которых высвобождается большое количество свободной энергии;
иначе говоря, такие реакции отличаются большой отрицательной величиной ∆G и создают большую степень неупорядоченности. Такие реакции обладают ярко выраженной тенденцией к спонтанному протеканию, хотя скорость этих реакций будет зависеть и от других факторов, в частности от наличия специфических ферментов (см. ниже). И наоборот, реакции, в которых ∆G имеет положительное значение (например, реакция образования пептидной связи между двумя аминокислотами), повышают упорядоченность Вселенной и не могут протекать самопроизвольно. Такие энергетически невыгодные реакции происходят лишь в тех случаях, когда они связаны с другими реакциями, обладающими столь большими отрицательными значениями ∆G, что и ∆G всего процесса становится отрицательным.
Ход большинства реакций может быть количественно предсказан. Известно много термодинамических параметров, исходя из которых
можно рассчитать изменения свободной энергии ∆G для большинства важных метаболических реакций клетки. Общее изменение свободной энергии при функционировании того или иного метаболического пути будет при этом выражаться как сумма изменений энергии на каждом из этапов этого пути. Рассмотрим две реакции:
А → В и В → Г,
значения ∆G которых равны соответственно +1 и — 13 ккал/моль. (Напомним, что один моль вещества содержит 6 х 1023 молекул.) В случае когда эти реакции сопряжены друг с другом, ∆G сопряженной реакции будет равно — 12 ккал/моль. Из этого следует, что энергетически невыгодная реакция А → Б, которая не может протекать спонтанно, может быть обусловлена энергетически выгодной реакцией В → Г при условии, что существует механизм, обеспечивающий сопряжение этих двух реакций.
2.4.2. Реакции биосинтеза зачастую непосредственно сопряжены с гидролизом АТР
Представим себе типичный биосинтетический процесс, при котором два мономера - А и Б - должны соединиться друг с другом в реакции дегидратации (называемой также конденсацией), сопровождающейся выделением воды:
А-Н + Б-ОН → А-Б + Н2О.
Обратная реакция (называемая гидролизом), в которой молекула воды разрушает ковалентно связанное соединение А-Б, почти всегда будет энергетически выгодной. Это имеет место, например, при гидролитическом расщеплении белков, нуклеиновых кислот и полисахаридов на субъединицы.

Схема 2-7. Свободная энергия и биологические реакции.

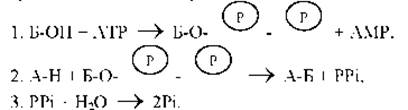
Общая стратегия, обеспечивающая образование клеткой А-Б из А-Н и Б-ОН, включает в себя многоступенчатую последовательность реакций, в результате которых происходит сопряжение энергетически невыгодного синтеза требуемых соединений со сбалансированной выгодной реакцией (рис. 2-17). Гидролизу АТР соответствует большая отрицательная величина ∆G (рис. 2-26), поэтому гидролиз АТР часто играет роль энергетически благоприятной реакции, благодаря которой осуществляются внутриклеточные реакции биосинтеза. На пути от А-Н и Б-ОН к А-Б, сопряженном с гидролизом АТР, энергия гидролиза сначала переводит Б-ОН в промежуточное высокоэнергетическое соединение, которое затем непосредственно реагирует с А-Н, образуя А-Б. Простейший механизм данного процесса включает в себя перенос фосфата от АТР к Б-ОН с образованием Б-ОРО3
![]() причем в этом случае суммарная реакция осуществляется всего лишь в две стадии:
причем в этом случае суммарная реакция осуществляется всего лишь в две стадии:
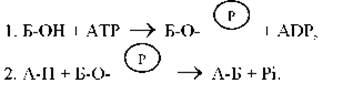
Поскольку образующееся промежуточное соединение ![]() затем вновь разрушается, суммарные реакции можно описать с помощью следующих уравнений:
затем вновь разрушается, суммарные реакции можно описать с помощью следующих уравнений:
А-Н + Б-ОН → А-Б и АТР → ADP + Pi.
Первая, энергетически невыгодная реакция оказывается возможной благодаря тому, что она сопряжена со второй, энергетически выгодной реакцией (гидролиз АТР). Примером сопряженных биосинтетических реакций подобного типа служит синтез аминокислоты глутамина (рис. 2-27).
Величина ∆G гидролиза АТР до ADP и неорганического фосфата зависит от концентрации всех реагирующих веществ и при обычных для клетки условиях лежит в пределах от —11 до —13 ккал/моль (см. разд. 7.1.10). Реакция гидролиза АТР в принципе может быть использована для осуществления термодинамически невыгодной реакции со значением ∆G, равным, скажем, + 10 ккал/моль, при наличии, конечно, соответствующей последовательности реакций. Однако для многих реакций биосинтеза оказывается недостаточным даже ∆G = —13 ккал/моль. В этих и других случаях путь гидролиза АТР изменяется таким образом, что сначала образуются AMP и PPj (пирофосфат) (рис. 2-28). На следующей стадии пирофосфат также подвергается гидролизу; общее изменение свободной энергии всего процесса составляет примерно — 26 ккал/моль.
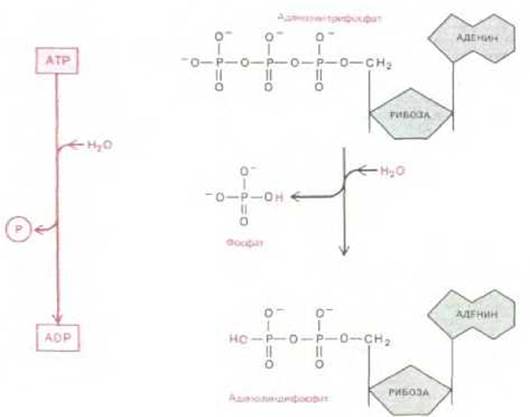
Рис. 2-26. При гидролизе АТР может отщепляться концевой фосфат, при этом выделяется полезная энергия, количество которой составляет в зависимости от внутриклеточных условий от 11 до 13 ккал/моль. Большая отрицательная величина ∆G данной реакции обусловлена рядом факторов. Вследствие отщепления концевого фосфата исчезает энергетически невыгодное электростатическое отталкивание между соседними отрицательными зарядами. Кроме того, высвобождающийся неорганический фосфат-ион стабилизируется благодаря резонансу и образованию энергетически выгодных водородных связей с водой.
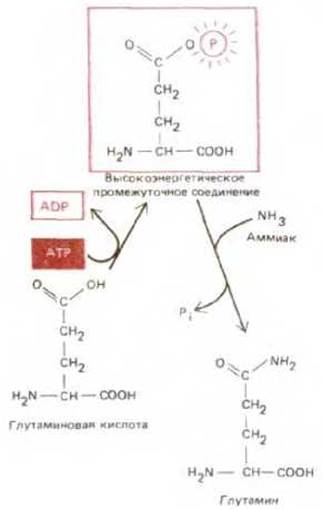
Рис. 2-27. Пример биосинтетической реакции дегидратации, запускаемой гидролизом АТР. Глутаминовая кислота сначала превращается в высокоэнергетическое фосфорилированное промежуточное соединение (соответствует соединению Б-О-Р в тексте), которое затем реагирует с аммиаком с образованием глутамина. В данном примере обе реакции осуществляются на поверхности одного и того же фермента - глутаматсинтетазы. Отметим, что обе молекулы для простоты представлены в незаряженной форме.
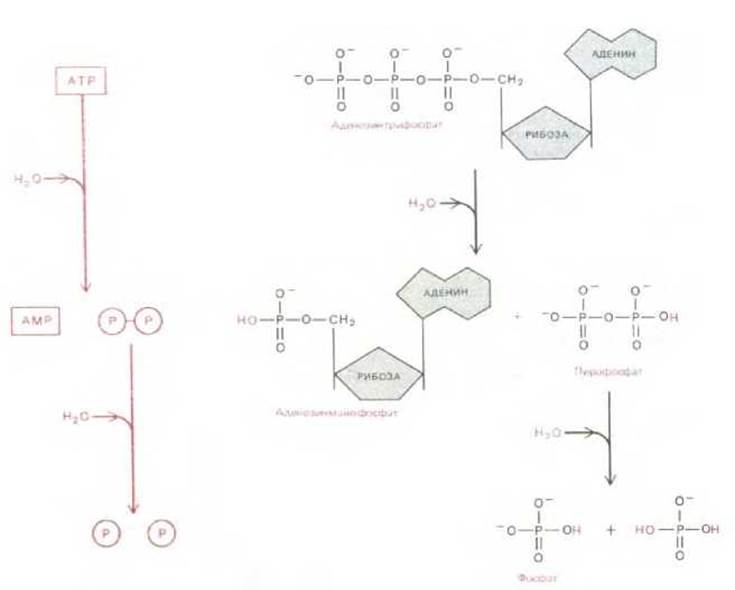
Рис. 2-28. Другой путь гидролиза АТР: сначала образуется пирофосфат, который затем подвергается гидролизу. На этом пути выделяется почти вдвое больше энергии, чем в реакциях, рассматриваемых на рис. 2-26. Показано, что атомы Н, извлеченные из воды, после гидролиза присоединяются к фосфатным группам. Однако при значениях рН, характерных для цитоплазмы, большая часть этих атомов отделяется, образуя свободный ион водорода (Н+).
Каким образом энергия гидролиза пирофосфата используется в биосинтетических реакциях? Один путь можно продемонстрировать на приведенном выше примере синтеза соединения А-Б из А-Н и Б-ОН. С помощью соответствующего фермента Б-ОН может вступить в реакцию с АТР и превратиться в высокоэнергетическое соединение Б-О-![]()
Теперь реакция состоит из трех стадий:
Суммарную реакцию можно представить в следующем виде: А-Н + Б-ОН → А-Б и АТР + Н2О → AMP + 2Рі.
Поскольку фермент всегда ускоряет катализируемую им реакцию как в прямом, так и в обратном направлении, соединение А-Б может распадаться, реагируя с пирофосфатом (реакция, обратная стадии 2). Однако энергетически выгодная реакция гидролиза пирофосфата (стадия 3) способствует поддержанию стабильности соединения А-Б за счет того, что концентрация пирофосфата остается очень низкой (это предотвращает протекание реакции, обратной реакции 2). Таким образом, энергия гидролиза пирофосфата обеспечивает протекание реакции в прямом направлении. Пример важной биосинтетической реакции указанного типа (синтез полинуклеотида) представлен на рис. 2-29.
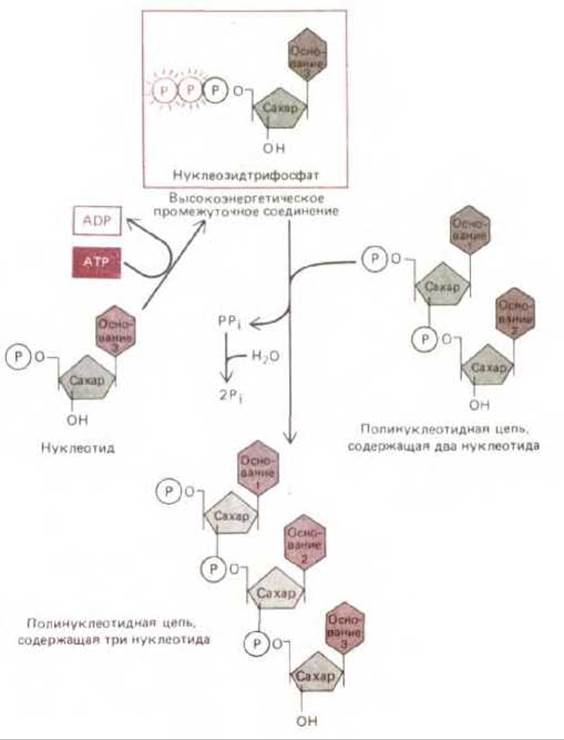
Рис. 2-29. Синтез полинуклеотида (РНК или ДНК) представляет собой многоступенчатый процесс, протекающий благодаря гидролизу АТР. На первом этапе нуклеозидмонофосфат (например, СМР) переходит в активированное состояние путем последовательного присоединения концевых фосфатов с двух молекул АТР. Образующееся высокоэнергетическое промежуточное соединение - нуклеозидтрифосфат, например СТР, - находится в свободном состоянии в растворе до тех пор, пока он не вступит в реакцию с концевым участком растущей цепи РНК или ДНК; в ходе реакции высвобождается пирофосфат. Энергетически крайне выгодный гидролиз последнего с образованием неорганического фосфата способствует тому, что весь процесс протекает в направлении синтеза полинуклеотида.
2.4.3. Коферменты участвуют в переносе специфических химических групп
Поскольку концевая фосфатная связь АТР легко расщепляется с выделением свободной энергии, это соединение служит эффективным источником фосфата для большого числа различных реакций фосфорилирования. Множество разнообразных, химически лабильных связей ведет себя подобным образом. Например, специфические молекулы-переносчики содержат ацетильные или метальные группы, связанные реактивными связями, что позволяет этим группам легко переходить на другие молекулы (табл. 2-2). Одна и та же молекула-переносчик нередко принимает участие во многих различных реакциях биосинтеза, для осуществления которых необходимо наличие ее специфической реакционноспособной группы.
Примером такой молекулы-переносчика может служить ацетил-кофермент А (ацетил-СоА), образующийся при расщеплении глюкозы.
Таблица 2-2. Некоторые коферменты, принимающие участие в реакциях переноса химических групп
|
Кофермент 1) |
Переносимая группа |
|
АТР |
Фосфатная |
|
NADH, NADPH |
Водород + электрон (гидрид-ион) |
|
Кофермент А |
Ацетильная |
|
Биотин |
Карбоксильная |
|
S-Аденозилметионин |
Метильная |
1) Коферментами являются малые молекулы, связанные с некоторыми ферментами и необходимые для проявления их активности. Каждый из перечисленных коферментов представляет собой молекулу-переносчик для небольшой химической группы и участвует в различных реакциях, в которых эта группа переносится на другую молекулу. Некоторые коферменты присоединяются к ферментам с помощью ковалентных связей, другие связаны с ними менее прочно. Ковалентно связанные коферменты иногда называют простетическими группами ферментов.
Он переносит ацетильную группу, присоединенную к СоА лабильной тиоэфирной связью (рис. 2-19). Эта ацетильная группа легко переходит на другую молекулу, такую, например, как молекула жирной кислоты. Другой заслуживающий внимания пример - это биотип, осуществляющий во многих реакциях биосинтеза перенос карбоксильной группы (рис. 230). Молекулы, подобные ацетил-СоА, биотину и АТР, называются коферментами, так как они тесно связаны с поверхностями различных ферментов и необходимы для проявления ферментативной активности. Многие коферменты не могут синтезироваться животными и должны поступать в организм с пищей (из растений и микроорганизмов). Витамины - важнейшие факторы питания, необходимые животным в следовых количествах - часто являются предшественниками требующихся коферментов.
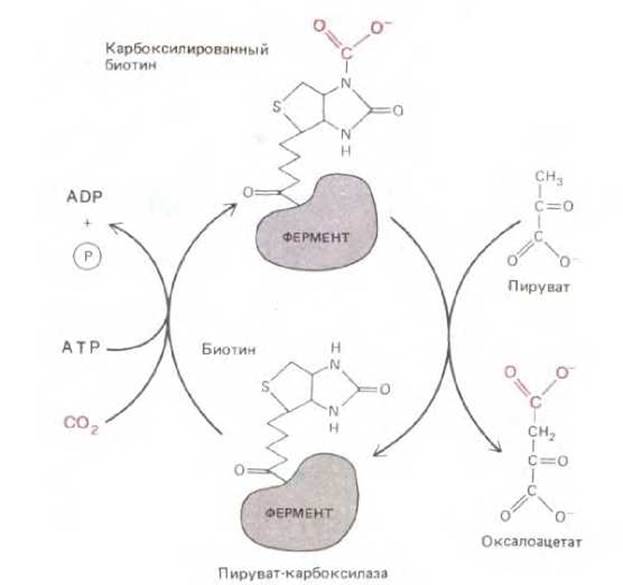
Рис. 2-30. Перенос карбоксильной группы коферментом биотином. Биотин играет роль молекулы-переносчика карбоксильной группы (— СОО-). В показанной последовательности реакций биотин ковалентно связан с ферментом пируват-карбоксилазой. Активированная карбоксильная группа, происходящая из бикарбонат-иона (HCO-3), связывается с биотином в реакции, протекающей за счет энергии гидролиза АТР. Затем гидроксильная группа переносится к метильной группе пирувата с образованием оксалоацетата.
2.4.4. Для биосинтеза необходимы восстановительные эквиваленты
Мы уже видели, что в клетке непрерывно протекают реакции окисления и восстановления. Химическая энергия, заключенная в молекулах питательных веществ, высвобождается в ходе окислительных процессов, тогда как для построения биологических молекул клетка нуждается, кроме всего прочего, в осуществлении ряда восстановительных реакций, протекающих с затратой химической энергии. Ранее рассмотренный нами принцип сопряженных реакций обеспечивает клеткам возможность непосредственного использования химической энергии катаболизма для синтеза NADH (см. рис. 2-21). Затем высокоэнергетическая связь между водородом и никотинамидным кольцом в молекуле NADH снабжает энергией другие термодинамически невыгодные ферментативные реакции, в которых водород (в виде гидрид-иона) переносится на другую молекулу. Поэтому NADH и легко образующийся из него NADPH называют носителями «восстановительной силы».
Чтобы понять, как это происходит на деле, рассмотрим лишь одну ступень биосинтеза - последнюю реакцию в синтезе липидной молекулы холестерола. В этой реакции два атома водорода присоединяются к полициклическому стероидному кольцу, восстанавливая двойную связь углерод—углерод (рис. 2-31). Как и в большинстве реакций биосинтеза, два атома водорода, необходимые для данной реакции, поставляются в виде гидрид-иона молекулы NADPH и протона (Н+) из раствора (Н+ + Н- = 2Н). Как и в случае NADH, гидрид-ион, который должен переноситься от NADPH, входит в состав никотинамидного кольца и легко отщепляется от него, поскольку никотинамидное кольцо становится при этом ароматическим, достигая таким образом наиболее стабильного состояния (см. рис. 2-22). Следовательно, как в NADH, так и в NADPH гидрид-ион присоединен высокоэнергетической связью, при разрыве которой он может быть перенесен на другую молекулу при условии, что имеется подходящий фермент, способный катализировать этот переход.
В химическом отношении различие между NADH и NADPH незначительно: NADPH имеет дополнительную фосфатную группу в той части молекулы, которая удалена от ее активной области (рис. 2-32). В самой реакции эта фосфатная группа не участвует. Однако она служит как бы «рукояткой», с помощью которой NADPH в качестве кофермента связывается с соответствующими ферментами. NADH, как правило, работает с ферментами, катализирующими катаболические реакции, тогда как NADPH взаимодействует с ферментами биосинтеза. Следовательно, катаболические и биосинтетические пути могут регулироваться независимо друг от друга путем изменения количества NADH и NADPH соответственно.
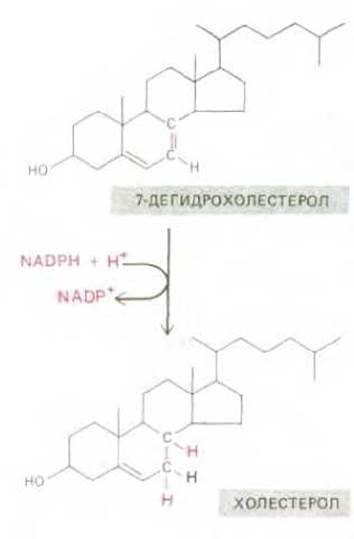
Рис. 2-31. Последний этап одного из путей биосинтеза холестерола. Восстановление связи С—С происходит в результате переноса на нее гидридиона с молекулы-переносчика NADPH и протона (Н+) из раствора.
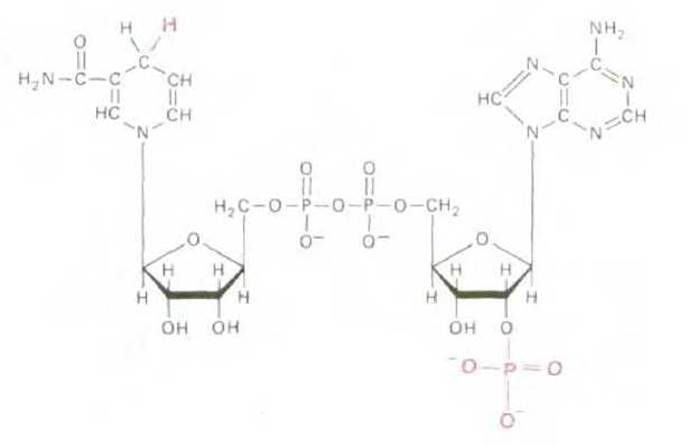
Рис. 2-32. Строение NADPH, отличающегося от NADH (рис. 2-22) только наличием дополнительной фосфатной группы, благодаря которой определенные ферменты (обычно участвующие в процессах биосинтеза) избирательно узнают это соединение.
2.4.5. Синтез биологических полимеров осуществляется путем повторения элементарных реакций дегидратации
Основными макромолекулами, синтезируемыми клетками, являются полинуклеотиды (ДНК и РНК), полисахариды и белки. Эти макромолекулы необычайно разнообразны по структуре и представляют собой наиболее сложные из известных молекул. Несмотря на это, они синтезируются из относительно небольшого числа малых молекул (называемых мономерами или субъединицами) с помощью ограниченного набора химических реакций.
Присоединение мономеров к белкам, полинуклеотидам и полисахаридам крайне упрощенно показано на рис. 2-33. Хотя в реакциях синтеза каждого полимера участвуют ковалентные связи разных типов, а также различные ферменты и кофакторы, тем не менее все эти реакции обнаруживают сильное сходство. Присоединение мономеров в каждом случае происходит путем реакции дегидратации - удаления молекулы воды из состава реагирующих соединений.
Как в обсуждавшемся ранее более общем случае (см. разд. 2.4.2), для образования указанных полимеров требуется химическая энергия, обеспечиваемая в конечном счете обычным путем сопряжения реакции биосинтеза с энергетически выгодной реакцией гидролиза нуклеозидтрифосфата. Для всех трех типов макромолекул по крайней мере один и: вовлеченных в процесс нуклеозидтрифосфатов расщепляется с образованием пирофосфата, который в дальнейшем в свою очередь гидролизуется, поставляя дополнительное количество необходимой для реакции энергии (рис. 2-29).
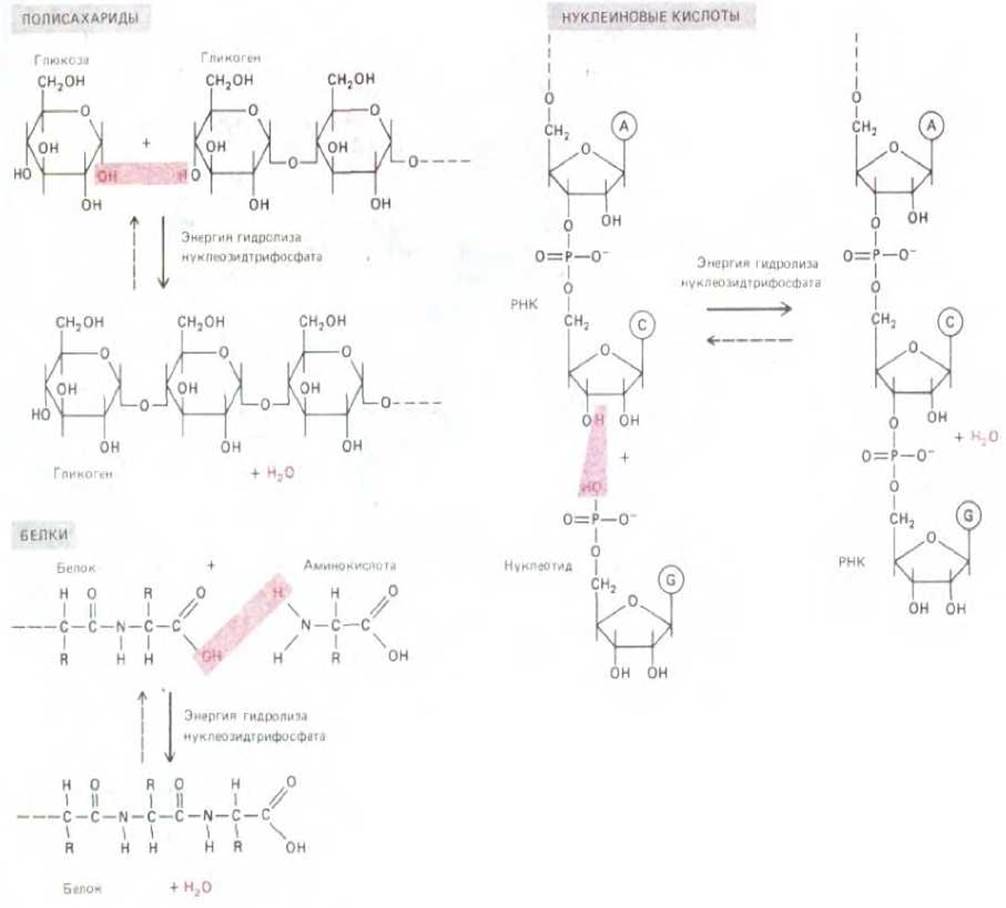
Рис. 2-33. Схематическое изображение реакций полимеризации, приводящих к синтезу биологических полимеров трех типов. В каждом случае при синтезе происходит потеря молекулы воды (дегидратация). На рисунке не отражен тот факт, что перед присоединением каждого из мономеров последние должны быть активированы высокоэнергетическими нуклеозидтрифосфатами. Обратная реакция - распад полимеров всех трех типов осуществляется путем простого присоединения молекул воды (гидролиз).
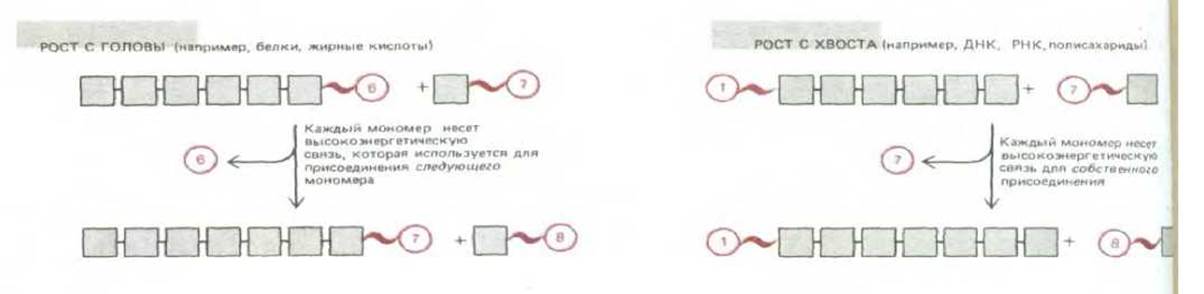
Рис. 2-34. Рост полимеров с головы и с хвоста.
Активированные промежуточные продукты реакций полимеризации могут быть ориентированы двояко, обусловливая полимеризацию либо «с хвоста», либо «с головы». При полимеризации «с головы» активированная связь находится на конце растущего полимера и, следовательно, должна регенерировать при каждом присоединении мономера В этом случае каждый мономер приносит с собой активированную группу, которая будет использована в реакции со следующим мономером данной последовательности (рис. 2-34). При полимеризации «с хвоста» активированная связь, которую несет с собой каждый новый мономер, будет использована для присоединения этого мономера. Для синтеза биополимеров используются оба типа полимеризации. В то время как синтез полинуклеотидов и некоторых простых полисахаридов происходит путем полимеризации «с хвоста», синтез белков осуществляется посредством полимеризации «с головы».
Заключение
Гидролиз АТР обычно сопряжен с энергетически невыгодными реакциями, такими, как биосинтез макромолекул, осуществляемый путем образования фосфорилированных промежуточных продуктов. Другие реакционноспособные молекулы-переносчики, называемые коферментами, переносят в ходе биосинтеза иные химические группы; например, NADPH переносит водород - в виде протона и двух электронов (гидрид-ион), а ацетил-СоА переносит ацетильные группы. Молекулы полимеров, такие, как белки и нуклеиновые кислоты, собираются из небольших активированных молекул-предшественников путем многократного повторения реакций дегидратации.