Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Контроль генной экспрессии
Молекулярно-генетические механизмы, участвующие в образовании разных типов клеток
В начале этой главы рассматривались разнообразные стратегии регуляции активности генов, позволяющие многоклеточному организму образовывать большое число разных типов клеток. Контролирующим генам свойственна некоторая «экономность». Она проявляется в том, что регуляторные белки образуют различные комбинации. Вероятно, этим можно объяснить тот факт, что с регуляторными последовательностями большинства генов высших эукариот связывается много белков. Существование дискретных типов клеток подразумевает, что активность белков- регуляторов в этой комбинаторной сети подчиняется сложной иерархии обратных связей, которые, по-видимому, управляются небольшим числом главных регуляторных белков. Однако логика построения этой сложной сети регуляции генов еще неясна. Например, непонятно, каким образом кратковременный синтез в неподходящем месте главного белка-регулятора гена Antennapedia у дрозофилы превращает антенну в ногу?
В данном разделе мы не ответим на этот конкретный вопрос, но постараемся проанализировать, как сеть, контролирующая активность генов, осуществляет переключения, которые сохраняются в последующих поколениях клеток. Клеточная память является основным условием образования и поддержания стабильности дифференцировавшихся клеток.
Начнем обсуждение этой проблемы с рассмотрения хорошо изученных механизмов дифференцировки в клетках бактерий и дрожжей, хотя некоторые из них, как установлено, не свойственны клеткам высших эукариот.
10-16
10.3.1. У многих бактерий некоторые последовательности ДНК перестраиваются, что приводит к включению и выключению генов [20]
Как отмечалось выше, дифференцировка клеток высших эукариот обычно происходит без заметных изменений в последовательности ДНК (см. разд. 10.1.2). Однако у многих прокариот стабильно наследуемый паттерн регуляции генов достигается путем специальной перестройки ДНК, активирующей или инактивирующей определенные гены. В связи с тем, что все изменения в последовательности ДНК будут точно скопированы в ходе последующих репликаций, изменение состояния активного гена унаследуется всеми потомками клетки, в которой произошла перестройка. Некоторые из таких перестроек в принципе обратимы, и через какой-то достаточно длинный промежуток времени может произойти переключение гена на другой тип активности.
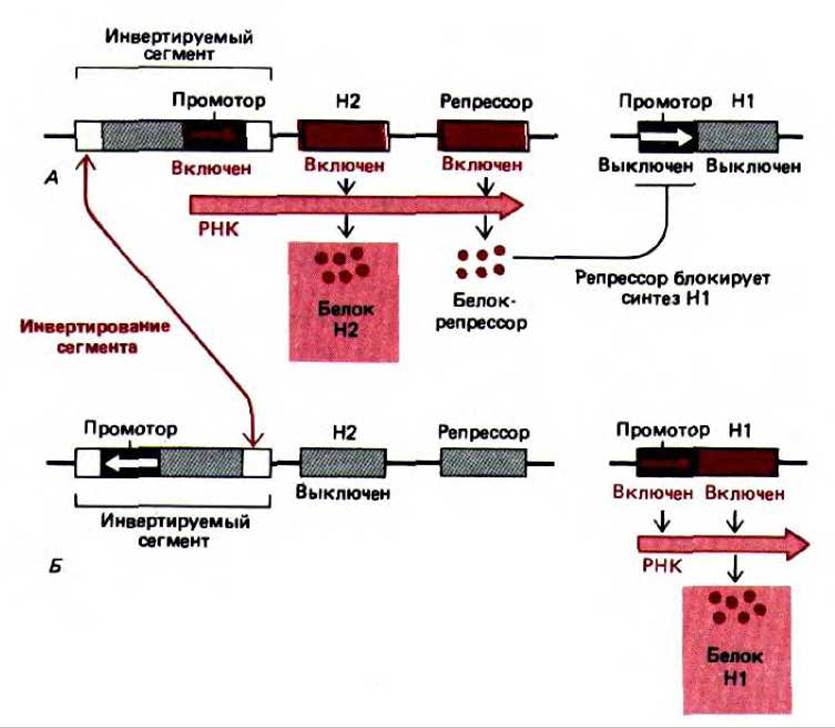
Рис. 10-28. Альтернативная транскрипция двух генов у бактерии Salmonella в результате сайт-специфической рекомбинации, приводящей к инверсии небольшого фрагмента ДНК. Механизм рекомбинации описан выше (см. разд. 5.4.7) и активируется лишь изредка (примерно один раз за каждые 105 клеточных делений). Таким образом, альтернативное образование флагеллина Н12 (А) либо флагеллина Н1 (Б) обычно строго наследуется в каждом клоне клеток.
В качестве примера механизма такого типа дифференцировки клетки можно привести перестройку у бактерии Salmonella. В этом случае определенный фрагмент ДНК размером 1000 нуклеотидных пар инвертируется в ходе реакции, катализируемой ферментом сайт-специфической рекомбинации (рис. 10-28). Итак, ДНК в этом сайте может находиться в двух состояниях. Влияние инверсии на экспрессию гена объясняется тем, что внутри фрагмента размером 1000 нуклеотидных пар находится промотор, ответственный за синтез определенного белка (названного флагеллином), который локализован на поверхности бактериальной клетки. Если этот промотор находится в одной ориентации, то образуется белок одного типа, а если промотор оказывается в другой ориентации-синтезируется другой белок. Поскольку такое переключение происходит очень редко, клоны клеток растут с одним или другим типом флагеллина. Этот феномен носит название фазовой вариации. Скорее всего такой механизм дифференцировки помогает популяции бактерий защищаться от иммунного ответа организма хозяина. Если у хозяина образуются антитела к одному типу флагеллина, некоторые бактерии, флагеллин которых оказался измененным вследствие перестройки генов, смогут выжить и размножиться.
У бактерий из природных популяций часто наблюдается фазовая вариация по одному или нескольким фенотипическим признакам. Подобная «нестабильность» обычно исчезает у стандартных лабораторных штаммов, и поэтому изучено очень мало соответствующих механизмов. Не все из них связаны с инверсией ДНК. Например, бактерия, вызывающая гонорею у человека (Neisseria gonorrhoeae), защищается от иммунного ответа благодаря наследуемой вариабельности свойств клеточной поверхности, возникающей вследствие конверсии генов (см. разд. 5.4.6). Этот механизм зависит от белка гeсА, который участвует в рекомбинации, и основан на переносе определенной последовательности из молчащей «кассеты» в главный ген (см. разд. 10.3.2). При этом может образовываться более 100 вариантов основного белка поверхности бактериальной клетки.
10-17
10-18
10.3.2. Главный регуляторный логус определяет тип спаривания у дрожжей [21]
Дрожжи - это одноклеточные эукариоты, которые могут существовать как в гаплоидном, так и в диплоидном состоянии. Диплоидные клетки образуются в ходе спаривания, при котором две гаплоидные клетки сливаются (см. рис. 13-17). Чтобы это произошло, гаплоидные клетки должны различаться по типу спаривания (по полу). У обычных пекарских дрожжей Saccharomyces cerevisiae существуют два типа спаривания а и а. Клетки двух типов приспособлены для спаривания друг с другом: каждая из них образует диффундирующие сигнальные и рецепторные молекулы, благодаря которым клетки противоположного типа спаривания способны узнавать друг друга и сливаться. Образовавшиеся в результате диплоидные клетки, обозначаемые a/а, обладают иными свойствами и отличаются от каждого из родительских типов. Диплоидные клетки не способны спариваться, но могут формировать споры, которые при мейозе дают начало гаплоидным клеткам.
Генетические изменения, обусловливающие существование трех типов дрожжевых клеток, основаны на действии главных генов- регуляторов. Главные регуляторные белки кодируются единственным локусом, который называется локусом типа спаривания (mating type locus, MAT). Совместное действие этих белков детерминирует тип клетки, определяя транскрипцию многих генов. Механизм действия главных регуляторных белков в данном случае известен (рис. 10-29), и на его примере можно проиллюстрировать принцип комбинационного контроля, описанного выше (см. разд. 10.1.5).
Образование трех главных регуляторных белков, определяющих тип спаривания у дрожжей (белки a1 a2 и а1 само по себе также контролируется, поскольку гаплоидные клетки дрожжей регулярно переключают свой тип спаривания. Молекулярный механизм, ответственный за такое переключение в ходе развития, по-видимому, характерен только для дрожжей: тип клетки зависит от того, какая из двух последовательностей ДНК а (кодирующая белки a1 и a2) или а (кодирующая белок a1 находится в данный момент в локусе МАТ; изменение типа спаривания возникает в результате замены ДНК в этом локусе. Всякий раз, когда клетки a-типа превращаются в клетки a-типа, ген а в локусе МАТ вырезается и замещается вновь синтезированным геном а, скопированным с молчащей копии, расположенной в другом месте генома. Поскольку в данном случае из активного «места» удаляется один ген, а на его место встает другой, этот механизм называют кассетным. Изменение может быть обратимым, поскольку при удалении гена а из локуса МАТ в геноме остается его молчащая копия. Копии молчащих генов а и а действуют как кассеты, «вставленные» в локус МАТ, который можно сравнить с «проигрывателем» (рис. 10-30).
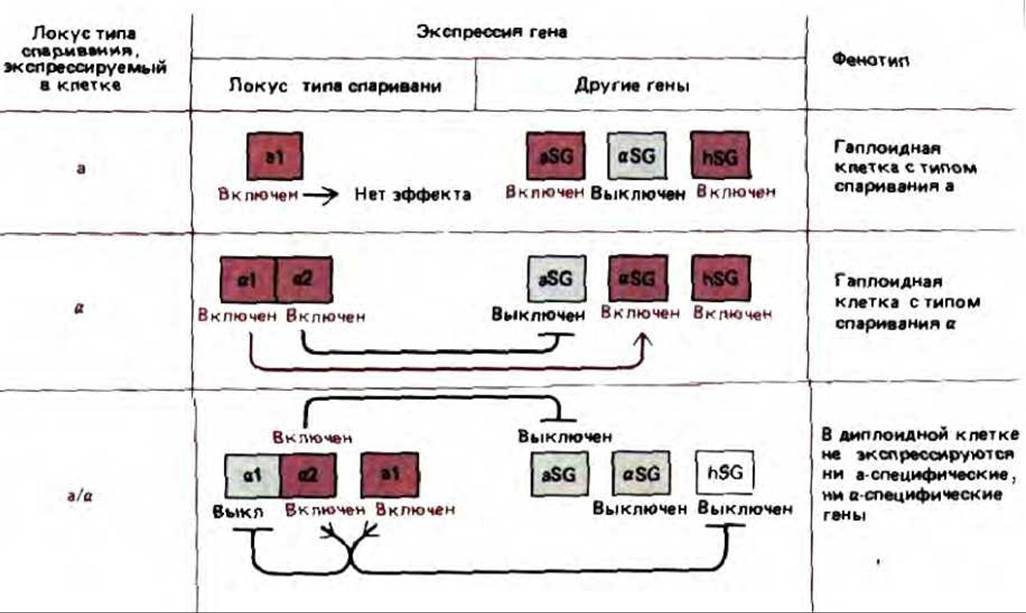
Рис. 10-29. Тип клеток у дрожжей определяется дрожжевыми белками-регуляторами, кодируемыми локусом МАТ. В гаплоидных клетках типа а, в гаплоидных клетках типа a и в диплоидных клетках (типа а/a) транскрибируются различные наборы генов. Гаплоидные клетки экспрессируют либо набор генов aSG (a-специфические гены), либо набор aSG (а-специфические гены) плюс набор hSG (гаплоид-специфические гены). В диплоидных клетках ни один из этих генов не экспрессируется. Белки a1, a2 и a1, детерминируемые локусом МАТ, связываются (поодиночке или в сочетаниях) с определенными последовательностями ДНК в элементах, расположенных перед промотором, и, таким образом, действуют как главные белки-регуляторы. Следует отметить, что белок А1 является белком-активатором, тогда как белок a2 - это белок-репрессор. Сам по себе белок а1 не оказывает никакого действия (а следовательно, клетка, не содержащая локус типа спаривания, принадлежит к типу а). Однако при одновременном синтезе белков а1 и a2 они образуют комплекс, включающий иной набор генов, чем белок a2, действующий сам по себе. Таким образом, простая система из трех белков служит хорошим примером принципа комбинаторного контроля генов, представленного на рис. 10-7.
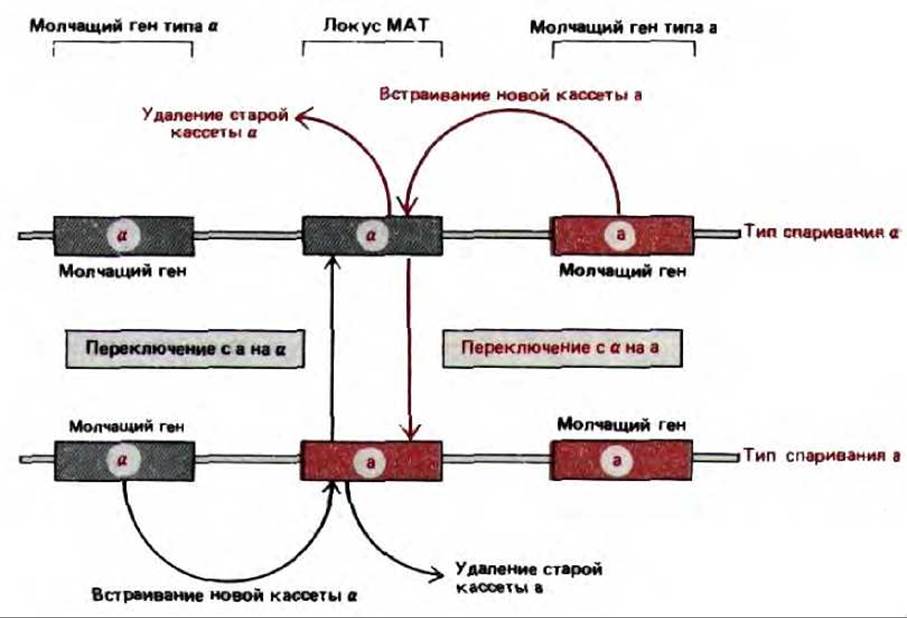
Рис. 10-30. Кассетная модель переключения типа спаривания у дрожжей. Кассетное переключение происходит в ходе процесса конверсии гена, запускаемого, когда нуклеаза НО делает двухцепочечный разрез в определенной последовательности ДНК локуса МАТ. ДНК вблизи разреза затем удаляется и заменяется копией молчащей кассеты, определяющей противоположный тип спаривания.
10.3.3. Способность переключать тип спаривания наследуется асимметрично [22, 23]
Переключение типа спаривания инициируется сайт-специфической эндонуклеазой (НО-эидонуклеазой), являющейся продуктом гена НО, Этот фермент делает двухцепочечный разрез в ДНК локуса МАТ, в результате эта область вырезается и затем ресинтезируется, при этом матрицей служит молчащий ген противоположного типа спаривания (рис. 10-30). Транскрипция гена НО, определяющего, когда и где происходит переключение, строго контролируется. С помощью генетического анализа было показано, что контроль обеспечивают по меньшей мере шесть регуляторных генов (от SWI 1 до SWI 6). В связи с тем, что при почковании дрожжевые клетки делятся асимметрично, одна из двух образовавшихся клеток больше («материнская»), чем другая («дочерняя»). Большинство материнских клеток в ходе дальнейшего роста переключает тип спаривания, а вновь образовавшиеся дочерние клетки (возникающие из почки) не синтезируют продукт гена НО и не способны переключаться до тех пор, пока при делении они не станут материнскими клетками (рис. 10-31). Асимметрия переключения оказалось связанной с асимметричным наследованием белка SWI 5, который присоединяется к ДНК перед геном НО и необходим для его транскрипции. Полагают, что белок SWI5 (либо его активная форма) наследуется лишь материнской клеткой. Остается непонятным, почему этого белка нет в почке, но характер его наследования может служить моделью асимметричной сегрегации некоторых признаков, наблюдаемой у высших эукариот.
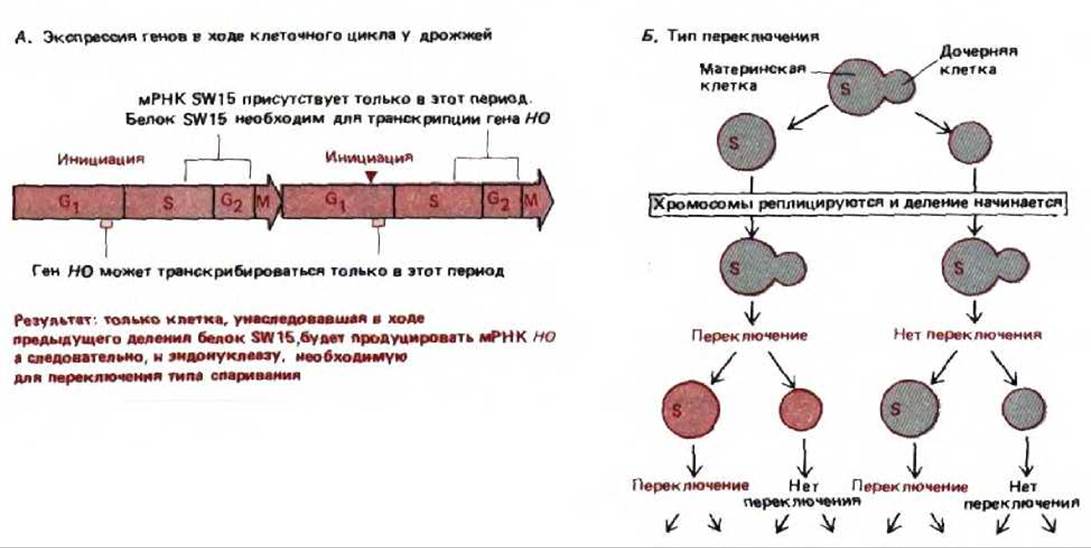
Рис. 10-31. Переключение типа спаривания в гаплоидных клетках S. cerevisiae. А. Экспрессия гена в ходе клеточного цикла дрожжей. В соответствии с приведенной схемой тип спаривания может переключаться лишь в клетках, унаследовавших сайт-специфический ДНК-связывающий белок SW15, необходимый для транскрипции гена НО. Более того, переключение может происходить только в фазе G1 это единственный отрезок времени в ходе клеточного цикла, когда может синтезироваться эвдонуклеаза НО (после окончания синтеза этот белок быстро исчезает, вероятно, в результате интенсивного протеолиза). Так как после каждого переключения происходит репликация ДНК, делящаяся клетка всегда образует две клетки одного и того же типа спаривания. Б. Схема переключения. Деление клеток осуществляется почкованием. После каждого деления можно различить большую «материнскую» и маленькую «дочернюю» клетки. Оказалось, что вновь образованные дочерние клетки не способны переключать свой тип спаривания (обозначенный на этом рисунке разными цветами) до того, как они пройдут через митоз в качестве материнских клеток и вступят в следующую фазу G1. По-видимому, подобная асимметрия отражает асимметричное наследование белка SW15 (обозначенного здесь как S).
10.3.4. Сайленсер, вероятно, «закрывает» участок хроматина у дрожжей [23, 24]
Если бы кодирующие последовательности двух молчащих генов, которые определяют тип спаривания, были лишены промоторов, механизм их активации при перемещении в локус МАТ, вероятно, был бы аналогичен фазовой вариации. Однако определение первичной структуры ДНК показало, что молчащие гены обладают всеми регуляторными сайтами, необходимыми для транскрипции. Эти гены сохраняются в молчащем состоянии благодаря расположенной за ними на некотором расстоянии последовательности ДНК, которая каким-то образом блокирует их экспрессию. Механизм действия таких сайленсеров неизвестен, тем не менее удалось идентифицировать некоторые белки, опосредующие их функции. Это оказалось возможным вследствие того, что у мутантов, дефектных по одному из четырех генов SIR (silent information regulator), экспрессия молчащих кассет все же происходит. Для действия белков SIR необходима сайленсерная последовательность ДНК, причем репрессируются все гены, расположенные на расстоянии нескольких тысяч нуклеотидных пар от сайленсера. Тот же механизм в норме препятствует вырезанию эндонуклеазой НО ДНК в области молчащих генов типов спаривания, в результате перенос осуществляется из молчащего локуса в локус МАТ, но никогда в обратном направлении.
Тот факт, что белки SIR подавляют и транскрипцию, и действие НО-эндонуклеазы, свидетельствует о том, что эти белки могут вызывать изменения в структуре хроматина дрожжей, способствуя «закрытию» целых областей хроматина, лежащих по соседству; в результате эти области становятся недоступными для самых разных ферментов. Два других наблюдения указывают на то, что в механизме действия сайленсеров есть нечто необычное. Для проявления репрессии необходима репликация ДНК, а последовательность, необходимая для инициации репликации (ARS), является существенной составной частью области сайленсера. Подробное изучение этого нового механизма контроля генетической активности может в какой-то мере прояснить влияние структуры хроматина на активность генов в клетках высших эукариот.
10.3.5. Два белка бактериофага, подавляющие синтез друг друга, могут участвовать в стабильном переключении на молекулярном уровне [25]
До сих пор обсуждались некоторые изменения типов клеток, происходящие по типу переключения, т. е. в результате перестройки ДНК. Тот факт, что генетическая информация, содержащаяся в единственном ядре соматической клетки, может дать начало целому растению или позвоночному животному, свидетельствует о том, что вряд ли основным механизмом дифференцировки клеток высших эукариот являются необратимые изменения в последовательности ДНК (хотя именно такие изменения лежат в основе дифференцировки лимфоцитов). Возможно, некоторые наследуемые изменения в экспрессии генов, наблюдаемые у высших организмов, обусловлены механизмом переключения, аналогичным тому, который описан у Salmonella и дрожжей, однако в настоящее время нет данных, подтверждающих эту гипотезу.
Ниже будет показано, что за наследуемый тип регуляции генетической активности могут отвечать несколько механизмов. Наиболее известный среди них - механизм переключения, присущий бактериофагу лямбда. От него зависит, будут ли фаговые частицы размножаться в цитоплазме Е. coli (что приведет к гибели клетки) или же геном фага встроится в ДНК хозяйской клетки и будет автоматически реплицироваться вместе с ней. В переключении участвует белок, кодируемый геномом бактериофага. В его состав входит около 50 генов. Эти гены в двух стабильных состояниях транскрибируются совсем по-разному. Так, например, вирус, который собирается включиться, должен синтезировать белок интегразу, необходимый для встраивания ДНК бактериофага в хромосому бактерии, и, кроме того, должен подавить образование вирусных белков, ответственных за размножение вируса (для клетки-хозяина эти белки летальны). После того как установился один или другой тип транскрипции, он уже стабильно поддерживается. В результате включенный в хромосому профаг может не проявляться в геноме £ coli на протяжении тысяч клеточных поколений.
Не останавливаясь здесь на тонкостях этой сложной системы регуляции, опишем некоторые ее общие свойства. Центром всей системы являются два фаговых белка: белок-репрессор (белок сI) и сrо-белок. Каждый из них блокирует синтез другого белка, связываясь с оператором его гена. Присутствие того или другого белка, в свою очередь, включает ряд иных генов, что в конечном итоге приводит к установлению одного из двух стабильных состояний. В состоянии 1 (лизогенное состояние) доминирует лямбда-репрессор, и именно он, а не сrо-белок синтезируется. В состоянии 2 (литическое состояние) доминирует и синтезируется сrо-белок, а не лямбда-репрессор (рис. 10-32). В состоянии 1 большая часть ДНК стабильно включенного в геном клетки-хозяина бактериофага (профага) не транскрибируется. В состоянии 2 фаговая ДНК интенсивно транскрибируется, реплицируется, упаковывается в новые частицы, которые при лизисе клетки выходят наружу.
Характер событий, которые разворачиваются в бактериальной клетке после заражения фагом лямбда, неслучаен. Если клетки хозяйского штамма растут хорошо, бактериофаг скорее всего пойдет по пути лизогенизации, что позволит его ДНК быстро размножатья вместе с хромосомой хозяина. Если клетка, несущая профаг, оказывается по каким-либо причинам ослабленной, фаг переходит из состояния 1 в состояние 2, чтобы размножиться в цитоплазме клетки и быстро выйти из нее. Информацию о статусе клетки-хозяина «поставляют» фагу другие белки, влияющие на переключение белка, репрессора и сrо-белка. На примере бактериофага лямбда можно убедиться в том, что относительно сложная модель поведения может определяться немногими белками-регуляторами, которые взаимно контролируют синтез и активность друг друга. Если вспомнить, какое количество белков содержится в эукариотической клетке, возможности, открывающиеся для регуляции активности генов, могут ошеломить.
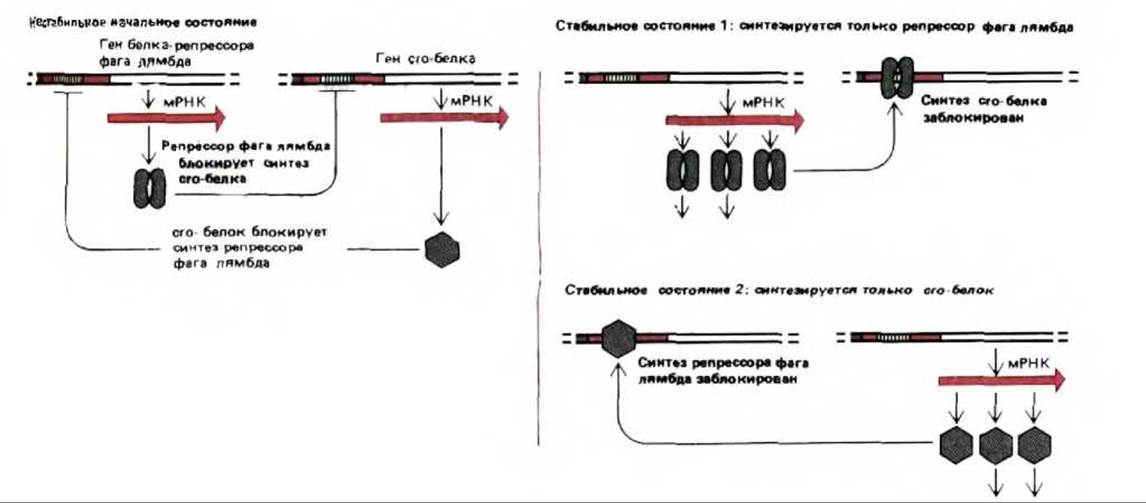
Рис. 10-32. Регуляторная система, определяющая поведение бактериофага лямбда в хозяйских клетках Е. coli. В стабильном состоянии 1 (лизогенное состояние) синтезируются большие количества белка-репрессора фага лямбда. Этот регуляторный белок выключает синтез ряда белков бактериофага, включая сrо-белок. В результате фаговая ДНК встраивается в хромосому Е. coli и автоматически дуплицируется вместе с ней по мере роста бактерии. В стабильном состоянии 2 (литическое состояние) синтезируются большие количества сrо-белка. Этот регуляторный белок выключает синтез белка-репрессора фага лямбда. В результате образуется много фаговых белков, вирусная ДНК свободно реплицируется в клетках Е. coli, формируются новые частицы бактериофага, что приводит к гибели клетки. Кооперативное и конкурентное взаимодействие между репрессором лямбда и сrо-белком способствует переключению по типу «все или ничего» между этими двумя состояниями.
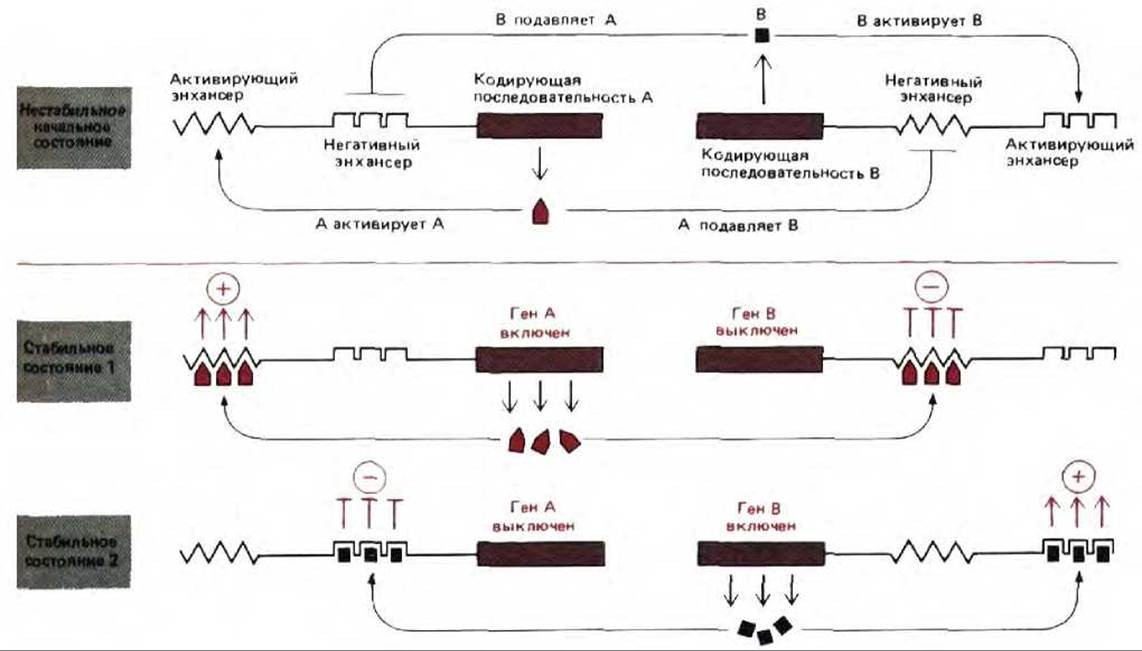
Рис. 10-33. Два главных белка-регулятора способствуют молекулярному переключению у эукариот. Следует отметить, что один и тот же белок может оказывать либо активирующее, либо репрессирующее действие на транскрипцию в зависимости от того, с какой последовательностью ДНК он связывается. Примеры такого типа действия, как полагают, встречаются среди ДНК-связывающих белков, контролирующих направление путей развития на ранних стадиях зародыша у дрозофилы.
10.3.6. Регуляторные белки у эукариот тоже могут детерминировать альтернативные стабильные состояния
Генетический анализ развития дрозофилы свидетельствует о том, что на строение белка у этой мухи влияет более 30 белков (см. разд. 16.5). Многие из этих белков являются главными белками-регуляторами, которые связываются с энхансерами и контролируют транскрипцию самых разных генов. Некоторые главные регуляторные белки стимулируют свою собственную транскрипцию, подавляя в то же время транскрипцию аналогичных главных генов, которые экспрессируются в других частях зародыша. Главенствующая роль энхансеров в контроле транскрипции эукариотических генов позволяет многим позитивным и негативным сигналам на расстоянии влиять на один и тот же ген. Это привело к развитию обширной сети реагирующих друг с другом белков-регуляторов (см. рис. 10-73). Однако для иллюстрации общих принципов, лежащих в основе клеточной памяти такого типа, можно ограничиться простой двухгенной системой, аналогичной системе переключения у фага лямбда (рис. 10-33).
О сложности регуляторной сети у высших эукариот можно судить, изучая последовательность ДНК регуляторной области гена, кодирующего главный белок-регулятор, который контролирует развитие многих основных частей тела у дрозофилы. Сравнивая очень длинные регуляторные области этого гена у двух не близкородственных видов дрозофилы, удалось выявить 20 коротких эволюционно консервативных последовательностей, расположенных определенным образом. Полагают, что каждая из них играет важную роль в связывании регуляторних белков (рис. 10-34).
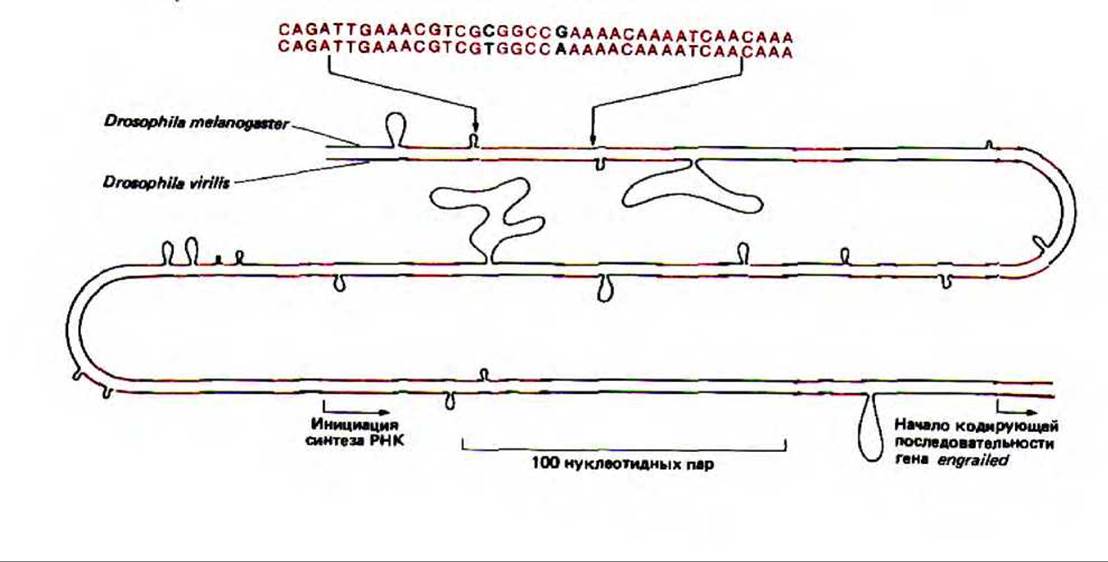
Рис. 10-34. Сравнение части регуляторной области перед геном engrailed у двух типов дрозофилы. Представлены соответствующие последовательности у Drosophila melanogaster и Drosophila virilis, причем области, где гомология достигает 90%, выделены цветом. Порядок нуклеотидов указан в верхней части рисунка. Петли соответствуют тем местам, где произошли вставки или делеции нуклеотидов в процессе дивергенции этих видов от общего предка около 60 млн. лет назад. (С любезного разрешения Judith A. Kassis и Patrick H. O'Farrell.)
10-19
10.3.7. Кооперативно связывающиеся кластеры белков-регуляторов могут передаваться непосредственно от родителей к потомкам [26]
Существует несколько объяснений устойчиво наследуемой картины экспрессии генов. Одно из них основано на том, что с определенным участком хроматина кооперативно связывается множество копий регуляторного белка. Если этот белковый кластер остается соединенным с ДНК во время репликации, то часть его получает «в наследство» каждая из дочерних молекул ДНК. Поскольку связывание данного белка с ДНК носит кооперативный характер, унаследованная часть белкового кластера будет инициировать присоединение дополнительных белковых субъединиц, что в результате обеспечит реконструкцию всего кластера. Таким образом, данный функциональный статус гена наследуется прямо и непосредственно с помощью прочно связанных с ДНК хромосомных белков (рис. 10-35). В принципе подобные непосредственно наследуемые белковые кластеры могут поддерживать индивидуальные гены в постоянно включенном или постоянно выключенном состоянии.
В настоящее время еще нет убедительных доказательств в пользу описанного здесь механизма генетической регуляции, однако имеются некоторые примеры, свидетельствующие о том, что этот механизм может иметь большое значение.
10.3.8. В клетках высших эукариот гетерохроматин содержит особым образом конденсированные области ДНК [27]
Регуляторные белки, связывающиеся с определенными последовательностями ДНК в эукариотических клетках, должны взаимодействовать не просто с молекулой ДНК, как у бактерий, а с ДНК, которая на всем своем протяжении связана с нуклеосомами. Необходимость транскрибировать ДНК в составе хроматина несомненно усложняет контроль транскрипции, однако о том, как действуют соответствующие механизмы, известно очень мало. С уверенностью можно утверждать лишь то, что у эукариот изменения в упаковке ДНК влияют на экспрессию генов. Как отмечалось выше, сайленсер, регулирующий транскрипцию у дрожжей, каким-то образом «закрывает» участки хроматина, расположенные с ним по соседству, и делает их недоступными для транскрипции и для воздействия эндонуклеазы (см. разд. 10.3.4). Однако задолго до открытия этого явления изучение клеток высших эукариот продемонстрировало существование гораздо более сильно закрытого хроматина; при этом в его структуре наблюдались видимые изменения.
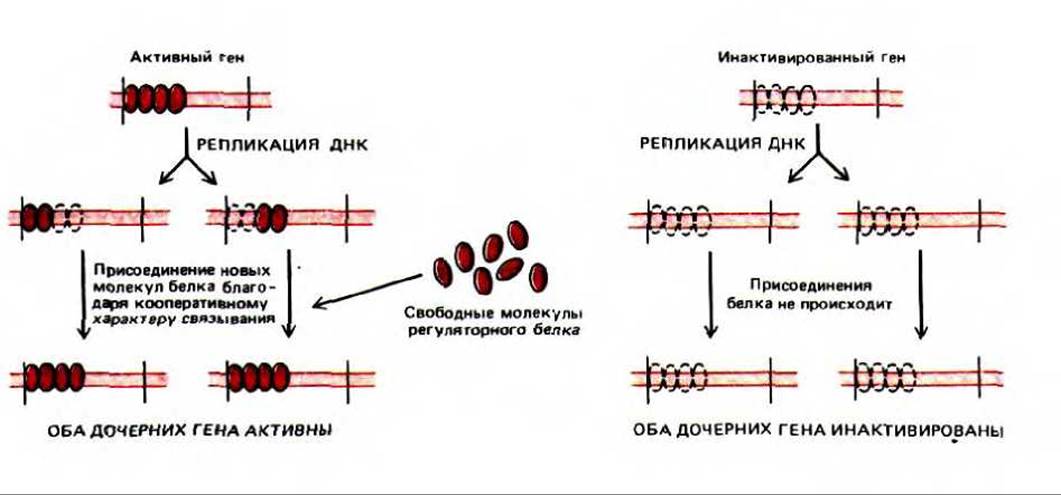
Рис. 10-35. Механизм, объясняющий прямое наследование состояния экспрессии гена в ходе репликации ДНК. Согласно этой гипотетической модели, части кооперативно связанного хластера белков-регуляторов непосредственно переносятся от родительской спирали ДНК к обеим дочерним молекулам. Унаследованный белковый кластер способствует тому, что каждая из дочерних спиралей ДНК связывает дополнительные копии тех же регуляторных белков. Поскольку связывание является кооперативным (см. рис. 9-15), ДНК, синтезировавшаяся на такой же родительской спирали, но без присоединенных регуляторных белков, не будет их связывать. Если присоединенный белок-регулятор выключает транскрипцию гена, то инактивированное состояние гена будет непосредственно наследоваться, как это происходит в случае инактивации Х-хромосомы. Если связанный белок-регулятор включает транскрипцию гена, будет наследоваться активное состояние гена.
Изучение хромосом под световым микроскопом, проводившееся в 30-е годы, показало, что некоторые их участки не способны деконденсироваться в интерфазе и, по-видимому, сохраняют свое высоко конденсированное состояние, характерное для метафазных хромосом (см. I разд. 9.2.2). Эти области были названы гетерохроматином в отличие от остального хроматина в интерфазном ядре, который носит название эухроматина. Некоторые участки хромосом конденсируются в гетерохроматин во всех клетках организма. В митотических хромосоми человека такой конститутивный гетерохроматин локализуется вокруг центромер и при специальном окрашивании легко выявляется в виде темноокрашенных зон (рис. 10-36). У некоторых других млекопитающих конститутивный гетерохроматин обнаруживается и в определенных зонах в плечах хромосом. В интерфазе участки конститутивного гетерохроматина могут агрегировать, образуя хромоцентры (см. рис. 9,43). У млекопитающих число и расположение таких хромоцентров зависит от типа клетки и стадии развития. Большинство областей конститутивного гетерохроматина содержит относительно простые тандемно-повторяющиеся последовательности, называемые сателлитной ДНК. Эти многократно повторяющиеся участки не транскрибируются, и их функция, равно как и функция формируемых ими в интерфазе конденсированных структур, остается неясной.
Некоторые области ДНК в интерфазе конденсируются и формируют гетерохроматин лишь в определенных клетках. Полагают, что эти области также не транскрибируются, однако они не состоят из простых последовательностей. Общее количество такого факультативного гетерохроматина заметно варьирует в различных клетках: в эмбриональных клетках его совсем немного, тогда как высокоспециализированные клетки отличаются высоким его содержанием. Можно предположить, что по мере развития клетки все больше и больше генов становятся неактивными вследствие того, что их ДНК приобретает конденсированную конформацию, которая не позволяет генам взаимодействовать с белками-активаторами. Большая часть данных о факультативном гетерохроматине получена при изучении инактивации одной из двух Х-хромосом в клетках самок млекопитающих.
10.3.9. Инактивация Х-хромосомы наследственно предопределена [28]
Все клетки женских особей млекопитающих имеют две Х-хромосомы, а клетки мужских организмов - одну Х- и одну Y-хромосому. Предполагают, что двойная доза продуктов генов, входящих в состав Х-хромосомы, летальна для организма; возможно, именно поэтому в женских клетках возник специальный механизм, ответственный за то, что одна из двух Х-хромосом постоянно находится в инактивированном состоянии. У мышей такая инактивация происходит между третьим и шестым днем эмбрионального развития: в каждой клетке женской особи с равной вероятностью одна или другая Х-хромосома конденсируется и образует гетерохроматин. Такие конденсированные хромосомы можно увидеть в световой микроскоп: в интерфазе они представляют собой четко оформленные структурные образования, называемые тельцами Барра, которые локализованы в окрестностях ядерной мембраны. Они реплицируются в поздней S-фазе; большая часть составляющей их ДНК не транскрибируется ни в одной из дочерних клеток. Поскольку инактивированная Х-хромосома устойчиво наследуется, каждый женский организм имеет мозаичное строение в том смысле, что он образован клональными группами клеток: примерно в половине групп активна Х-хромосома, унаследованная по материнской линии (Хм), а в другой половине - Х-хромосома, унаследованная от отца (Х0). Иными словами, клетки, в которых экспрессируется Хм или, наоборот, Х0, расположены во взрослом организме небольшими кластерами, что отражает стремление сестринских клеток оставаться в тесном контакте друг с другом в процессе эмбрионального развития и роста организма, в то время как на ранних стадиях развития происходит некое перемешивание (рис. 10-37).
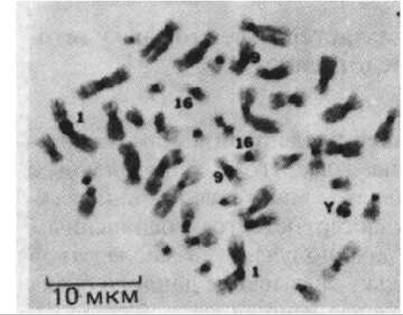
Рис. 10-36. Хромосомы человека в метафазе. Специальная техника окрашивания позволяет выявить области конститутивного гетерохроматина (темные участки). Некоторые хромосомы помечены цифрами и буквой. (С любезного разрешения James German.)
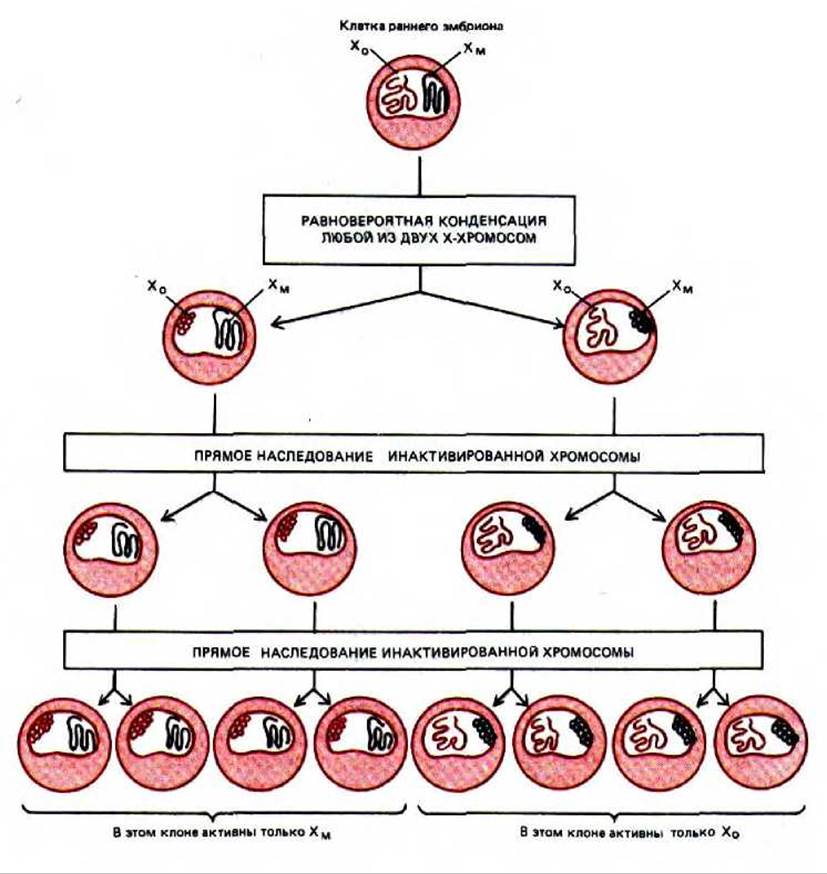
Рис. 10-37. Схема, иллюстрирующая клональное наследование конденсированной неактивной Х-хромосомы, которое имеет место у самок млекопитающих.
Процесс конденсации, в ходе которого образуется гетерохроматин X-хромосомы, имеет тенденцию распространятся вдоль хромосомы.
Это было продемонстрировано в экспериментах с мутантными особями, в клетках которых одну из Х-хромосом присоединили к концу аутосомы (неполовой, соматической хромосомы). В таких мутантных клетках участки аутосом, граничащие с инактивированной Х-хромосомой, часто конденсировались в гетерохроматин, что сопровождалось наследуемой инактивацией содержащихся в них генов. Полученные данные позволяют предполагать, что инактивация Х-хромосом - это кооперативный процесс, который можно рассматривать как «кристаллизацию», распространяющуюся из центра кристаллизации, расположенного на Х-хромосоме. После завершения конденсации хроматина такая конденсация наследуется в ходе всех последующих репликаций ДНК благодаря механизму, аналогичному тому, который представлен на рис. 10-35. Конденсированная хромосома может вновь стать активной при формировании половых клеток. Таким образом, в ДНК, входящей в состав этой хромосомы, не происходит никаких изменений.
10.3.10. Гены дрозофилы могут выключаться благодаря наследуемым свойствам структуры хроматина [29]
Феномен, аналогичный инактивации Х-хромосомы у самок млекопитающих, имеет место и у дрозофилы. Для его изучения весьма эффективными оказались генетические методы. У мух, несущих хромосомные перестройки, в результате которых середина гетерохроматиновой области переносится в эухроматин, эухроматиновые гены, оказавшиеся поблизости от гетерохроматина, инактивируются. Ситуация аналогична присоединению аутомосомы к неактивной Х-хромосоме у млекопитающих; инактивация в обоих случаях происходит одинаково: зона инактивации распространяется от точки разрыва хромосомы и захватывает один или несколько генов. Скорость «эффекта распространения» в разных клетках различна, но зона инактивации, возникшая в эмбриональной клетке, стабильно наследуется всеми последующими поколениями клеток (рис. 10-38).
Изучение описанного эффекта у дрозофилы показало, что скорость распространения зоны инактивации меньше у мух, геном которых содержит дополнительный конститутивный гетерохроматин. Возможно, это связано с тем, что в клетках таких мух мало белков, необходимых для образования гетерохроматина. Аналогичным действием обладают и многие генные мутации. Поскольку соответствующие гены клонированы и секвенированы, можно надеяться, что в скором будущем белки, участвующие в образовании гетерохроматина у дрозофилы, тоже будут известны.
Независимо от того, каковы молекулярные механизмы упаковки определенных областей генома эукариот в гетерохроматин, сам феномен гетерохроматизации следует отнести к таким регуляторным процессам, которые отличают клетки эукариот от клеток бактерий. Особенность такой уникальной формы регуляции состоит в том, что в данном случае память о функциональном статусе гена хранится в виде наследуемой структуры хроматина и не обусловлена существованием стабильной обратной связи саморегулирующихся белков-регуляторов, которые в ядре могут менять свою локализацию. Неизвестно, действуют ли механизмы такого типа лишь в случае инактивации больших областей хромосомы или же они могут работать и на уровне одного или нескольких генов. Данные, приведенные ниже, позволяют предположить, что экспрессия отдельных генов часто регулируется близлежащей контролирующей последовательностью и не зависит полностью от общего хромосомного окружения.
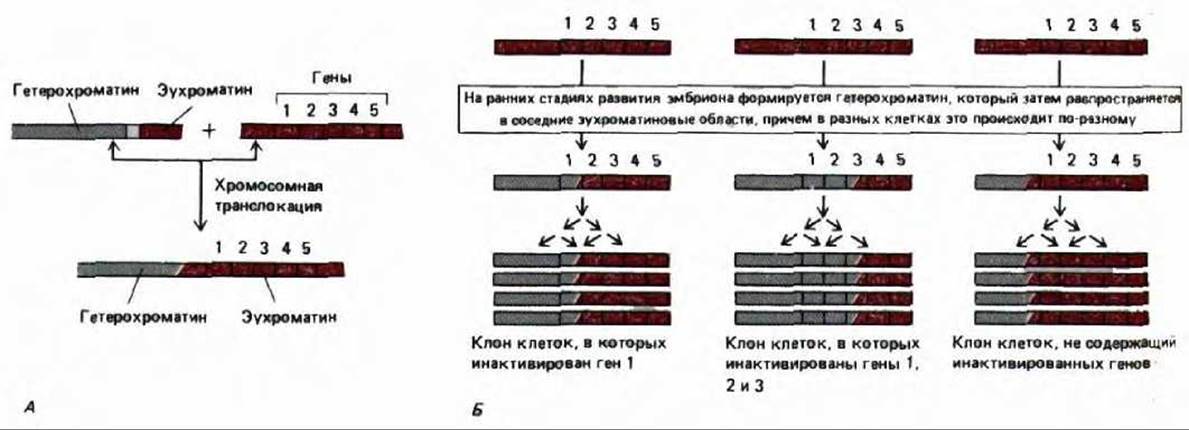
Рис. 10-38. Эффект положения мозаичного типа у дрозофилы. Распространению гетерохроматина (обозначен серым цветом) в соседние эухроматиновые области обычно препятствуют специальные пограничные последовательности неизвестной породы. Однако у мух, несущих в хромосомах определенные транслокации, эти пограничные последовательности отсутствуют. А. На ранних стадиях развития таких мух гетерохроматин начинает распространяться в соседнюю область хромосомы, продвигаясь в разных клетках на разные расстояния. Б. Такое распространение вскоре останавливается, однако достигнутый уровень распространения гетерохроматина наследуется; в результате получаются большие клоны клеток-потомков, у которых одни и те же гены сконденсированы в гетерохроматин и, следовательно, инактивированы (отсюда и «мозаичный» вид у некоторых из этих мух). Это явление имеет много общего с инактивацией Х-хромосомы у млекопитающих.
10.3.11. Для оптимальной экспрессии гена часто бывает необходимо его определенное положение в хромосоме [30]
Гены, перенесенные в другие участки хромосомы, транскрибируются в зависимости от типа клетки. Следовательно, они должны нести с собой информацию, необходимую для их селективной экспрессии в соответствующих клетках. В качестве примера можно привести ген дрозофилы Sgs-3, которому для правильной транскрипции в слюнных железах необходимо 600 нуклеотидных пар, расположенных перед ним; установлено, что его транскрипция осуществляется с нормальной скоростью почти в любом сайте (но не в гетерохроматине) политенной хромосомы. Подобным образом трансгенные млекопитающие, содержащие фрагмент тканеспецифического гена, экспрессируют этот ген в соответствующих клетках, но только в том случае, если фрагмент достаточно длинен и несет большую часть последовательности энхансера.
Большинство привнесенных генов в клетках трансгенных животных для правильной экспрессии требуют гораздо больше фланкирующей последовательности, чем ген Sgs-3. Более того, у разных трансгенных особей наблюдаются разные уровни активности этих генов. Так как подобные вариации зависят от того, где трансген встроился в хромосому животного-хозяина, их называют эффектом положения в хромосоме. Некоторые результаты, полученные при встраивании гена альфа-фетопротеина мыши в случайные области ее генома, представлены в табл. 10-2. В данном примере ген активен только в тех тканях, где он экспрессируется и в норме, однако уровень его транскрипции обычно в пять-десять раз ниже, чем он должен быть в тех тканях, где его активность высока. И наоборот, уровень транскрипции может быть аномально высок в тканях, где обычно уровень экспрессии этого гена низок.
Если ген ß-глобина человека (для которого характерен сильный эффект положения при экспрессии в эритроцитах трансгенных мышей) соединить с фрагментом ДНК, который обычно расположен на расстоянии 50000 нуклеотидных пар от его промотора, эффект положения исчезает и полностью восстанавливается транскрипционная активность.
Таблица 10-2. При экспрессии генов, перенесенных в геном мыши, обычно проявляется эффект положения. У независимо полученных трансгенных особей уровень активности генов различается
|
Процент от тотальной мРНК в «летках |
|||||
|
Желточного мешка |
печени |
кишечник |
мозга |
Копийность гена на клетку |
|
|
Эндогенный ген |
20 |
5 |
0,1 |
0 |
2 |
|
Трансгенная особь 1 |
3,4 |
1 |
0,1 |
0 |
4 |
|
Трансгенная особь 2 |
4,8 |
30 |
1,3 |
0 |
4 |
|
Трансгенная особь 3 |
4,4 |
13 |
4,7 |
0 |
4 |
|
Трансгенная особь 4 |
0,4 |
0,4 |
0 |
0 |
12 |
В состав фрагмента ДНК, который был инъецирован в оплодотворенную яйцеклетку мыши, помимо гена альфа-протеина «ходила последовательность размером 14000 нуклеотидных нар. Эта последовательность содержала три энхансера, влияющих на экспрессию гена альфа-фетопротеина.
Сравнение уровней синтеза мРНК инъецированного Ієна и мРНК, образующейся в норме эндогенным геном в указанных тканях зародыша, проводили методом гибридизации. (По R. Е. Hammer et al., Science 235:53-58, 1987.)
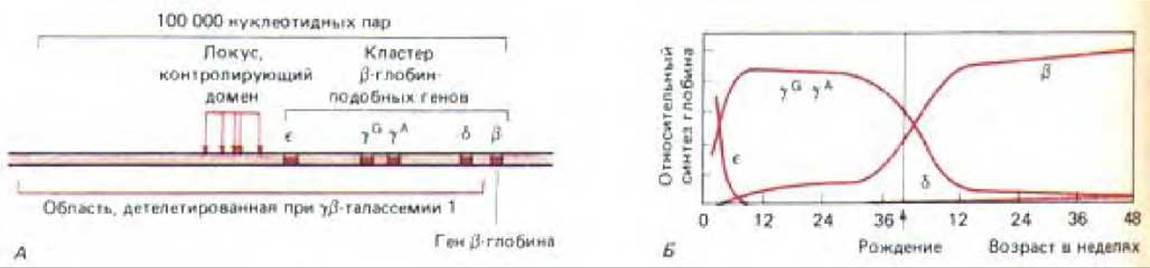
Рис. 10-39. Кластер ß-подобных глобиновых генов у человека. А. Организация этих генов. Представлен большой участок хромосомы, содержащей 100000 нуклеотидных пар. Он содержит кластер сверхчувствительных к нуклеазе сайтов, составляющих «доменкон-тролирующий участок». Этот контролирующий локус и все, за исключением одного, глобиновые гены в случае у- ß -талассемии несут делецию. Б. Изменения при экспрессии ß-подобных глобиновых генов на разных стадиях развития человека. Каждая из глобиновых цепей, контролируемых этими генами, для образования гемоглобина эритроцитов соединяется с а-глобиновой цепью, У пациентов с талассемией уровень синтеза ß -глобина в значительной степени снижен (не показано). (А-по F. Grosveld, G. В. van Assendelft, D. R. Greaves and G. Kollias, Cell 51: 975-985, 1987.)
Этот фрагмент, содержащий шесть сверхчувствительных к нуклеазе сайтов (см. разд. 9.1.19), оказывает воздействие на весь кластер глобиновых генов; его называют участком, контролирующим домен. Главный вывод, который следует из результатов изучения эффекта положения, состоит в том, что многие гены позвоночных для достижения нужного уровня экспрессии нуждаются в определенных последовательностях, расположенных на некотором расстоянии от них. Далее мы обсудим, какова роль этих последовательностей.
10.3.12. Для активации эукариотических генов может быть необходима локальная деконденсация хроматина [31]
У людей с определенной формой талассемии (наследственная форма анемии) перед геном ß-глобина имеются большие делении ДНК. Делетированная область (~100 000 нуклеотидных пар) содержит несколько ß-глобин-подобных генов, а также участок, контролирующий домен, который был идентифицирован в экспериментах с трансгенными мышами (рис. 10-39, A) Хотя сам ген ß-глобина и не поврежден, уровень его транскрипции значительно снижен. При обработке нуклеазой этот ген, в отличие от нормального гена ß -глобина, демонстрирует такую же низкую скорость реакции, что и основная фракция хроматина и, следовательно, не имеет структуры активного хроматина. Его нормальный гомолог в том же эритроците не содержит делеции, и к моменту начала транскрипции первого из этой группы гена (ген s-глобина) весь кластер ß-глобин- подобных генов (90000 нуклеотидных пар), по-видимому, деконденсируется, превращаясь в активный хроматин (рис. 10-39, А).
Подобные результаты свидетельствуют в пользу двухступенчатой схемы индукции транскрипции генов высших эукариот. На стадии 1 весь хроматин в области, содержащей десятки тысяч нуклеотидных пар, превращается в относительно деконденсированную «активную» форму (рис. 10-40). Эта стадия может запускаться определенным типом белка-регулятора, который вызывает структурное изменение в близлежащем хроматине. Такое изменение распространяется от домен-контролирующего участка через всю петлю этого домена хроматина. На стадии 2 белки- регуляторы, которые действуют на энхансеры и лежащие перед промотором элементы, регулируют транскрипцию определенных генов, локализованных внутри области экспонированного активного хроматина. Благодаря такому местному контролю сперва в желточном мешке зародыша экспрессируется ген s-глобина человека, затем в печени эмбриона экспрессируются два гена у-глобина и, наконец, ко времени рождения включаются гены ß-глобина (рис. 10-39, Б).
10.3.13. Напряжение, возникающее при суперспирализации ДНК, позволяет осуществлять воздействие на расстоянии [32]
Неизвестно, как в хромосоме осуществляется контроль на большом расстоянии, В настоящее время описано несколько способов передачи сигнала из одного участка молекулы ДНК в другой, удаленный от него на расстояние многих тысяч нуклеотидов. В одном случае в закрытой петле двойной спирали ДНК происходят топологические изменения, которые приводят к образованию суперскрученной ДНК. Суперспирализация ДНК лучше всего изучена на примере небольших кольцевых молекул, таких, как плазмиды и хромосомы некоторых вирусов (см. рис. 5-71). Однако такие же события могут произойти и с любым другим участком ДНК, ограниченным двумя концами, которые не могут свободно вращаться (например, с петлей хроматина, прочно связанной у основания).
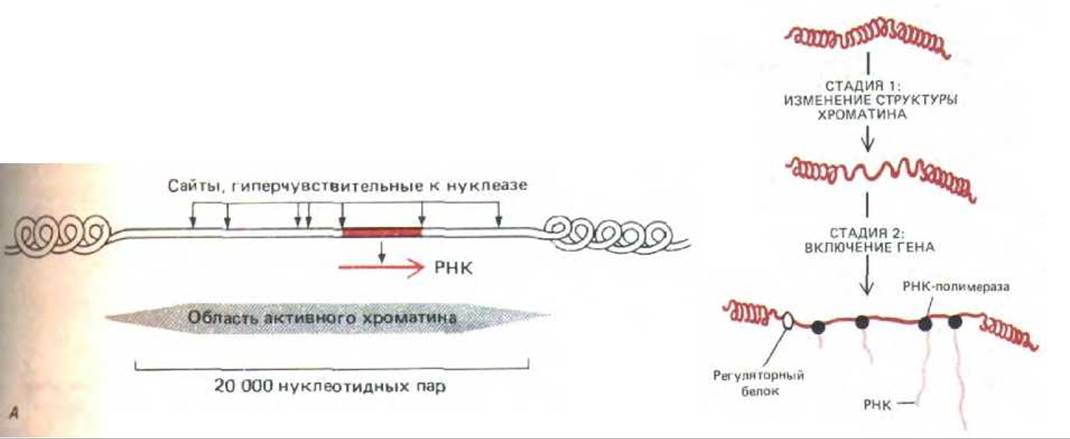
Рис. 10-40. Изменения хроматина в активных генах. А. Структура хроматина гена лизоцима в яйцеводе курицы, где этот ген активен. Как показано, область деконденсированного активного хроматина (определяемая по чувствительности к ДНКазе) содержит 24 000 нуклеотидных пар. Она включает семь гиперчувствительных к нуклеазе сайтов и представляет собой специфическую последовательность ДНК, где, как полагают, нуклеосома заменена другими ДНК-связывающими белками. Б. Две стадии активации эукариотических генов. На стадии 1 структура небольшой области хроматина модифицирована таким образом, чтобы в ходе подготовки к транскрипции она могла деконденсироваться. На стадии 2 белки-регуляторы связываются с определенными сайтами на изменившемся хроматине, чтобы индуцировать синтез РНК. Транскрипция у прокариот, по-видимому, начинается со стадии 2 процесса контроля эукарнотических генов. (А А.Е. Sipple et al. In: Structure and Function of Eucaryotic Chromosomes [W. Hennig ed.]. Berlin: Springer Verlag, 1987.)
Простой метод визуализации топологических напряжений, приводящих к суперспирализации ДНК, изображен на рис. 10-41. В двойной спирали ДНК с двумя фиксированными концами для компенсации каждых 10 открытых (не скрученных) нуклеотидных пар образуется один супервиток ДНК. Образование супервитка восстанавливает нормальный поворот спирали в остальных областях, где основания остаются спаренными; в ином случае (для схемы, приведенной на рис. 10-41, Б) потребовалось бы увеличить число пар, приходящихся на один виток, с 10 до 11. Спираль ДНК сопротивляется подобным деформациям, предпочитая ослаблять напряжение, изгибаясь в суперспирализованные петли.
У бактерий, таких, например, как E. соlі, обнаружен особый фермент, называемый ДНК-гнразой, который, используя энергию гидролиза АТР, непрерывно образует в ДНК супервитки и тем самым поддерживает в петельных доменах постоянные механические напряжения. Это так называемые отрицательные супервитки: они закручены в противоположную сторону по сравнению с положительными супервитками, образующимися при открытии фрагмента спирали. В связи с тем, что напряжение, вызываемое суперспирализацией, при этом снижается, расплетание двойной спирали ДНК у Е. coli энергетически более выгодно, чем расплетание ДНК, которая не подверглась суперспирализации.
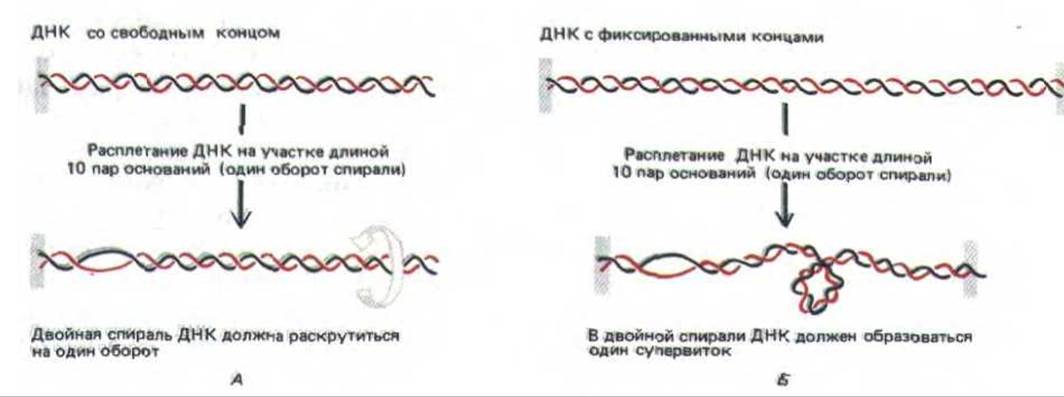
Рис. 10-41. Напряжение, возникающее при сверхспирализации ДНК, приводит к суперскручиванию молекулы. А. У молекулы ДНК с одним свободным концом (либо разрывом в одной из цепей, который служит шарниром) двойная цепь раскручивается на один виток на каждые 10 неспаренных нуклеотидных пар. Б. Если вращению что-либо препятствует, сверхвитки вводятся в ДНК путем раскручивания спирали в другом месте. В результате на каждые 10 неспаренных нуклеотидных пар возникает один сверхвиток. На этом рисунке изображена положительная сверхспираль (см. рис. 10-42).
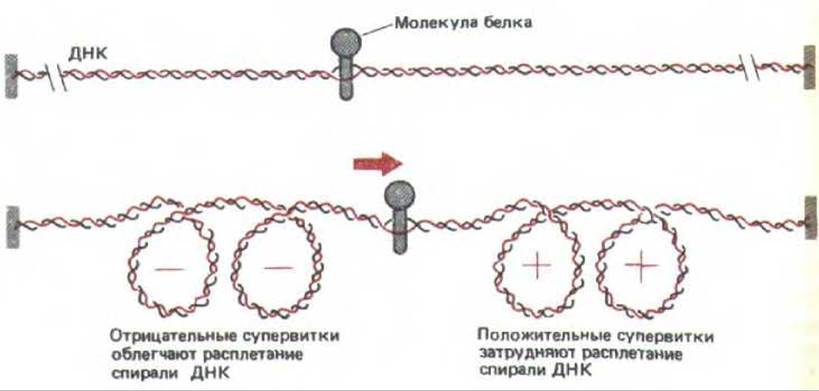
Рис. 10-42. Суперскручивание фрагмента ДНК с помощью белка, передвигающегося вдоль двойной спирали ДНК. Как и на рис. 10-41, Б, два конца ДНК зафиксированы, кроме того, принимается, что молекула белка закреплена относительно этих концов или же, что силы трения при движении затрудняют свободное вращение этого белка. Таким образом, при движении возникает избыток витков спирали, которые накапливаются в ДНК перед белком, а за ним образуется нехватка витков. Экспериментальные данные свидетельствуют о том, что продвижение молекул РНК- полимеразы вдоль цепи ДНК сопровождается такими же сжатиями. Напряжение, возникающее в результате положительного суперскручивания впереди молекулы, приводит к тому, что этот участок ДНК труднее открыть, однако имеющееся напряжение должно облегчать сбрасывание ДНК с нуклеосом, что необходимо для работы полнмеразы при транскрипции хроматина (см. рис. 9-32).
В эукариотических клетках ДНК-гираза не обнаружена, а эукариотические ДНК топоизомеразы типов I и II снимают напряжение, вызванное суперспирализацией, а не усиливают его (см. разд. 5.3.10). Вот почему большая часть ДНК в эукариотических клетках не напряжена, Тем не менее при инициации транскрипции ДНК происходит раскручивание спирали (см. рис. 9-65). Более того, продвижение молекулы РНК-полимеразы (а также других белков) вдоль ДНК приводит к появлению в ее молекуле положительного напряжения перед ферментом и отрицательного за ним (рис. 10-42). Вследствие подобного топологического изменения, событие, происшедшее в единственном сайте ДНК, может привести к возникновению сил, действующих по всей петле хроматина. Остается неясным, приводит ли подобное воздействие к запуску дальнейших событий, что было бы необходимо, если бы топологические изменения действительно имели отношение к контролю экспрессии у эукариотических генов.
10.3.14. Механизм образования активного хроматина остается неясным
Согласно модели активации генов, приведенной на рис. 10-40, некоторые из регуляторных белков у высших эукариот имеют функции, отличающие их от бактериальных аналогов. Вместо того, чтобы способствовать «посадке» РНК-полимеразы (или факторов транскрипции) на близлежащий промотор (см. рис. 10-27), некоторые сайт-специфические ДНК-связывающие белки могут участвовать в деконденсации хроматина в определенном участке хромосомы, могут удалить нуклеосому с соседнего энхансера или промотора и обеспечить таким образом доступ белков-регуляторов обычного типа. Однако полной уверенности в том, что в эти события имеют место в действительности, нет. Вполне вероятно, что наблюдаемые отличия в структуре хроматина активных генов являются закономерным следствием сборки факторов транскрипции и/или РНК- полимеразы на последовательности промотора, а не условием, необходимым для инициации транскрипции.
Идентификация определенных последовательностей ДНК, действующих как домен-контролирующий участок гена ß-глобина человека, позволила бы выделить белки, связывающиеся с этими последовательностями, и клонировать их гены (см. разд. 9.1.8). В настоящее время остается лишь строить предположения о том, как такие области функционируют. Возможно, их последовательности представляют собой очень сильные энхансеры (см. разд. 10.2.11.). Три другие гипотезы представлены на рис. 10-43.
Принципиальное различие схем, приведенных на рис. 10-43, говорит о том, как мы еще далеки от понимания процесса перехода хроматина из неактивного в активное состояние. Неизвестно, сколько существует форм хроматина и какие именно его структурные особенности приводят к тому, что некоторые области более конденсированы, чем другие. Исходя просто из функции хроматина, невозможно объяснить, почему аминокислотные последовательности гистонов (в особенности Н3 и Н4) оказываются такими консервативными. Недавно выявлены некоторые химические свойства, присущие только активному хроматину (см. разд. 9.2.10), а для отделения нуклеосом (и связанных с ними последовательностей ДНК) активного хроматина от остальных нуклеосом стали использовать моноклоналные антитела. Применяя эти методы при работе с хроматином, выделенными из трансгенных животных, в принципе возможно отличить регуляторные области, ответственные за активацию хроматина, от других участков, что несомненно должно способствовать пониманию того, как контролируются эукариотические гены.
10.3.15. В ходе эволюции многоклеточных организмов возникают новые уровни генного контроля [33]
Дрожжевые клетки служат удобной моделью для изучения эукариотических клеток. В самом деле, высокая степень функционального родства между белками дрожжей и человека не перестает удивлять исследователей. Тем не менее, не все аспекты контроля генной экспрессии можно изучать на дрожжах. По-видимому, в дрожжевой клетке не содержится гистон H1 и почти весь хроматин находится в активном состоянии. Не выявляются в них и контролирующие участки ДНК, которые способны воздействовать на гены на большом расстоянии. Не используется в дрожжевой клетке и альтернативный сплайсинг РНК, о котором речь пойдет ниже.
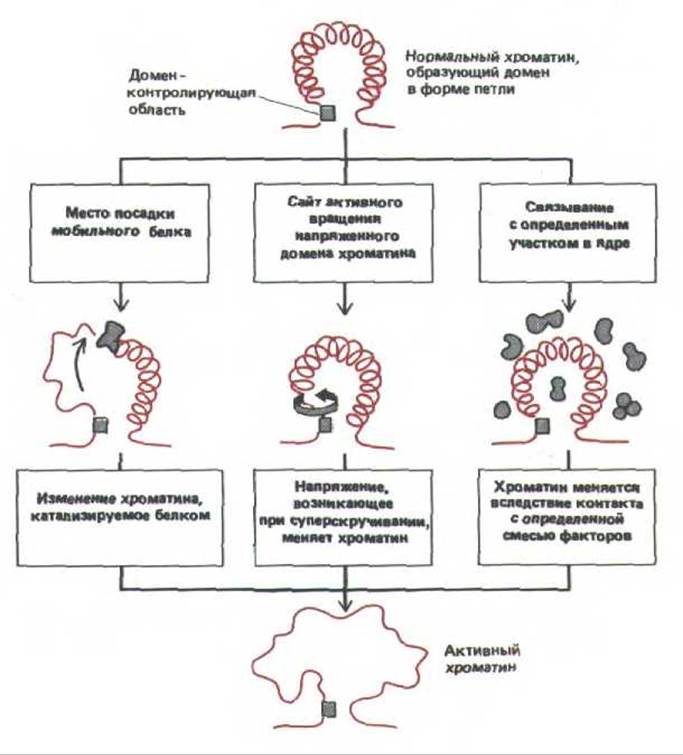
Рис. 10-43. Три гипотезы, предложенные для объяснения большого радиуса действия домен-контролирующего участка на генетическую активность. Обычно считается, что петля хроматина представляет собой целый домен хромосомы, который имеет форму петли и содержит ДНК размером 100000 и более нуклеотидных пар. На самом деле неизвестно, чем объясняется такая дальность действия, возможно, здесь функционируют и другие механизмы. Доказательства того, что хроматин проходит стадию деконденсации вне зависимости от транскрипции ДНК, получены при наблюдении дисков политенных хромосом дрозофилы содержащих ген Sgs-3. Некоторые мутанты, не способные образовывать в этом участке РНК, тем не менее в ходе развития личинок образуют пуф (см. рис. 9-48).
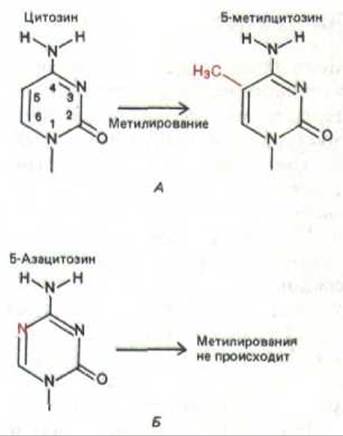
Рис. 10-44. А. Образование 5-метил-цитозина происходит при метилировании цитоэина в молекуле цепи ДНК. У позвоночных этот процесе ограничен цитозиновыми остатками (С), находящимися в составе последовательности CG, К. Синтетический нуклеотид, содержащий основание 5-азацитозин (5-aza-C), не может метилироваться. Более того, если небольшие количества 5-aza-C включаются в ДНК, они подавляют метилирование нормальных цитозинов.
Беспозвоночные, такие, как дрозофила, имеют геномы большего размера нежели у дрожжей, содержат гистон Н1, гетерохроматин и по крайней мере некоторые типы активного хроматина (см. рис. 9-54). У беспозвоночных есть также и альтернативный сплайсинг РНК. Однако один уровень контроля генной экспрессии, присущий позвоночным, у беспозвоночных, по-видимому, отсутствует: у них нет общей системы подавления активности на основе метилирования ДНК.
10-20
10.3.16. При делении клеток позвоночных тип метилирования ДНК передается по наследству [34]
Основания в молекуле ДНК в некоторых случаях подвергаются модификации. Например, мы уже говорили о том, что метилирование А в последовательности GATC приводит к ошибкам копирования в ходе репликации у бактерий (см. разд. 5.3.8.); напротив, метилирование А или С в определенном сайте защищает бактерию от воздействия ее собственных рестриктаз (см. разд. 4.6.2). В ДНК позвоночных содержится 5-метнлцнтозин (5-метнл-С), который, по всей вероятности, не оказывает влияния на спаривание оснований (рис. 10-44, А). Метилирование ограничено основанием С в последовательности CG. В связи с тем, что эта последовательность спарена точно с такой же последовательностью (но в обратной ориентации) на другой цепи ДНК, передача по наследству существующего типа метилирования ДНК обеспечивается простым механизмом копирования. Фермент, называемый поддерживающей метилазой, действует лишь на те последовательности CG, которые спарены с уже метилированными последовательностями CG. В результате существовавший ранее тип метилирования автоматически наследуется в ходе репликации ДНК (рис. 10-45).
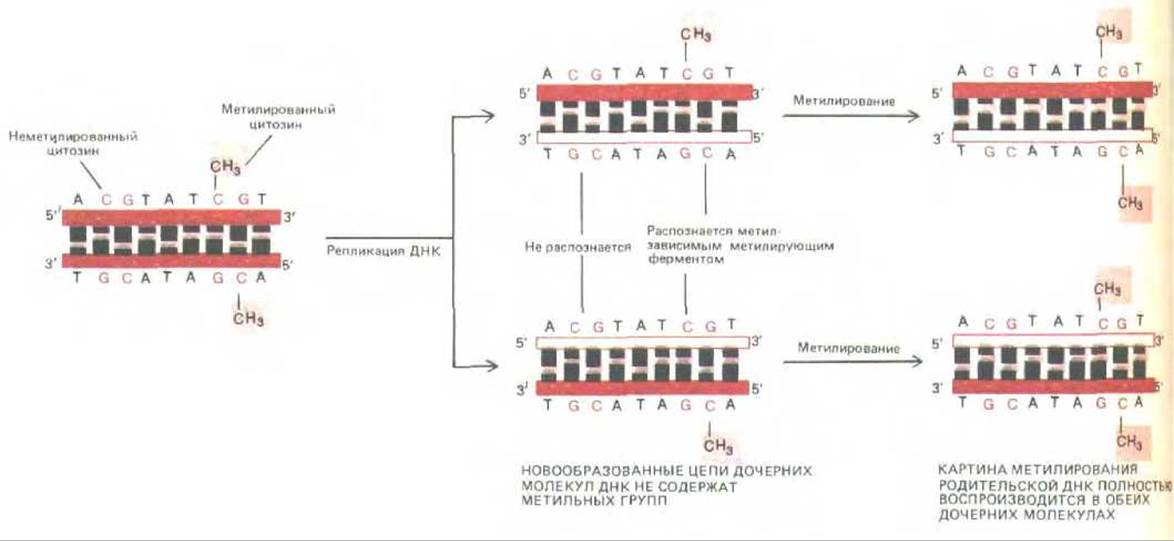
Рис. 10-45. Точное наследование порядка метилирования ДНК. В ДНК позвоночных метилирована большая часть остатков цитозина, входящих в состав последовательности CG (см. рис. 10-44). После того как разметка ДНК метильными группами проведена, каждый сайт метилирования наследуется дочерними молекулами ДНК. Это означает, что изменение в метилированой разметке ДНК сохраняется и наследуется в клетку.
Некоторые рестриктазы разрезают ДНК в области, содержащей динуклеотид CG, и для их действия необходимо, чтобы эта последовательность не была метилирована. Например, HpaІІ разрезает последовательность CCGG, но не способна это сделать, если средний С метилирован. Таким образом, чувствительность ДНК к ресгриктязс HpaІІ может служить тестом на метилирование определенных сайтов. Фермент НраІІ-метилаза в обычных условиях защищает любую бактерию от своей собственной рестрикгазы HpaІІ. Следовательно, эту метилазу можно использовать для введения оснований 5-метил-С в определенные последовательности CG (а именно в CCGG) в составе клонированной молекулы ДНК (при клонировании ДНК в E.coli метилирование по CG-сайтам утрачивается). С помощью этой методики удалось показать, что каждая отдельная метилированная последовательность CG обычно сохраняется в ходе многих клеточных делений в культуре клеток позвоночных, а неметилированные последовательности CG так и остаются неметилированными.
Автоматическое наследование 5-метил-С ставит проблему «курицы и яйца»: на какой стадии происходит первое метилирование у позвоночных? Установлено, что при введении неметилированной ДНК в оплодотворенную яйцеклетку мыши почти все CG-сайты этой ДНК метилируются (хотя существует одно важное исключение, описанное ниже). Таким образом, большая часть генома млекопитающих может оказаться сильно метилированной. Поскольку известно, что в норме поддерживающая метилаза не способна метилировать ДНК, лишенную метальных групп, остается предположить, что в яйцеклетке должен присутствовать другой фермент: учреждающая метилаза. Вероятно, выполнив свою функцию, она исчезает, а за сохранение метилированных нуклеотидов в ДНК клеток развивающихся тканей отвечает уже другая, поддерживающая метилаза.
10-5
10-20
10.3.17. Метилирование ДНК у позвоночных способствует тому, что клетка придерживается выбранного пути развития [35]
Какова роль метилирования CG? Эксперименты, проведенные с использованием рестриктазы Hpall, свидетельствуют о том, что ДНК неактивных генов метилирована сильнее, нежели ДНК активных генов. Более того, оказалось, что неактивный ген, ДНК которого метилирована, после активации теряет большую часть своих метальных групп. Убедительное доказательство того, что именно метилирование влияет на экспрессию генов, получено в опытах с 5-азацитозином (5-aza-C, см. рис. 10-44,6), который на короткий период добавляли к культивируемым клеткам. 5-aza-C, аналог основания, не способный метилироваться, включается в состав ДНК и действует в качестве ингибитора поддерживающей метилазы, снижая таким образом общий уровень метилирования ДНК. В клетках, обработанных 5-aza-C, определенные ранее неактивные гены активировались и одновременно получали неметилированные остатки С. После разовой активации активное состояние этих генов поддерживалось и в отсутствие 5-aza-C во многих последующих поколениях клеток. Этот факт указывает на то, что изначальное метилирование генов способствовало их пребыванию в неактивном состоянии.
На основании результатов, полученных в опытах с 5-азацитозином, было выдвинуто предположение, что метилирование ДНК может играть главную роль в возникновении различных типов клеток. Это означало бы, что специализация клеток у позвоночных и беспозвоночных осуществляется разными путями. Последующее изучение показало, однако, что роль метилирования ДНК в дифференцировке клеток, по-видимому, не столь существенна и носит скорее вспомогательный характер. Важные переключения в ходе развития осуществляются регуляторными белками, способными влиять на активность генов вне зависимости от их метилирования. Например, Х-хромосома самок сперва конденсируется и инактивируется, и лишь затем некоторые из ее генов метилируются сильнее. И наоборот, определенные гены, активные в печени, в ходе развития включаются тогда, когда они еще полностью метилированы, и лишь позднее уровень их метилирования начинает снижаться.
Значение метилирования ДНК для экспрессии генов в значительной степени прояснилось в результате опытов по трансфекции. Например, тканеспецифичный ген, кодирующий актин мышц, выделяли как в полностью метилированной, так и в полностью неметилированной формах. При введении двух модификаций этого гена в культуру мышечных клеток оба варианта транскрибировались одинаково эффективно. Если же этот ген вводили в фибробласты, где он в норме не экспрессируется, неметилированный вариант транскрибировался на низком уровне, который тем не менее был выше, чем у введенного метилированного гена или у эндогенного гена, присутствующего в фибробласте и также метилированного. На основании этих опытов можно сделать вывод, что у позвоночных метилирование ДНК используется для закрепления пути развития, выбранного иными способами.
В отдельных случаях можно с достаточной точностью определить, могут ли последовательности ДНК, транскрибируемые с высокой эффективностью в клетках одного типа, транскрибироваться в клетках позвоночных другого типа. Подобные эксперименты показали, что уровни транскрипции в двух типах клеток позвоночных иногда различаются более чем в 106 раз. Неэкспрессируемые гены позвоночных гораздо менее «расплывчаты» в отношении транскрипции, чем неэкспрессируемые гены бактерий, у которых наибольшие известные различия в скорости транскрипции экспрессируемых и неэкспрессируемых генов не превышают 1000-кратный уровень. Способствуя дальнейшему снижению транскрипции генов, включенных иным способом, метилирование ДНК, по-видимому, вносит свой вклад в это различие.
10.3.18. CG-богатые островки позволяют выявить у млекопитающих около 30000 генов «домашнего хозяйства» [36]
В ходе эволюции метилированные остатки в геноме имеют тенденцию к исчезновению, что объясняется специфическими особенностями механизма репарации. Дело в том, что случайное дезаминирование неметилированного цитозина приводит к возникновению урацила, который в норме не входит в состав ДНК и потому легко распознается ферментом репарации, вырезается и затем заменяется на цитозин. Последствии случайного дезаминирования остатка 5-метилцитозина не могут быть устранены подобным образом, так как при дезаминировании 5-метил-С образуется тимин, который неотличим от других, немутантных остатков тимина, входящих в состав ДНК. Следовательно, в ходе эволюции метилированные остатки цитозина в геноме имеют тенденцию превращаться в тимин.
После того, как около 400 млн. лет назад произошла дивергенции позвоночных и беспозвоночных, подобным образом утерялось более трех из каждых четырех CG, что привело к значительному уменьшению содержания этого динуклеотида в геноме позвоночных. Оставшиеся последовательности CG очень неравномерно распределены по геному: существуют отдельные области длиной 1000-2000 нуклеотидов (СG-островки), в которых содержание CG в 10-20 раз выше, чем в среднем по геному. Подобные островки окружают промоторы так называемых генов «домашнего хозяйства», т.е. тех генов, которые кодируют белки, необходимые для жизнедеятельности клетки и, следовательно, экспрессируемые в клетках любого типа (рис. 10-46). Эти гены можно противопоставить тканеспецифичным генам, кодирующим белки, присущие лишь строго определенным типам клеток.
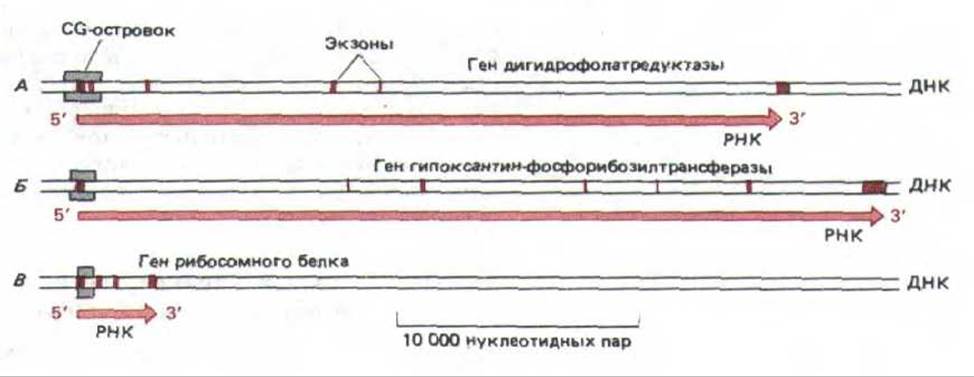
Рис. 10-46. CG-островки в трех генах «домашнего хозяйства» млекопитающих. Прямоугольниками отмечен размер каждого островка, которые, как показано, окружают промоторы каждого гена. Следует отметить, что у большинства генов млекопитающих экзоны (выделены цветом) короче, нежели интроны. (По А. Р. Bird, Trends Genet. 3: 342-347, 1987.)
Распределение CG-островков можно легко объяснить как побочный эффект развития системы метилирования CG, предназначенный для снижения экспрессии неактивных генов у позвоночных (рис. 10-47). В половых клетках все тканеспецифичные гены (за исключением тех, которые присущи яйцеклетке и спермию) неактивны и метилированы. За долгую эволюцию их метилированные CG были утеряны при случайном дезаминировании. Однако CG-последовательности в промоторных областях генов, активных в половых клетках (включая все гены «домашнего хозяйства»), оставались деметилированными и при спонтанном дезаминировании всегда репарировались. Полагают, что эти гены узнаются сайтспецифическими ДНК-связывающими белками, которые присутствуют в половых клетках и удаляют любые метильные группы в области промоторов генов «домашнего хозяйства». Эксперименты с клонированными генами показывают, что лишь CG, входящие в состав CG-островков, остаются неметилированными, если в яйцеклетку мыши инъецировать совершенно неметилированную ДНК.
Известно, что геном млекопитающих (размером около 3 х 109 нуклеотидных пар) содержит около 30 000 CG-островков, каждый из которых имеет в длину около 1000 нуклеотидных пар. Большинство островков совпадает с 5'-концом транскрипционной единицы и таким образом, по-видимому, с 5'-концом гена. В связи с тем, что ДНК, окружающую CG-островки, можно выделить и клонировать отдельно, относительно просто решается задача идентификации и характеристики жизненно важных генов (генов «домашнего хозяйства»). Вероятно, несколько десятков тысяч остальных генов являются тканеспецифичными и не экспрессируются в половых клетках. Так как большая часть их последовательностей CG утеряна, эти тканеспецифичные гены гораздо труднее выявить в геноме.
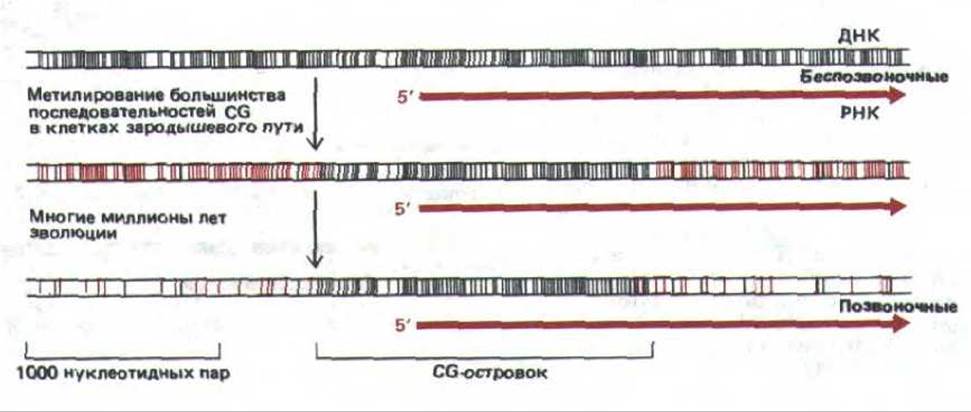
Рис. 10-47. Схема, иллюстрирующая заметную нехватку последовательностей CG и наличие CG-островков. Черными линиями отмечено расположение неметилированных динуклеотидов CG в последовательности ДНК, а красными линиями обозначены метилированные CG-динуклеотиды. Метилированные гены беспозвоночных неизвестны.
10.3.19. Сложный характер регуляции генов необходим для образования многоклеточного организма [37]
Клетки эмбриона имеют много общего с компьютером, поскольку постоянно получают информацию о своем расположении в данный момент и объединяют эту информацию с поступившей ранее для того, чтобы на каждой стадии развития действовать соответствующим образом. Изучение дрозофилы генетическими методами показало, что в образовании и поддержании основного плана строения тела участвует относительно небольшое число (порядка 100) генов, кодирующих главные регуляторные белки, взаимодействующие между собой. В любом многоклеточном организме подавляющее большинство генов (и жизненно важных, и тканеспецифичных), вероятно, регулируются посредством сложных контролирующих цепочек, исходящих от генов главных регуляторных белков. Если в регуляции генов эукариот центральную роль играют механизмы, сильно отличающиеся от бактериальных (например, механизмы, зависящие от прямого наследования структуры хроматина), можно ожидать, что именно эти механизмы контролируют некоторые гены главных белков-регуляторов.
В настоящее время ничего неизвестно о том, как осуществляется контроль за действием генов главных белков-регуляторов у позвоночных, однако начали появляться первые данные о том, как эти гены контролируются у дрозофилы. Например, гомеотические гены, определяющие разное развитие отдельных сегментов тела мухи, находятся в двух сложных локусах Antennapedia и Bithorax. Комплекс биторакса, ответственный за дифференцировку двух грудных сегментов и восьми сегментов брюшка, содержит три транскрипционные единицы, называемые Ubx, abd-A и abd-B. Каждая транскрипционная единица, по-видимому, кодирует семейство белков-регуляторов, образующихся в результате альтернативного сплайсинга РНК. Полагают, что кодирующие области этого комплекса содержат менее 20 000 нуклеотидных пар, тогда как регуляторные последовательности насчитывают приблизительно 300000 нуклеотидных пар. По-видимому, регуляторные области состоят из набора энхансеров, расположение которых по длине хромосомы соответствует расположению сегментов тела, подвергающихся действию этих энхансеров (рис. 10-48). Эти факты в совокупности с данными о строении тела мутантных мух, у которых один из энхансеров транслоцирован из одной части комплекса биторакса в другую, позволяют выдвинуть предположение о регуляции генов внутри комплекса биторакса на основе изменений в структуре хроматина. Согласно этому предположению, в клетках, образующих комплекс биторакса и расположенных все ближе к концу тела, последовательно открываются лежащие один за другим домены хроматина. Это дает возможность энхансерам, локализованным в данных доменах, активироваться в строгой очередности (рис. 10-49). Весьма вероятно, что механизмы, контролирующие гены белков-регуляторов, не менее сложны.
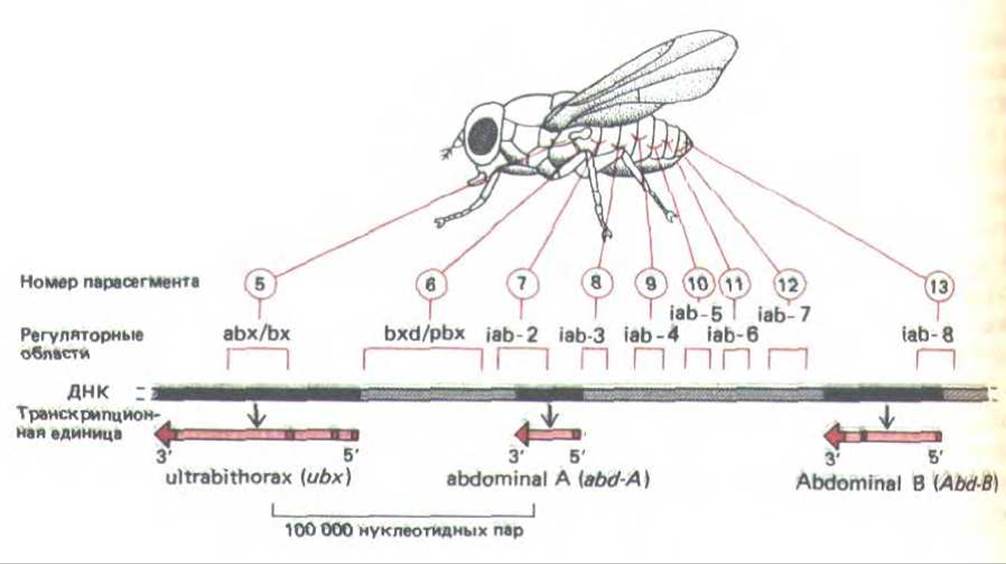
Рис. 10-48. Организация биторального комплекса у дрозофилы. В этой важной области хромосомы размером 300 000 нуклеотидных пар содержатся три гена - Ubx, abd-A и Abd-B. которые кодируют главные регуляторные белки, контролирующие развитие груди и брюшка. Гомеотические мутации помогли выявить еще девять групп регуляторных последовательностей ДНК. Каждая из этих групп необходима для развития указанных парасегментов, а также других парасегментов, расположенных ближе к концу тела. Считается, что эти регуляторные последовательности ДНК действуют как энхансеры, контролируя экспрессию одного из близлежащих генов, а порядок их расположения на молекуле ДНК соответствует расположению тех сегментов тела, на которые они воздействуют (см. рис. 10-49). (По М. Peifer, F. Karch and W. Bender, Genes Devel. 1: 891-898, 1987.)
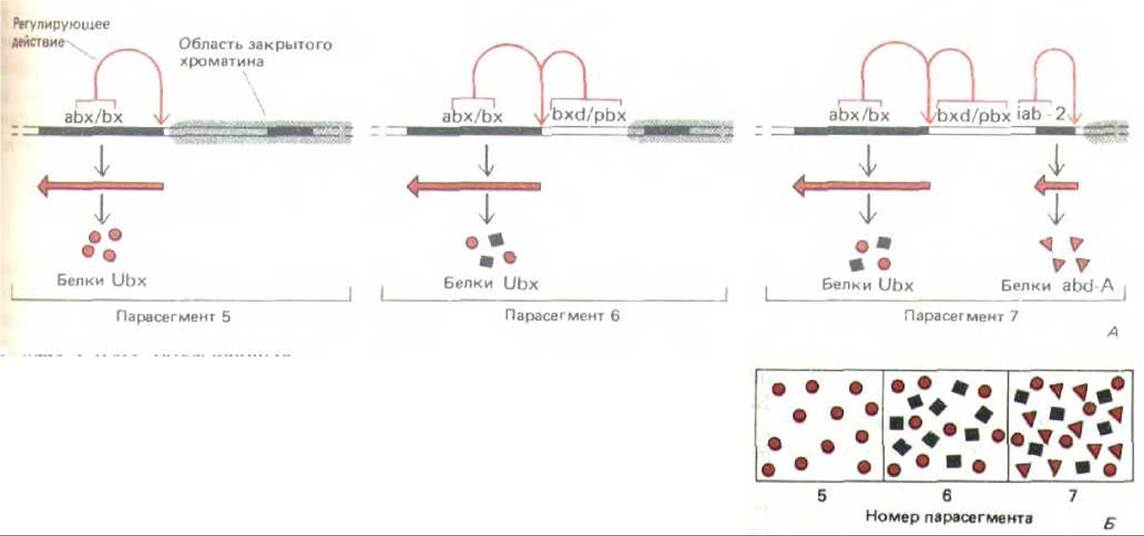
Рис. 10-49. Схема, объясняющая тачное соответствие между положением в хромосоме каждого регулирующего участка биторального гомплекса и расположением на теле мухи тех парасегментов, на которые оказывают влияние мутации в этой области. А. Контроль на уровне изменения структуры хроматина. Предполагается, что хроматин деконденсируется или же постепенно активируется во все более отдаленных парасегментах, таким образом, в парасегменте 5 открыта только регуляторная область вbх/bх, тогда как все остальные регуляторные участки экспонированы в самых удаленных парасегментах. находящихся под контролем того комплекса (парасегмент 13, см. рис. 10-48). На данном рисунке изображены лишь три парасегмента. Ген Ubx может образовывать несколько различных транскриптов (обозначенных здесь квадратиками и кружочками), отбор которых контролируется регуляторными областями. Таким образом, биторальный комплекс образует в каждом из парасегментов свою смесь белков-регуляторов (Б).
Заключение
В организме животных и растений функционируют механизмы, ответственные за то, что в разных клетках транскрибируются разные гены. Так как многие специализированные клетки обладают способностью поддерживать свои уникальные свойства при выращивании их в культуре, механизмы регуляции генов должны быть стабильными и наследуемыми. Прокариоты и дрожжи представляют собой весьма удобную модельную систему, с помощью которой можно изучать механизмы регуляции генов. Некоторые из этих механизмов могут также принимать участие в возникновении специализированных типов клеток у высших эукариот. Один из них - конкурентное взаимодействие между двумя или более главными белками-регуляторами, каждый из которых, подавляя образование другого, стимулирует свой собственный синтез.
Изучение экспрессии генов, сконструированных методами генной инженерии, а также фрагментов, встроившихся в случайные сайты генома трансгенных животных, показало, что большая часть генов высших эукариот контролируется смесью диффундирующих белков-регуляторов, уникальных для каждого типа клеток. Кроме того, на экспрессию генов у высших эукариот может влиять переход хроматина в более или менее конденсированное состояние; у позвоночных транскрипцию неактивных генов подавляет метилирование. Однако для большинства генов эти дополнительные уровни контроля могут либо определяться, либо преодолеваться диффундирующими белками-регуляторами. До сих пор неизвестно, каким образом контролируются гены, кодирующие главные белки-регуляторы, которые, собственно, и детерминируют у позвоночных тип клетки.