Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Контроль генной экспрессии
Посттранскрипционный контроль
Хотя контроль активности большинства генов осуществляется главным образом на уровне инициации транскрипции, тем не менее и позже, в ходе передачи информации от РНК к белку, такой контроль происходит на самых разных этапах. Более того, вполне вероятно, что для некоторых генов каждая стадия их экспрессии находится под контролем. Большая часть сведений о посттранскрипционной регуляции получена лишь недавно, и механизм контроля на этом уровне изучен далеко не "Годностью.
В настоящем разделе речь идет о регуляции экспрессии гена после того, как РНК-полимераза связалась с его промотором и начала синтез РНК. Обсуждение ведется в той же последовательности, в какой регуляторные механизмы могут воздействовать на молекулу РНК после начала транскрипции.
10.4.1. Аттенуация транскрипции приводит к преждевременной терминации синтеза некоторых молекул РНК [38]
Феномен аттенуации транскрипции изучали преимущественно на бактериях, где с помощью этого механизма регулируется экспрессия многих генов. Для осуществления регуляции такого типа в начале РНК-цепи должна присутствовать определенная последовательность нуклеотидов, которая позволяла бы молекуле РНК находиться в одной из двух возможных конформаций. Более стабильную конформацию имеет петля РНК, которая служит сигналом терминации для бактериальной РНК-полимеразы; в результате синтез РНК преждевременно останавливается (см. рис. 5-6). Однако, если с определенной последовательностью растущей молекулы РНК связывается регуляторная молекула, цепь РНК приобретает такую конформацию, при которой сигнала терминации не образуется, а получается длинная функциональная молекула РНК (рис. 10-50). У бактерий таким регуляторним компонентом обычно служит рибосома, которая в процессе трансляции «садится» на растушую цепь РНК.
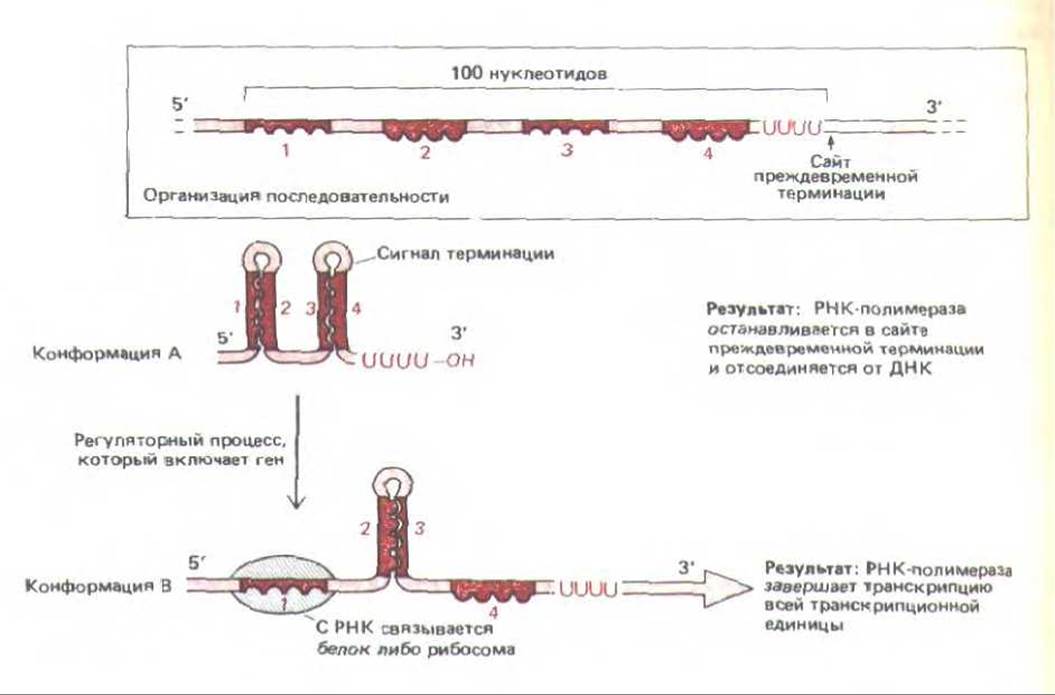
Рис. 10-50. Регуляция экспрессии генов с помощью аттенуации транскрипции у прокариот. По мере роста РНК-транскрипта за счет добавлення нукдеотидов к 3'-концу, РНК-транскрипт приобретает одну из двух указанных информации. Наиболее стабильной является конформация А, которая содержит две шпильки с двойной спиралью, возникшие при спаривании комплементарных оснований. В связи с тем, что за спиралью шпильки, образовавшейся при спаривании сайтов 3 и 4, следует серия U-нуклеотидов, шпилька служит сигналом терминации для бактериальной РНК-полимеразы. Конформация Б образуется, если с сайтом 1 на транскрипте РНК связывается регуляторный белок или рибосома, в результате свободный сайт 2 спаривается с сайтом 3, при этом сигнал терминации пропадает и образуется длинный функциональный транскрипт РНК, который и запускает экспрессию гена.
У эукариот аттенуация транскрипции участвует в регуляции небольшого числа генов. Так как в клеточном ядре функционально активные рибосомы отсутствуют, возможно, что с определенными последовательностями РНК связываются регуляторные молекулы, однако механизм аттенуации в клетках эукариот не изучен.
10-23
10.4.2. Сплайсинг РНК может регулироваться таким образом, что один и тот же ген направляет синтез различных форм белка [39]
Первоначально сплайсинг РНК был открыт у вируса. Оказалось, что из одного первичного транскрипта у него образуется несколько молекул мРНК, и, следовательно, синтезируется несколько разных белков (см. разд. 9.4.12). Многие гены высших эукариот образуют различные белки именно с помощью альтернативного сплайсинга РНК. Если в нескольких участках транскрнпта существуют различные точки сплайсинга, то один и тот же ген может служить матрицей для десятков различных белков. Обычно, однако, возможности сплайсинга ограничены и с каждого транскрипта транслируется лишь несколько белков.
В некоторых случаях альтернативный сплайсинг имеет место вследствие «двусмысленности интрона»: стандартный механизм удаления интронов не может четко различить две или более альтернативные пары 5'- и 3'-сайтов сплайсирования, и, таким образом, в разных ситуациях случайно реализуются разные варианты. Подобная конститутивная форма альтернативного сплайсинга, по-видимому, ответственна за образование различных аномальных мРНК мутантного гена (3-глобина у некоторых лиц, страдающих ß-талассемией (см. рис. 9-86). Для других генов такая двусмысленность характерна и в норме, при этом во всех тканях, где ген экспрессируется, образуются кодируемые им разные версии одного и того же белка.
Во многих случаях регулируется именно альтернативный сплайсинг РНК, а не конститутивный. Отбор сайтов сплайсинга определяется клеткой. Следовательно, в разных клетках в соответствии с потребностями организма с одного и того же первичного транскрипта РНК могут транслироваться различные белки (или наборы белков). Таким образом, многие белки образуются в тканеспецифичных формах. Среди них компоненты 1) внеклеточного матрикса (фибронектин), 2) клеточного скелета (тропомиозин), 3) плазматической мембраны, 4) ядра (см, табл. 10-1) и 5) внутриклеточных путей клеточной сигнализации (С-киназа и тирозин-протеинкиназа, кодируемые протоонкогеном src; рис. 10-51).
Как правило, замены экзонов, происходящие при альтернативном сплайсинге РНК, не приводят к появлению совершенно разных белков. Вместо этого образуется серия белков, функции которых аналогичны. Их называют изоформами. Изоформы белка модифицированы таким образом, чтобы они годились для конкретной ткани. Изменения в них могут определять, с какими другими белками будет взаимодействовать данная молекула, причем каталитические или структурные домены остаются прежними. Например, одна и та же транскрипционная единица в клетках щитовидной железы дает начало кальцитонину, а в клетках нервной ткани - далекому от него по свойствам пептидному гормон (CGRP - calcitonin-gene-related peptide).
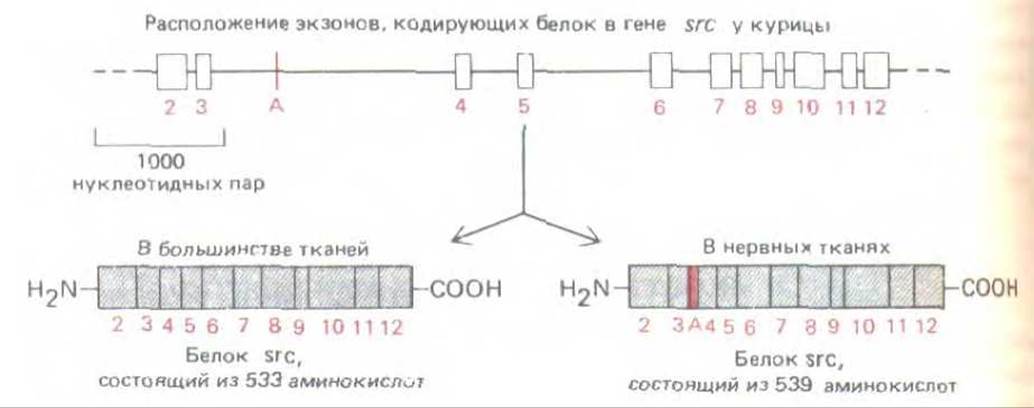
Рис. 10-51. При регуляторном альтернативном сплайсинге РНК с гена src считываются две несколько отличающиеся формы тирозинпротеинкиназы. Экзон А включается в последовательность лишь в нервных тканях. Поскольку такая тканеспецифичность в сплайсинге сохранилась в ходе эволюции (характерна и для птиц, и для млекопитающих), можно предположить, что наблюдаемая разница в белках, кодируемых геном src, весьма важна для биологической активности этого регуляторного белка. На рисунке указаны только экзоны, кодирующие белок (экзон 1 формирует 5'-лидерную последовательность мРНК). (По J. В. Levy et al., Моl. Cell Biol. 7: 4142-4145, 1987.)
10.4.3. Альтернативный сплайсинг РНК может использоваться для включения и выключения генов [40]
Некоторые гены постоянно транскрибируются во всех клетках, однако из-за существования конститутивного сплайсинга образуемая мРНК кодирует нефункционирующий белок, и ген экспрессируется лишь в тех клетках, где происходит специализированная реакция сплайсинга. Такой тип генной регуляции особенно хорошо охарактеризовав у дрозофилы. Так, например, свойство Р-элемента (см. разд. 5.6.10) перемещаться лишь в половых клетках, связано с его неспособностью образовывать активную транспозазу в соматических клетках. Это явление в свою очередь обусловлено присутствием в мРНК транспозазы интрона, который, по-видимому, удаляется лишь в половых клетках. С помощью генетического анализа выявлен другой пример. Пол мух определяется каскадной активацией генов, каждый из которых ответствен за синтез белка, детерминирующего правильный сплайсинг РНК следующего в этом ряду гена (рис. 10-52). Области ДНК, кодирующие некоторые белки, которые детерминируют пол мухи, клонированы и секвенированы, что в значительной мере облегчило изучение механизмов, регулирующих выбор сайта сплайсинга.
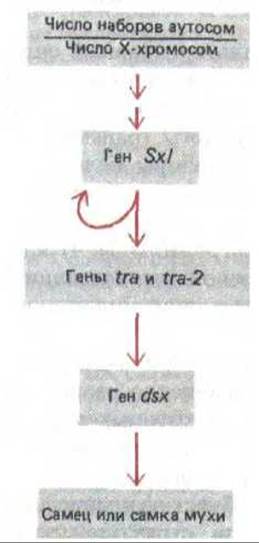
Рис. 10-52. Каскадные изменения в экспрессии генов, определяющих пол у дрозофилы, зависят от альтернативного сплайсинга РНК. Если отношение числа наборов аутосом к числу Х-хромосом равно единице (в норме это два набора аутосом и две Х-хромосомы), особь развивается в самку; мухи, у которых это отношение равно двум (в норме два набора аутосом и одна Х-хромосома), развиваются как самцы. Это соотношение определяется уже на ранних стадиях развития и затем сохраняется в каждой клетке, Функция генов, представленных на рисунке, как раз и состоит в передаче информации об этом соотношении другим генам, определяющим фенотип, характерный для того или иного пола. Такие гены функционируют как два альтернативных набора, определяющие свойства, характерные для самки и для самца. Ген dsx (doubl esex - двупол ость) получил свое название благодаря тому, что у мутантов, не экспрессирующих этот ген, работают оба набора, специфичные для самок и для самцов. На рисунке представлена цепь событий, которые происходят при развитии самок. Стрелки указывают действие каждого гена, участвующего в этом процессе. У самцов гены Sxl, tra и tra2 транскрибируются, но образуют только нефункциональную мРНК, а транскрипт гена dsx сплайсируется, причем в итоге образуется белок, который включает гены, детерминирующие женский путь развития. У самок транскрипт Sxl сплайсируется совершенно по-другому, в результате образуется белок, контролирующий сплайсинг, который, с одной стороны, поддерживает свой собственный синтез, а с другой стороны, включает два гена tra (указано стрелками). В свою очередь, продукты генов tra, действуя кооперативно, меняют схему сплайсинга РНК у транскрипта гена dsx. Получившаяся мРНК гена dsx образует измененную форму белка dsx, которая выключает гены, определяющие мужской путь развития.
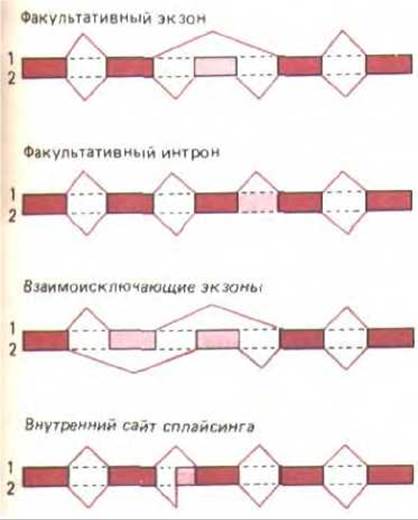
Рис. 10-53. Четыре пути альтернативного сплайсинга РНК, которые имели место в эксперименте. В каждом случае одна транскрибированная РНК может сплайсироваться двумя альтернативными способами с образованием двух разных мРНК (1 и 2). Более темным цветом обозначены последовательности РНК, присутствующие в обоих типах мРНК. Прямоугольники, окрашенные светлее, соответствуют последовательностям, имеющимся лишь в мРНК одного типа. Соседние прямоугольники соединены цветными линиями, указывающими на последовательности нитронов. По-видимому, не существует какого-либо простого механизма или единого правила, которые могли бы объяснить, почему происходит тот или иной выбор. (По A. Andre-adis, М. Е. Gallego, В. Nadal-Ginard, Annu. Rev. Cell Biol. 3: 207-242, 1987.)
10-23
10.4.4. Механизмы, ответственные за выбор сайта для регулируемого сплайсинга РНК, неизвестны
Полагают, что регулируемые изменения в выборе сайтов сплайсинга РНК осуществляются путем связывания ткане- и геноспецифичных белков или молекул РНК с растущим РНК-транскриптом. Так как выбор сайтов сплайсинга происходит и при конститутивном, и при регулируемом варианте по одним и тем же стандартным консенсусным последовательностям, связывание с определенным компонентом должно менять конформацию транскрипта РНК, с тем чтобы закрыть или открыть сайты сплайсинга, ранее существовавшие в молекуле. Вероятно, тут задействованы сложные механизмы, так как простое предположение о том, что при связывании белка сайт сплайсинга закрывается, не объясняет в достаточной мере, почему наблюдается такое разнообразие продуктов сплайсинга (рис. 10-53). Для изучения молекулярных механизмов регулируемого сплайсинга необходимо реконструировать его в бесклеточной системе, что позволило бы выделить все необходимые компоненты и проанализировать действие каждого из них на сплайсосому.
10.4.5. Изменение сайта, в котором происходит расщепление транскрипта РНК и его полиаденилирование, может менять карбоксильный конец белка [41]
У эукариот 3'-конец молекулы мРНК определяется не терминацией синтеза РНК РНК-полимеразой, а в ходе реакции расщепления РНК, которая катализируется дополнительными факторами при элонгации транскрипта (см. разд. 9.4.5). Место такого расщепления может варьировать, при этом изменяется карбоксильный конец получающейся молекулы белка, который кодируется 3'-концом мРНК. У прокариот образование более длинного транскрипта РНК приводит лишь к появлению дополнительных аминокислот в белковой цепи. Однако у эукариот при сплайсинге образование более длинного транскрипта может привести к тому, что исходный карбоксильный конец белка будет полностью удален и замещен новым.
С изменением такого типа связано переключение синтеза антител при созревании В-лимфоцитов с мембраносвяз энных на секретирующие формы. В незрелых В-клетках образующиеся антитела связаны с плазматической мембраной, где они служат рецепторами антигенов. Стимуляция антигенами одновременно запускает деление этих клеток и начало секреции ими антител. Секретируемая форма антител отличается от мембраносвязанной только в терминальной части карбоксильного конца: мембраносвязанная форма содержит здесь длинную цепь из гидрофобных аминокислот, пересекающую липидный бислой, а секретируемая форма несет гораздо более короткий фрагмент водорастворимых аминокислот. Таким образом, для переключения с синтеза мембраносвязанных на секретируемые антитела необходима иная нуклеотидная последовательность на 3'-конце мРНК.
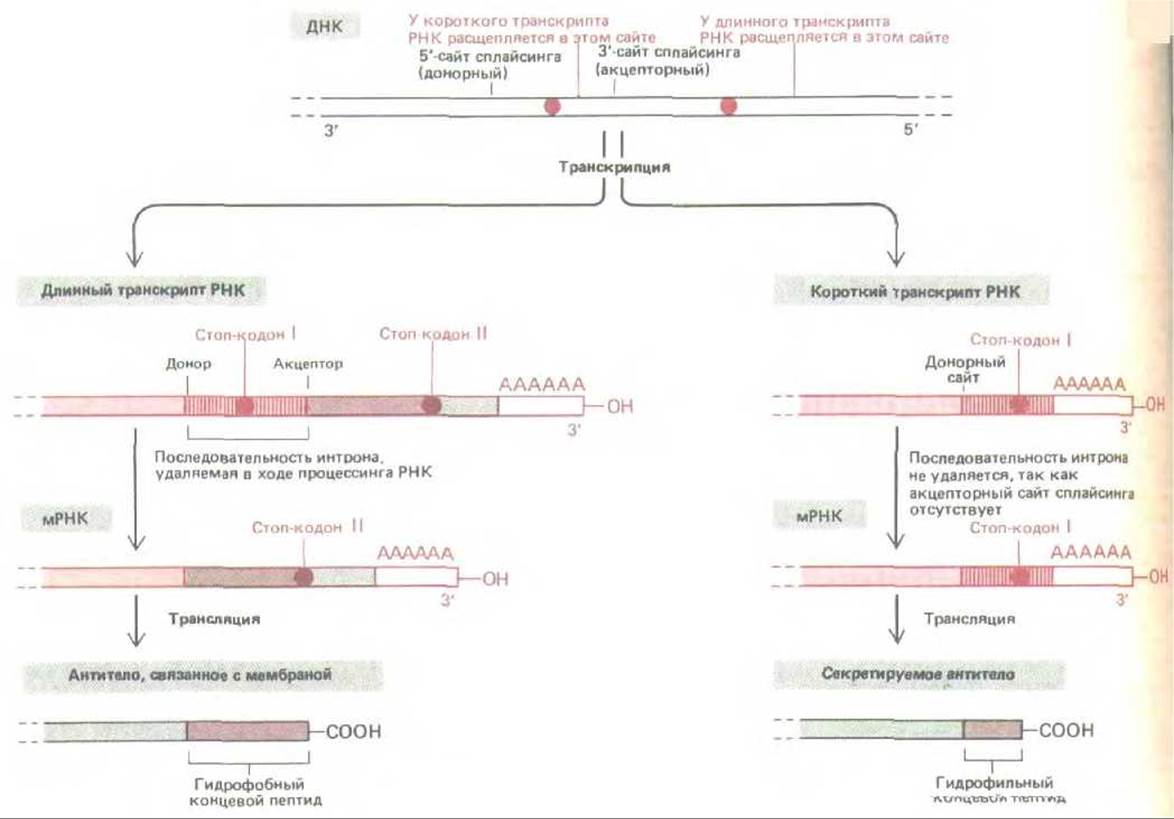
Рис. 10-54. Выбор сайта расщепления РНК и полиаденилирования весьма важен при образовании антител. В нестимулированных В-клетках (слева) образуются длинные транскрипты РНК, и при сплайсинге удаляется последовательность интрона вблизи 3'-конца этой молекулы. В результате образуется мРНК, которая кодирует молекулу антитела, связывающуюся с мембраной. Напротив, после стимуляции антигеном (справа) первичный транскрипт РНК разрезается перед акцепторным сайтом сплайсинга последнего экзона. В результате некоторые последовательности интрона, удалявшиеся из длинного транскрипта, остаются в качестве кодирующих последовательностей в коротком транскрипте. Это те последовательности, которые кодируют гидрофильную карбоксиконцевую часть секретируемой молекулы антитела.
Мембраносвязанная форма белка образуется при транскрипции всех кодирующих последовательностей ДНК с образованием длинного транскрипта. Нуклеотиды, кодирующие длинный гидрофобный карбоксильный конец мембраносвязанного белка, локализованы в последнем экзоне (рис. 10-54, слева). Интрон, предшествующий этому экзону, содержит нуклеотиды, кодирующие водорастворимый хвост секретируемой молекулы; при сплайсинге мРНК они удаляются. Секретируемая форма молекулы образуется с более короткого первичного транскрипта, который заканчивается перед началом следующего экзона. Следовательно, в этом транскрипте перед нуклеотидами, кодирующими водорастворимый хвост, отсутствует акцепторный сайт сплайсинга, который мог бы взаимодействовать с имеющимся донорным сайтом. В результате эти нуклеотиды остаются в образующейся молекуле мРНК (рис. 10-54, справа).
Неизвестно, однако, как контролируется реакция расщепления, определяющая переключение длины транскриптов РНК.
10.4.6. Открытие альтернативного сплайсинга требует пересмотра понятия «ген» [42]
С тех пор, как стало известно, что эукариотические гены содержат интроны, а их кодирующие последовательности можно состыковать по-разному, вновь встал вопрос о том, что следует понимать под словом «ген». Первое определение гена на молекулярном уровне было предложено в начале 40-х гг. на основании изучения биохимической генетики гриба-нейроспора. До этого времени геном считали область генома, которая в мейозе обособляется как отдельная единица и ответственна за проявление определенного фенотипического признака, например, белых и красных глаз у дрозофилы или гладких и морщинистых семян у гороха. После работ на нейроспоре стало ясно, что ген, как правило, соответствует области генома, направляющей синтез единственного фермента. На основании этого возникло предположение, что один ген кодирует одну полипептидную цепь. Эта гипотеза оказалась весьма плодотворной. При изучении механизмов экспрессии в 60-х гг. ген стали определять как фрагмент ДНК, который транскрибируется с образованием РНК, кодирующей одну полипептидную цепь (или одну структурную РНК, как например, молекулы тРНК или рРНК). Обнаруженный в конце 70-х гг. феномен прерывистости генов эукариот не противоречил принятым представлениям. Однако теперь нам стало ясно, что в клетках высших эукариот многие последовательности ДНК могут кодировать два и более различных белка благодаря альтернативному сплайсингу. Что же тогда следует считать геном?
В тех относительно редких случаях, когда два сильно различающихся эукариотических белка образуются из одной транскрипционной единицы, говорят, что эти белки кодируются различными генами, которые на хромосоме перекрываются. Однако определение видоизмененных белков, образующихся в результате альтернативного сплайсинга РНК, как продуктов перекрывающихся генов, может показаться излишне усложненным. Проще изменить исходную формулировку и считать геном любую последовательность ДНК, которая транскрибируется как отдельная единица и кодирует набор близкородственных полипептидных цепей (изоформы белков).
10.4.7. Экспорт РНК из ядра может регулироваться [43]
Первичный транскрипт РНК в среднем в 10 раз длиннее, чем зрелая молекула РНК, образующаяся при сплайсинге. Но по некоторым данным пределы клеточного ядра покидает только одна двадцатая часть всей гяРНК (см. разд. 9.4.8). Таким образом, значительная часть первичных транскриптов (вероятно, половина) полностью разрушается в ядре, никогда не образуя молекулу мРНК, предназначенную для переноса. Распаду подвергаются и те молекулы РНК, последовательности которых не могут превратиться в мРНК, и такие молекулы, которые способны соответствующим образом процессироваться лишь в клетках другого типа.
Перенос РНК через ядерные поры представляет собой активный процесс (см. разд. 8.3.3). Если этот процесс зависит от специфического узнавания транспортируемых молекул РНК (либо связавшихся с РНК молекул белка или РНК) белком-рецептором, входящим в состав комплекса ядерной поры, то РНК, не имеющие такого опознавательного знака, будут избирательно задерживаться в ядре. С другой стороны, для переноса РНК могут и не потребоваться опознавательные сигналы, в этом случае автоматически переносится вся РНК, за исключением той, которая избирательно задерживается. Третья возможность заключается в том, что используется и селективный перенос, и селективное задержание. Поскольку любая РНК задерживается в ядре до тех пор, пока с ней связаны компоненты сплайсосомы, селективное задержание может обусловливаться механизмом, препятствующим завершению сплайсинга определенной молекулы РНК. В настоящее время ни одна из этих гипотез не получила четкого экспериментального подтверждения, более того, представляется маловероятным, чтобы транспорт РНК из ядра играл существенную роль в регуляции экспрессии большинства генов у эукариот.
В связи с тем, что вирус использует для своего размножения клеточный аппарат, изучение цикла развития вируса часто помогает понять механизмы клеточных процессов. Например, геном аденовируса представляет собой двухцепочечную молекулу ДНК, которая реплицируется и транскрибируется в ядре клетки-хозяина. На поздних стадиях инфекции транспорт хозяйской РНК из ядра останавливается, в результате большая часть РНК, попадающей в цитоплазму, оказывается принадлежащей аденовирусу. Генетический анализ показал, что для такого изменения в избирательности переноса РНК из ядра необходимы два образующихся на ранних стадиях инфекции аденовирусных белка. Таким образом, взаимодействие аденовируса с клеткой-хозяином может служить перспективной модельной системой для изучения контроля за транспортом РНК.
10-24
10.4.8. Белки, связывающиеся с 5’-лидерной областью мРНК, участвуют в негативном контроле трансляции [44]
Не все молекулы РНК, достигающие цитоплазмы, транслируются в белок. Трансляция некоторых из них блокируется особыми белками-репрессорами (рис. 10-55), которые связываются вблизи 5'-конца, там, где должна происходить инициация трансляции. Такой тип регуляции был впервые обнаружен у бактерий, где избыток рибосомных белков может подавлять трансляцию своих собственных мРНК.
В клетках эукариот особенно хорошо изучен тип негативного контроля трансляции, который дает возможность быстро привести в соответствие синтез внутриклеточного белка ферритина с количеством имеющихся в клеточном содержимом атомов железа. Показано, что после добавления железа мРНК ферритина в цитоплазме перемещается из неактивного рибонуклеопротеинового комплекса в трансляционноактивный полирибосомный комплекс. С помощью генной инженерии установлено, что регуляция, направляемая железом, связана с последовательностью размером 30 нуклеотидов, которая расположена на 5'-лидерном конце молекулы мРНК ферритина. Этот элемент, контролирующий ответ на железо, складывается в структуру, состоящую из стебля с петлей (см. рис. 10-60, Б); элемент связывается с регуляторным белком в том случае, если этот белок не соединен с железом. При связывании регуляторного белка с элементом, контролирующим ответ на железо, трансляция любой последовательности РНК, расположенной за этим сайтом, подавляется (рис. 10-55). Добавление железа приводит к диссоциации комплекса РНК— белок, что вызывает увеличение скорости трансляции мРНК в 100 раз.
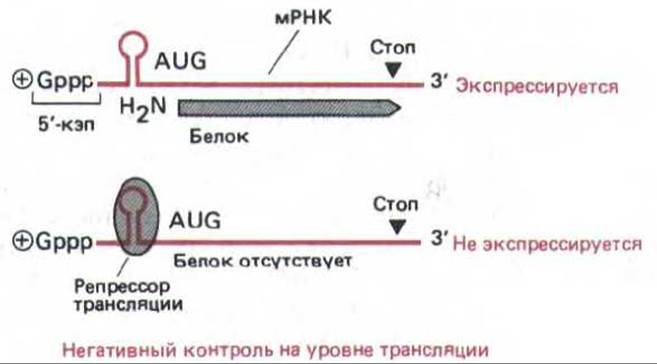
Рис. 10-55. Негативный контроль трансляции с участием сайт-специфического ДНК-связывающего белка (репрессор трансляции). Связывание этого белка с молекулой мРНК приводит к снижению уровня ее трансляции. Известно несколько примеров контроля на уровне трансляции такого типа. В данном случае представлен механизм повышения синтеза ферритина при увеличении концентрации свободного железа в клетке (см. также рис. 10-60).
10.4.9. Присутствие энхансера трансляции в некоторых вирусных мРНК свидетельствует о существовании механизма позитивного контроля трансляции [45]
В принципе, позитивный контроль трансляции может осуществляться засчет расположенной на мРНК специальной области «трансляционного энхансера», который способен выборочно привлекать рибосомы. Показано, что определенные РНК-вирусы (пикорнавирусы) содержат такую область. Ее присутствие приводит к тому, что трансляция начинается с внутренних сайтов AUG, которые в других случаях в эукариотической клетке не используются для инициации синтеза белка (рис. 10-56).
Позитивный контроль трансляции обнаружен также и в дрожжевых клетках. Генетическими методами были выявлены специфические белки, необходимые для активации трансляции мРНК дрожжевого гена GCN4. В отсутствие этих белков мРНК не транслируется. мРНК гена GCN4 напоминает слабо транслируемые мРНК высших эукариот. Полагают, что трансляция таких мРНК контролируется аналогичным образом. (К этому классу относится около 5% всех охарактеризованных до сих пор мРНК). У таких РНК 5'-лидерная последовательность необычно длинна и содержит серию триплетов AUG, препятствующих трансляции основной кодирующей последовательности, расположенной за сайтом инициации синтеза коротких пептидов. Стоп-кодон, локализованный перед основной кодирующей последовательностью, препятствует сквозному считыванию. Сходным образом, у пикорнавирусов трансляция основной кодирующей последовательности такой мРНК может зависеть от связывания молекул-активаторов трансляции с последовательностями энхансеров трансляции, расположенных вблизи соответствующих кодонов AUG, что приводит к повторной инициации трансляции (рис. 10-57). Однако каков механизм подобной активации трансляции, до сих пор неизвестно.
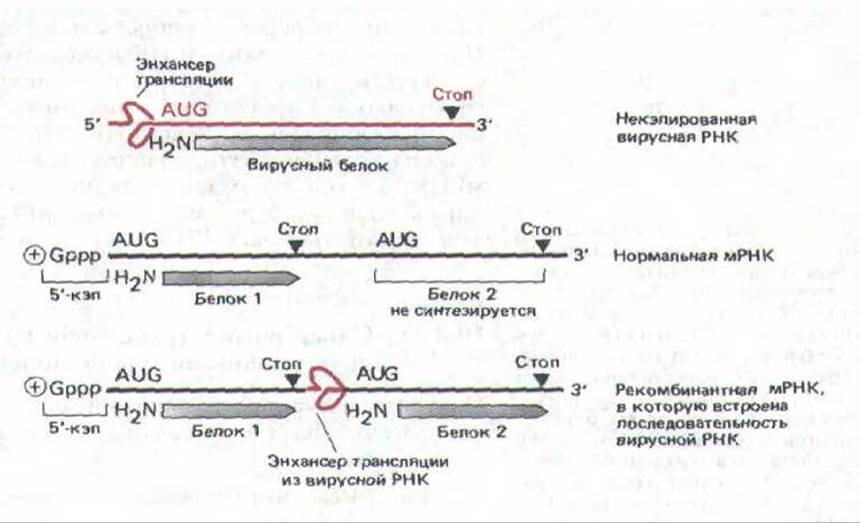
Рис. 10-56. Схема эксперимента, который демонстрирует существование последовательности РНК в геномах некоторых РНК-содержащих вирусов, выступающей в роли трансляционного энхансера. Геном пикорнавирусов (к которым относится и вирус полиомиелита) представляет собой плюснить РНК, т.е. может служить непосредственно мРНК для синтеза вирусоспецифических белков. У этих вирусов нет нэпа на 5'-конце РНК, который необходим для инициации белкового синтеза на большинстве молекул мРНК. Измеряя уровень белкового синтеза, катализируемого различными рекомбинантными РНК, в молекуле вирусной РНК можно идентифицировать последовательности трансляционных энхансеров длиной несколько сот нуклеотидных пар. Как показано на схеме, перемещая эту последовательность в середину цепи мРНК, можно вставить рибосому начинать трансляцию с соседнего внутреннего кодона AUG; таким образом, можно обойти правила, которые в норме заставляют начинать белковый синтез только с первого кодона AUG.
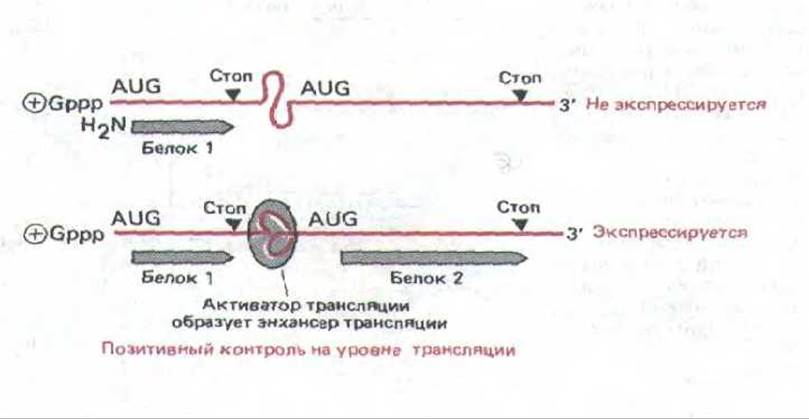
Рис. 10-57. Модель позитивного контроля трансляции, согласно которой для интенсивной трансляции мРНК необходимо связывание белка (активатора трансляции). Хотя известно, что трансляция специфических мРНК находится под позитивным контролем, его механизм до конца неясен. Установлено, что позитивный контроль имеет отношение к синтезу коротких пептидов, трансляция которых инициируется перед первым AUG. Это дает право считать, что в данном случае действует механизм, аналогичный тому, который описан у пикорнавирусов (рис. 10-56).
10-25
10.4.10. Многие мРНК-объект контроля на уровне трансляции [46]
Насколько контроль на уровне трансляции распространен у высших эукариот? Согласно некоторым оценкам, таким способом регулируется экспрессия одного гена из десяти. Контроль на уровне трансляции дает возможность клетке быстро и обратимо менять концентрацию белка, не подавляя синтез кодирующей его мРНК (см. разд. 12.4.7). По-видимому, экспрессия некоторых протоонкогенов регулируется именно так.
Особенно важную роль контроль на уровне трансляции играет в оплодотворенных яйцеклетках, где необходимо переключить синтез с белков, присущих ооциту в состоянии покоя, на белки, участвующие в быстром делении клеток. В таких яйцеклетках имеется большой запас мРНК, образовавшейся в ходе созревания ооцита. Многие из этих материнских мРНК до оплодотворения яйцеклетки не транслируются. Изучение яйцеклеток двустворчатых моллюсков показало, что до и после оплодотворения с рибосомами ассоциированы различные мРНК. При трансляции таких мРНК в бесклеточной системе образуются белки, соответствующие определенной стадии созревания яйцеклетки моллюска, однако это происходит лишь тогда, когда сохраняется мРНК в виде рибонуклеопротеина. Если РНК очистить от связанных с ней белков и затем транслировать, разница между белками, синтезированными на мРНК, взятой на разных стадиях, исчезает. Следовательно, фактор, определяющий, будет ли данная мРНК транскрибироваться, должен зависеть от того, как РНК связывается с регуляторними молекулами.
5-8
10.4.11. Сдвиг рамки трансляции приводит к образованию двух белков на одной молекуле мРНК [47]
Контроль на уровне трансляции, описанный выше, влияет на скорость инициации новых полипептидных цепей на молекуле мРНК. Обычно завершение синтеза белка происходит автоматически. Однако в отдельных случаях образующийся белок может изменяться в ходе процесса, называемого сдвигом рамки трансляции (считывания).
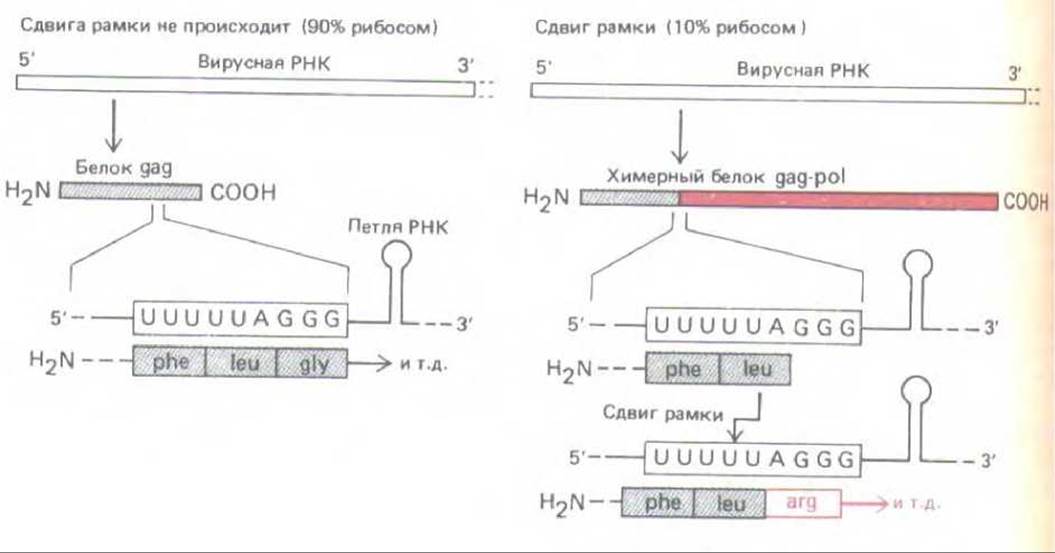
Рис. 10-58. Сдвиг рамки при трансляции необходим для образования обратной транскриптазы ретровируса. Вирусные обратная транскриптаза и интеграза образуются при расщеплении большого химерного белка gag-pol, а белки капсида в результате расщепления белка gag, присутствующего в больших количествах. Синтез обоих белков начинается в одной точке, но у gag он заканчивается на стоп-кодоне в той же рамке считывания, а при сдвиге рамки в направлении — 1 синтезируется химерный белок. Сдвиг рамки обусловлен локальными особенностями в структуре РНК (к ним относится и показанная на рисунке петля РНК), которые приводят к тому, что тРНКLeu присоединенная к карбоксильному концу растущей полипептидной цепи, время от времени соскальзывает на один нуклеотид назад в рибосоме и спаривается с кодоном UUU вместо UUA, который определял ее включение. Представлена последовательность вируса иммунодефицита человека (ВИЧ-1). (По Т. Jacks et al., Nature 331: 280-283, 1988.)
Сдвиг рамки трансляции широко распространен у ретровирусов, что позволяет получать с одной мРНК различные количества двух или более белков. У этих вирусов обычно образуется большой полипротеин, который разрезается вирусной протеазой с образованием нескольких капсидных белков (gag-белки), обратной транскриптазы вируса и интегразы (роl-белки). Во многих случаях гены gag и роl находятся в разных рамках считывания, и, таким образом, сдвиг рамки необходим для образования ро1-белков, присутствующих в гораздо меньших количествах. Сдвиг рамки происходит по определенному кодону в мРНК, и для его осуществления необходимо присутствие специфических последовательностей, которые могут находиться и перед этим сайтом, и за ним (рис. 10-58).
10-26
10-27
10.4.12. Экспрессия генов может контролироваться изменением стабильности мРНК [48]
Большая часть мРНК в клетках бактерий весьма нестабильна и имеет время полужизни около 3 минут. Так как мРНК у бактерий быстро синтезируется и также быстро разрушается, бактерия в ответ на изменения окружающей среды может соответствующим образом регулировать экспрессию своих генов.

Рис. 10-59. Особые сигнальные последовательности, ответственные за нестабильность (быструю деградацию) некоторых мРНК. А. Три мРНК, время полужизни которых сильно различается. Непрерывный распад молекул мРНК, кодирующих различные факторы роста, обусловливает быстрое изменение их концентрации в ответ на внеклеточные сигналы. Гистоны необходимы, главным образом, для формирования хроматина, образующегося в ходе синтеза ДНК. Значительные изменения в стабильности их мРНК ограничивают время синтеза пистонов S-фазой клеточного цикла. Б. За необычно быстрый распад мРНК ответственны особые последовательности на 3'-нетранслируемом конце молекулы. Представленные результаты получены в экспериментах, когда указанные измененные последовательности РНК синтезировались в клетках с генов, модифицированных методами генной инженерии.
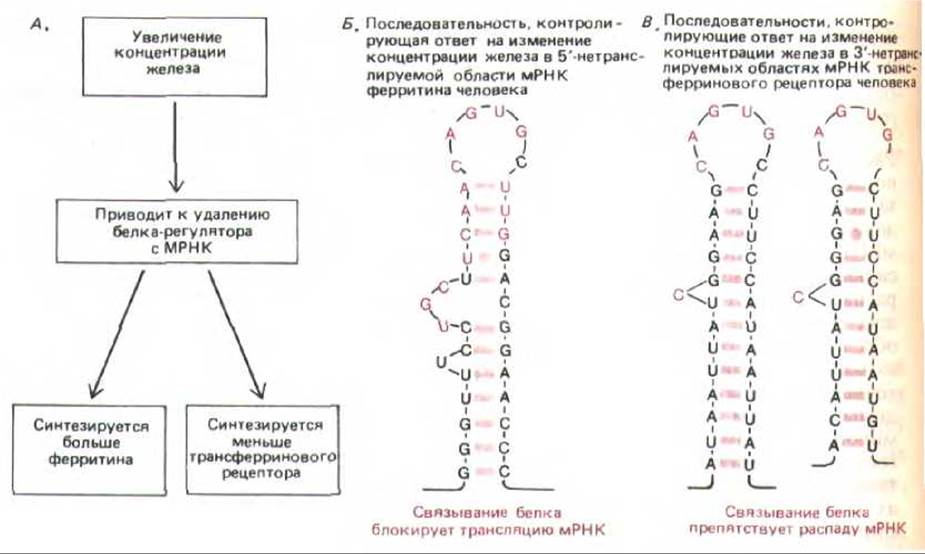
Рис. 10-60. В ответ на увеличение концентрации железа клетка повышает уровень синтеза ферритина (чтобы связать избыток железа) и снижает уровень синтеза рецепторов трансферрина (чтобы в клетку попадало меньше железа). Полагают, что оба типа ответов обусловлены одним и тем же регуляторным белком. Этот белок узнает общие свойства мРНК, кодирующих ферритин и рецептор трансферрина. А. Регуляторний белок отделяется от мРНК. Б. Элемент, контролирующий ответ на железо, расположенный в 5'-нетранслируемой области мРНК ферритина. Нуклеотиды, выделенные цветом, идентичны в мРНК ферритина млекопитающих, птиц и земноводных. Если поместить эту последовательность в 5'-нетранслируемую область других мРНК, то их трансляция также будет контролироваться уровнем содержания железа в среде. В. Две из пяти одинаковых последовательностей, от которых зависит ответ на изменение концентрации железа в среде, расположенные в З'-нетранслируемой области мРНК, кодирующей рецептор трансферрина. Железо-зависимый контроль стабильности мРНК требует присутствия многих сайтов связывания регуляторных белков. Считается, что нуклеотиды, выделенные цветом, а также спиральный стебель шпильки, последовательность которого не так важна, играют решающую роль в узнавании белка. Поскольку контроль синтеза рецептора трансферрина и ферритина осуществляется разными механизмами, их уровни отвечают на изменения концентрации железа противоположным образом, несмотря на то, что в регуляции принимает участие один и тот же белок. (По М. W. Hentze et al., Science 238: 1570-1573, 1987; J. L. Casey et al., Science 240: 924-928, 1988.)
В эукариотических клетках мРНК более стабильна. Напримеp мРНК, кодирующая 3-глобин, имеет время полужизни более 10 ч, есть и такие мРНК, время полужизни которых составляет всего 30 минут! или еще меньше. Нестабильные мРНК часто кодируют белки-регуляторы, концентрация которых в клетке быстро меняется (например, факторы роста и продукты протоонкогенов fos и mуc). Нетранслируемая 3'-область многих таких нестабильных мРНК содержит длинные последовательности, обогащенные А и U, которые, по-видимому, и ответственны за их нестабильность (рис. 10-59).
Стабильность мРНК может меняться в ответ на внеклеточные сигналы. Так, например, стероидные гормоны действуют на клетку, не только усиливая транскрипцию отдельных генов (см. разд. 12.2.1), но и повышая стабильность некоторых мРНК, считываемых с этих генов. И наоборот, добавление к клеткам железа уменьшает стабильность мРНК, кодирующей трансферриновый рецептор, что приводит к образованию меньшего количества белка, связывающего железо. Интересно, что в дестабилизации мРНК трансферринового рецептора, по-видимому, участвует тот же чувствительный к железу белок, связывающийся с РНК, который контролирует трансляцию мРНК ферритина. В данном примере с трансферриновым рецептором белок соединяется с противоположным концом мРНК (нетранслируемый 3'-конец), что обусловливает усиление, а не ослабление синтеза белка (рис. 10-60).
10.4.13. Для избирательной деградации мРНК необходим постоянный синтез белка [49]
Контроль стабильности мРНК в клетках эукариот лучше всего изучен для мРНК, кодирующих гистоны. Время полужизни этих мРНК во время S-фазы клеточного цикла (когда требуются новые гистоны) составляет около 1 ч, но при остановке синтеза ДНК сокращается до нескольких минут. Если в ходе S-фазы синтез ДНК подавить антибиотиками, гистоновая мРНК становится нестабильной; возможно, накопление свободных гистонов в отсутствие новой ДНК, с которой они могли бы связаться, специфически повышает скорость распада гистоновой мРНК.
Регуляция стабильности гистоновой мРНК зависит от короткой структуры, состоящей из петли и двухцепочечного участка на 3'-конце; она заменяет роlуА-последовательность, присутствующую на 3'-конце других мРНК. Такой 3'-конец образуется после того, как гистоновая мРНК синтезируется РНК-полимеразой II, в ходе специальной реакции расщепления, для которой необходимо спаривание с основаниями небольшой РНК, входящей в состав рибонуклеопротеиновой частицы (U7-мя РНК). Если методами генной инженерии соединить этот 3'-конец с другими мРНК, они также становятся нестабильными при остановке синтеза ДНК (см. рис. 10-59). Таким образом, как и в случае мРНК других типов, скорость распада жестко контролируется сигналами, расположенными вблизи 3'-конца, с которого, как полагают, и начинается деградация мРНК.
Если в середину кодирующей последовательности гистоновой мРНК поместить стоп-кодон, такая мРНК теряет способность быстро деградировать. Исходя из этого, было высказано предположение, что нуклеаза, ответственная за деградацию мРНК, соединена с рибосомой, и перед тем, как она начинает реакцию, большая часть гистоновой мРНК должна транслироваться. Это предположение могло бы объяснить, почему значительная часть нестабильных мРНК селективно стабилизируется при обработке клеток ингибитором белкового синтеза циклогексимидом. Тем не менее остается неясным, почему система деградации мРНК должна быть связана таким образом с рибосомой.
10.4.14. Некоторые мРНК расположены в определенных областях цитоплазмы [50]
Метод гибридизации in situ позволяет локализовать в клетке специфические молекулы мРНК (см. разд. 4.6.11). В гл. 16 будет идти речь о том, что некоторые мРНК, участвующие в формировании частей тела на ранних стадиях развития, сконцентрированы в определенных участках цитоплазмы ооцита (см. рис. 16-22, 16-60). Хотя остается неизвестным, с чем они при этом связаны, в ряде случаев подобное распределение по областям зависит от длинного нетранслируемого 3'-конца мРНК.
Легче всего определить локализацию молекул мРНК в больших по размеру ооцитах, однако примеры специфической локализации мРНК известны и для соматических клеток. Вероятно, в будущем с помощью методов генной инженерии станет возможным менять расположение конкретных молекул мРНК в цитоплазме с тем, чтобы выявить эффект такого перемещения на функцию этих мРНК.
10-28
10.4.15. Редактирование мРНК изменяет смысл информационной РНК [51]
Открытие все новых молекулярных механизмов, используемых клеткой, заставляет биологов постоянно удивляться. Например, совсем недавно было обнаружено, что все мРНК у трипаносомы содержат общую кэпированную последовательность на 5'-конце, которая транскрибируется отдельно и затем добавляется к 5'-концам транскриптов гяРНК при сплайсинге двух ранее не связанных между собой молекул. Подобный транссплайсинг имеет место у нематод, когда к ряду мРНК добавляется лидерная 5'-последовательность. Обнаружен он и у растений при комбинировании отдельных транскриптов РНК, из которых образуется кодирующая последовательность некоторых белков в хлоропластах. Разрезание и воссоединение транскриптов может оказаться кратчайшим путем к появлению новых белков, а те немногие известные сегодня случаи такого соединения экзонов могут быть остатками процессов, некогда имевших гораздо более широкое распространение.
Другой любопытный феномен, в значительной мере изменяющий транскрипты РНК, был обнаружен в митохондриях трипаносом. Он заключается в редактировании РНК: в определенные области транскрипта добавляется или удаляется один (или более) нуклеотид U, что приводит к изменению исходной рамки считывания и меняет смысл информации. Однако неизвестно, как контролируется редактирование, в результате которого образуется последовательность, кодирующая необходимый белок.
Редактирование РНК, хотя и в более ограниченных пределах, встречается у млекопитающих, где с помощью этого механизма ген аполипопротеина. В образует два типа транскриптов: в одном из транскритов цитозин, кодируемый ДНК, заменяется на урацил, в результате чего появляется стоп-кодон и синтезируется короткий тканеспецифичный вариант этого большого белка. Хотя до сих пор приведенный пример редактирования РНК остается единственным, представляется маловероятным, что этот феномен у млекопитающих ограничивается только одним геном.
10.4.16. Реакции, катализируемые РНК, вероятно, | имеют весьма древнее происхождение [52]
Все обсуждаемые в данном разделе механизмы контроля на посттранскрипционном уровне зависят от специфического узнавания определенной молекулы РНК; именно таким путем отбираются молекулы для специальных превращений, например, сплайсинга или деградация. Узнавание возможно благодаря существованию большого числа сайт-специфических РНК-связывающих молекул, большая часть которых еще не охарактеризована. Сайты РНК, с которыми ассоциируют эти молекулы, обычно содержат группу открытых нуклеотидов в одноцепочечном участке (см. рис. 10-60). Следовательно, подобное сайт-специфическое связывание отличается от связывания с ДНК, где нуклеотидная последовательность обычно распознается по спаренным основаниям в двойной спирали. Более того, все известные молекулы, связывающиеся с определенными последовательностями ДНК, представляют собой белки; между тем к объединению со специфическими последовательностями РНК способны и белки, и молекулы РНК, принцип узнаваний у которых частично основан на комплементарном спаривании оснований РНК-РНК. Таким образом, пытаясь разобраться в посттранскрипционных процессах, мы вступили в мир РНК. Реакции, катализируемые молекулами РНК, гораздо труднее поддаются изучению, чем реакции, катализируемые белками. Большие молекулы РНК при выделении, из-за присутствия следовых количеств рибонуклеаз, легко распадаются, и их трудно очистить до гомогенного состояния, сохранив при этом, активность. Однако в настоящее врем» методы генной инженерии с использованием очищенных РНК-полимераз позволяют получать in vitro большое количество чистых РНК с любой последовательностью (рис. 9-81). Благодаря этому появилась возможность подробно изучить химию катализируемых РНК реакций самосплайсинга (см. разд. 3.2.11) и определить минимальные размеры последовательностей, необходимых для саморасщепления РНК вироида растений (рис. 10-61). Другой реакцией, в которой РНК играет роль катализатора как у прокариот, так и у эукариот, является расщепление предшественников тРНК комплексом белок—РНК, известным под названием РНКаза Р. РНК, входящая в состав мяРНП-частиц сплайсосом, вероятно, может также формировать и разрушать ковалентные связи (хотя это еще и не доказано). Полагают, что активный центр ферментативного комплекса пелтидилтрансферазы, участвующего в полимеризации аминокислот рибосомой, расположен на рРНК (см. разд. 5.1.8).
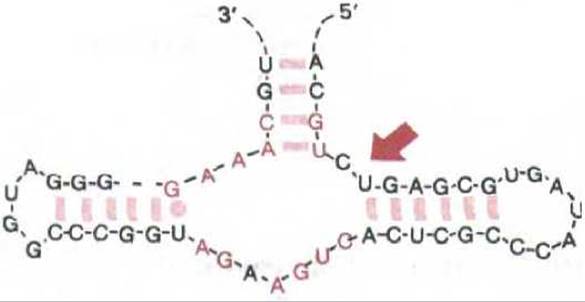
Рис. 10-61. Структура активного центра РНК вироида растений. Эта короткая молекула РНК сама расщепляет себя в участке, указанном стрелкой. Нуклеотиды, выделенные цветом, идентичны у семи саморасщепляющихся РНК, шесть из которых обнаружены в растениях и одна у животных. Реакции саморасщепления превращают тандемно повторенные последовательности одноцепочечной РНК (промежуточный продукт вироид-подобной РНК) в однокопийную линейную молекулу РНК, которая затем замыкается в кольцо. (По А. С. Forster et al., Nature 334: 265-267, 1988.)
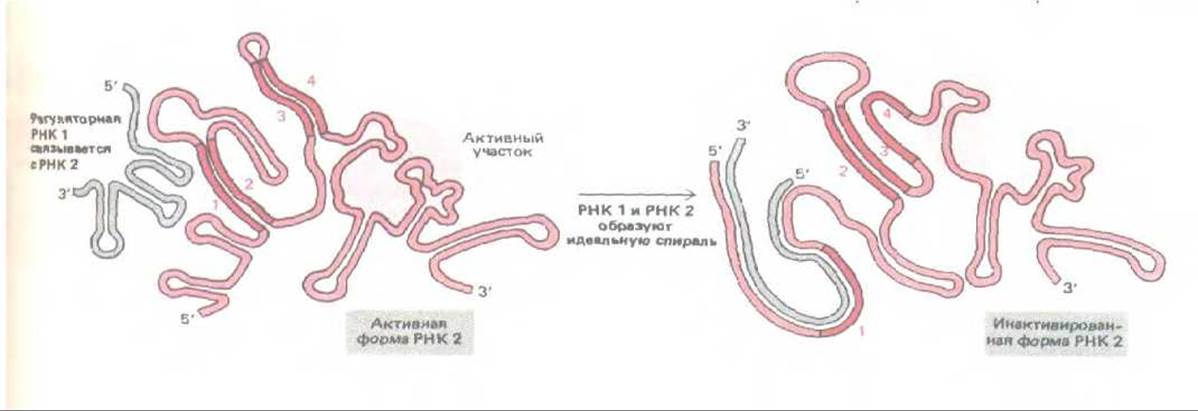
Рис. 10-62. Регуляторное взаимодействие двух молекул РНК способствует поддержанию постоянного числа копий в семействе бактериальных ДНК-содержащих плазмид ColEl. РНК (длиной около 100 нуклеотидов) представляет собой регуляторную молекулу, которая подавляет активность РНК 2 (длиной около 500 нуклеотидов), участвующей в инициации репликации плазмидной ДНК. РНК 1 комплементарна последовательности на 5'-конце РНК 2 и ее концентрация возрастает пропорционально числу молекул плазмидной ДНК в клетке. У РНК 2 последовательность 2 комплементарна как последовательности 1, так и последовательности 3 (ср. рис. 10-50) и способна замещаться при связывании РНК 1; в результате меняется конформация последовательности 4, инактивирующая РНК 2. (По Н. Masukata and J.Tomizawa, Cell 44: 125-136, 1986.)
Молекулы РНК обладают также и регуляторной функцией. Антисмысловая РНК в клетках, измененных экспериментальным путем, делает эти клетки не способными экспрессировать определенный ген (механизм, аналогичный тому, который в норме регулирует экспрессию некоторых генов бактерий). Этот механизм на самом деле может иметь гораздо более широкое распространение. Особенно хорошо изученным примером такого рода служит контроль с обратной связью за началом репликации ДНК большого семейства бактериальных плазмид. Контролирующая система ограничивает копийность плазмид, и таким образом не дает плазмидам убить хозяйскую клетку (рис. 10-62).
Изучение реакций, катализируемых РНК, представляет особый интерес для понимания хода эволюции. Как уже обсуждалось в гл. 1, первые клетки, по-видимому, не содержали ДНК, и в них было очень мало, а может быть и вообще не было белков. Многие из реакций, катализируемых РНК в современных клетках, могут представлять собой молекулярные ископаемые, т.е. происходить от той сложной сети реакций, направляемых РНК, которые предположительно преобладали в метаболизме клетки 3,5 млрд лет назад. Разобравшись в них, биологи, возможно, смогут проследить пути возникновения первой живой клетки.
Заключение
При осуществлении контроля экспрессии генов клетки воздействуют на многие стадии перехода РНК→белок. Полагают, что большинство генов регулируется на нескольких уровнях, хотя преобладающим считают контроль на уровне инициации транскрипции. Тем не менее, некоторые гены транскрибируются с постоянной скоростью, а их включение и выключение происходит только за счет воздействия на РНК. К таким посттранскрипционным регуляторним процессам относят: 1) аттенуацию транскрипции путем преждевременной терминации, 2) альтернативный выбор сайта сплайсинга, 3) контроль за образованием 3'-конца путем расщепления и добавления polyA, 4) контроль инициации трансляции и 5) регулируемую деградацию мРНК. Для большинства из этих контролирующих процессов необходимо узнавание последовательностей или структур в молекуле РНК. Такое узнавание может осуществляться либо белком-регулятором, либо регуляторной молекулой РНК.