Молекулярная биология клетки - Том 3 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
От клеток к многоклеточным организмам
Поддержание нормальной организации тканей
Обновление путем простого удвоения
У позвоночных дифференцированные клетки в большинстве своем не перманентны - они все время погибают и замещаются новыми. В течение жизни взрослого организма новые дифференцированные клетки создаются одним из двух способов: 1) при простом удвоении существующих дифференцированных клеток образуются две дочерние клетки того же типа; 2) новые клетки могут образовываться из недифференцированных стволовых клеток, и этот способ, как мы увидим дальше, связан с изменением клеточного фенотипа.
Скорость обновления варьирует от ткани к ткани. Время оборота клеток может измеряться сутками, как в эпителиальной выстилке тонкого кишечника (она обновляется за счет деления стволовых клеток), а может длиться год и более, как в поджелудочной железе (где происходит простое удвоение клеток). Во многих тканях, обычно обновляющихся очень медленно, при надобности возможна стимуляция более быстрого образования новых клеток. В этом разделе мы рассмотрим обновление путем простого удвоения дифференцированных клеток на примере печени и эндотелиальных клеток.
17.3.1. Печень-промежуточное звено между пищеварительным трактом и кровью [9]
Переваривание пищи - процесс сложный. Определенные клетки, выстилающие пищеварительный тракт, выделяют различные вещества, такие как соляная кислота и ферменты, расщепляющие компоненты пищи на более простые соединения. Другие клетки всасывают продукты переваривания из просвета кишечника и переносят их в кровь для использования другими клетками организма. Все эти процессы регулируются в соответствии с составом поступившей пищи и с концентрацией метаболитов в циркулирующей крови. Этот комплекс задач выполняется с помощью своего рода разделения труда: одни группы клеток секретируют НС1 или ферменты, другие всасывают питательные вещества, третьи вырабатывают пептидные гормоны (например, гастрин), регулирующие пищеварительную и метаболическую активность, и т. д. (рис. 17-9). Некоторые из этих клеток расположены в стенке кишечника вперемешку, другие собраны в крупные железы, которые соединены с кишечником и развиваются у эмбриона как выросты кишечного эпителия.
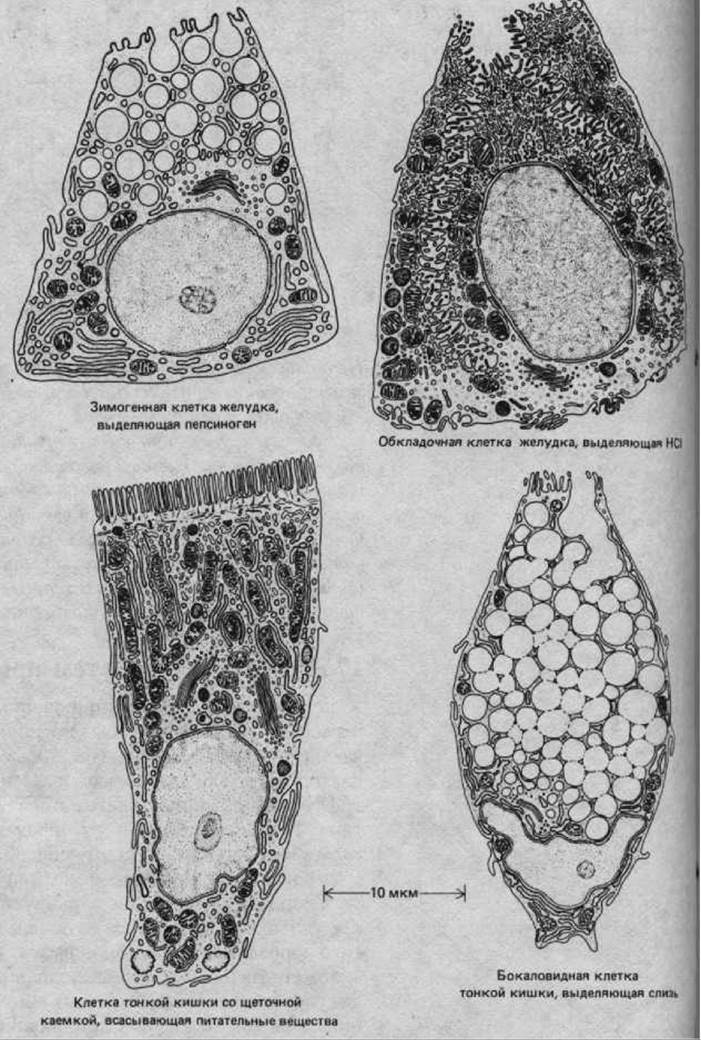
Рис. 17-9. Некоторые виды специализированных клеток, встречающихся в эпителиальной выстилке желудочно-кишечного тракта. На срезах эпителия часто видны рядом клетки разного типа (см. рис. 17-17, Б). (По Т. L. Lentz, Cell Fine Structure. Philadelphia: Saunders, 1971.)
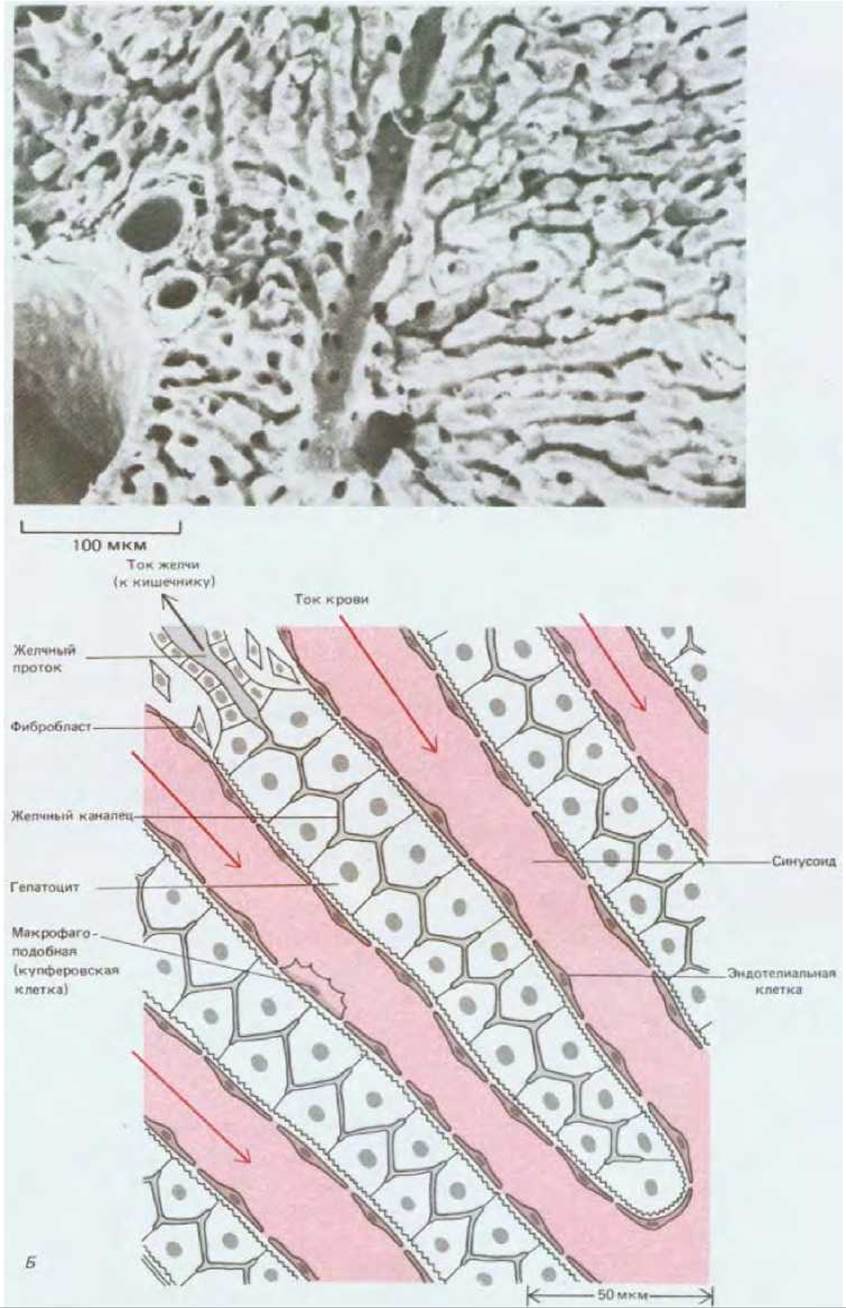
Рис. 17-10. Структура печени. А. Микрофотография участка печени, полученная с помощью сканирующего электронного микроскопа. Видны складчатые слои гепатоцитов (трабекулы) и множество узких каналов (синусоидов), по которым протекает кровь. Более широкие каналы - это сосуды, которые распределяют к собирают кровь, протекающую через синусоиды. Б. Схематическое изображение тонкой структуры печени. Гепатоциты отделены от кровяного русла лишь одним тонким слоем эндотелиальных клеток с разбросанными между ними макрофагоподобными купферовскими клетками. Небольшие отверстия в этом слое позволяют гепатоцитам обмениваться с кровью молекулами и мелкими частицами, но гепатоциты защищены при этом от прямого контакта с движущимися клетками крови. Помимо обмена веществами с кровью гепатоциты образуют систему очень узких желчных канальцев, в которые они выделяют желчь, выходящую далее через желчные протоки в кишечник. В действительности структура печени не так регулярна, как на этой схеме. (A R.G. Kessel, R. Н. Каrdоn, Tissues and Organs: A Text-Atlas of Scanning Electron Microscopy. San Francisco: Freeman, 1979.)
Самая крупная из таких желез - печень. У эмбриона она развивается в том месте, где одна из главных вен проходит рядом со стенкой первичной кишки. Этот орган и во взрослом состоянии сохраняет необычайно тесную связь с кровью. Печеночные клетки (гепатоциты), происходящие из эпителия первичной кишки, образуют складчатые слои (трабекулы), примыкающие к заполненным кровью пространствам - синусоидам (рис. 17-10, А). Кровь отделена от поверхности гепатоцитов слоем уплощенных эндотелиальных клеток, покрывающих каждую трабекулу (рис. 17-10, Б). Такая структура облегчает выполнение важнейших функций печени, в основе которых лежит обмен метаболитами между печеночными клетками и кровью.
Печень - важнейший орган, в котором питательные вещества, всосавшиеся из кишечника, преобразуются для использования другими тканями организма. Большую часть крови печень получает прямо из кишечного тракта (через портальную вену). Гепатоциты ответственны за синтез, расщепление и хранение множества различных веществ. Они играют центральную роль в углеводном и жировом обмене всего организма; и они же вырабатывают большую часть белков, содержащихся в плазме крови. В то же время гепатоциты сохраняют связь с просветом кишечника через систему мельчайших канальцев и более крупных протоков (рис. 17-10, Б). Через эти протоки гепатоциты выделяют в кишечник и отходы метаболизма, и эмульгирующее вещество - желчь, которая облегчает всасывание жиров. Внутри популяции гепатоцитов (в отличие от остальных частей пищеварительного тракта), по-видимому, нет заметного «разделения труда»: все гепатоциты способны выполнять один и тот же широкий круг метаболических и секреторных функций.
По-своему «образу жизни» гепатоциты тоже значительно отличаются от клеток, выстилающих просвет самого кишечника. Последние находятся в очень тяжелых условиях; они не могут жить долго, соприкасаясь с механически и химически агрессивным содержимым кишечника, и должны быстро и непрерывно заменяться новыми клетками (см, рис. 17-17). Гепатоциты же избавлены от прямого контакта с содержимым кишки, они живут значительно дольше и обновляются с небольшой, но строго контролируемой скоростью.
17.3.2. Утрата печеночных клеток стимулирует их пролиферацию [10]
Даже в медленно обновляющейся ткани небольшой, но постоянный дисбаланс между образованием и утратой клеток привел бы к катастрофическим последствиям. Если у человека каждую неделю будут делиться 2% печеночных клеток, а теряться будет только 1% клеток, то печень начнет расти и через 8 лет ее вес превысит вес всего остального тела. Должен существовать какой-то гомеостатический механизм, приводящий скорость размножения клеток в соответствие с массой ткани. Необходимость в подобном контроле особенно велика у такого органа, как печень, клетки которой время от времени разрушаются под действием ядов (например, алкоголя).
Существование гомеостатического контроля клеточной пролиферации в печени было четко показано в опытах, в которых значительную часть гепатоцитов удаляли хирургическим путем или же вызывали их гибель, вводя животному четыреххлористый углерод. Примерно через сутки после такого повреждения в популяции оставшихся гепатоцитов возникает волна клеточных делений, и утраченная ткань быстро замещается. Например, если удалить у крысы две трети печени, то оставшаяся часть регенерирует до нормальных размеров приблизительно за две недели. В подобных случаях сигнал для регенерации печени можно обнаружить в крови: если у двух крыс хирургическим путем создать перекрестное кровообращение и у одной из них удалить две трети печени, то митотическая активность появится и в неповрежденной печени второй крысы. Что это за фактор в крови и как он действует, пока не выяснено, несмотря на многочисленные исследования. Возможно, что таким сигналом служит сложное сочетание каких-то химических условий, а не один- единственный фактор роста. Сходные явления регенерации наблюдаются в почках, имеющих, по-видимому, аналогичную систему управления ростом.
17.3.3. Для регенерации необходим координированный рост компонентов ткани [11]
Подобно большинству органов, печень - это смесь клеток различных типов. Кроме гепатоцитов и эндотелиальных клеток, выстилающих синусоиды, здесь имеются специализированные макрофаги (купферовы клетки), которые поглощают твердые частицы из кровотока и разрушают «изношенные» эритроциты; есть также небольшое число фибробластов, образующих рыхлый соединительнотканный остов (см. рис. 17-10, Б). Клетки всех этих типов способны к делению. Для того чтобы произошла полноценная регенерация, их размножение должно быть надлежащим образом скоординировано.
Важность сбалансированной регенерации клеток всех типов можно показать на примере дисбаланса и его последствий. Например, если многократно повреждать печень четыреххлористым углеродом или алкоголем с такими короткими интервалами, что гепатоциты не будут успевать полностью восстанавливаться, преимущество могут получить фибробласты; в этом случае печень будет необратимо «забита» излишней соединительной тканью, и для роста гепатоцитов после устранения токсического агента останется очень мало места. Такое состояние, называемое циррозом, часто встречается у хронических алкоголиков. Регенерация сильно поврежденных скелетных мышц тоже зачастую бывает серьезно затруднена из-за слишком быстрого роста соединительнотканного компонента, в результате чего на месте мышечных волокон появляется рубцовая ткань. Такой дисбаланс, однако, возникает при значительном повреждении ткани; в обычных же условиях обновления ткани регуляторные механизмы, пока еще мало изученные, обеспечивают поддержание соответствующей смеси клеток разного типа.
17.3.4. Все кровеносные сосуды выстланы эндотелиальными клетками [12]
В отличие от приведенных выше примеров некоординированного роста фибробластов эндотелиальные клетки, выстилающие кровеносные сосуды, обладают удивительной способностью изменять свою численность и расположение в соответствии с локальными требованиями. Почти все ткани нуждаются в кровоснабжении, а оно в свою очередь зависит от эндотелиальных клеток. Эти клетки создают способную к гибкой адаптации систему жизнеобеспечения с разветвлениями во всех областях тела. Если бы не эта способность эндотелиальных клеток расширять и восстанавливать сеть кровеносных сосудов, рост тканей и процессы заживления были бы невозможны.
Самые крупные кровеносные сосуды - это артерии и вены, имеющие толстую прочную стенку из соединительной ткани и гладкой мускулатуры (рис. 17-11, А). Эта стенка выстлана изнутри чрезвычайно тонким одиночным слоем эндотелиальных клеток, который отделен от окружающих слоев базальной мембраной. Толщина соединительнотканного и мышечного слоев стенки варьирует в зависимости от диаметра и функции сосуда, но эндотелиальная выстилка имеется всегда (рис. 17-11, Б). Стенки тончайших разветвлений сосудистого дерева - капилляров и синусоидов - состоят только из эндотелиальных клеток и базальной мембраны (рис. 17-12). Таким образом, эндотелиальные клетки выстилают всю сосудистую систему - от сердца до мельчайших капилляров - и управляют переходом веществ (а также лейкоцитов) из тканей в кровь и обратно. Более того, изучение эмбрионов показало, что сами артерии и вены развиваются из простых малых сосудов, построенных исключительно из эндотелиальных клеток и базальной мембраны: соединительная ткань и гладкая мускулатура там, где это нужно, добавляются позднее под действием сигналов от эндотелиальных клеток.
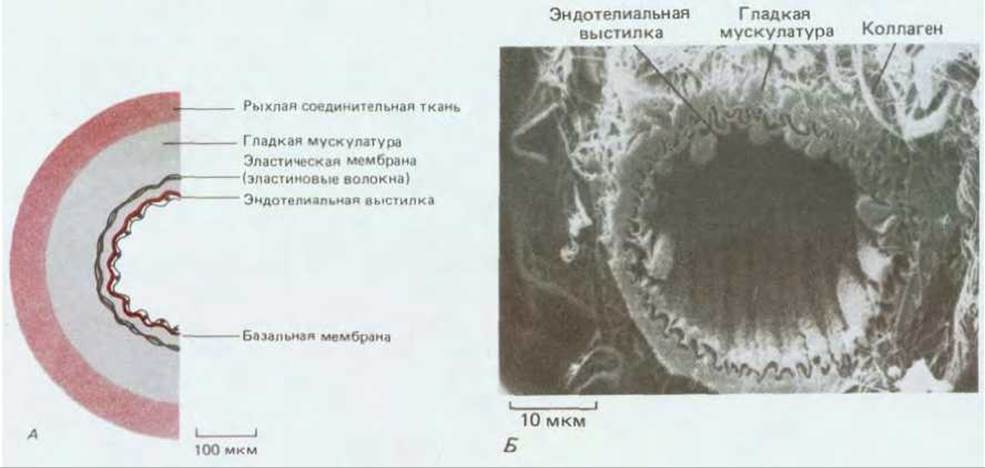
Рис. 17-11. А. Участок стенки малой артерии (схематический поперечный разрез). Эндотелиальные клетки, несмотря на их неприметность, являются важнейшим компонентом стенки. Сравните со строением капилляра на рис. 17-12. Б. Перерезанная артериола (микрофотография, полученная с помощью сканирующего электронного микроскопа). Можно видеть внутреннюю выстилку из эндотелиальных клеток, а вокруг них - слой гладкой мускулатуры и волокнистой соединительной ткани. Эндотелий сосуда собран в складки вследствие небольшого сокращения мышечного слоя. При фиксации препарата эндотелий, сжавшись, несколько отошел от остальных слоев, и здесь образовалась узкая щель. (Б- R. G. Kessel, R. H. Kardon, Tissues and Organs: A Text-Atlas of Scanning Electron Microscopy. San Francisco: Freeman, 1979.)
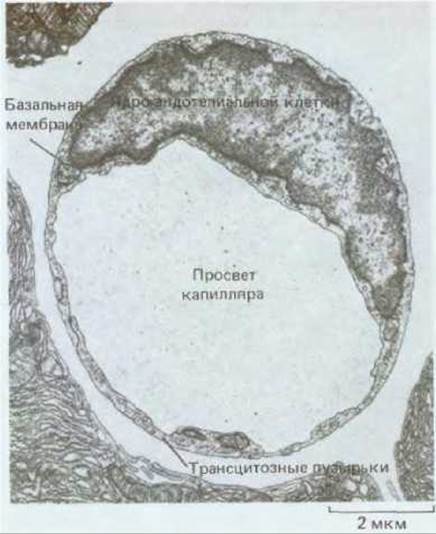
Рис. 17-12. Поперечный срез узкого капиляра та поджелудочной железы (электронная микрофотография). Стенка образована одной эндотелиальной клеткой, окруженной базальной мембраной. Обратите внимание на мелкие (80 нм) «трансцитозные» пузырьки. Предполагается, что они обеспечивают перенос макромолекул через стенку такого капилляра: молекулы захватываются в пузырьки на поверхности клетки, обращенной в просвет сосуда, и выводятся путем экзоцитоза на наружной поверхности (или наоборот). (R. P. Bolender, J. Cell Biol., 61, 269-287, 1974. С разрешения Rockefeller Univ. Press.)
17.3.5. Новые эндотелиальные клетки образуются путем простого деления существующих эндотелиальных клеток [13]
Во всей сосудистой системе взрослого организма эндотелиальные клетки сохраняют способность к делению и передвижению. Если, например, участок стенки аорты будет поврежден и лишится своей эндотелиальной выстилки, в окружающем эндотелии образуются новые клетки, которые перемещаются так, чтобы покрыть поврежденное место. Новые клетки способны даже покрывать внутреннюю поверхность пластиковых трубок, используемых хирургами для замены поврежденных частей кровеносных сосудов.
Пролиферацию эндотелиальных клеток можно продемонстрировать путем мечения их в фазе S 3Н-тимидином. В нормальных сосудах доля эндотелиальных клеток, включающих метку, особенно высока в местах разветвления артерий, где турбулентность потока крови ускоряет износ эндотелиальных клеток и тем самым, по-видимому, стимулирует их обновление. В целом, однако, эти клетки обновляются очень медленно: время жизни клетки измеряется месяцами или даже годами.
Эндотелиальные клетки не только восстанавливают выстилку существующих кровеносных сосудов, но и создают новые сосуды. Это обязательно должно происходить у зародыша, чтобы сосудистая сеть не отставала от роста тела, и в тканях взрослого организма, которые подвергаются циклическим перестройкам, а также при заживлении ран.
17.3.6. Новые капилляры образуются как ответвления существующих сосудов [14, 15]
Новые сосуды сначала возникают как капилляры, которые ответвляются от уже имеющихся мелких сосудов. Этот процесс ангиогенеза представляет собой реакцию на специфические сигналы. Его можно легко продемонстрировать у кроликов. В ухе кролика прокалывают небольшое отверстие и с обеих сторон укрепляют покровные стекла, чтобы получилась узкая камера с прозрачными стенками, в которой могут расти клетки, окружающие рану. Удобно также наблюдать ангиогенез в таких прозрачных структурах, как роговица глаза. Раздражение роговицы вызывает рост новых кровеносных сосудов от ее ободка, обильно снабжаемого кровью, по направлению к центру, где в норме сосудов почти нет. Таким образом происходит васкуляризация роговицы в результате прорастания эндотелиальных клеток в ее плотную, богатую коллагеном ткань.
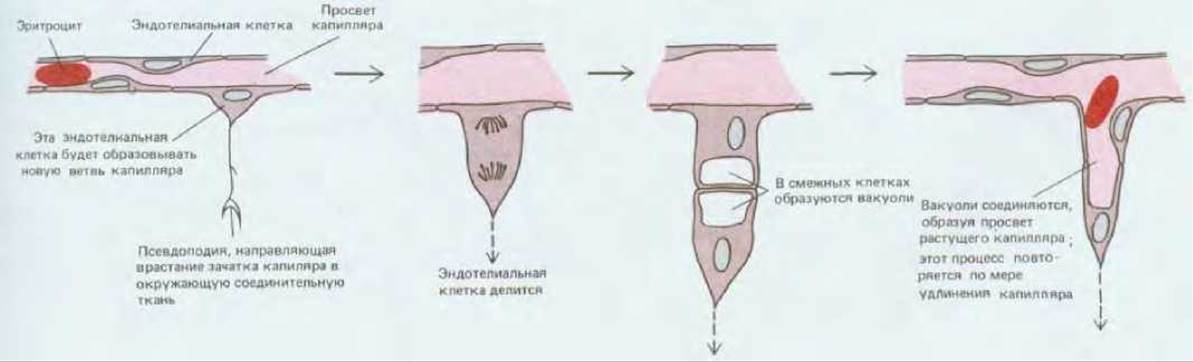
Рис. 17-13. Новый кровеносный капилляр образуется путем «отпочковывания» эндотелиальной клетки от стенки существующего малого сосуда. Эта схема основана на наблюдениях над клетками в прозрачном хвосте живого головастика. (По С. С. Speidel, Am. J. Anat., 52, 1-79, 1933.)
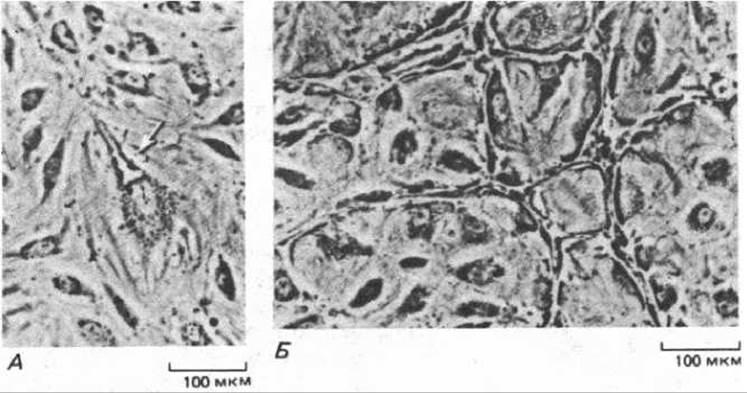
Рис. 17-14. В эндотелиальных клетках, растущих в культуре, спонтанно возникают вакуоли, которые соединяются, образуя сеть капиллярных трубочек. На фото А а Б представлены последовательные стадии этого процесса. Стрелкой (А) указана вакуоль, появившаяся сначала в одной эндотелиальной клетке. Культуры произошли от групп из двух-четырех эндотелиальных клеток, взятых из коротких отрезков капилляра. Эти клетки садятся на поверхность культуральной чашки, покрытую коллагеном, и формируют небольшую распластанную колонию, которая постепенно увеличивается по мере пролиферации клеток. Колония распространяется по чашке, и в конце концов (примерно через 20 дней) в центральных участках начинают формироваться капиллярные трубки; вскоре появляются и ответвления, а еще через 5-10 дней уже можно видеть обширную сеть трубок (В). I. Folkman, С. Haudenschild, Nature, 288, 551-556, 1980. Copyright Macmillan Jornals Ltd.)
Такого рода наблюдения показывают, что эндотелиальные клетки, которые в будущем сформируют новый капилляр, отрастают от стенки существующего капилляра или небольшой венулы, выпуская сначала тонкие длинные псевдоподии (рис. 17-13); затем образуется массивный отросток, который позже становится полым и превращается в трубку. Этот отросток продолжает удлиняться до тех пор, пока не встретит другой капилляр, с которым он соединяется, создавая путь для циркуляции крови. Как показали опыты на тканевых культурах, в среде, содержащей подходящие ростовые факторы, эндотелиальные клетки спонтанно образуют капиллярные трубочки даже в условиях изоляции от клеток каких-либо других типов. Первый признак образования такой трубочки в культуре - это появление в клетке удлиненной вакуоли, которая вначале полностью окружена цитоплазмой (рис. 17-14, А). Такие же вакуоли возникают в соседних клетках и в конце концов выстраиваются концом к концу так, что сливаются в один капиллярный канал (рис. 17-14, Б). Капилляры, образующиеся в чистой культуре эндотелиальных клеток, не содержат крови, и по ним не протекает никакая жидкость. Очевидно, ток и давление крови не нужны для формирования капиллярной сети.
17.3.7. Рост капиллярной сети регулируют факторы, выделяемые окружающими тканями [15]
В живом организме эндотелиальные клетки образуют новые капилляры везде, где в них есть надобность. По-видимому, когда клеткам в тканях недостает кислорода, они выделяют ангиогенные факторы, идуцирующие новый рост капилляров. Вероятно, именно по этой причине почти все клетки у позвоночных находятся не дальше 50 мкм от капилляра. Точно так же и при заживлении ран в участке, примыкающем к поврежденной ткани, происходит кратковременная «вспышка» роста капилляров (рис. 17-15). Местное раздражение и местная инфекция тоже вызывают пролиферацию новых капилляров, а когда воспаление проходит, многие из вновь образованных капилляров претерпевают обратное развитие и постепенно исчезают.
Ангиогенез важен также при росте опухоли. Опухоль, растущая в виде плотной массы, остается очень небольшой, пока не будет обеспечена капиллярами. Без снабжения внутренней части кровью она существовала бы только за счет диффузии питательных веществ с периферии и поэтому не могла бы увеличиваться больше чем до нескольких миллиметров в диаметре. Для дальнейшего роста опухоль должна индуцировать образование капиллярной сети, которая проросла бы в опухолевую массу. Маленький кусочек такой опухоли, пересаженный в роговицу, вызывает быстрый рост капиллярных сосудов в направлении от васкулярного края к имплантату (рис. 17-16), и скорость роста опухоли резко возрастает, как только сосуды достигнут ее.
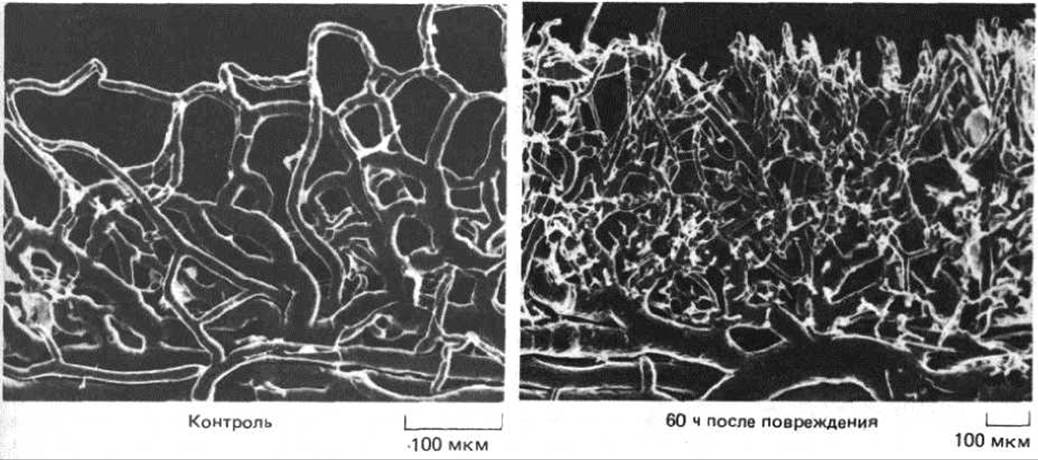
Рис. 17-15. Слепки кровеносных сосудов края роговицы, показывающие реакцию на повреждение (микрофотографии, полученные с помощью сканирующего электронного микроскопа). Слепки сделаны путем инъекции в сосуды специальной смолы, которая позже затвердевает. При этом выявляется форма просвета, но не внешние очертания клеток. Через 60 ч после ранения множество новых капилляров начинает отрастать по направлению к поврежденному участку (чуть выше верхнего края фото). Их ориентированный рост отражает хемотаксическую реакцию эндотелиальных клеток на ангиогенный фактор, выделяемый в области раны. (С любезного разрешения Peter С. Burger.)
Во всех этих случаях внедряющиеся эндотелиальные клетки должны отвечать на сигнал, который подает ткань, требующая притока крови. Ответ эндотелиальных клеток имеет по крайней мере три составляющих. Во-первых, клетки должны продырявить базальную мембрану вокруг существующего кровеносного сосуда. Показано, что эндотелиальные клетки во-время ангиогенеза секретируют протеазы, например активатор плазминогена, которые позволяют им «проедать» себе путь в базальной мембране родительского капилляра или венулы. Во-вторых, эндотелиальные клетки должны двигаться в сторону источника сигнала. В-третьих, они должны делиться. При определенных обстоятельствах один или два из этих трех компонентов ответа могут быть вызваны в отсутствие других. Например, иногда новые капилляры образуются даже при блокаде пролиферации эндотелиальных клеток облучением. Показано также, что какой-то фактор, находящийся в раневой жидкости, привлекает эндотелиальные клетки и побуждает их к секреции протеаз, не стимулируя, однако, пролиферацию.
Другие факторы способны вызвать все три компонента реакции эндотелиальных клеток. Таковы, например, кислый фактор роста фибробластов (кислый ФРФ) и основной фактор роста фибробластов (основной ФРФ). Эти два белка, которые были независимо выделены и очищены из нескольких различных источников и поэтому известны и под разными другими названиями, сходны по аминокислотным последовательностям (55% гомологии). Помимо сильно выраженного действия их на эндотелиальные клетки они стимулируют пролиферацию фибробластов и клеток ряда других типов, а также служат важными регуляторами раннего эмбрионального развития (разд. 16.2.3). Какие клетки их выделяют, не вполне ясно. Клетки многих типов, включая макрофаги, тучные клетки и жировые клетки, могут выделять и другие вещества, действующие как ангиогенные факторы в период заживления, роста ткани или воспаления. Ангиогенез, так же как и иные процессы клеточной пролиферации, регулируется не каким-то одиночным сигналом, а сложным (и, возможно, избыточным) комплексом сигналов.
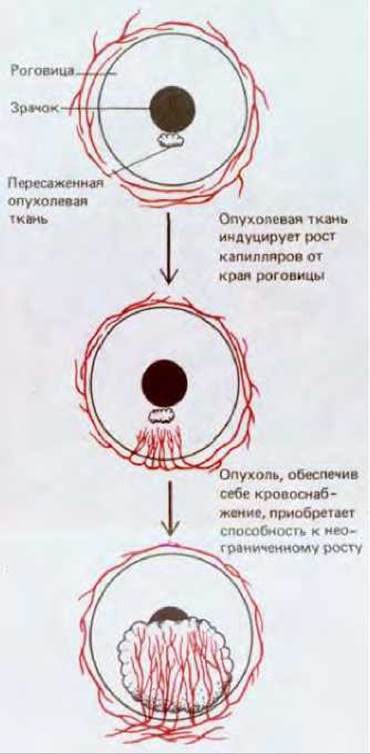
Рис. 17-16. Опухолевая ткань, пересаженная в роговицу, выделяет фактор, вызывающий рост капилляров. Капилляры обеспечивают опухоль питательными веществами из общего кровотока, и это позволяет ей расти.
Заключение
У позвоночных большинство популяций дифференцированных клеток подвержено обновлению. В некоторых случаях полностью дифференцированные клетки просто делятся, образуя дочерние клетки того же типа. Примером могут служить гепатоциты (печеночные клетки), скорость размножения которых регулируется таким образом, чтобы поддерживать нужное общее их количество. Если значительная часть печет разрушена, скорость деления оставшихся гепатоцитов возрастает для восполнения потери. Но восстановление иногда бывает несбалансированным; например, когда в многократно повреждаемой печени фибробласты начинают расти слишком быстро по сравнению с гепатоцитами, печеночная ткань замещается фиброзной.
Эндотелиальные клетки образуют одиночный слой, выстилающий все кровеносные сосуды и регулирующий обмен веществами между кровью и окружающими тканями. Новые кровеносные сосуды развиваются из существующих мелких сосудов в виде выростов эндотелиальных клеток: эти клетки способны образовывать полые капиллярные трубочки даже при росте в культуре. В живом организме испытывающие кислородное голодание и поврежденные ткани стимулируют ангиогенез, выделяя ангиогенные факторы, которые привлекают близлежащие эндотелиальные клетки и стимулируют их к пролиферации и выделению протеаз.